匹立尼酸对肝癌经导管动脉栓塞术后癌旁肝组织氧化应激和细胞凋亡的作用
杨培鈺 杜伟 李正亮 周舟 熊文翠
大理大学1临床医学院,2第一附属医院放射科(云南大理671000)
肝细胞癌(hepatocellular carcinoma,HCC)是一种常见的高侵袭性恶性肿瘤,是全球第五大常见癌症和第二大致死癌症[1],由于肝癌的发病隐匿,大多数患者在确诊时已处于中晚期,无法通过肝切除术、射频消融或肝移植治疗,经导管动脉栓塞术(TAE)成为了不能进行手术切除和肝脏移植患者的主要治疗手段[2-4]。由于栓塞剂的非选择性,使其无法避免的扩散到癌旁正常肝组织,导致相应供血动脉栓塞,而且肝脏有一半的氧供来自肝动脉,导致癌旁肝组织缺血/再灌注损伤[5],其中大量活性氧簇(reactive oxygen species,ROS)的释放所致的氧化应激是主要因素,其次是炎症反应和细胞水肿,引起正常肝组织坏死、凋亡[6-7],而且80%的HCC 患者合并有肝硬化、门脉高压的基础病变,以致TAE 术后癌旁正常肝组织肝功能损伤更为严重,增加了TAE 术后发生急性肝衰竭的概率[8],严重影响了患者预后,因此如何缓解TAE 术后肝功能不同程度下降成为了临床上改善患者预后的关键。笔者前期研究结果发现:兔VX2 肝癌模型经TAE 术后,癌旁肝组织抗氧化酶系统减弱、NF-κB 介导的炎症因子增加,引起氧化应激和炎症反应,导致正常肝组织坏死凋亡增加,肝功能受损[9-10]。本次实验是在前期研究基础上从动物水平进一步探讨缓解TAE 术后肝功能下降的治疗方法及其可能的机制。过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptors,PPARs)是核受体超家族、配体依赖的转录因子,包括PPAR-α、PPAR-β、PPAR-γ三种亚型,其中PPAR-α主要分布在代谢旺盛的器官,如肝脏、心脏、肾脏[11]。将PPARs 作为药物治疗靶点成为近年来的研究热点,研究表明PPAR-α可以通过调节脂质代谢相关基因的转录来改善氧化应激损伤,减少细胞坏死凋亡[12-13],匹立尼酸是一种新型人工合成的PPAR-α激动剂,通过激活PPAR-α来发挥其调节相关基因转录的作用。然而PPAR-α激动剂匹立尼酸对肝癌经TAE 术后癌旁肝组织能否发挥其调节相关基因表达的作用,来减轻氧化应激和细胞凋亡,缓解TAE 术后肝功能降低,从而改善预后,其相关内容国内外鲜有报道,仍需进一步探讨。
1 材料与方法
1.1 实验动物荷瘤兔2只(东南大学附属中大医院惠赠),健康新西兰大白兔80只[购于昆明楚商科技有限公司,许可证号SCXK(滇)K2018-0001],体质量2.5~3.5 kg,雌雄不限,普通饲料喂养。
1.2 主要试剂谷丙转氨酶测试盒、谷草转氨酶测试盒(上海博耀生物科技有限公司)。兔(SOD、GSH-PX、CAT)ELISA 试剂盒(购于南京建成生物工程研究所有限公司),MDA测试盒(购于上海酶联生物科技有限公司)。TUNEL 试剂盒(上海翊圣生物科技有限公司)。动物总RNA 快速提取试剂盒(捷瑞,GK3016),RevertAid First Strand cDNA Synthesis Kit(美国Thermo 公司,K1622),FastStart Universal SYBR Master(瑞士ROCHE公司,04913850001),实时荧光定量PCR 仪(BIO-RAD,CFX96)。抗兔二抗(美国Bio Vision 公司)。
1.3 模型建立、分组及处理荷瘤兔传代、瘤粒注射方式[10]成功建立兔VX2肝癌模型60只,采用随机数字表法将其随机分为对照组(CON 组),TAE 组,联合治疗组(WT组),每组20只。CON组不作任何处理,TAE 组进行TAE 手术治疗[14],WT 组在TAE 术前连续3 d 经耳缘静脉注入匹立尼酸3 mg/(kg·d)。兔VX2 肝癌模型建立及TAE 治疗(图1)。
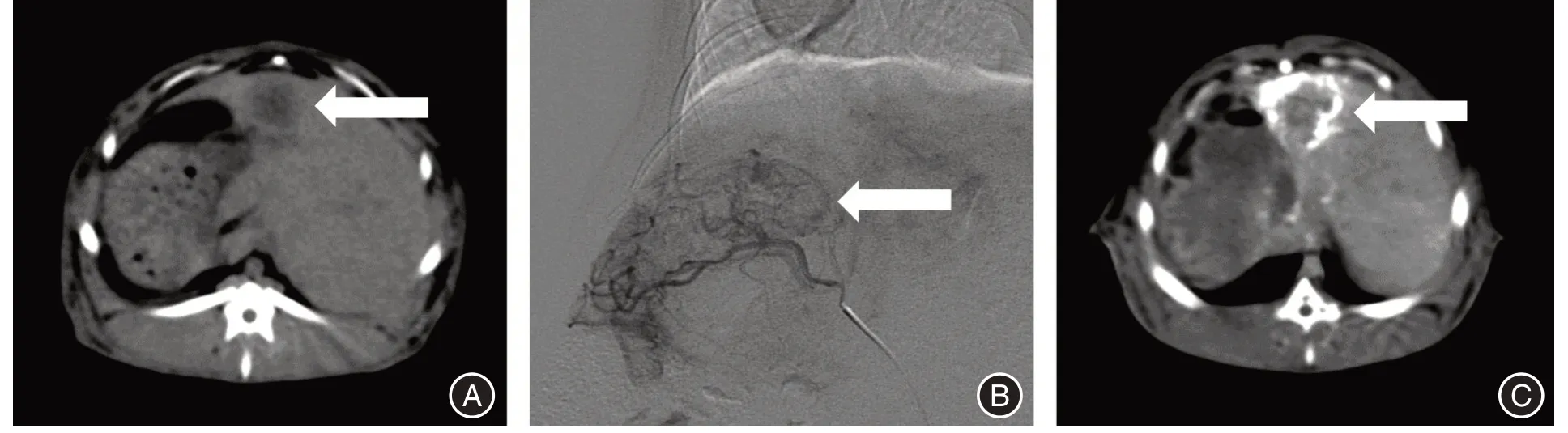
图1 兔VX2 肝癌模型及TAE 治疗Fig.1 Rabbit VX2 liver cancer models and TAE treatment
1.4 肝功能检测和癌旁肝组织样本分离TAE 术后3 d 经兔耳缘静脉采集3 组实验兔外周血(每只4 mL),测量肝功能指标ALT、AST,具体操作严格按照ALT、AST 试剂盒使用说明进行。随后将实验兔处死,取剑突下腹部正中偏左切口,剖出完整肝脏,于肿块边缘2 cm 以外分离出癌旁肝组织,液氮速冻,-80 ℃冰箱保存备用。
1.5 氧化应激指标SOD、GSH-Px、CAT 和MAD的检测取适量样本制备各组癌旁肝组织匀浆,严格按照SOD、GSH-Px、CAT 和MAD 试剂盒使用说明进行操作,分别测得各组SOD、GSH-Px、CAT和MAD 的吸光度值,计算得出各氧化应激指标活性、含量。
1.6 TUNEL 法检测肝细胞凋亡指数(AI)具体操作步骤严格按TUNEL 试剂盒进行,通过光学显微镜观察细胞核着色呈棕黄色或棕褐色的凋亡细胞。采取双盲法观察并计算细胞凋亡指数AI。
1.7 RT-qPCR检测SOD1、Bcl-2、Caspase-3 mRNA表达水平取适量样本制备各组癌旁肝组织匀浆,采用Trizol 法提取总mRNA,用微量分光光度计测得OD 值,计算出RAN 纯度和浓度,严格按照试剂盒使用说明进行逆转录、RT-qPCR 反应,SOD1引物序列上下游分别为:5′-CACCATCCACTTCGAGCAGA-3′,3′-GTCACATTACCCAGGTCGCC-5′;Bcl-2 引物序列上下游分别为:5′-TGGACAAACCTGAGCCCTAAC-3′,3′-TCACTTTCTGCAGGCCAAGT-5′;Caspase-3 引物序列上下游分别为5′-CAGACACGGTGGAGCAGATC-3′,3′-AAGACTACCAAGCCGCTGAC-5′;以GAPDH 作为内参,其引物序列上下游为5′-GCTGCTTTTAACTCTGGCAAAGT-3′,3′-TGATGGCCTTCCCGTTGATG-5′。反应条件:95 ℃,10 min;95 ℃,15 s;60 ℃,20 s;72 ℃,25 s;40 个循环;72 ℃,5 min。绘制溶解曲线,采用2-ΔΔCt法分析mRNA 的相对表达含量。
1.8 蛋白免疫印迹法(Western blot)检测SOD1、Bcl-2、Caspase-3 蛋白表达Western blot 法检测癌旁肝组织匀浆中SOD1、Bcl-2、Caspase-3 蛋白表达,β-actin 作为内参,Ecl 显色,曝光2~3 次,使用软件分析测定条带的灰度值。
1.9 统计学方法利用GraphPad Prism 7.0 对数据进行统计学分析,采用单因素分析和t检验对数据进行分析,计量资料用均数±标准差表示,P<0.05为差异有统计学意义。
2 结果
2.1 肝功能指标ALT、AST 变化水平与CON 组比较,TAE 组ALT、AST 水平明显增加;与TAE 组比较,WT 组ALT、AST 水平明显减少;WT 组较对照组增多,差异均有统计学意义(P<0.001,表1)。
表1 肝功能指标ALT、AST 和凋亡指数AITab.1 Liver function(ALT,AST)and apoptosis index±s
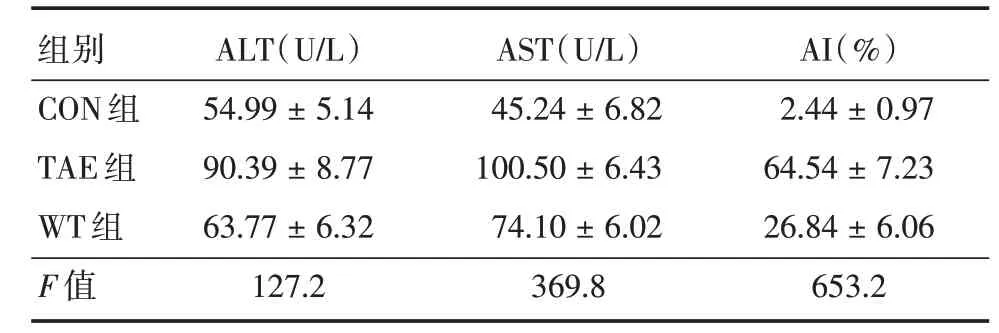
表1 肝功能指标ALT、AST 和凋亡指数AITab.1 Liver function(ALT,AST)and apoptosis index±s
注:ALT、AST、AI 各组间比较差异均有统计学意义
组别CON 组TAE 组WT 组F 值ALT(U/L)54.99±5.14 90.39±8.77 63.77±6.32 127.2 AST(U/L)45.24±6.82 100.50±6.43 74.10±6.02 369.8 AI(%)2.44±0.97 64.54±7.23 26.84±6.06 653.2
2.2 氧化应激指标SOD、GSH-Px、CAT 和MAD的活性和含量变化与CON 组比较,TAE 组SOD、GSH-Px、CAT 活性明显降低,MAD 含量明显增加(P<0.001);与TAE 组比较,联合治疗组SOD、GSH-Px、CAT 活性明显升高,MAD 含量明显减少(P<0.001);WT 组与对照组比较SOD 活性增加(P<0.001),余GSH-Px、CAT、MDA 差异无统计学意义(图2)。
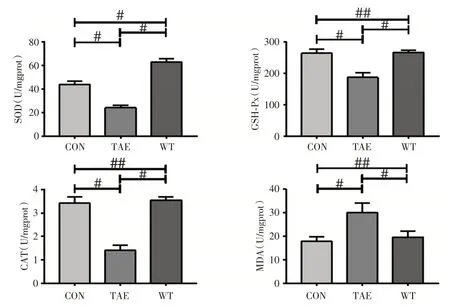
图2 各组癌旁肝组织SOD、GSH-Px、CAT 活性变化(U/mgprot,n=20),MDA 含量变化(nmol/mgprot,n=20)Fig.2 Vitality of SOD,GSH-Px,CAT(U/mgprot,n=20)and levels of MDA(nmol/mgprot,n=20)
2.3 凋亡情况及AI与CON 组比较,TAE 组AI明显增加;与TAE 组比较,WT 组AI 明显减小;WT组AI 较对照组增加,差异均有统计学意义(表1、图3)。

图3 癌旁肝组织凋亡情况(×40)Fig.3 Apoptosis of liver tissue adjacent cancer(×40)
2.4 SOD1、Bcl-2、Caspase-3 mRNA 表达水平变化与CON 组比较,TAE 组SOD1、Bcl-2 mRNA 表达明显下降,Caspase-3 mRNA 表达明显上升(P<0.001);与TAE 组比较,WT 组SOD1、Bcl-2 mRNA表达明显上升(P<0.001);与CON 组比较,WT 组SOD1、Bcl-2 表达均上升(P<0.001),而Caspase-3与之相比,差异无统计学意义(P=0.385 3,图4)。
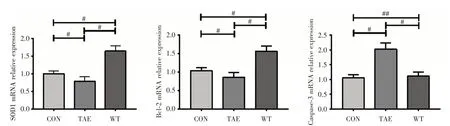
图4 各组SOD1、Bcl-2、Caspase-3 mRNA 相对表达含量(n=20)Fig.4 SOD1,Bcl-2,Caspase-3 mRNA relative expression(n=20)
2.5 SOD1、Bcl-2、Caspase-3 蛋白表达水平变化与CON 组比较,TAE 组SOD1、Bcl-2 蛋白表达明显下降,Caspase-3 蛋白表达明显上升(P<0.05);与TAE组比较,WT组SOD1、Bcl-2 蛋白表达明显上升,Caspase-3 蛋白表达明显下降(P<0.001);WT 组与对照组比较,差异均有统计学意义(P<0.001,图5、6)。
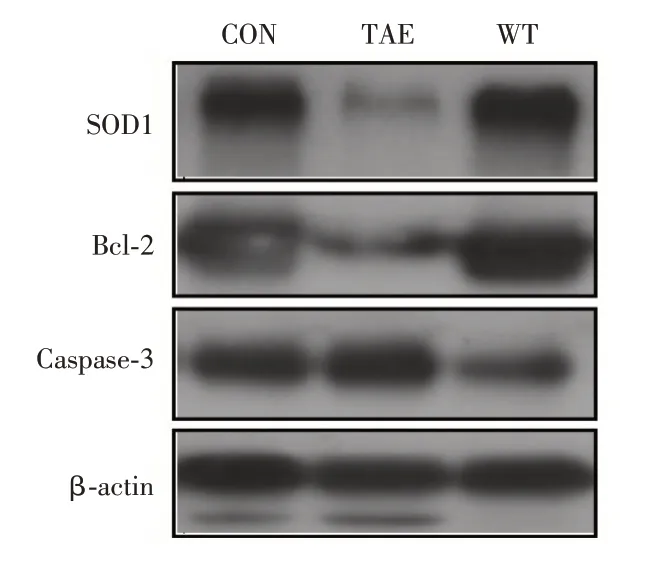
图5 各组癌旁肝组织相关蛋白Western-blot 结果(n=3)Fig.5 Western-blot of SOD1,Bcl-2,Caspase-3 protein(n=3)
3 讨论
肝癌是一种高发恶性肿瘤,全世界每年新增肝癌患者60 万例,超过50%的新发病例出现在我国[15]。肝癌患者早期症状不明显,就诊时多被诊断为肝癌晚期[16],患者失去了手术切除和肝脏移植的机会,此时TAE 成为了肝癌治疗的主要方式[17]。由于栓塞剂不可避免的进入癌旁正常肝组织血管,引起肝脏缺血/再灌注损伤,导致氧化应激,细胞凋亡增多,而且大部分患者有肝硬化病史,TAE 术后患者肝功能受损更为严重,极大的影响了患者的预后。本次实验探讨PPAR-α激动剂匹立尼酸对兔VX2 肝癌经TAE 术后癌旁肝组织氧化应激和细胞凋亡的作用,为临床如何改善经导管动脉栓塞术后患者预后提供新思路。
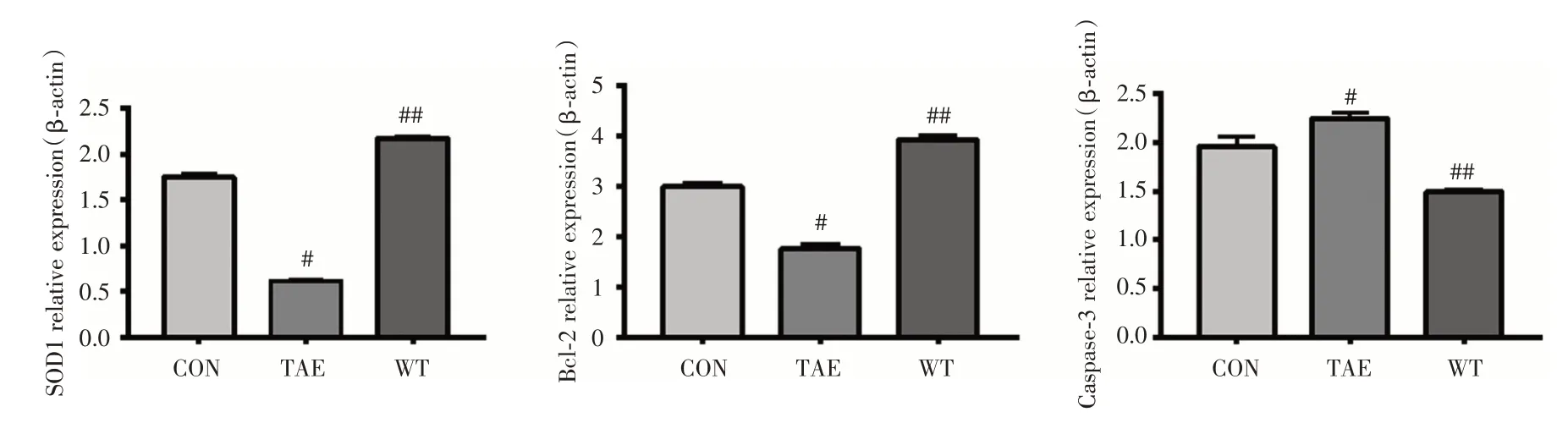
图6 各组癌旁肝组织SOD1、Bcl-2、Caspase-3 蛋白相对表达(n=3)Fig.6 SOD1,Bcl-2,Caspase-3 relative expression(n=3)
本次实验结果显示TAE 组肝功能明显下降,病理图片中凋亡细胞明显增多,而联合治疗组肝功能明显改善,病理图片中凋亡细胞明显减少,提示TAE 术后肝功能不同程度受损,匹立尼酸具有改善TAE 术后肝功能不全的效果,与以往的实验结果相符。丙二醛(Malondialdehyde,MDA)的含量可以反映氧化应激损伤的严重程度[18]。SOD、GSH-Px、CAT 是抗氧化损伤的主要防御系统[19],其中超氧化物歧化酶尤为重要,目前人体内发现的SOD 分为三类,包括SOD1、SOD2、SOD3,研究发现酵母菌SOD1 和SOD2 缺乏时更容易受氧化应激影响,尤其是SOD1 缺乏[20-21]。TAE 术后MDA 含量明显增加,抗氧化酶SOD、GSH-Px、CAT 活性明显降低,直接和间接的提示TAE 术后癌旁肝组织ROS产生过多,抗氧化能力减弱,而预先使用匹立尼酸后癌旁肝组织ROS 产生明显减少,抗氧化酶活性明显增强,同时SOD1 的mRNA 和蛋白表达也明显增高,提示匹立尼酸可以减少ROS 的产生,增强抗氧化酶的活性,同时也可以促进SOD1 的表达。TAE 术后癌旁肝组织Bcl-2 表达明显减少,Caspase-3 表达明显增加,细胞凋亡增加,预先使用匹立尼酸后Bcl-2 表达明显增加,Caspase-3 表达明显减少,提示匹立尼酸可以促进抗凋亡因子Bcl-2 的表达,抑制Caspase-3 的表达。COLLINO 等[22]、BARLAKA 等[23]研究表明PPAR-α激动剂WY-14643 通过抑制氧化应激和炎症反应,减少细胞凋亡,从而缓解小鼠大脑、心脏缺血/再灌注损伤。非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)如今成为了导致HCC的主要危险因素[24],PANTAZI等[25]发现PPAR-α激动剂WY-14643 可以通过抗氧化应激作用来抑制小鼠NAFLD 的缺血/再灌注损伤,减少细胞凋亡,并可防止NAFLD 演变为HCC。以上结果表明WY-14643 可以减轻损伤保护肝脏,本次实验结果之相符,但是WOODS 等[26]发现PPAR-α激动剂WY-14643会诱导小鼠肝脏氧化应激损伤。不过与本文类似的研究结果绝大多数都与前者相符,此外,类似的研究基本上是用小鼠建模,而本次研究则是通过兔建模并发现了PPAR-α激动剂匹立尼酸可以增强抗氧化酶的活性并增加SOD1 的表达来抑制氧化应激,增加Bcl-2 和减少Caspase-3 表达来减少细胞凋亡,从而改善肝组织缺血/再灌注损伤,缓解TAE 术后肝功能损伤。线粒体参与的凋亡是最为重要的细胞凋亡途径,ZHOU 等[27]研究发现ROS 的增加可以抑制PI3K/Akt,使得线粒体膜上的Bax 表达增加,Bcl-2 表达减少,最终导致线粒体Caspase-9、Caspase-7、Caspase-3 释放增加,导致细胞凋亡;同时Akt 降低可引起p53 升高,p21 减低,cdc2 和CyclinB1 降低,导致细胞周期停滞(G2/M 期),由此推测PPAR-α激动剂WY-14643 也可能通过调节ROS/PI3K/Akt 通路来缓解细胞凋亡,同时对细胞周期可能也有调节作用,使得细胞周期停滞,一定程度上可能具有抑制肿瘤细胞生长的作用。ZHANG 等[28]研究发现通过激活JAK2/STAT3 通路,可以增强机体抗氧化酶,从而缓解缺血再灌注所致的氧化应激损伤,减少心肌细胞凋亡,结合本研究结果,推测WY-14643 也可能通过激活PPAR-α来增加JAK2/STAT3表达,从而增强机体抗氧化酶(S0D、GSH-Px、CAT),缓解氧化应激损伤,减少正常肝细胞凋亡。本研究发现不同通路都与ROS 过多所致的氧化应激关系密切,因此,如何有效减少ROS 是缓解缺血/再灌注所致细胞凋亡的关键。
PPAR-α改善氧化应激和细胞凋亡的调节机制比较复杂,本研究的相关因子较为表浅,对于PPAR-α具体是如何通过调节相关因子转录来改善氧化应激和细胞凋亡还需应用基因敲除、相关因子抑制剂等技术进一步研究。在实验设计方面略为简单。同时本次实验也缺乏ROS 含量的直接测量指标。
综上所述,PPAR-α激动剂匹立尼酸可以一定程度的改善TAE 术后兔癌旁正常肝组织因氧化应激和细胞凋亡所致的肝功能下降,对于临床上肝癌TAE 术后患者肝功能不全的预防及治疗具有重要意义,但是具体机制还需进一步研究。

