抑制p38/p53信号通路对癫痫大鼠神经元损伤的保护作用
夏杰 徐小敏 张其梅
三峡大学第一临床医学院&宜昌市中心人民医院神经内科(湖北宜昌443000)
癫痫是常见的神经系统慢性发作性疾病,其发病机理尚未完全明确。已证明海马神经元变性和死亡是癫痫的特征性病理改变之一,海马神经元的损伤会进一步促进癫痫的发生发展[1-2]。海马神经元损伤的主要方式之一是细胞凋亡,信号转导通路的异常激活可促进神经元凋亡[3]。p38是丝裂素活化蛋白激酶(mitogen activated protein kinases,MAPKs)家族重要成员,激活后发生核转位,对许多蛋白激酶和转录因子具有磷酸化激活的作用,在细胞凋亡中发挥重要的作用[4]。p53 蛋白是p38 的下游转录因子,主要功能是使细胞程序性凋亡,对细胞分裂增殖起负性调控作用。研究发现,上调p53 的表达可以诱导肿瘤细胞凋亡,抑制p38/p53 通路可保护缺血性卒中神经元的凋亡[5-6]。本研究以氯化锂-匹罗卡品癫痫大鼠为实验对象,观察p38/p53 信号通路在海马神经元中的活化规律,探讨抑制该信号通路对癫痫持续状态(status epilepsy,SE)后神经元损伤保护作用的机制,从信号转导的角度来研究癫痫的形成和发展。
1 材料与方法
1.1 实验动物健康雄性SD 大鼠40 只,鼠龄1月龄,体质量180 ~220 g,由三峡大学医学院动物实验中心提供,符合国家医用动物使用标准(许可证编号:SCXK(鄂)2017-0012,级别:清洁级),所有实验操作严格按照三峡大学医学院动物伦理委员会要求进行。
1.2 分组及模型建立40 只SD 大鼠随机分为正常对照组4 只,癫痫组、抑制剂组、二甲亚枫(DMSO)溶剂对照组各12 只,每组中癫痫发作后30 min、2 h和6 h各4只。癫痫组大鼠清醒状态下腹腔注射氯化锂(美国Sigma 公司,127 mg/kg),20 h后再腹腔注射匹罗卡品(MCE 公司,50 mg/kg);抑制剂组在匹罗卡品注射前30 min预先腹腔注射p38特异性抑制剂SB203580(MCE 公司,15 mg/kg),SB203580 溶于生理盐水+2%DMSO(基因科技上海有限公司)中,配制成浓度为3 g/L 的溶液。DMSO溶剂对照组腹腔注射等量生理盐水+2%DMSO,正常对照组腹腔注射等量生理盐水。发作程度按Racine 评分[5]标准判断,评分达Ⅳ-Ⅴ级大鼠纳入研究。观察到Ⅳ级发作开始计时,分别于30 min、2 h 及6 h 进行脑组织标本取材制作。
1.3 标本制备在设计的时间节点,四组大鼠用10%水合氯醛(0.33 mL/100 g)腹腔注射麻醉,经生理盐水及4%多聚甲醛持续灌注固定。Paxinox 立体定位图谱取标本组织,每块厚约2 mm。脑组织进行脱水、石蜡包埋等处理,做连续冠状切片,切片厚4 μm。
1.4 免疫组化染色采用链霉卵白素-过氧化物酶法(SP 法)。兔抗大鼠p38MAPK 多克隆抗体(1∶200 μL,Servicebio 公司)、兔抗大鼠p-p38MAPK 多克隆抗体(1∶200 μL,Servicebio 公司)、兔抗大鼠p53 抗体(1∶200 μL,Abbkine 公司)、兔抗大鼠pp53 抗体(1∶200 μL,Abcam 公司)、HRP 标记山羊抗兔二抗(1∶200 μL,Servicebio 公司)、DAB 显色试剂盒(Servicebio 公司),具体步骤按说明书进行。阴性对照以等量磷酸盐缓冲液(PBS)代替一抗,其余同上。
1.5 组织病理学观察标本制成常规石蜡切片,HE 染色,光学显微镜下观察四组大鼠海马CA1 及CA3 区病理变化。
1.6 统计学方法400倍光镜下取大鼠海马CA1区连续6 个不重复的视野,计数p38/p-p38、p53/p-p53免疫反应阳性细胞。所有数据整理后导入SPSS 20.0 进行统计分析。数据用均数±标准差表示,组间均数比较采用单因素方差分析,P<0.05 表示差异有统计学意义。
2 结果
2.1 p38 抑制剂对大鼠达癫痫Ⅳ级发作潜伏期的影响癫痫组大鼠、DMSO 溶剂对照组、抑制剂组达癫痫Ⅳ级发作潜伏期的时间分别为(33.33 ±1.15)、(35.33 ± 1.52)、(42.67 ± 2.08)min。与癫痫组大鼠相比,抑制剂组达到癫痫Ⅳ级的发作潜伏期延长,差异有统计学意义(P<0.05,表1),DMSO组与癫痫组相比,差异无统计学意义(P>0.05,表1)。
表1 p38 抑制剂对大鼠达癫痫Ⅳ级发作潜伏期影响Tab.1 p38 inhibitor influence on the latent period of epileptic grade Ⅳseizures in rat±s

表1 p38 抑制剂对大鼠达癫痫Ⅳ级发作潜伏期影响Tab.1 p38 inhibitor influence on the latent period of epileptic grade Ⅳseizures in rat±s
注:*P <0.05,与癫痫组相比差异有统计学意义;##P >0.05,与癫痫组相比差异无统计学意义
别大鼠达到癫痫Ⅳ级发作潜伏期(min)##组DMSO 溶剂对照组癫痫组抑制剂组35.33±1.52 33.33±1.15 42.67±2.08*
2.2 组织病理学观察正常对照组大鼠海马神经元细胞陈列齐整、形态规则,胞质丰富,胞核位于中央,核仁清楚。癫痫组大鼠海马神经元细胞排列紊乱,胞体缩小,胞核固缩,细胞间隙增宽,严重时细胞脱失,胞浆空泡变性等。抑制剂组也有不同程度神经元细胞变性坏死,但程度较癫痫组轻。见图1。
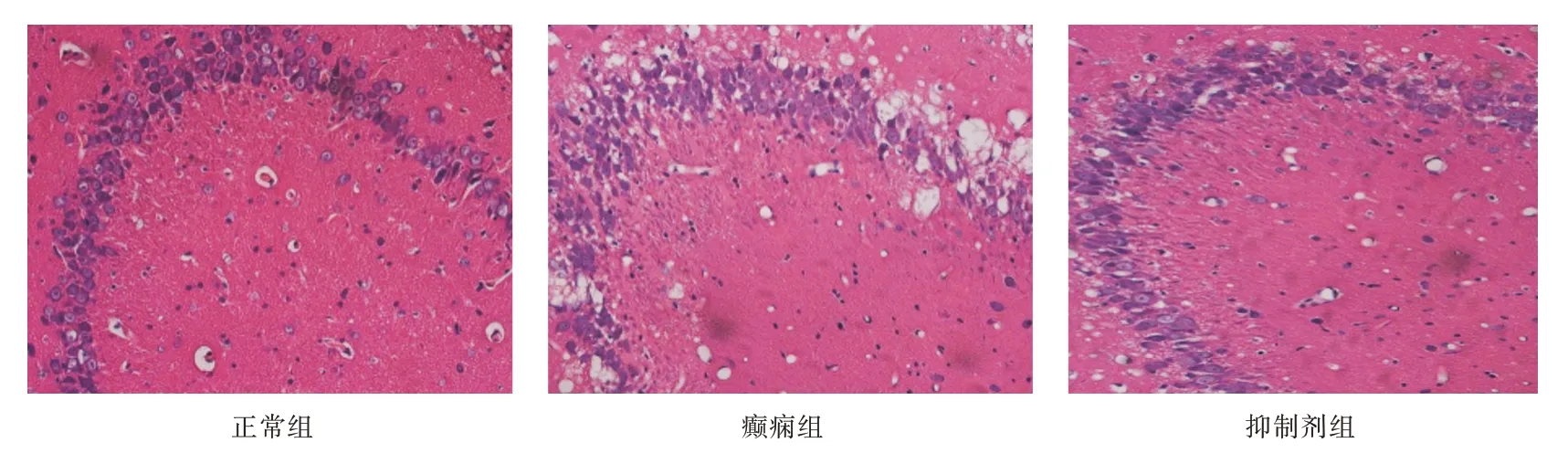
图1 HE 染色观察正常组、癫痫组(2 h)及抑制剂组(2 h)大鼠CA3 区病理学变化(×200)Fig.1 HE staining to observe the normal group,the epilepsy group(2 h)and inhibitor group(2 h)organization pathology change in CA3 region of rat(×200)
2.3 p38/p-p38 免疫组化检测正常对照组中,海马CA1 区可见部分p38/p-p38 阳性细胞。癫痫组大鼠SE 30 min 后,p38/p-p38 阳性细胞增多,呈棕黄色颗粒状,2 h 时达到峰值,呈簇团样密集分布(图2),6 h 后阳性细胞数减少,癫痫组各时间点p38/p-p38 阳性细胞数较对照组增多,差异有统计学意义(P<0.05,表2)。抑制剂组p38/p-p38 阳性细胞数同样在SE 30 min 增多,2 h 达高峰,6 h 减少,与同阶段癫痫组相比减少,差异具有统计学意义(P<0.05,表2)。
表2 大鼠海马CA1 区p38、p-p38 阳性细胞数Tab.2 Number of p38 and p-p38 positive cells in hippocampal CA1 region of rats±s
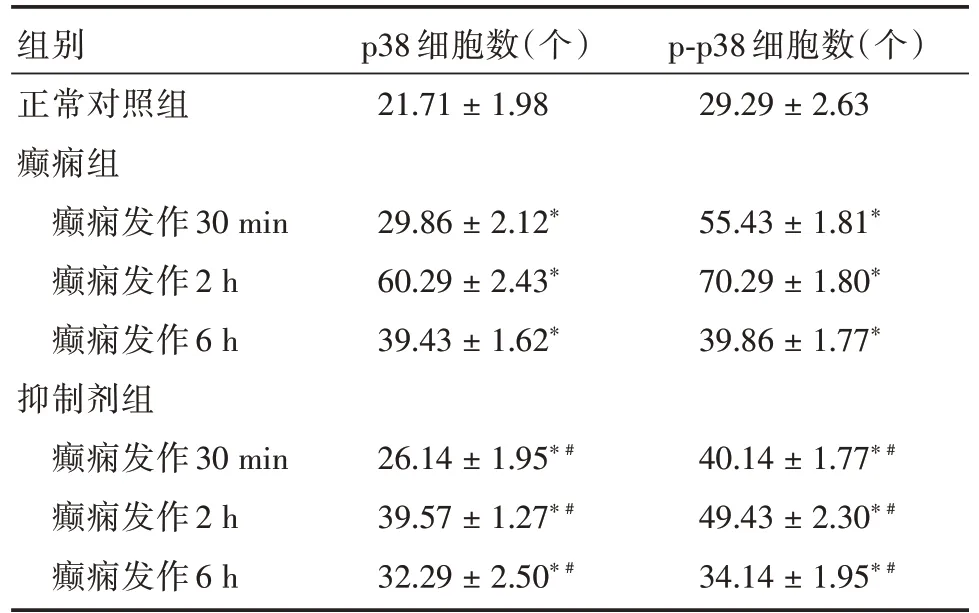
表2 大鼠海马CA1 区p38、p-p38 阳性细胞数Tab.2 Number of p38 and p-p38 positive cells in hippocampal CA1 region of rats±s
注:*P <0.05,与对照组相比差异有统计学意义;#P <0.05,与同阶段癫痫组相比差异有统计学意义
p38 细胞数(个)p-p38 细胞数(个)对照组21.71±1.9829.29±2.63组别正常癫痫组癫痫发作30 min癫痫发作2 h癫痫发作6 h抑制剂组癫痫发作30 min癫痫发作2 h癫痫发作6 h 29.86±2.12*60.29±2.43*39.43±1.62*26.14±1.95* #39.57±1.27* #32.29±2.50* #55.43±1.81*70.29±1.80*39.86±1.77*40.14±1.77* #49.43±2.30* #34.14±1.95* #
2.4 p53/p-p53 免疫组化检测正常对照组中,海马CA1 区偶有p53/p-p53 阳性细胞。癫痫组大鼠SE 30 min后,阳性细胞数增多,呈棕黄色小颗粒样,2 h 后阳性细胞继续增多,呈密集样排列(图2),6 h 后阳性细胞数达峰值,与正常对照组比,癫痫组各时间点p53/p-p53 阳性细胞数增多,差异有统计学意义(P<0.05,表3)。抑制剂组p53/p-p53阳性细胞数在SE 30 min 开始增多,6 h 达高峰,与同阶段癫痫组相比减少,差异有统计学意义(P<0.05,表3)。
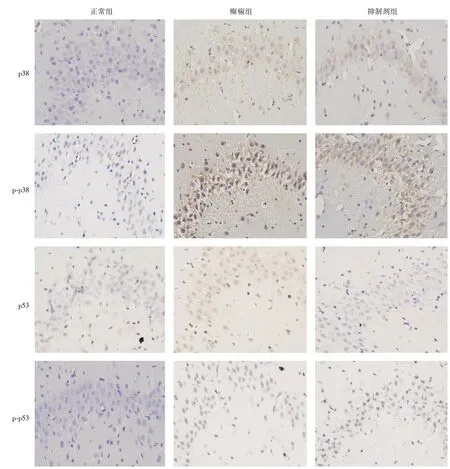
图2 免疫组化检测p38/p-p38/p53/p-p53 在正常组、癫痫组(2 h)及抑制剂组(2 h)大鼠CA3 区表达情况(×400)Fig.2 Immunohistochemical detection of p38/p-p38/p53/p-p53 expressionin normal group,in EP group(2 h)and inhibitor group(2 h)in CA3 region of rats(×400)
表3 大鼠海马CA1 区p53、p-p53 阳性细胞数Tab.3 Number of p53 and p-p53 positive cells in hippocampal CA1 region of rats ±s
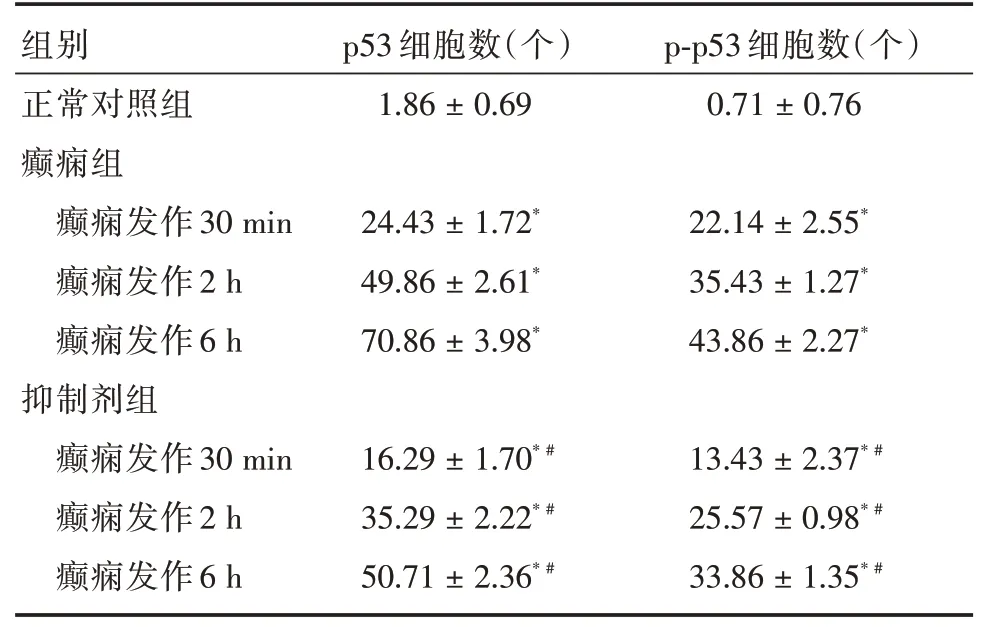
表3 大鼠海马CA1 区p53、p-p53 阳性细胞数Tab.3 Number of p53 and p-p53 positive cells in hippocampal CA1 region of rats ±s
注:*P <0.05,与对照组相比差异有统计学意义;#P <0.05,与同阶段癫痫组相比差异有统计学意义
组别正常对照组癫痫组癫痫发作30 min癫痫发作2 h癫痫发作6 h抑制剂组癫痫发作30 min癫痫发作2 h癫痫发作6 h p53 细胞数(个)1.86±0.69 24.43±1.72*49.86±2.61*70.86±3.98*16.29±1.70* #35.29±2.22* #50.71±2.36* #p-p53 细胞数(个)0.71±0.76 22.14±2.55*35.43±1.27*43.86±2.27*13.43±2.37* #25.57±0.98* #33.86±1.35* #
3 讨论
氯化锂-匹罗卡品诱发癫痫动物模型已成为实验研究SE 和颞叶癫痫的理想模型[8-9]。而Racine评分的分级标准也是主要的评判大鼠造模过程中癫痫发作轻重程度的工具[5]。本实验成功建立匹罗卡品癫痫持续状态模型,给予p38 抑制剂,观察各组大鼠癫痫发作达到Ⅳ级发作潜伏期,结果显示p38 抑制剂可以有效延缓潜伏期。
癫痫发作后海马出现多种病理生理变化,包括神经元丢失、胶质细胞增生、苔藓纤维出芽、突触传递改变、炎性细胞浸润、血管再生、离子通道的改变等[11]。海马神经元损伤会进一步促进癫痫的发生发展。反复的癫痫发作诱发海马齿状回区苔藓纤维出芽(mossy fiber sprouting,MFS),形成异常兴奋性突触回路,反过来又进一步加重海马神经元损伤[11]。癫痫后海马神经元的损伤也可以引起认知功能的损害[12]。实验显示癫痫发作后海马CA1 区和CA3 区均出现不同程度神经元细胞变性坏死,而抑制剂组大鼠海马神经元细胞病变程度较癫痫组轻,提示p38 抑制剂对癫痫发作海马损伤有一定保护作用。
MAPK 是细胞外信号引起细胞核反应的共同转导通路,也是能够引起细胞产生相应生物学作用的重要信号传导通路[13]。p38 信号转导通路在MAPK 家族中拥有重要地位,它既能在介导炎症刺激、应激反应中发挥特别的作用,也能在细胞存活、分化和发育等过程中发挥关键的作用。研究证实,使用极低剂量的SB203580 干预处理培养的神经细胞30 min,可观察到p38 通路受到抑制[14]。研究表明p38 抑制剂SB203580 能选择性抑制p38通路的激活,减少大鼠癫痫发作并保护海马神经元,提示p38 通路与大脑抗癫痫机制有相关性[15]。本研究中观察到注射抑制剂后大鼠海马区p38/pp38 免疫反应阳性细胞数相应减少,提示SB203580可以抑制p38 途径正常激活转导通路。
p53是一种序列特殊的转录因子,在各种形式的细胞应激下,p53 激活可抑制细胞生长和促进细胞死亡。在癫痫损伤神经元中p53表达升高[16]。研究发现癫痫发作后许多凋亡的神经元锥体细胞聚集在海马CA1 区,锥体细胞内可见p53 蛋白表达升高[16]。研究发现,癫痫发作后miR-128 蛋白的促神经元凋亡机制与激活p53 级联信号通路有关,给予p53 抑制剂治疗后,miR-128 蛋白的促神经元损伤作用明显减轻[17]。本实验中观察到癫痫发作时间越长,海马区p53/p-p53 阳性细胞数增多越明显,注射p38 抑制剂后p53/p-p53 表达下调,同阶段神经元损伤也减轻,提示抑制p38 信号通路可能通过抑制p53 基因的转录活化,从而减轻了癫痫发作后神经元的细胞凋亡。
综上所述,p38/p53 信号通路可能在癫痫发作后海马神经元细胞的凋亡中扮演着重要的角色,抑制p38/p53 信号通路可以减轻氯化锂-匹罗卡品致痫大鼠海马神经元的损伤,对致痫后神经元的损伤具有一定保护作用,推测p38/p53 信号通路可能参与了癫痫的发生发展过程,但具体调控机制目前尚未明确,有待进一步研究。

