基于生理及寒热模型大鼠肠道菌群多样性变化的淫羊藿药性归属研究
卢 芳,闫静思,刘树民
基于生理及寒热模型大鼠肠道菌群多样性变化的淫羊藿药性归属研究
卢 芳1,闫静思2,刘树民3*
1. 黑龙江中医药大学继续教育学院,黑龙江 哈尔滨 150040 2. 黑龙江中医药大学研究生院,黑龙江 哈尔滨 150040 3. 黑龙江中医药大学中医药研究院,黑龙江 哈尔滨 150040
基于高通量测序技术探讨淫羊藿对生理状态及寒热模型大鼠肠道菌群多样变化的影响以判断淫羊藿的药性归属。取SD大鼠40只随机分为3部分,生理状态大鼠、热证模型大鼠及寒证模型大鼠。生理状态大鼠共10只,随机分为2组:空白组与淫羊藿组(SmQ);热证模型大鼠共15只,随机分为3组:空白组、热证模型组(RmcM)、热证模型淫羊藿组(RmcQ);寒证模型大鼠共15只,随机分为3组:空白组、寒证模型组(HMmc)、寒证模型淫羊藿组(HQmc)。分别采用优乐甲120 mg/kg及冰水游泳方式建立大鼠热证与寒证模型,SmQ组、RmcQ组和HQmc组自造模第1天起ig淫羊藿提取物(10 mL/kg),空白组给予等量生理盐水,连续给药15 d,之后取大鼠新鲜粪便进行肠道菌群多样性分析。淫羊藿可引起不同证候大鼠肠道菌群中OTUs数量、α多样性及主要菌门丰度的变化,同时通过β多样性分析可发现不同样本间的菌群结构出现显著性差异;同一样本间的菌群结构较为相似,表明实验所获得的样本可用于分析肠道菌群的变化。在门水平下,各模型淫羊藿组样本的拟杆菌门相对丰度均发生显著上升,厚壁菌门相对丰度发生显著下降,结合两菌门所具有的功能可对淫羊藿药性进行进一步推断。通过对不同证候大鼠肠道菌群多样性的综合分析,生品淫羊藿药性偏寒凉,这可为临床合理用药提供理论依据。
淫羊藿;肠道菌群;中药药性;高通量测序;证候
中药药性理论是对中药性质与功能的高度概括,以四气五味为其核心内容,此外还包括升降浮沉、归经、毒性等内容[1]。淫羊藿来源于小檗科植物淫羊藿Maxim.、箭叶淫羊藿(Sieb. et Zucc.) Maxim.、柔毛淫羊藿Maxim.或朝鲜淫羊藿Nakai的干燥叶,为临床常用的补肾药。淫羊藿首载于《神农本草经》,其性寒、味辛;而《本草纲目》中,李时珍对淫羊藿的描述为“味甘气香,性温不寒,能益精气”,同时根据《中国药典》2020年版记载,淫羊藿性温,味辛、甘,主入肝、肾经,具有补肾阳、强筋骨、祛风湿的功效[2]。与最初的记载相比,淫羊藿的药性描述存在较大变化,因此明确该药药性对临床用药具有指导作用。中药的“寒、热、温、凉”药性可通过药物作用后的机体反映概括得来[3],而肠道菌群对于维持人体健康具有重要作用,通过对比服药前后的肠道菌群差异可对药物的功能及性质进行推测。本课题组前期从物质及能量代谢的角度对其药性进行了初步研究[4],故本实验以Illumina MiSeq高通量测序平台为依托,从大鼠肠道菌群结构及多样性角度着手,研究生品淫羊藿对生理状态与寒热模型大鼠的影响,进一步分析淫羊藿的药性归属,为临床辨证用药提供理论依据。
1 仪器与材料
1.1 仪器与试剂
KDC-160HR型高速低温离心机(科大创新股份公司),RS232G型紫外分光光度计(Eppendorf公司),AL204电子天平(梅特勒-托利多仪器有限公司),超低温冰箱(赛默飞世尔科技中国有限公司),YP10001电子称(上海佑科仪器有限公司),DYY-6C型电泳仪,2720型聚合酶链式反应(PCR)仪(美国ABI公司),gdsAUTO520型凝胶成像系统和32RL117950型台式紫外分析仪(美国BG公司),FLx800型多功能酶标仪(美国BioTek公司),QuantiFluorTMTBS380型荧光计(美国Promega公司)。
TruSeq Nano DNA LT样品制备试剂盒(FC-121-4001、FC-121-4002),核酸纯化试剂盒(Agencourt AMPure XP Beads,批号A63881)和MiSeq测序试剂盒v2(600-cycles-PE,货号MS-102-3003)均购自Illumina公司;溴化乙锭 [生工生物工程(上海)股份有限公司,货号EX328-5 mL];强力土壤DNA提取试剂盒(美国MoBio,货号12888);Q5超保真DNA聚合酶(新英格兰生物有限公司);脱氧核糖核苷三磷酸(dNTP,10 mmol/L,上海派森诺生物科技有限公司);APGX-500G DNA 凝胶回收试剂盒(美国Axygen公司);文库检测及定量试剂盒(Invitrogen公司,批号75510-019);高灵敏度DNA检测试剂盒(Agilent公司,批号5067-4626)。
1.2 药物
淫羊藿药材购买于世一堂中药材有限公司,批号为140316,经黑龙江中医药大学中药资源学教研室王振月教授鉴定为小檗科植物淫羊藿Maxim.的干燥叶。优甲乐片(德国默克,批号20160815,规格50mg×100 片/盒),氯化钠注射液(吉林省都邦药业股份有限公司,批号1509290509)。
1.3 动物
SD雄性大鼠,SPF级,体质量(200±20)g,由黑龙江中医药大学实验动物中心提供,动物实验由黑龙江中医药大学实验动物管理与使用委员会批准(批准号2018043001),许可证编号SCXK(黑)2018-003。标准鼠饲料喂养,自由饮水,所有实验大鼠的使用严格遵守动物保护协会所规定的有关规定。实验动物监测系统环境为通风、避光、隔音、屏蔽状态,采用自动定时光控系统控制大鼠生活环境的明暗光照(12 h/12 h),室温(24±3)℃,湿度40%~70%,噪声≤40 dB,光照强度300 lx。
2 方法
2.1 供试药液的制备
2.1.1 淫羊藿提取物的制备 淫羊藿提取物由前期实验所得[5]。提取方法:将淫羊藿生药材于15倍蒸馏水中回流提取1 h,共2次;合并2次药液,滤过并减压浓缩至稠浸膏,出膏率约为21%。依照《中国药典》2020年版要求对供试药液进行测定,生品淫羊藿提取物中淫羊藿苷的质量分数为0.53%,根据成人每日临床最高用量10 g及出膏率计算大鼠给药剂量为0.175 g/kg,临用时以蒸馏水稀释,制成36 mg/kg的淫羊藿提取物溶液。
2.1.2 优甲乐溶液的制备 取优甲乐片剂研细,取粉末适量,精密称定,加入蒸馏水超声混悬,制成12 mg/mL的优乐甲溶液。
2.2 动物分组、造模与给药
2.2.1 动物的分组 SD大鼠40只随机分成3部分,供生理状态实验、热证模型大鼠实验及寒证模型大鼠实验用。生理状态实验大鼠随机分为2组:空白(K)组与淫羊藿组(SmQ),每组5只;热证模型实验大鼠随机分为3组:空白组、热证模型组(RmcM)、热证模型淫羊藿组(RmcQ),每组5只;寒证模型实验大鼠随机分为3组,包括空白组、寒证模型组(HMmc)与寒证模型淫羊藿组(HQmc),每组5只。
2.2.2 造模及给药 大鼠适应性饲养3 d后开始造模,热证模型实验中的RmcM组与RmcQ组大鼠ig给予120 mg/kg优甲乐。空白组大鼠ig给予等量蒸馏水,1次/d,连续15 d;寒证模型实验中的HMmc组与HQmc组大鼠在0 ℃冰水中游泳,当大鼠后腿僵直时结束,1次/d,连续15 d。SmQ组、RmcQ组和HQmc组大鼠从造模第1天开始ig淫羊藿提取物10 mL/kg,各实验中的空白组、RmcM组与HMmc组每天ig给予等量蒸馏水,连续15 d。实验进行至第14天,将各组大鼠放入实验动物监测系统中24 h,监测各组大鼠的氧气消耗量、CO2呼出量、产热量及能量转化率。
2.3 样本采集
末次给药后,将大鼠麻醉,随后截取大鼠盲肠段,取其内容物即新鲜粪便,于液氮中速冻并保存于超低温冰箱(−80 ℃)中。
2.4 粪便DNA提取及测序
利用强力土壤DNA提取试剂盒提取各样本的全部DNA,提取步骤严格按照说明书进行,提取结束后,利用0.8%琼脂糖凝胶电泳判断DNA分子大小,并通过紫外分光光度计对DNA进行定量。在干冰条件邮寄至上海派森诺生物科技有限公司进行测序。随后通过PCR扩增及其产物定量、文库构建、质检与定量获得合格的文库,最后在MiSeq机器上进行2×300 bp的双端测序。得到原始数据后,再经QIIME软件与Mothur软件等进行分析,最终得到各组实验样本菌群的分析与处理结果。
2.5 统计分析
3 结果
3.1 各组大鼠基础代谢情况
结果表明与空白组相比,淫羊藿对生理状态大鼠的基础代谢无显著影响。在热证模型实验中,RmcM组大鼠的产热量、CO2呼出量及能量转化率较空白组均显著升高,表明热证大鼠造模成功;与RmcM组相比,RmcQ组大鼠的CO2呼出量显著降低。在寒证模型实验中,HMmc组大鼠的产热量、CO2呼出量、氧气消耗量及能量转化率较空白组均显著降低;与HMmc组相比,HQmc组大鼠各项指数未发生显著变化。见表1~3。
3.2 淫羊藿提取物对生理状态大鼠肠道菌群多样性的影响
3.2.1 2组大鼠样本肠道菌群的OTUs(operational taxonomic units)划分与分析 空白组共有2650个OTUs,独有1433个OTUs,SmQ组有2099个OTUs,独有882个OTUs,2组共有1217个OTUs,如图1所示。与空白组相比,SmQ组OTUs数量显著降低。
3.2.2 2组大鼠样本肠道菌群的α多样性分析 如图2-A~C所示,各组样本的多样性几近饱和,表明测序深度足够,同时各组样本量已足以反应群落的丰富度。将2组样本的生物多样性指数进行比较,如表4所示,与空白组相比,SmQ组的丰富度指数Chao1与多样性指数Shannon均显著升高(<0.05、0.01)。
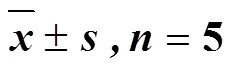
表1 生理状态大鼠基础代谢情况()
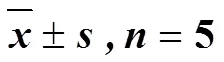
表2 热证模型大鼠基础代谢情况()
与空白组比较:*<0.05**<0.01;与RmcM组比较:#<0.05
*< 0.05**< 0.01blank group;#< 0.05RmcM group

表3 寒证模型大鼠实验基础代谢实验结果()
与空白组比较:*<0.05**<0.01,表4同
*< 0.05**< 0.01blank group, same as below Table 4
3.2.3 2组大鼠样本肠道菌群的分类学组成分析 空白组肠道菌群隶属于11个门、61个属,SmQ组肠道菌群隶属于13个门、63个属,如图3所示。结合图4进一步分析,与空白组相比,门水平下SmQ组中的厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)丰度水平显著上调,放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和疣微菌门(Verrucomicrobia)丰度水平显著下调。属水平下SmQ组中的棒杆菌属(<0.01)、阎氏菌属(<0.05)、粘放线菌里斯滕森菌属(<0.05)、嗜碱菌属(<0.01)、柯林斯氏菌属(<0.05)、拟杆菌属(<0.01)、副拟杆菌属(<0.01)、丁酸弧菌属(<0.01)、芽孢杆菌属(<0.01)、球菌属(<0.01)、肠球菌属(<0.01)、乳杆菌属(<0.01)、克(<0.01)、布劳特氏菌属(<0.05)、考拉杆菌属(<0.01)、粪芽孢菌属(<0.01)、霍尔德曼氏菌属(<0.05)、萨特氏菌属(<0.05)、冷杆菌属(<0.05)丰度水平显著上调;苏黎世杆菌属(<0.05)、粪球菌属(<0.05)、毛螺菌属(<0.05)、罗斯拜瑞氏菌属(<0.05)、粪杆菌属(<0.01)、颤螺旋菌属(<0.01)、支原体属(<0.01)丰度水平显著下调。
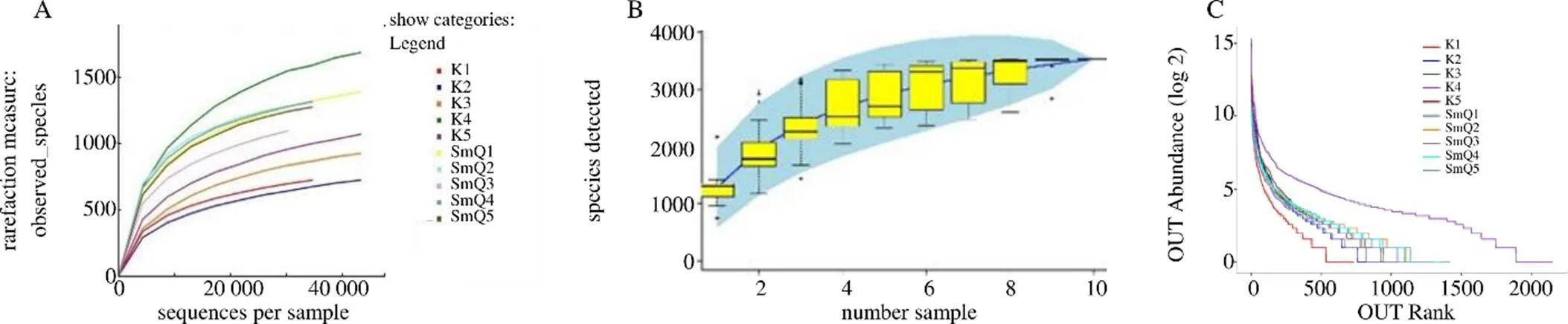
图2 生理状态大鼠样本肠道菌群的稀疏曲线(A)、物种累积曲线(B)、丰度等级曲线(C)
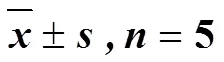
表4 生理状态大鼠肠道菌群微生物多样性指数()
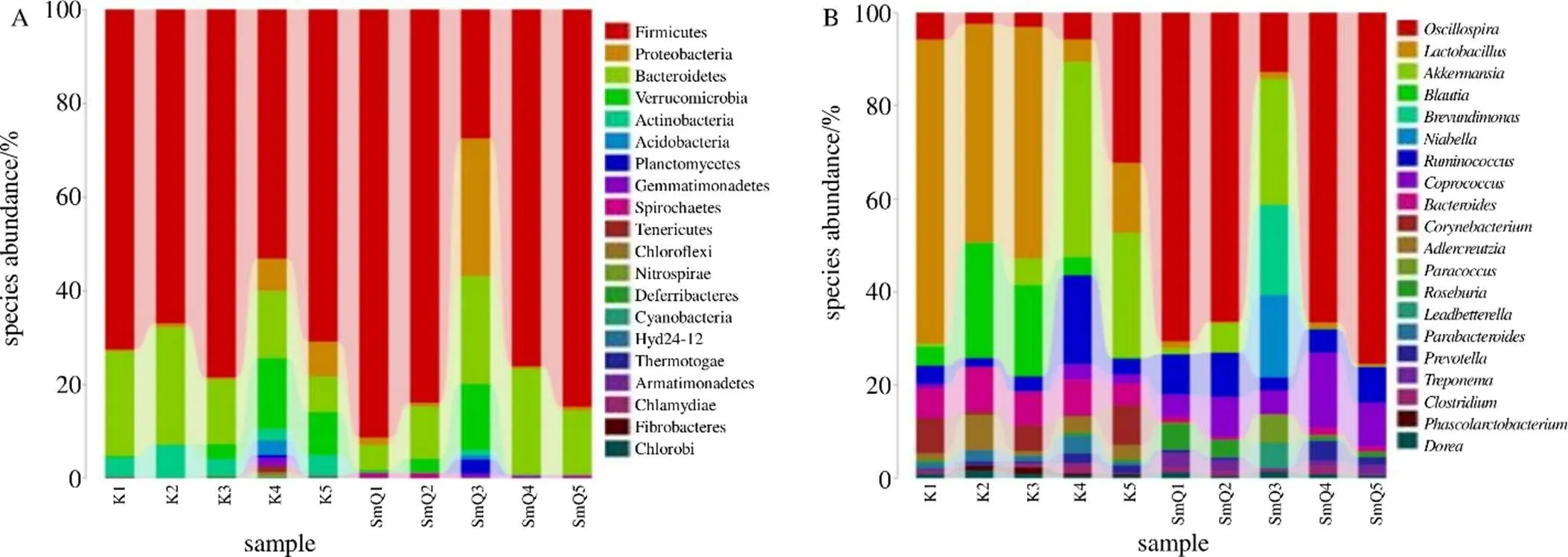
图3 生理状态大鼠样本肠道菌群在门(A) 和属(B) 水平下丰度分布
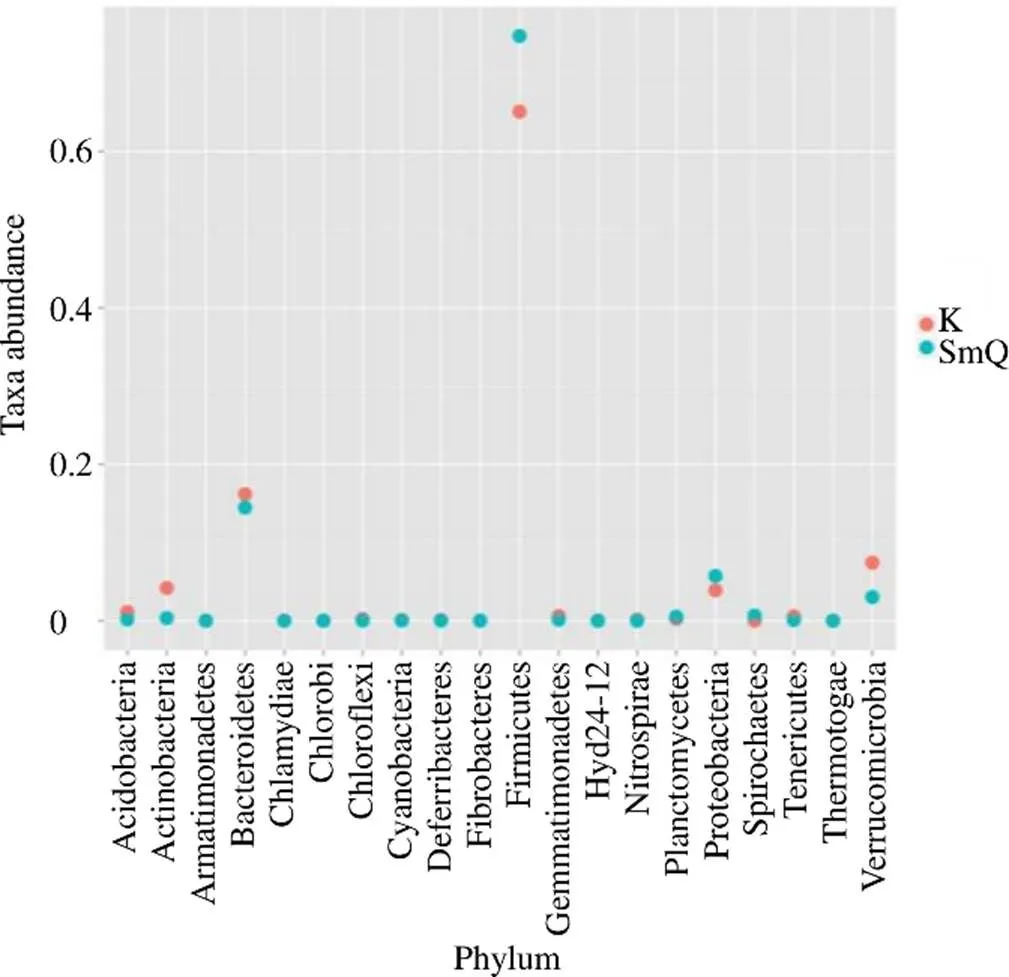
图4 生理状态大鼠样本肠道菌群具有显著差异的菌门
3.2.4 2组大鼠样本肠道菌群的LEfse(linear discriminant analysis effect size)分析 根据LEfSe分析,可确定2组间具有丰富度差异的菌群种类,如图5所示。在空白组中,丰度较高的菌属有、拟杆菌属、芽孢杆菌属、嗜碱菌属、乳杆菌属、、克里斯滕森菌属、、丁酸弧菌属、粪芽孢菌属、布劳特氏菌属、球菌属、考拉杆菌属、柯林斯氏菌属、、副拟杆菌属、霍尔德曼氏菌属、棒杆菌属、萨特氏菌属、肠球菌属。在SmQ组中,丰度较高的菌属有、、、粪球菌属、粪杆菌属、罗斯拜瑞氏菌属、苏黎世杆菌属、颤螺旋菌属、、。
3.2.5 2组大鼠样本肠道菌群的β多样性分析 如图6-A所示,各组样本基本存在于各自区域内,表明组内样本间的肠道菌群具有较强的相似性。在图6-B中,组间差异显著高于组内差异,表明2组间样本的肠道菌群结构多样性存在明显差异,即淫羊藿提取物可对生理状态大鼠的肠道菌群产生影响。
3.2.6 2组大鼠样本肠道菌群比较分析 如图7所示,通过偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA),空白组与SmQ组各自聚类,且2组显著分开,表明2组间的肠道菌群结构及多样性具有明显差异。
3.3 淫羊藿提取物对热证模型大鼠肠道菌群多样性的影响
3.3.1 3组大鼠样本肠道菌群的OTUs划分与分析 热证模型实验共分为3组,其中空白组共有2220个OTUs,独有498个OTUs,RmcM组共有1643个OTUs,独有8个OTUs,RmcQ组共有1715个OTUs,独有11个OTUs,3组共有的OTUs为1531个,如图8所示。与空白组相比,RmcM组和RmcQ组OTUs显著降低,但RmcQ具有一定回调趋势。
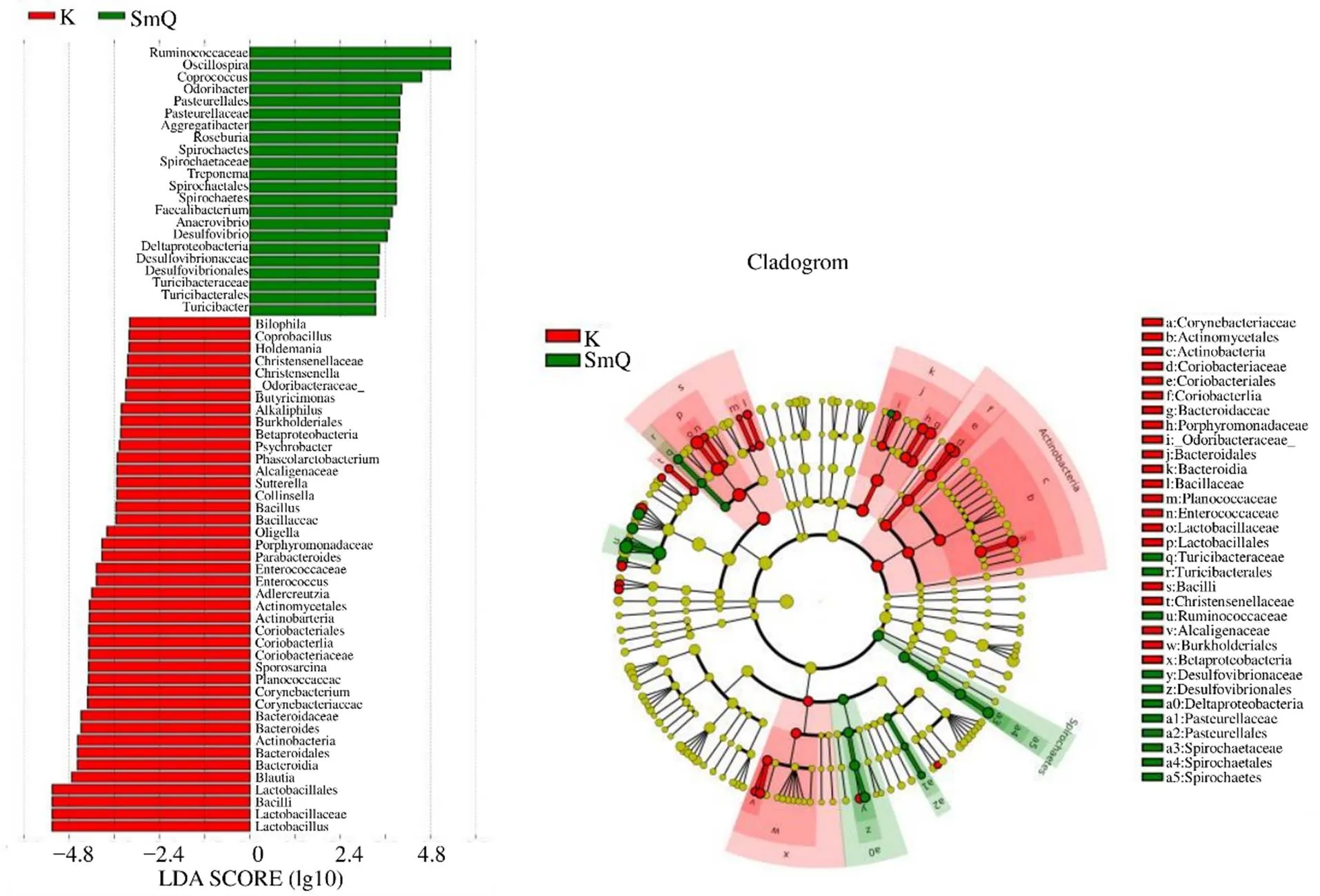
图5 生理状态大鼠样本肠道菌群的LEfSe多级物种差异判别分析
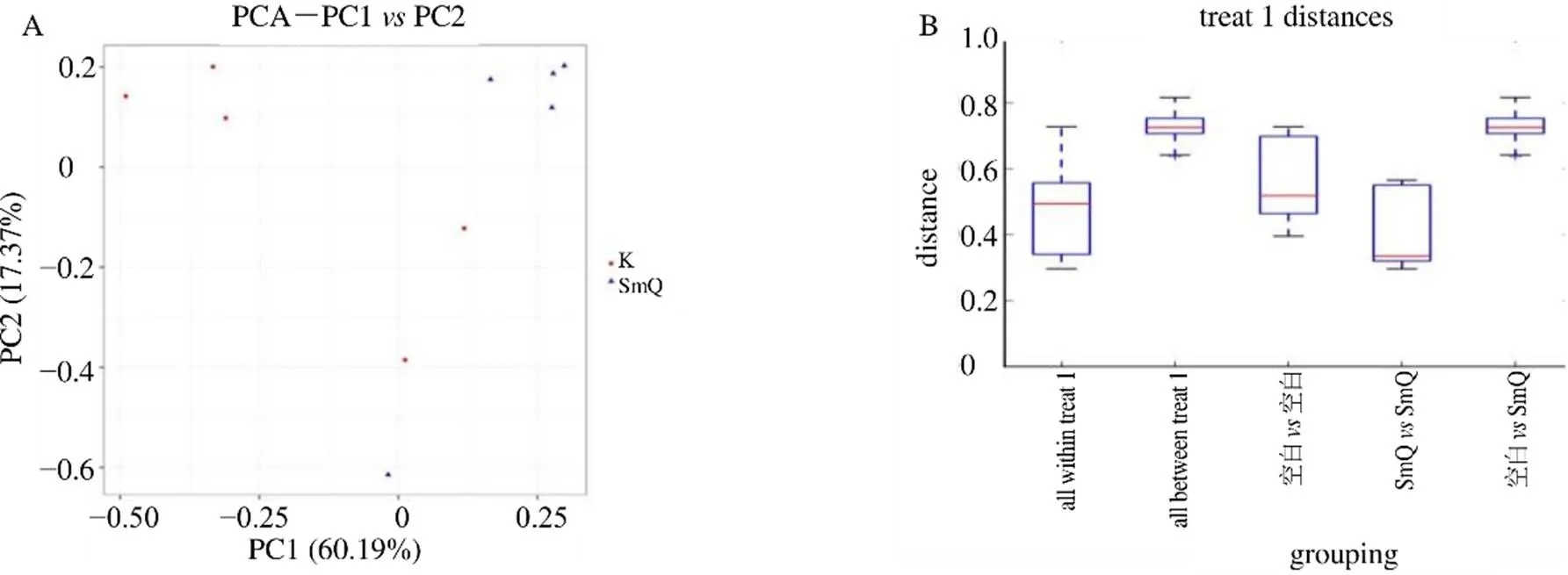
图6 生理状态大鼠样本肠道菌群β多样性分析
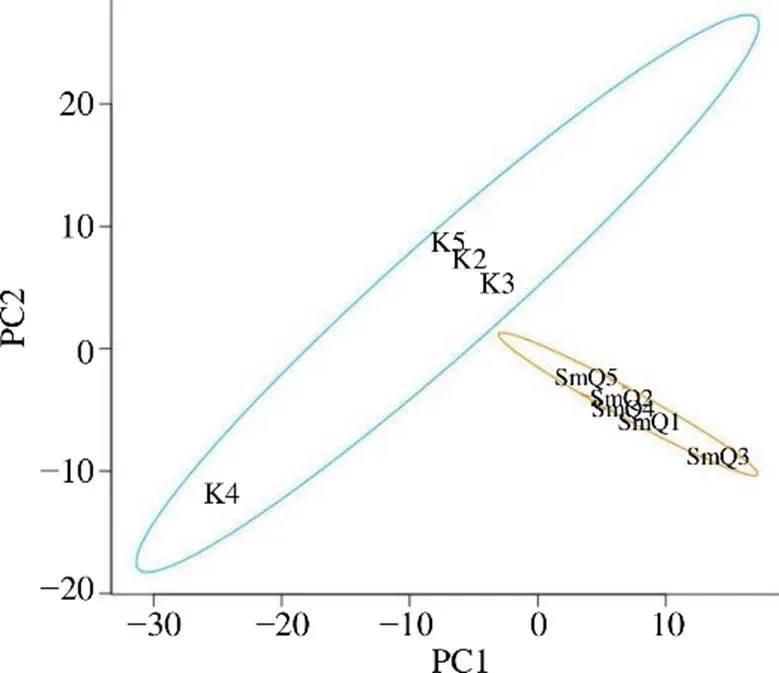
图7 生理状态大鼠样本肠道菌群PLS-DA
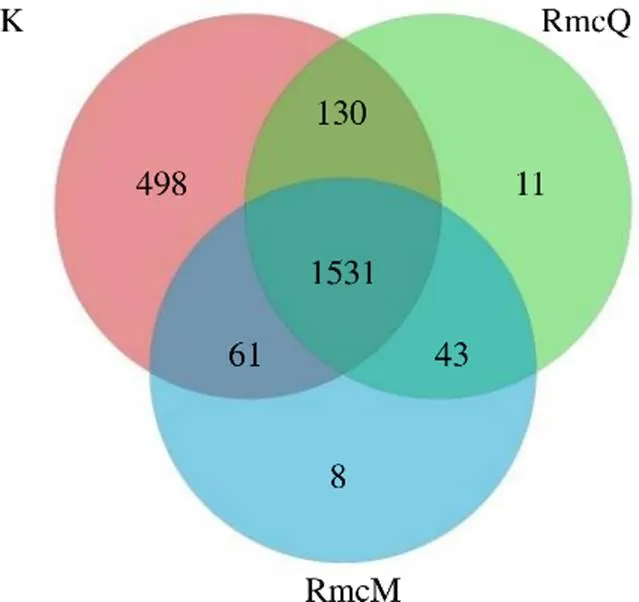
RmcQ-热证模型淫羊藿组 RmcM-热证模型组,下图同
3.3.2 3组大鼠样本肠道菌群的α多样性分析 如图9-A~C所示,曲线趋于平坦,表明样本量足以反应群落丰富度,同时测序深度足以反映样本的多样性。从图9-C可以看出RmcM组肠道菌群丰度显著低于空白组,但RmcQ组丰度曲线介于RmcM组和空白组之间,说明有上调肠道菌群丰度的作用,可见经淫羊藿治疗后RmcM组群落的均匀度被拉伸,丰富度显著增加。与空白组相比,RmcM组Chao1和ACE指数值有所降低,多样性指数无明显差异。与RmcM组比较,RmcQ组Chao1与ACE指数值有所回升,但3组间的指数差异并不具显著性,见表5。
3.3.3 3组大鼠样本肠道菌群的分类学组成分析 空白组肠道菌群隶属于10个门、50个属;RmcM组肠道菌群隶属于8个门、48个属;RmcQ组肠道菌群隶属于8个门、49个属。如图10所示,在门水平下,空白组、RmcM组、RmcQ组具有显著性差异的有拟杆菌门、厚壁菌门和疣微菌门,其中RmcQ组拟杆菌门的丰度水平呈上调趋势,厚壁菌门和疣微菌门呈下调趋势;各组丰度水平排序结果如下:在拟杆菌门中为RmcQ组>RmcM组>空白组;在厚壁菌门中为RmcM组>空白组>RmcQ组;在疣微菌门中为空白组>RmcM组>RmcQ组。结合图11分析,在属水平下,与空白组相比,RmcM组中考拉杆菌属(<0.05)的丰度水平显著性下降;与RmcM组相比,RmcQ组中嗜碱菌属与戴沃斯菌属(<0.05)的丰度水均显著下降。
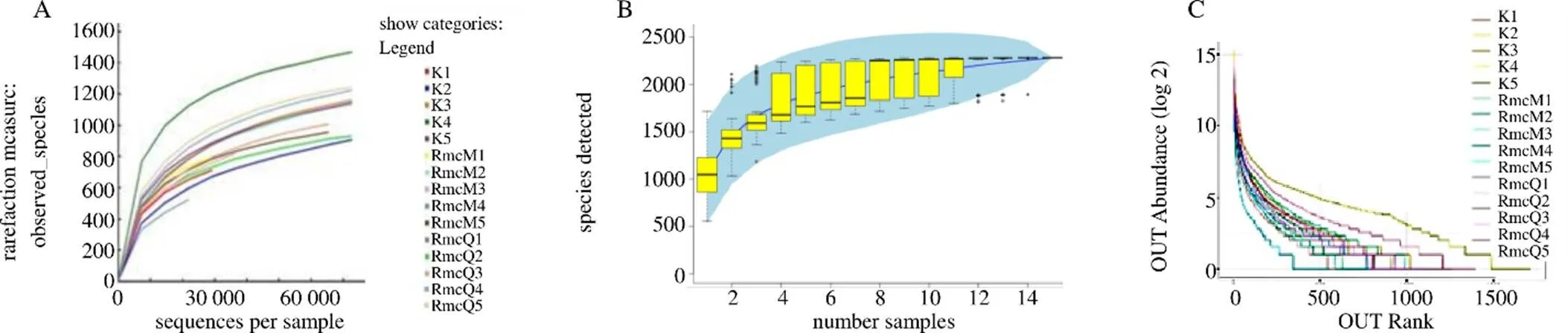
图9 热证模型大鼠样本肠道菌群的稀疏曲线(A)、物种累积曲线(B)、丰度等级曲线(C)
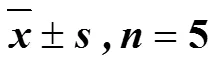
表5 热证模型实验菌群微生物多样性指数()
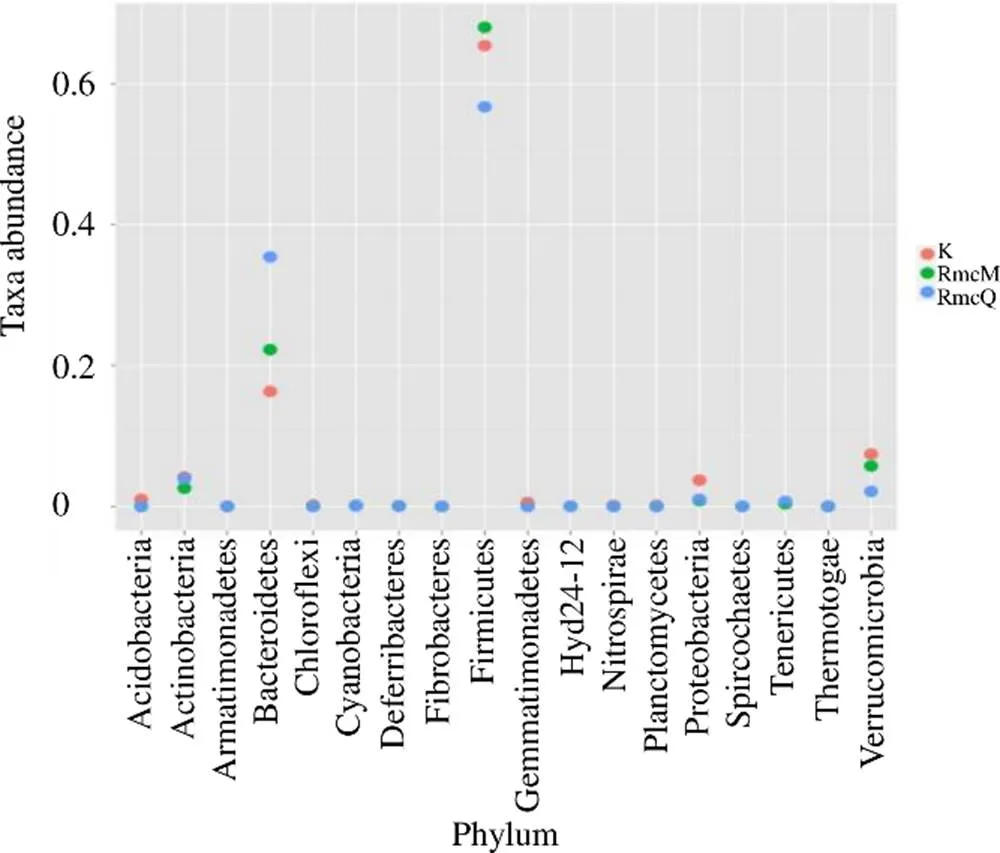
图10 热证模型大鼠样本间肠道菌群具有显著差异的菌门
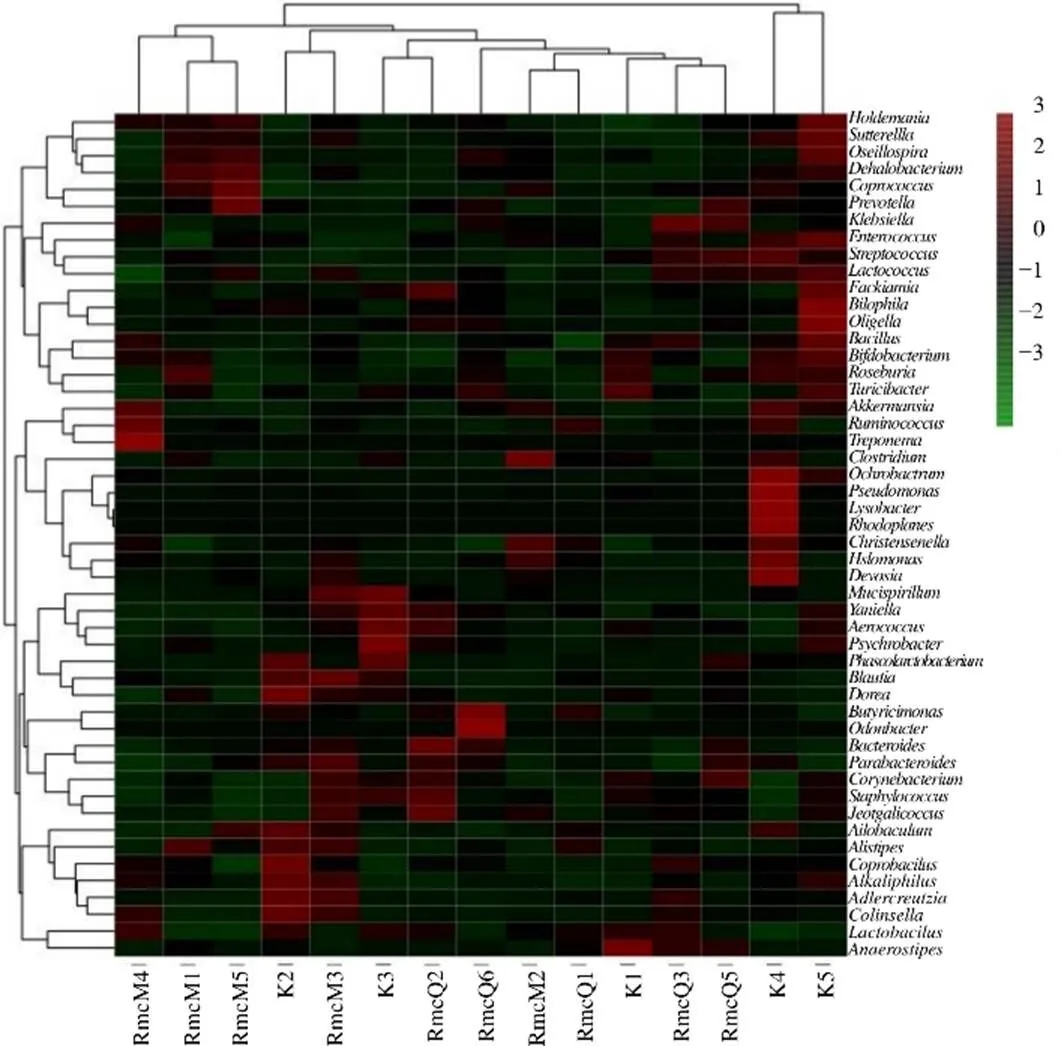
图11 热证模型大鼠样本肠道菌群属水平的群落分类丰度分布热图
3.3.4 3组大鼠样本肠道菌群的β多样性分析 基于UniFrac距离的样本聚类分析以等级树的形式表现各组样本间的相似性,样本间分支越短,两样本越相似,如图12所示。与RmcM组相比,空白组多数样本与RmcQ组样本间分支长度更短,表明2组间群落结构具有明显相似性。
3.3.5 3组大鼠样本肠道菌群比较分析 通过PLS-DA,如图13所示,空白组、RmcM组、RmcQ组3组各呈类聚现象,且空白组和RmcM组无明显交叉,表明RmcM组菌群群落有明显变化,RmcQ组和空白组有所交叉,具有一定共线性,表明对热证模型大鼠肠道菌群有回调作用。
3.4 淫羊藿提取物对寒证模型大鼠肠道菌群多样性的影响
3.4.1 3组大鼠样本肠道菌群的OTUs划分与分析 空白组共有2004个OTUs,独有982个OTUs,HMmc组共有1908个OTUs,独有14个OTUs,HQmc组共有1907个OTUs,独有51个OTUs,3组共有的OTUs为822个OTUs,如图14所示。与空白组相比,HMmc组和HQmc组OTUs显著降低。
3.4.2 3组大鼠样本肠道菌群的α多样性分析 如图15-A~C所示,测序深度足够反映群落多样性,同时各组样本的OTUs数量接近实际情况。在图15-C中可明显看出空白组群落丰富度最高,但均匀度最差;HQmc组群落丰富度下调,但群落均匀度显著增加。与空白组比较,HMmc组Simpson和Shannon指数显著升高(<0.05),Chao1与ACE指数也有所升高。与HMmc组比较,HQmc组Chao1与ACE指数有所升高,如表6所示。

图12 热证模型大鼠样本肠道菌群β多样性分析
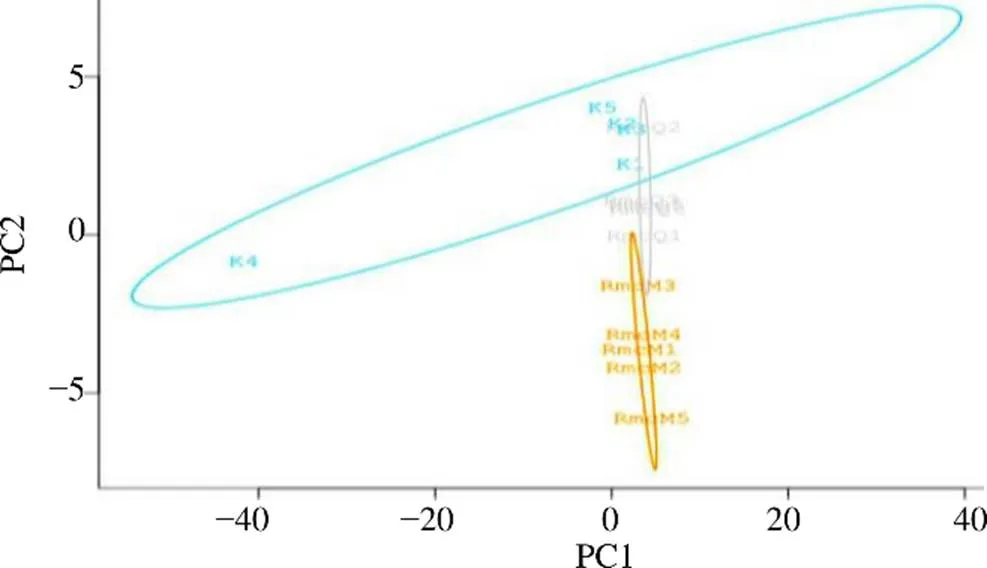
图13 热证模型大鼠样本肠道菌群PLS-DA判别分析
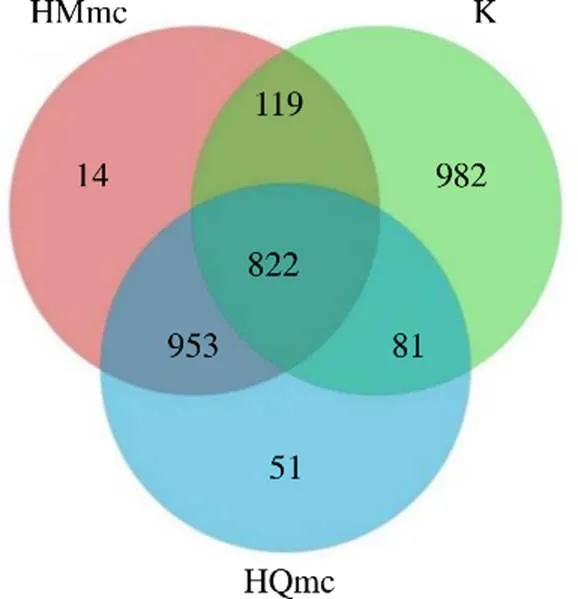
HMmc-寒证模型组 HQmc-寒证模型淫羊藿组,下图同
3.4.3 3组大鼠样本肠道菌群的分类学组成分析 在门水平上,空白组肠道菌群隶属于10个门,45个属;HMmc组肠道菌群隶属于9个门,54个属;HQmc肠道菌群隶属于9个门,53个属。如图16所示,空白组、HMmc组和HQmc组具有显著性差异的有拟杆菌门、厚壁菌门和变形菌门,其中HQmc组拟杆菌门和变形菌门的丰度水平呈上调趋势,厚壁菌门呈下调趋势。各组门丰度水平排序结果如下:在拟杆菌门和变形菌门中HQmc组>HMmc组>空白组;在厚壁菌门中空白组>HMmc组>HQmc组;在空白组中拟杆菌门和变形菌门丰度水平显著高于HMmc组与HQmc组。结合图17、18进一步分析,在属水平下,与空白组相比,HMmc组中乳杆菌属(<0.05)、布劳特氏菌属(<0.05)、拟杆菌属、棒杆菌属(<0.01)、粘放线菌属(<0.05)、副拟杆菌属(<0.05)、支原体属(<0.05)的丰度水平显著下降,颤螺旋菌属(<0.01)、厌氧弧菌属(<0.01)的丰度水平显著上升。与HMmc组相比,HQmc组中拟杆菌属(<0.05)、普氏菌属(<0.01)的丰度水平显著上升,乳杆菌属(<0.05)的丰度水平显著下降。
图15 寒证模型大鼠样本肠道菌群的稀疏曲线(A)、物种累积曲线(B)、丰度等级曲线(C)
表6 寒证模型大鼠菌群微生物多样性指数()
与空白组比较:*<0.05
*< 0.05blank group
3.4.4 3组大鼠样本肠道菌群的LEfse分析 如图19所示,在空白组中丰度较高的菌属有苏黎世杆菌属、、芽孢杆菌属、嗜碱菌属、、乳杆菌属、、、、、、、、棒杆菌属、、、、阎氏菌属;在HMmc组中丰度较高的菌属有支原体属、、颤螺旋菌属、、;在HQmc组中丰度较高的菌属有、拟杆菌属、、厌氧弧菌属、、丁酸弧菌属、普氏菌属、、、、。
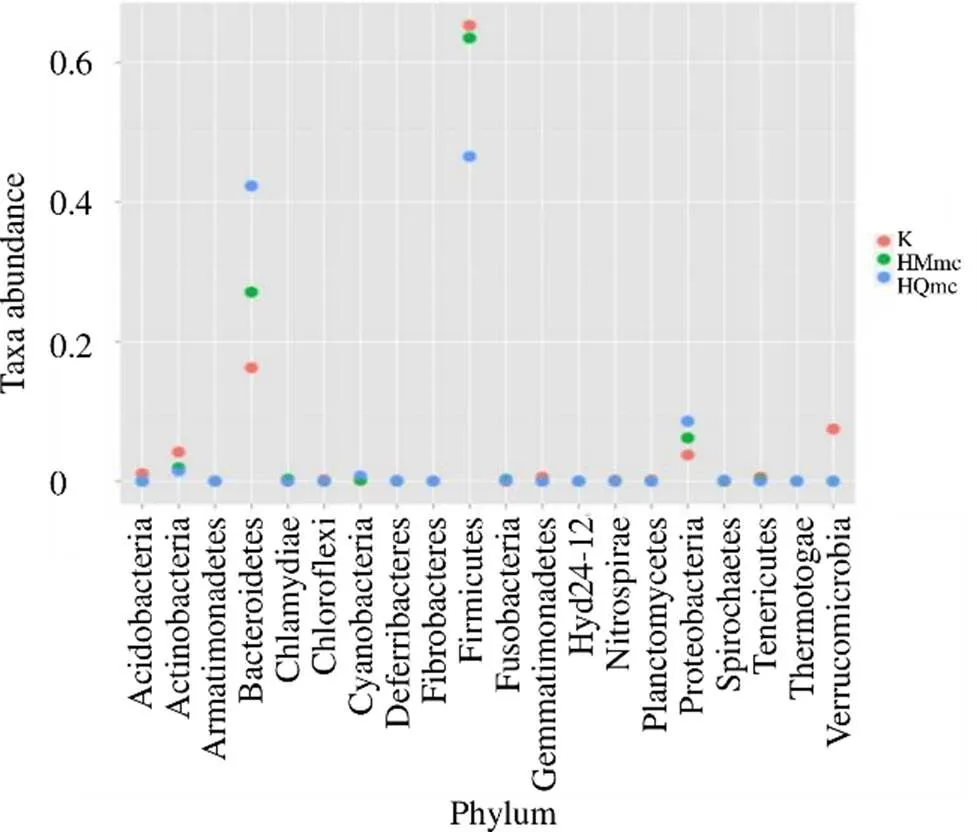
图16 寒证模型大鼠样本间肠道菌群具有显著差异的菌门
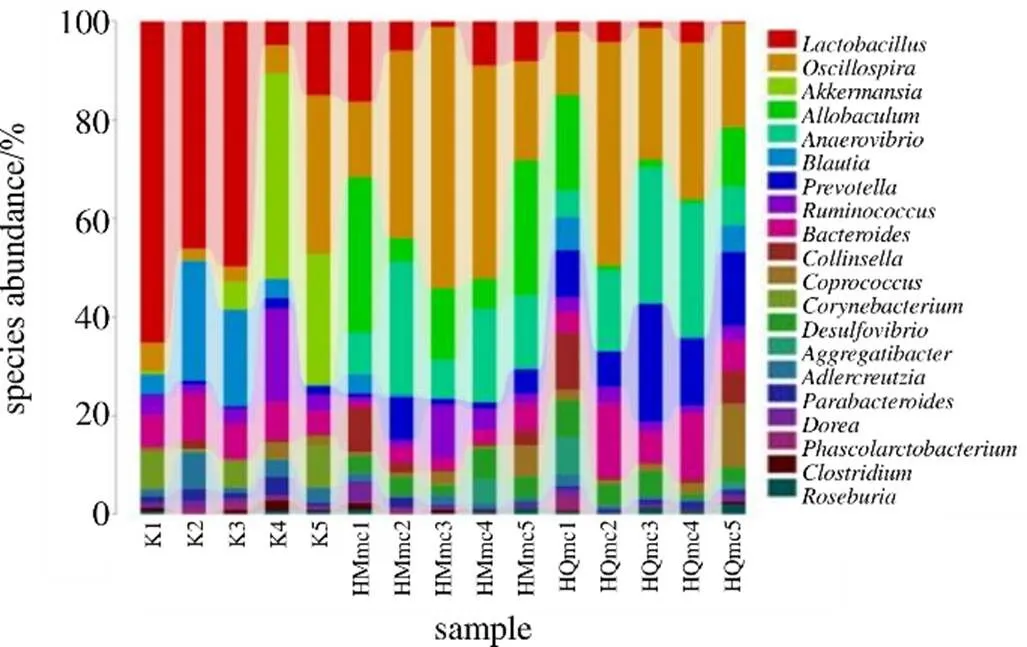
图17 寒证模型大鼠样本肠道菌群在属水平下丰度分布
3.4.5 3组大鼠样本肠道菌群的β多样性分析 通过PCA主成分分析,可考察各样本组间群落结构的相似性,如图20所示,空白组与HMmc组的样本完全分离,HMmc组与HQmc组的样本基本分离,3组样本基本存在于各自区域内,表明寒证及淫羊藿提取物对大鼠肠道菌群结构产生了一定影响。
3.4.6 3组大鼠样本肠道菌群比较分析 如图21所示,空白组独自聚集,HMmc组和HQmc组聚集区域较为一致,且空白组和HMmc组明显无交叉,表明HMmc组大鼠菌群群落较空白组有明显变化。HQmc组和HMmc组大鼠肠道菌群交叉较为集中,且HQmc组大部分被HMmc组所包围,表明HMmc组大鼠肠道菌群多样性更为丰富。
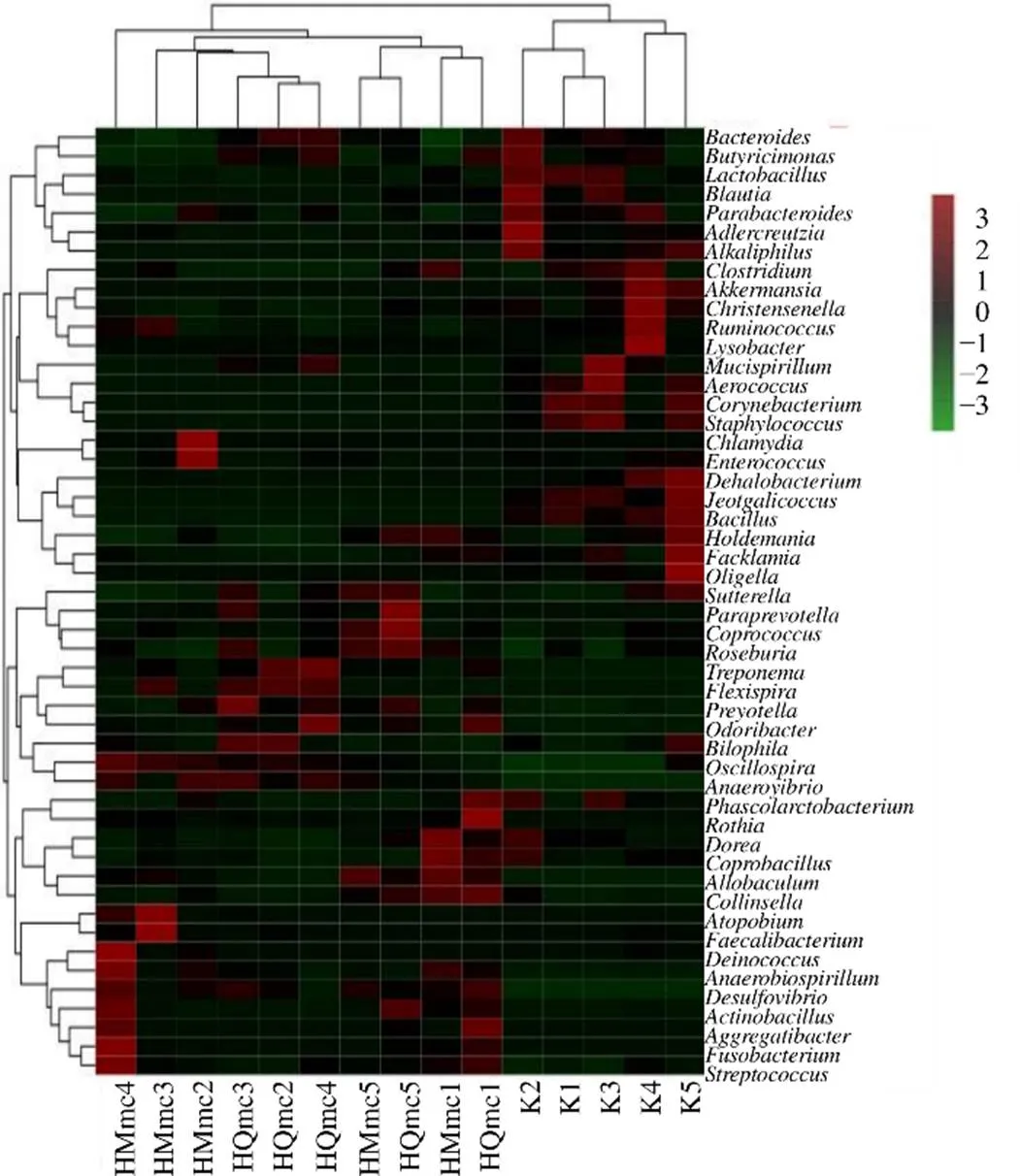
图18 寒证模型大鼠样本属水平的群落分类丰度分布热图
4 讨论与结论
中医认为“入腹方知性”,即中药经口服进入人体后会产生不同的疗效,药物疗效与所患病症之间具有紧密联系,借此对中药的寒热温凉进行判断。本研究选取生理状态及寒热模型状态大鼠进行实验,其中寒热证模型的建立参考既往研究。热证模型大鼠以优乐甲为造模试剂[6],造模成功后,大鼠出现体温升高、大便干燥等症状,与实热证表现的身热烦躁、大便秘结、小便短赤等临床症状相符合;寒证模型采用在0 ℃冰水游泳的方式造模[7],造模成功后,大鼠出现寒颤、蜷缩少动、反应迟钝、大便稀、小便清等症状,与中医寒证症状具有一致性。为模拟服药过程,实验采取ig方式给予各组大鼠生品淫羊藿提取物。
本课题组前期基于实验动物基础代谢和能量代谢[8],对炮制前后淫羊藿的药性归属进行了初步研究。结果发现生品淫羊藿可显著降低实验动物的氧气吸入量、二氧化碳呼出量及自主活动系数,并显著降低大鼠血清中甲状腺素与促甲状腺激素的含量;而炮制后的淫羊藿可使实验动物的产热量显著升高,明显增加大鼠血清中甲状腺素、琥珀酸脱氢酶、促甲状腺激素、三磷酸腺苷(adenosine triphosphate,ATP)酶的含量及总抗氧化能力,诱导ATP酶的产生,同时促进ATP氧化分解产生能量,表明生品淫羊藿与炮制品淫羊藿可对机体产生相反的作用。本实验基础代谢实验结果表明,生品淫羊藿可显著降低热证模型大鼠的CO2呼出量,并回调热证模型大鼠的产热量及能量转化率,表明该药对热证模型各指标具有一定改善作用;但生品淫羊藿干预寒证模型大鼠后,使其显著降低的基础代谢各项指标均发生了同向变化,表明该药对寒证模型作用较小,结合前期研究结果推测生品淫羊藿的药性偏寒凉。肠道菌群研究结果表明,生品淫羊藿对不同模型大鼠肠道菌群的OTUs数量具有不同的调节趋势,可使生理状态大鼠肠道菌群OTUs数量显著降低;生品淫羊藿干预热证模型大鼠后,可明显回调热其显著下降的OTUs数量;寒证模型大鼠总体及独有的OTUs数量显著下降,生品淫羊藿对其总体OTUs数量影响不明显,但可显著回调其独有的OTUs数量。同时各组样本的α多样性指数也发生不同变化,生品淫羊藿使生理状态大鼠的Chao1与Shannon指数显著升高;在热证模型实验中,模型组大鼠的Chao1和ACE指数有所下降,生品淫羊藿给药后可回升相应指数,表明该药可回调热证模型大鼠的群落丰富度;在寒证模型实验中,模型组大鼠肠道菌群的Chao1、ACE、Simpson与Shannon指数均有所升高,生品淫羊藿干预后,使寒证模型的Chao1与ACE指数发生同向变化,结合其OTUs数量进一步分析可知生品淫羊藿虽然对寒证模型的OTUs总量影响较小,但可增加寒证模型大鼠的菌群物种数,即提高寒证模型的群落丰富度。这些变化表明,生品淫羊藿可抑制生理状态大鼠肠道菌群多样性,回调热证模型大鼠肠道菌群多样性,同向调节寒证模型大鼠肠道菌群多样性,因此推测生品淫羊藿可能具有与热相反的药性。
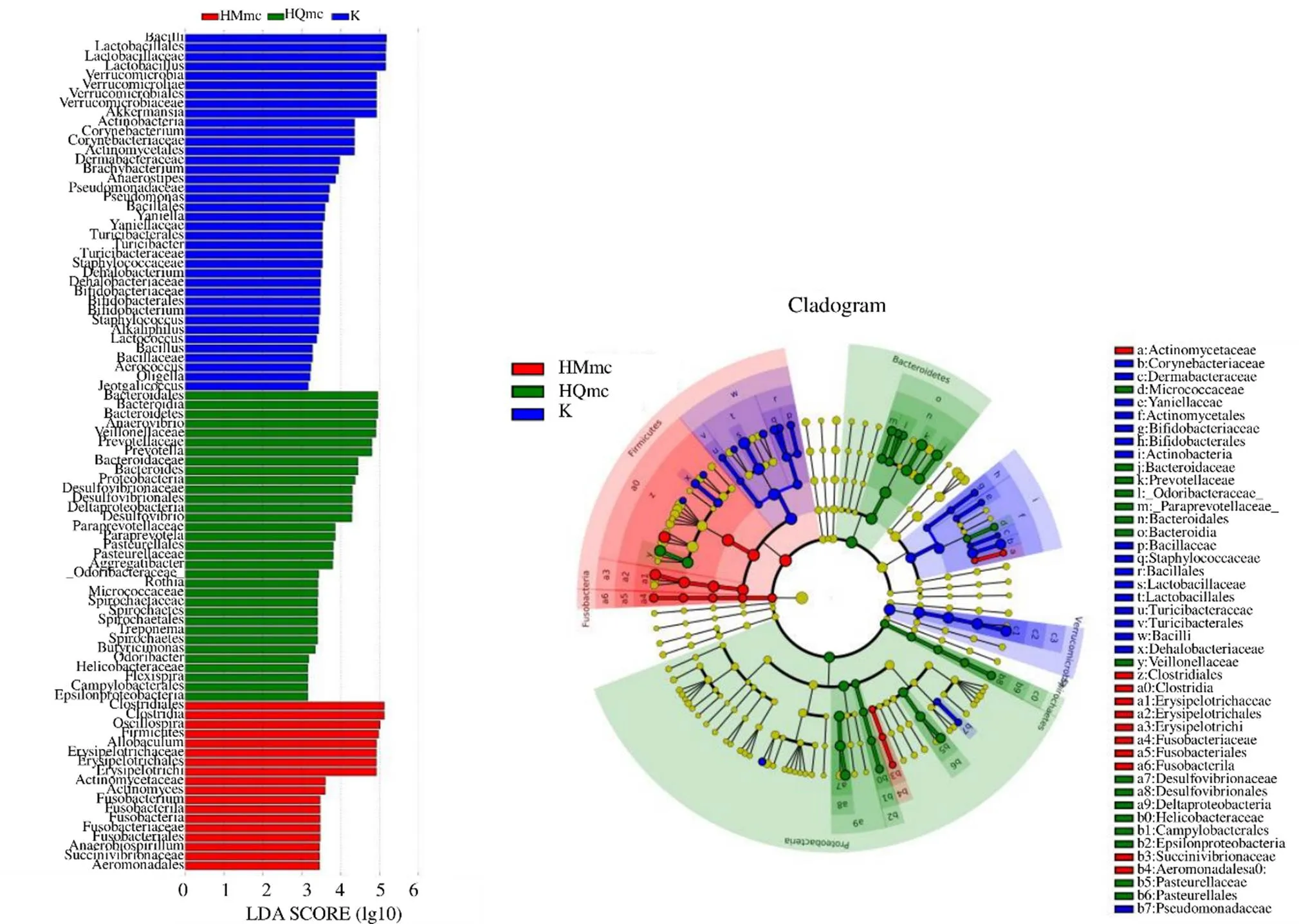
图19 寒证模型大鼠样本肠道菌群的LEfSe多级物种差异判别分析

图20 寒证模型大鼠样本肠道菌群β多样性的PCA
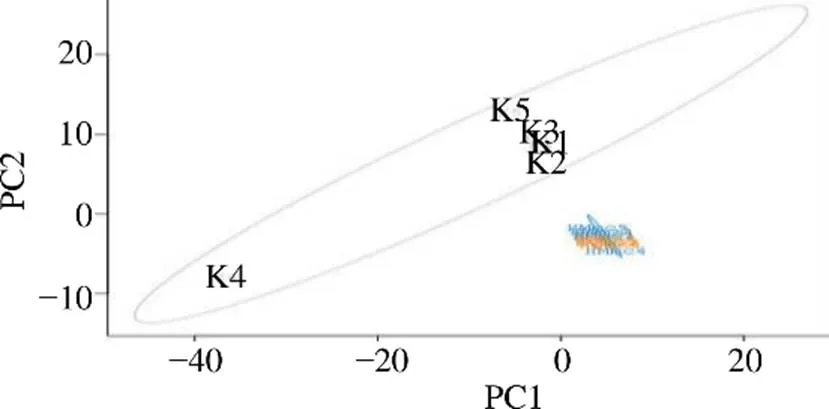
图21 寒证模型大鼠样本肠道菌群PLS-DA判别分析
另外,通过研究不同分类水平下具有显著性差异分类单元的丰度变化,发现在门水平下各模型大鼠肠道菌群主要以拟杆菌门、厚壁菌门与变形菌门为主,生品淫羊藿可使热证模型大鼠肠道菌群的拟杆菌门丰度水显著增加,并下调厚壁菌门的丰度水平,同时使寒证模型大鼠肠道菌群中变形菌门的丰度水平显著升高。已有研究表明,厚壁菌门与拟杆菌门间的比值与机体健康状态密切相关,两者比值降低更有利于维持宿主健康。拟杆菌可参与多糖代谢与胆汁酸和类固醇代谢,厚壁菌门可帮助机体从食物中获得能量[9],同时2个菌门在肠道中均可代谢碳水化合物产生短链脂肪酸,包括丁酸盐和丙酸盐,二者可参与机体的脂质代谢与葡萄糖代谢[10-11],对维持机体健康具有重要意义。主要菌门丰度水平的变化结果提示,生品淫羊藿通过调节拟杆菌门与厚壁菌门的丰度水平对热证模型各指标起到一定改善作用,可帮助热证模型大鼠恢复并维持健康状态,同时厚壁菌门丰度水平的降低提示生品淫羊藿可抑制细胞获取食物中的能量,降低细胞能量储藏。
综上所述,结合3组实验所得的基础代谢实验结果与肠道菌群多样性研究结果,从肠道菌群的角度出发推测生品淫羊藿的药性偏向寒凉,该判断与课题组前期实验结果具有一致性。而《中国药典》2020年版中记载淫羊藿的药性为温,与本实验所得出的结果不一致,其原因可能是《中国药典》中收录的该药材为炙淫羊藿(生品淫羊藿切丝后加入已加热融化的羊脂油中,文火炒至均匀有光泽后取出放凉)。羊脂油性温,经其炮制后淫羊藿的药性发生改变,由寒凉转为温性,温肾助阳之力增强。
利益冲突 所有作者均声明不存在利益冲突
[1] 黄璐琦. 论中药药性理论的研究方向 [J]. 中药与临床, 2011, 2(2): 1-3.
[2] 中国药典 [S]. 一部. 2020: 340-342.
[3] 李文兰, 张秀丽, 隋峰, 等. 中药性味理论的现代研究进展 [J]. 中国实验方剂学杂志, 2015, 21(12): 227-230.
[4] 卢芳, 冯镇凯, 杨晓旭, 等. 基于大鼠物质能量代谢的淫羊藿炮制前后的四气研究 [J]. 中药材, 2017, 40(10): 2320-2324.
[5] 杨晓旭, 王宇, 薛迪, 等. 基于抗衰老抗氧化作用的淫羊藿拆分组分筛选研究 [J]. 辽宁中医药大学学报, 2016, 18(2): 11-14.
[6] 肖航, 谭成, 窦德强. 3种寒性中药对优甲乐所致甲亢模型动物的影响 [J]. 中华中医药学刊, 2016, 34(9): 2122-2125.
[7] 马清翠, 杨伟娜, 王洪海, 等. 中医寒证动物模型造模方法研究进展述评 [J]. 江苏中医药, 2009, 41(8): 80-82.
[8] 杨晓旭, 韩贞爱, 王宇, 等. 炮制前后淫羊藿对实验动物基础和能量代谢的影响 [J]. 中医药信息, 2017, 34(3): 1-5.
[9] 郎敏, 郑克鸿, 曾松华, 等. 肥胖2型糖尿病患者胃旁路术后肠道菌群的变化 [J]. 南方医科大学学报, 2017, 37(10): 1337-1344.
[10] Lin H V, Frassetto A, Kowalik E J Jr,. Butyrate and propionate protect against diet-induced obesity and regulate gut hormones via free fatty acid receptor 3-independent mechanisms [J]., 2012, 7(4): e35240.
[11] Louis P, Flint H J. Diversity, metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine [J]., 2009, 294(1): 1-8.
Categorization of drug property ofbased on changes of intestinal microbial flora diversity in physiological and cold-heat syndrome rats
LU Fang1, YAN Jing-si2, LIU Shu-min3
1. School of Continuing Education, Heilongjiang University of Traditional Chinese Medicine, Harbin 150040, China 2. Graduate School of Heilongjiang University of Traditional Chinese Medicine, Harbin 150040, China 3. Institute of Traditional Chinese Medicine, Heilongjiang University of Chinese Medicine, Harbin 150040, China
To explore the effects of crudeon the changes of intestinal flora in physiological state, cold-heat syndrome model rats based on high-throughput sequencing technology, in order to determine the cold and heat properties of.Forty SD rats were randomly divided into three parts, including physiological state rats, heat syndrome model rats, and cold syndrome model rats. Ten rats in physiological state were randomly divided into two groups, including control group andadministration group (SmQ); Fifteen heat syndrome model rats were randomly divided into three groups, including control group, heat syndrome model group (RmcM) andadministration group (RmcQ); Fifteen cold syndrome model rats were randomly divided into three groups including control group, cold syndrome model group (HMmc), andadministration group (HQmc). The heat and cold syndrome model were modeled with 120 mg/kg Euthyrox and ice water at 0℃. Theadministration group was given the extract (10 mL/kg) from the 1st d of modeling, and the control group was treated with equivalent normal saline for 15 d. Finally fresh rat faeces were taken for analysis of intestinal flora diversity.can cause changes in the number of OTUs, the diversity of alpha and the abundance of main bacteria in the intestinal flora of rats with different syndromes. By analyzing the diversity of beta, it can be found that there were significant differences in the structure of the flora between different samples, and the structure of the flora between the same samples was similar, indicating that the samples obtained from the experiment can be used to analyze the changes in the intestinal flora. At the phylum level, the relative abundance of Bacteroidesphylum in theadministration group increased significantly, and the relative abundance of Firmicutesphylum decreased significantly. Combining the functions of the phylum can infer the property of.The analysis of the diversity of the intestinal flora of rats with different syndromes shows that the property ofmaybe belong to the cold property, which provides a theoretical basis for clinical rational use of drugs.
; intestinal flora; traditional Chinese medicine property; high-throughput sequencing; syndrome
R285
A
0253 - 2670(2021)13 - 3954 - 12
10.7501/j.issn.0253-2670.2021.13.019
2020-11-24
国家重点基础研究发展计划(“973”计划):利水功效古存今失中药的药性研究(2013CB531804);黑龙江中医药大学优秀创新人才项目(2018RCL13)
卢 芳,女,博士,副研究员,从事中药药性理论及药效物质基础研究。E-mail: lufang_1004@163.com
刘树民,男,博士生导师,教授,从事中药药性及中药毒性研究。Tel: (0451)82193278 E-mail: keji-liu@163.com
[责任编辑 潘明佳]