忍冬藤提取物诱导骨肉瘤细胞凋亡的作用及机制研究
严宝飞,段金廒,张景正,刘圣金,刘 嘉*,毛艺蓓,曾庆琪, 3
忍冬藤提取物诱导骨肉瘤细胞凋亡的作用及机制研究
严宝飞1, 2,段金廒2,张景正1,刘圣金2,刘 嘉1*,毛艺蓓1,曾庆琪1, 3
1. 江苏卫生健康职业学院,江苏 南京 211800 2. 南京中医药大学 江苏省中药资源产业化过程协同创新中心,中药资源产业化与方剂创新药物国家地方联合工程研究中心,国家中医药管理局中药资源循环利用重点研究室,江苏 南京 210023 3. 南京中医药大学第一附属医院,江苏 南京 210029
研究忍冬藤提取物对骨肉瘤细胞增殖和凋亡的作用及机制。采用超高效液相色谱-飞行时间质谱联用技术(UPLC-Q-TOF/MS)表征忍冬藤提取物的化学成分;采用MTT法检测忍冬藤提取物对人骨肉瘤细胞HOS、143B以及人肾皮质近曲小管上皮细胞HK-2存活率的影响;采用荧光显微镜观察忍冬藤提取物对HOS、143B细胞凋亡的影响;采用Annexin V/PI双染法检测忍冬藤提取物对HOS细胞凋亡的影响;采用JC-1染色法检测忍冬藤提取物对HOS细胞线粒体膜电位的影响;采用Western blotting法检测忍冬藤提取物对HOS细胞B细胞淋巴瘤2相关X蛋白(bcl-2 associated X,Bax)、B细胞淋巴瘤2(B cell lymphoma-2,Bcl-2)、活化的半胱氨酸蛋白酶-3(cleaved Caspase-3)、活化的多聚腺苷二磷酸核糖聚合酶(cleaved poly ADP-ribose polymerases,cleaved PARP)、cleaved Caspase-9和细胞色素C(cytochrome-c,Cyt-C)蛋白表达的影响。忍冬藤提取物中鉴定出有机酸类、三萜皂苷类、黄酮类、环烯醚萜类和氨基酸类5种类型的36种化学成分。忍冬藤提取物抑制HOS和143B细胞存活率,显著诱导HOS细胞凋亡(<0.01),Caspase-3抑制剂Z-VAD-FMK显著抑制忍冬藤提取物诱导的HOS细胞凋亡(<0.05、0.01);忍冬藤提取物显著提高HOS细胞Caspase-3活性(<0.01),显著改变HOS细胞线粒体膜电位(<0.05、0.01),显著上调HOS细胞Bax、cleaved Caspase-3、cleaved PARP、cleaved Caspase-9、Cyt-C和Bax/Bcl-2蛋白表达水平(<0.05、0.01),显著下调Bcl-2蛋白表达水平(<0.05、0.01)。忍冬藤提取物能够抑制骨肉瘤细胞增殖,并通过线粒体凋亡途径诱导细胞凋亡,其机制可能与下调Bcl-2蛋白表达,上调Bax、cleaved Caspase-3、cleaved PARP、cleaved Caspase-9和Cyt-C蛋白表达,激活Caspase级联反应有关。
忍冬藤;骨肉瘤;凋亡;作用机制;UPLC-Q-TOF/MS
骨肉瘤又名成骨肉瘤,是一种可以直接产生骨样组织的原发性恶性肿瘤,多发于青少年,发病率位居原发性恶性骨肿瘤第1位;其初期症状为间断性的疼痛和肿胀,随后发展为无法缓解的持续性疼痛,并伴有局部炎性反应、病理性骨折等表现[1]。中医学虽无“骨肉瘤”病名记载,但早有关于其症状及临床表现的描述,如《灵柩·痈疽》载“发于膝,状大痈,色不变,如坚石”,并将其归属为“下石疽”“骨疽”“骨瘤”“骨蚀”等范畴,体虚外感结里、邪气博结于骨为其病因病机。中医对骨肉瘤的病因、病位和病机的认识与辨证论治的实践充分,中医辨证论治和整体观念的治疗原则在骨肉瘤治疗过程中具有独特的优势[2]。
忍冬藤为忍冬科植物忍冬Thunb.的干燥茎枝,始载于魏晋时期的《名医别录》,自1963年被《中国药典》收载,其性甘、味寒,具有清热解毒、疏风通络之功效,用于治疗温病发热、热毒血痢、痈肿疮疡等症,《本草纲目》称其“茎叶及花,功用皆同,治一切湿气及诸肿痛”[3]。忍冬藤主要含黄酮类、有机酸类、三萜类等成分,具有抗肿瘤、抗炎、抗菌、免疫调节、解热等药理活性。忍冬藤及其有效成分具有显著的抗肿瘤作用,但尚未有研究报道其对骨肉瘤细胞的作用及机制。因此,本研究考察忍冬藤提取物对人骨肉瘤细胞HOS和143B增殖和凋亡的影响,并初步探讨其诱导细胞凋亡的机制,以期为忍冬藤的临床应用及开发提供依据。
1 材料
1.1 细胞
HOS、143B细胞及人肾皮质近曲小管上皮细胞HK-2购自美国ATCC。
1.2 药材
忍冬藤(批号20200613)购自江苏省中医院,经南京中医药大学段金廒教授鉴定为忍冬科植物忍冬Thunb.的干燥茎枝,凭证标本存放于南京中医药大学江苏省中药资源产业化过程协同创新中心。
1.3 药品与试剂
甲醇(批号20200814)购自南京化学试剂公司;乙腈购自德国Merck公司;对照品新绿原酸(批号XLYS20190413)、绿原酸(批号LYS20190306)、隐绿原酸(批号YLYS20190316)、异绿原酸B(批号YLYS220181107)、异绿原酸A(批号YLYS120190104)、异绿原酸C(批号YLYS320190203)购自南京春秋生物工程有限公司,质量分数均大于98%;胎牛血清(批号FSS500)购自杭州四季青公司;DMEM培养基(批号1776550)购自美国Gibco公司;MTT(批号M-2253)购自美国Spectrum Chemical公司;二甲基亚砜(DMSO,批号276855)购自美国Sigma公司;AnnexinV-FITC/碘化丙啶(PI)双染试剂盒(批号20200306)、JC-1线粒体膜电位检测试剂盒(批号KG-A306)购自上海李记生物科技公司;B细胞淋巴瘤2相关X蛋白(bcl-2 associated X,Bax)抗体(批号5023T)、B细胞淋巴瘤2(B cell lymphoma-2,Bcl-2)抗体(批号15071T)、活化的半胱氨酸蛋白酶-3(cleaved Caspase-3)抗体(批号9661T)、活化的多聚腺苷二磷酸核糖聚合酶(cleaved poly ADP-ribose polymerases,cleaved PARP)抗体(批号5625T)、cleaved Caspase-9抗体(批号7237T)、细胞色素C(cytochrome-C,Cyt-C)抗体(批号4280T)、甘油醛-3-磷酸脱氢酶(glyceraldehyde- 3-phosphate dehydrogenase,GAPDH)抗体(批号5174T)、HRP标记的羊抗兔IgG抗体(批号32935S)购自美国CST公司;Caspase-3抑制剂Z-VAD-FMK(批号sc6753)购自美国Santa cruz公司;Hochest 33258染色试剂盒(批号H4046)、Caspase-3活性检测试剂盒(批号C1115)购自碧云天生物技术有限公司;BCA蛋白定量试剂盒(批号23246)、PVDF膜(批号LC2002)购自美国Thermo Fisher Scientific公司。
1.4 仪器
EPED型超纯水系统(南京易普达易科技发展有限公司);KQ250E型超声波清洗器(昆山禾创超声仪器有限公司);ML204/MS105型电子天平(美国托利多公司);Rotavapor R-210型旋转蒸发仪(瑞士Buchi公司);30A型超高效液相色谱仪(日本岛津公司);Triple TOF 5600+型质谱仪(美国AB Sciex公司);TS2R型浮雕反差倒置荧光显微镜、TS100型倒置显微镜(日本尼康公司);MINI-4小型垂直电泳仪(美国Bio-Rad公司);Multiskan MK3型酶联免疫检测仪(美国Thermo Fisher Scientific公司);流式细胞仪(美国Beckman Coulter公司)。
2 方法
2.1 忍冬藤提取物的制备
忍冬藤粉碎,过40目筛,称取25 g粉末,置于100 mL具塞锥形瓶中,加入50%甲醇50 mL,静置1 h,室温超声50 min后滤过;滤渣中加入50%甲醇50 mL,室温超声50 min,合并滤液,浓缩至25 mL即得忍冬藤提取物(以生药量计1 g/mL),于4 ℃保存,临用前用含10%胎牛血清的DMEM培养基稀释至相应质量浓度。
2.2 忍冬藤提取物的UPLC-Q-TOF/MS分析
2.2.1 供试品溶液的制备 取“2.1”项下忍冬藤提取物,13 000 r/min离心10 min,经0.22 μm滤膜滤过,得到供试品溶液。
2.2.2 对照品溶液的制备 精密称定对照品,加入50%甲醇溶液,配制成新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A、异绿原酸C质量浓度分别为0.213、0.243、0.530、0.174、0.306、0.204 mg/mL的对照品溶液。
2.2.3 色谱条件[4]Waters Acquity UPLC BEH C18色谱柱(100 mm×2.1 mm,1.7 μm),流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~5.0 min,5%~27% B;5.0~10.0 min,27%~95% B;10.0~15.0 min,95% B;15.0~15.2 min,95%~5% B;15.2~20.0 min,5% B;柱温为25 ℃;体积流量为0.3 mL/min;进样量为3 μL。
2.2.4 质谱条件 正、负离子模式;雾化气压力为379.225 kPa;辅助气压力为379.225 kPa;气帘气压力为241.325 kPa;离子源温度为550 ℃;离子喷雾电压为4500 V/−4500 V;去簇电压为60 V/−60 V;碰撞能量为60 eV/−60 eV;TOF-MS扫描范围为/100~2000;子离子扫描范围为/50~1500。
2.3 忍冬藤提取物对HK-2细胞存活率的影响
取处于对数生长期的HK-2细胞,以5×103/孔接种于96孔板,培养24 h。设置对照组和忍冬藤提取物(5、10、25、50、75、100 mg/mL)组,弃去培养基,各给药组加入100 μL药物,对照组加入不含药物的DMEM培养基(含0.1% DMSO),培养24 h。加入MTT(5 mg/mL),培养4 h,弃去培养基,加入DMSO,室温振荡,使结晶充分溶解,采用酶标仪测定492 nm处的吸光度()值,计算细胞存活率。
细胞存活率=给药/对照
2.4 忍冬藤提取物对骨肉瘤细胞存活率的影响
取处于对数生长期的HOS和143B细胞,按“2.3”项下方法处理,给药后分别培养24、48、72 h,测定细胞存活率。
2.5 Hochest染色法检测细胞凋亡
取处于对数生长期的HOS和143B细胞,以2.5×104/孔接种于24孔板,培养24 h。设置对照组和忍冬藤提取物(25、50、75 mg/mL)组,各给药组加入500 μL药物,对照组加入不含药物的DMEM培养基(含0.1% DMSO),培养24 h。弃去培养基,以PBS洗涤2次,于4%多聚甲醛溶液中固定30 min;弃上清,PBS洗涤3次,加入300 μL Hochest 33258工作液,室温避光孵育10 min;弃上清,PBS洗涤3次,加入300 μL PBS,于荧光倒置显微镜下观察细胞凋亡情况。
2.6 Annexin V/PI双染法检测细胞凋亡率
取处于对数生长期的HOS细胞,以4×105/孔接种于6孔板,培养24 h。按“2.5”项下方法处理,用不含EDTA的胰酶收集各组细胞,1000 r/min离心10 min,PBS洗涤2次,加入500 μL Binding Buffer重悬细胞,加入5 μL Annexin V/FITC混匀,再加入PI染液,室温混合后避光孵育15 min,采用流式细胞仪检测细胞凋亡率。
2.7 Caspase-3试剂盒检测Caspase-3活性
取处于对数生长期的HOS细胞,以5×103/孔接种于96孔板,培养24 h。设置对照组和忍冬藤提取物(25、50、75 mg/mL)组,各给药组加入500 μL药物,对照组加入不含药物的DMEM培养基(含0.1% DMSO),培养24 h。加入PBS洗涤2次,弃上清,每2×106个细胞加入100 μL裂解液,重悬细胞,裂解15 min,期间振荡3~4次;4 ℃、8000 r/min离心15 min,吸取上清液,采用BCA蛋白定量试剂盒测定蛋白质量浓度,调整至每10微升待测样品中含10~30 μg蛋白。取10 μL待测样品,加入80 μL检测缓冲液和10 μL Caspase-3底物Ac-DEVD-pDNA(2 mmol/L),混匀,37 ℃避光孵育2~4 h,采用酶标仪测定405 nm处的值,计算Caspase-3活性。
2.8 Z-VAD-FMK对HOS细胞存活率的影响
取处于对数生长期的HOS细胞,以5×103/孔接种于96孔板,培养24 h。设置对照组、Z-VAD-FMK(10 μmol/L)组、忍冬藤提取物(25、50、75 mg/mL)组、忍冬藤提取物联用Z-VAD-FMK组。Z-VAD-FMK预处理30 min后,各给药组再加入100 μL药物,对照组加入不含药物的DMEM培养基(含0.1% DMSO),培养24 h,按“2.3”项下方法测定细胞存活率。
2.9 JC-1染色法检测线粒体膜电位变化
取处于对数生长期的HOS细胞,按“2.7”项下方法处理,用不含EDTA的胰酶收集各组细胞,1000 r/min离心10 min,加入500 μL JC-1工作液,培养15 min,2000 r/min离心5 min,收集细胞,用1×Incubation Buffer洗涤2次,采用流式细胞仪检测线粒体膜电位的变化。
2.10 Western blotting法检测Bax、Bcl-2、cleaved Caspase-3、cleaved PARP、cleaved Caspase-9和Cyt-C蛋白表达情况
取处于对数生长期HOS细胞,按“2.6”项下方法处理,收集各组细胞,采用总蛋白分离提取试剂盒提取细胞总蛋白,采用BCA蛋白定量试剂盒测定蛋白质量浓度,蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入含5%脱脂奶粉的PBS封闭2 h,分别加入Bax、Bcl-2、cleaved Caspase-3、cleaved PARP、cleaved Caspase-9和Cyt-C抗体(1∶1000),4 ℃孵育过夜;TBST洗涤4次,5 min/次,加入HRP标记的羊抗兔IgG抗体(1∶1000),孵育2 h;TBST洗涤4次,5 min/次,加入ECL化学发光试剂显影,采用ChemiScope 3300 mini化学发光成像系统采集图像,ClinxChemi图像软件进行灰度值分析。
2.11 数据统计分析
3 结果
3.1 忍冬藤提取物成分鉴定
忍冬藤提取物正、负离子模式下总离子流图见图1。在色谱及质谱条件优化后,基于Triple TOF 5600+工作站PeakView工作站、对照品和相关文献,在忍冬藤提取物中共鉴定出36种化学成分,见表1。
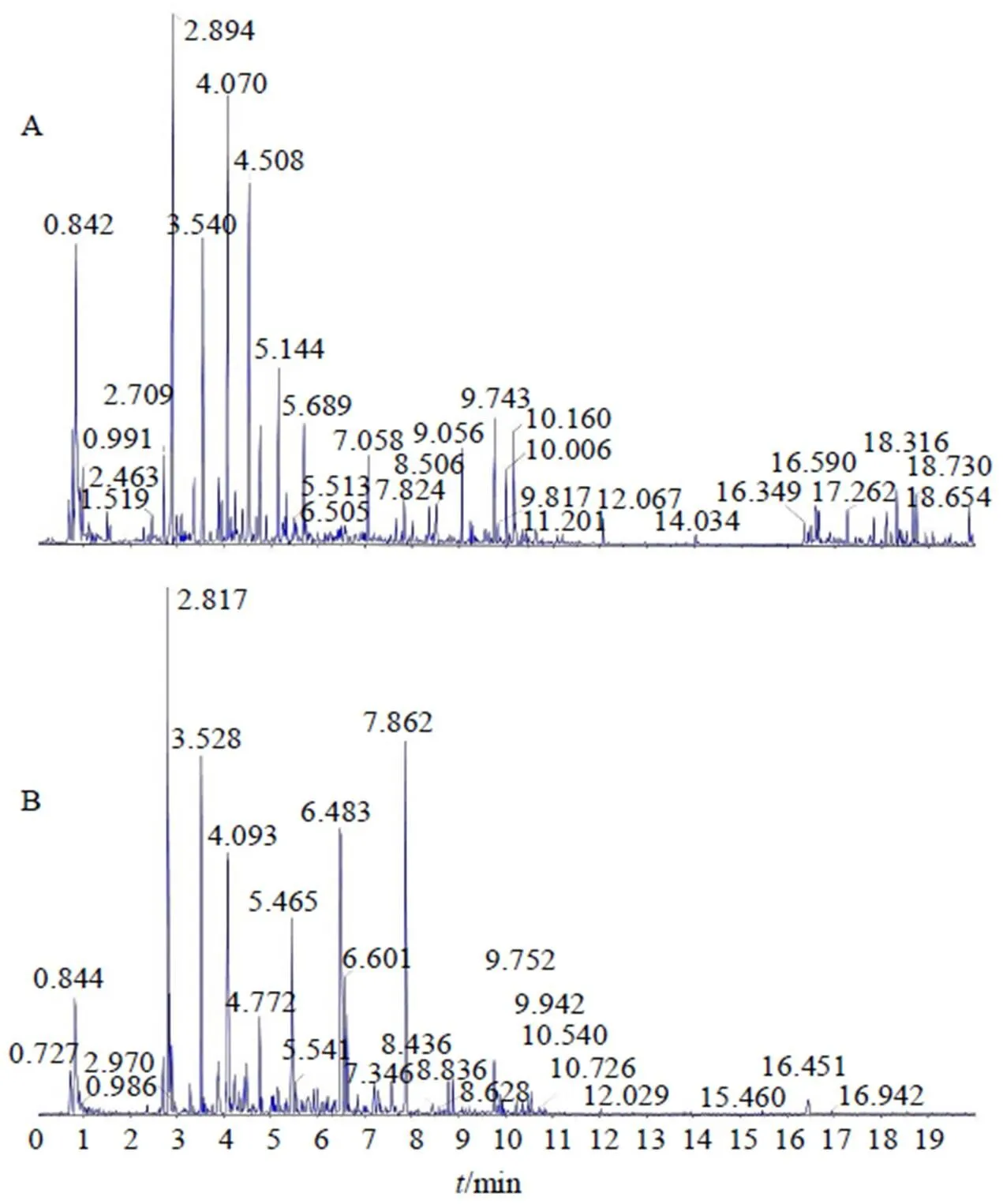
图1 正 (A)、负离子模式(B) 忍冬藤提取物的总离子流图
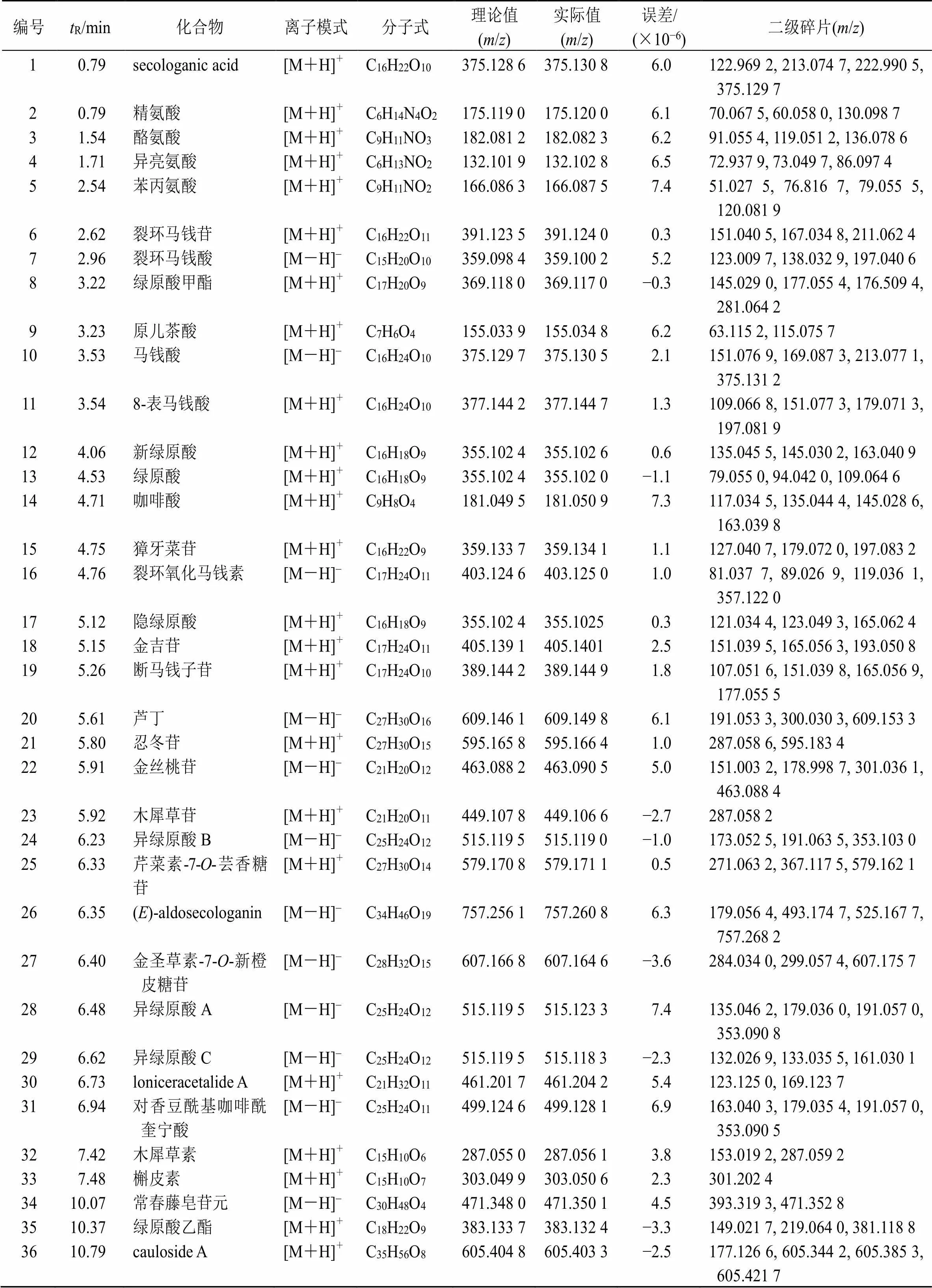
表1 忍冬藤提取物的UPLC/Q-TOF-MS分析
3.2 忍冬藤提取物对HK-2、HOS和143B细胞存活率的影响
如图2所示,忍冬藤提取物最大给药浓度仍然没有达到HK-2细胞的半数抑制浓度(50% maximal inhibitory concentrations,IC50)值;如图3所示,忍冬藤提取物抑制HOS和143B细胞存活率,呈剂量和时间相关性;忍冬藤提取物作用于HOS细胞24、48、72 h的IC50分别为37.15、24.07、12.93 mg/mL,作用于143B细胞24、48、72 h的IC50值分别为39.88、25.95、18.34 mg/mL。
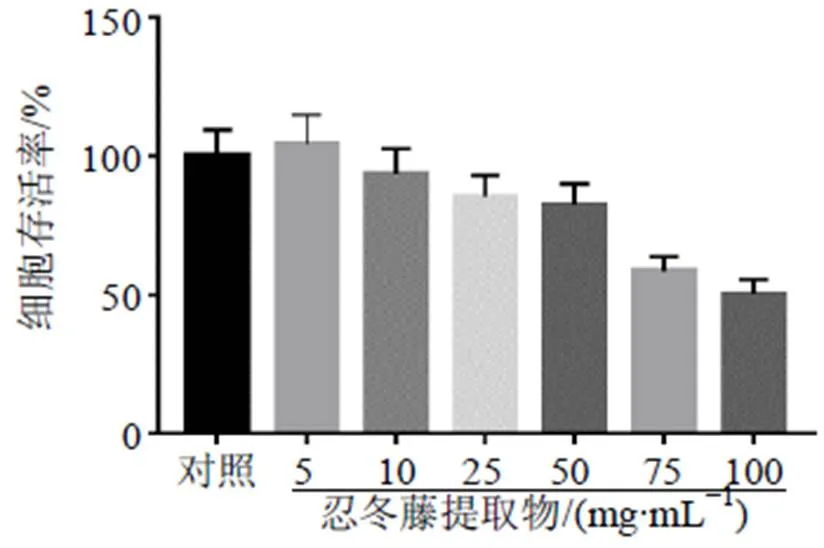
图2 忍冬藤提取物对HK-2细胞存活率的影响()
3.3 忍冬藤提取物对HOS和143B细胞凋亡的影响
如图4所示,对照组HOS和143B细胞形态正常,细胞核呈现弥散均匀蓝色荧光;忍冬藤提取物组HOS和143B细胞均出现浓染致密的颗粒块状蓝色荧光等明显的细胞凋亡特征,表明忍冬藤提取物能够促进HOS和143B细胞凋亡。
3.4 忍冬藤提取物对HOS细胞凋亡的影响
如图5所示,与对照组比较,各给药组HOS细胞凋亡率明显升高(<0.01),呈剂量相关性,表明忍冬藤提取物能够诱导HOS细胞凋亡。
3.5 忍冬藤提取物对HOS细胞Caspase-3活性的影响
如图6所示,与对照组比较,忍冬藤提取物(50、75 mg/mL)组Caspase-3活性显著升高(<0.01)。
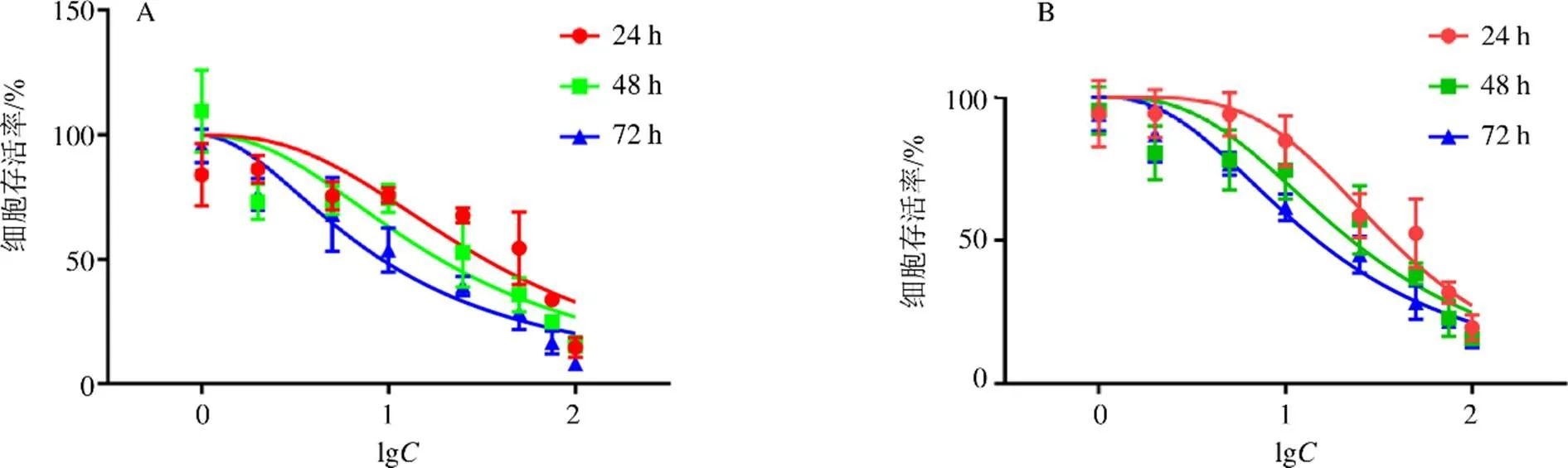
图3 忍冬藤提取物对HOS细胞 (A) 和143B细胞 (B) 存活率的影响()

图4 忍冬藤提取物对HOS和143B细胞凋亡的影响
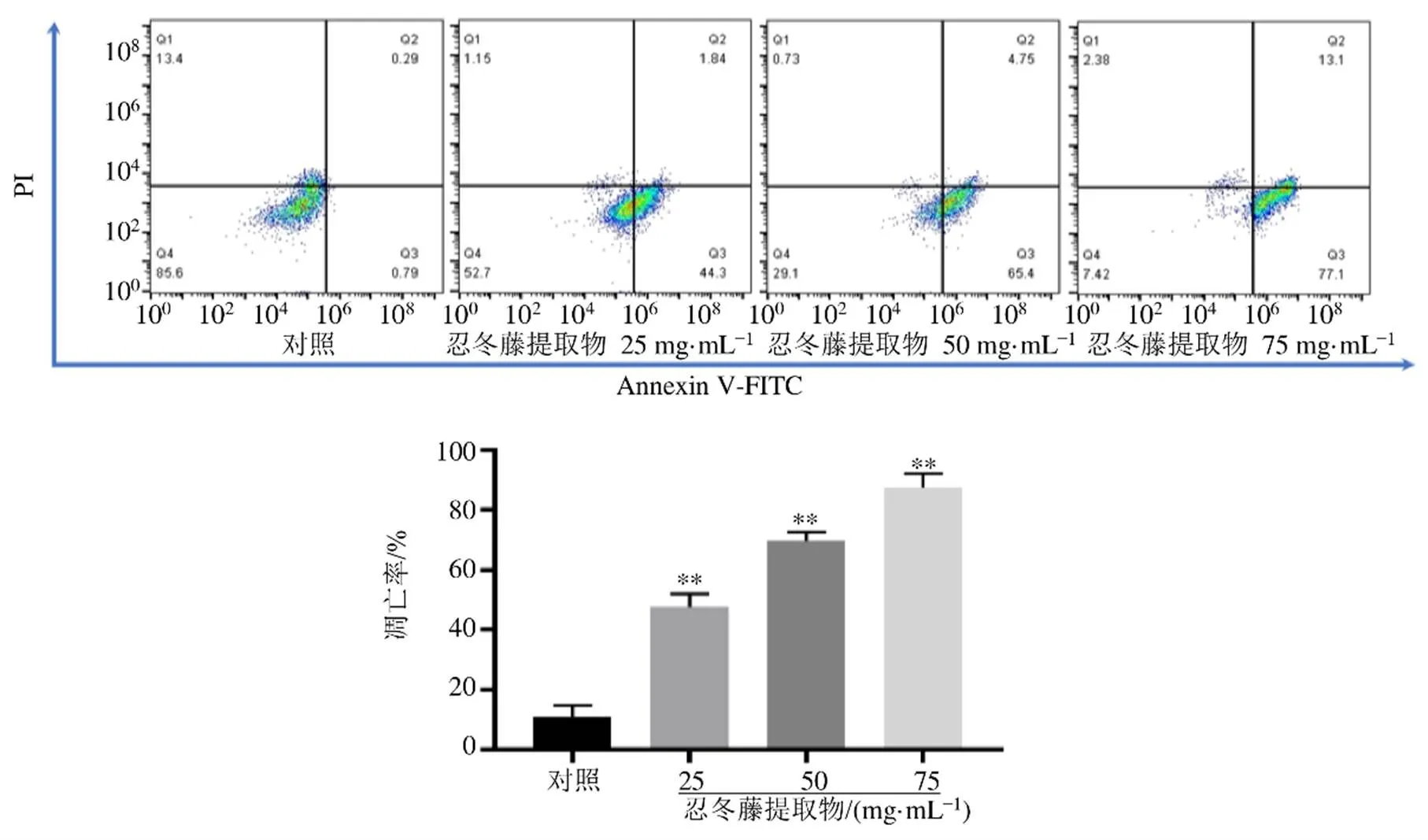
与对照组比较:*P<0.05 **P<0.01,下图同
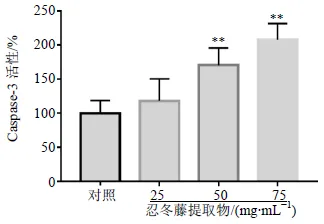
图6 忍冬藤提取物对HOS细胞Caspase-3活性的影响()
3.6 Z-VAD-FMK对HOS细胞存活率的影响
如图7所示,与单独给予忍冬藤提取物相比,联用Z-VAD-FMK能够显著提高细胞存活率(<0.05、0.01),表明忍冬藤提取物诱导HOS细胞凋亡具有Caspase-3相关性。
3.7 忍冬藤提取物对HOS细胞线粒体膜电位的影响
如图8所示,与对照组比较,各给药组HOS细胞绿色荧光(JC-1 monomer)显著增强(<0.01),忍冬藤提取物(50、75 mg/mL)组细胞红色荧光(JC-1 aggregate)显著减弱(<0.05、0.01),表明忍冬藤提取物能够降低HOS细胞线粒体膜电位,呈剂量相关性。
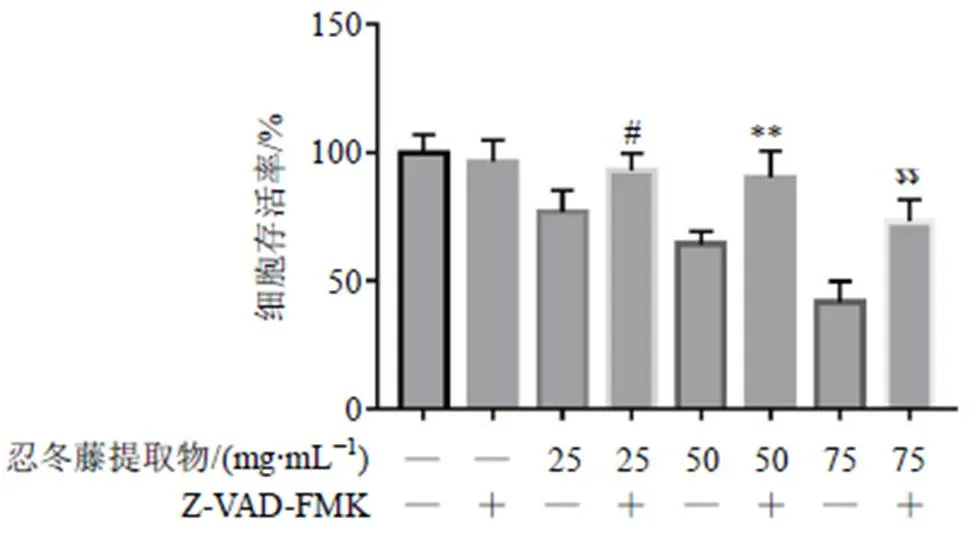
与忍冬藤提取物(25 mg/mL)组比较:#P<0.05;与忍冬藤提取物(50 mg/mL)组比较:**P<0.01;与忍冬藤提取物(75 mg/mL)组比较:$$P<0.01
3.8 忍冬藤提取物对HOS细胞Bax、Bcl-2、cleaved Caspase-3、cleaved PARP、cleaved Caspase-9和Cyt-C蛋白表达的影响
如图9所示,与对照组比较,各给药组HOS细胞Bax、cleaved Caspase-9蛋白表达水平显著升高(<0.01),Bcl-2蛋白表达水平显著降低(<0.05、0.01);忍冬藤提取物(50、75 mg/mL)组细胞Bax/Bcl-2、cleaved Caspase-3、Cyt-C、cleaved PARP蛋白表达水平显著升高(<0.05、0.01)。

图8 忍冬藤提取物对HOS细胞线粒体膜电位的影响()
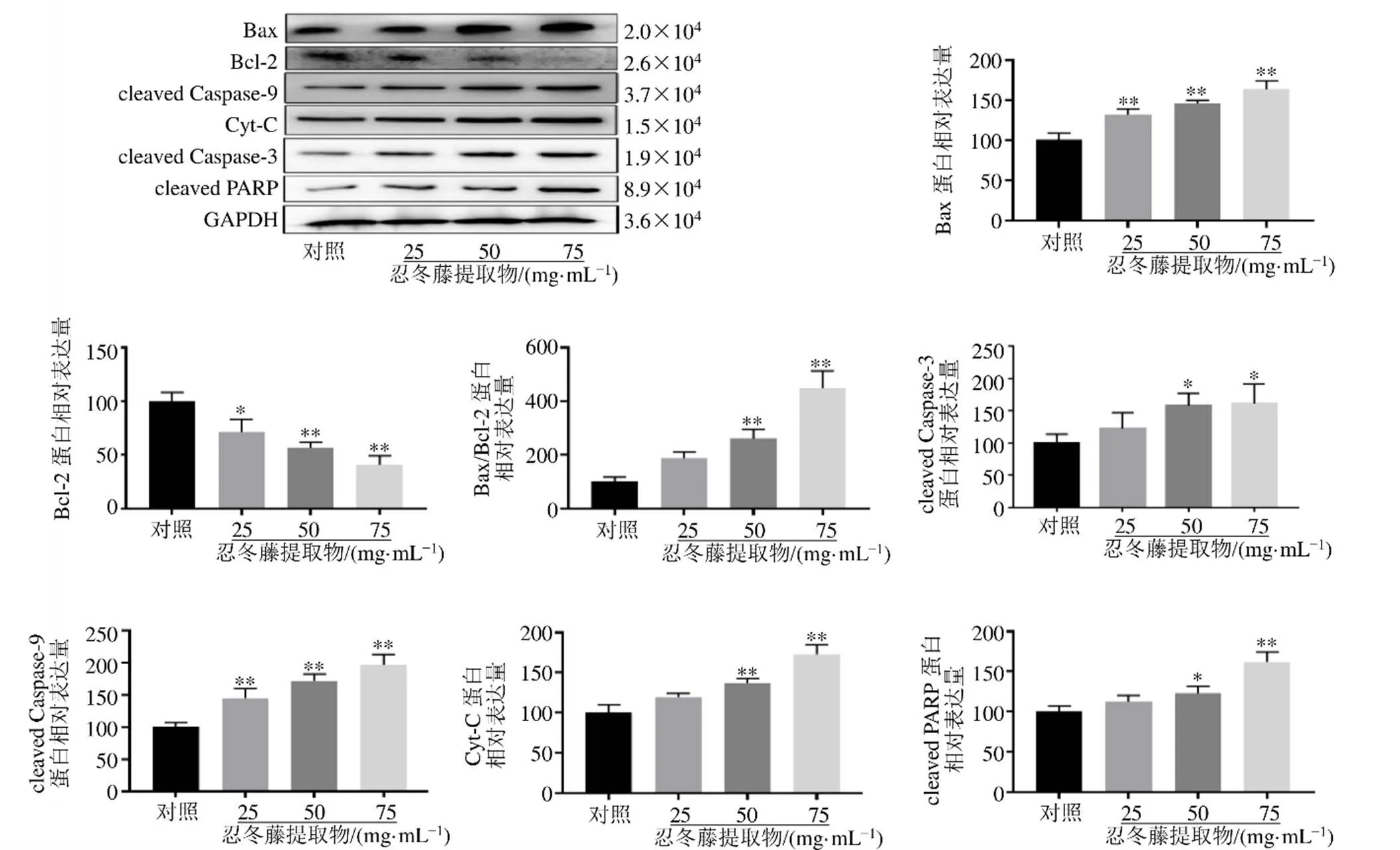
图9 忍冬藤提取物对HOS细胞Bax、Bcl-2、cleaved Caspase-3、cleaved PARP、cleaved Caspase-9和Cyt-C蛋白表达的影响()
4 讨论
目前临床常用放疗结合外科技术治疗骨肉瘤,但易产生耐药性和严重的不良反应,术后骨肉瘤患者5年生存率为70%,肺转移患者5年生存率仅为20%,因此开发抑制骨肉瘤的新药尤其重要[1,4]。细胞凋亡是细胞死亡的一种程序化形式,是细胞在生理或病理调节下启动自身内部机制,经过多种信号转导途径,结束自身生命的过程[5]。细胞凋亡因其不引起周围组织炎性损伤而被认为是杀死肿瘤细胞的最佳方式,是许多化疗药物清除肿瘤细胞的重要途径[6]。诱导肿瘤细胞凋亡是中药发挥抗肿瘤作用的重要机制[7]。本研究采用忍冬藤提取物干预骨肉瘤细胞,观察其对骨肉瘤细胞增殖和凋亡的影响,并探讨其诱导细胞凋亡的机制,为忍冬藤及其组方防治骨肉瘤提供理论基础与实验依据。
本课题组前期分别以水、不同比例乙醇和甲醇提取忍冬藤,系统考察了不同提取物对骨肉瘤细胞增殖的抑制作用,发现50%甲醇提取物的抑制作用最强,因此基于忍冬藤50%甲醇提取物开展后续研究。本研究结果显示,忍冬藤提取物显著抑制HOS和143B细胞的增殖并诱导其凋亡,提示忍冬藤提取物具有显著的抗骨肉瘤作用;相同剂量下,忍冬藤提取物对HK-2细胞的抑制作用低于HOS和143B细胞,提示忍冬藤提取物在杀伤骨肉瘤细胞的同时,对正常人体细胞具有一定安全性;相同剂量下,HOS细胞对忍冬藤提取物更为敏感,故选取HOS细胞进行凋亡机制的探究。
凋亡诱导蛋白Bax和凋亡抑制蛋白Bcl-2同属Bcl-2家族成员,在凋亡过程中起到重要作用[8],Bax/Bcl-2比值的变化调控线粒体途径细胞凋亡进程[9]。Cyt-C存在于线粒体中,具有调控细胞凋亡的作用[10]。Cyt-C自线粒体释放至胞质进而激活Caspase级联反应,是细胞凋亡的关键步骤,Cyt-C的释放受Bcl-2家族蛋白控制[11]。凋亡的发生是由Caspase家族成员介导的蛋白酶级联反应过程,其中Caspase-3是最下游的凋亡最终执行蛋白[12]。内源性线粒体凋亡途径中上游分子Caspase-9激活Caspase-3,启动Caspase级联反应,切割DNA修复因子PARP等Caspase底物,从而使细胞凋亡进入不可逆阶段[13-14]。本研究结果显示,忍冬藤提取物能够促使HOS细胞Caspase-3活化,Caspase-3抑制剂Z-VAD-FMK可以有效抑制忍冬藤提取物诱导的HOS细胞凋亡,表明忍冬藤提取物诱导HOS细胞凋亡具有Caspase-3相关性,提示Caspase-3的活化可能是忍冬藤提取物诱导HOS细胞凋亡的关键分子机制。忍冬藤提取物能够显著降低HOS细胞线粒体膜电位,下调Bcl-2蛋白表达水平,上调Bax、cleaved Caspase-3、cleaved PARP、cleaved Caspase-9、Cyt-C和Bax/Bcl-2蛋白表达水平,表明忍冬藤提取物能够通过线粒体凋亡途径诱导HOS细胞凋亡,其机制可能为忍冬藤提取物上调Bax蛋白表达,下调Bcl-2蛋白表达;增加线粒体膜的通透性,导致线粒体膜电位下降,促使线粒体内Cyt-C释放进入细胞质中,与衔接蛋白凋亡蛋白酶活化因子-1(apoptotic protease activating factor-1,Apaf-1)相互作用,在三磷酸腺苷(adenosine triphosphate,ATP)和dATP的协助下形成凋亡复合体,激活Caspase-9,进一步激活Caspase-3,启动Caspase级联反应,最终诱导细胞凋亡。
中药的药效是其复杂化学成分作用于机体生理病理过程的整体调节效应,体现在多种化学成分通过多途径、多环节调节机体内部的动态平衡[15]。目前,主要基于金银花对忍冬藤化学成分进行研究,但二者来源于药用植物忍冬的不同器官,植物不同器官生长发育节律不一,产生的初生与次生代谢产物的种类与含量也因此产生差异,故本研究基于UPLC-Q-TOF/MS对忍冬藤的化学成分进行全面快速地定性分析[16-17],鉴定出忍冬藤中有机酸类、三萜皂苷类、黄酮类、环烯醚萜类和氨基酸类5种类型的36种化学成分,其中()-aldosecolo-ganin、金圣草素-7--新橙皮糖苷、cauloside A、精氨酸、酪氨酸、异亮氨酸和苯丙氨酸等成分为忍冬藤中首次报道,可能是忍冬藤诱导细胞凋亡的物质基础,后续可以基于忍冬藤单体成分或成分群开展实验,探讨各成分间的协同、加和甚至拮抗作用,进一步阐明忍冬藤抗肿瘤的作用机制。
利益冲突 所有作者均声明不存在利益冲突
[1] Ma B, Zhu J W, Zhao A,. Raddeanin A, a natural triterpenoid saponin compound, exerts anticancer effect on human osteosarcoma via the ROS/JNK and NF-κB signal pathway [J]., 2018, 353: 87-101.
[2] 张雨凝, 肖海涛. 肖海涛教授运用中医药治疗多发性骨髓瘤的临床经验 [J]. 中西医结合心血管病电子杂志, 2020, 8(18): 174-175.
[3] 康帅, 张继, 魏爱华, 等. 金银花的本草再考证 [J]. 药物分析杂志, 2014, 34(11): 1922-1927.
[4] Zhao A, Zhang Z J, Zhou Y F,. β-Elemonic acid inhibits the growth of human osteosarcoma through endoplasmic reticulum (ER) stress-mediated PERK/ eIF2α/ATF4/CHOP activation and Wnt/β-catenin signal suppression [J]., 2020, 69: 153183.
[5] 李龙妹, 黄锦鹏, 河文峰, 等. 龙葵提取物澳洲茄碱诱导A549细胞凋亡的机制研究 [J]. 中药新药与临床药理, 2020, 31(12): 1422-1427.
[6] Jan R, Chaudhry G E. Understanding apoptosis and apoptotic pathways targeted cancer therapeutics [J]., 2019, 9(2): 205-218.
[7] 李小江, 邬明歆, 孔凡铭, 等. 中药有效成分抗肿瘤活性及作用机制研究进展 [J]. 中草药, 2020, 51(9): 2587-2592.
[8] Delbridge A R, Grabow S, Strasser A,. Thirty years of BCL-2: Translating cell death discoveries into novel cancer therapies [J]., 2016, 16(2): 99-109.
[9] Fickova M, Macho L, Brtko J. A comparison of the effects of tributyltin chloride and triphenyltin chloride on cell proliferation, proapoptotic p53, Bax, and antiapoptotic Bcl-2 protein levels in human breast cancer MCF-7 cell line [J]., 2015, 29(4): 727-731.
[10] Yadav N, Gogada R, O'Malley J,. Molecular insights on cytochrome C and nucleotide regulation of apoptosome function and its implication in cancer [J]., 2020, 1867(1): 118573.
[11] 潘朝旺, 王伟, 祁学章, 等. 金荞麦提取物对人宫颈癌Hela细胞增殖和诱导凋亡的影响 [J]. 中药药理与临床, 2018, 34(5): 96-100.
[12] Günther C, Martini E, Wittkopf N,. Caspase-8 regulates TNF-α-induced epithelial necroptosis and terminal ileitis [J]., 2011, 477(7364): 335-339.
[13] Brentnall M, Rodriguez-Menocal L, De Guevara R L,. Caspase-9, Caspase-3 and Caspase-7 have distinct roles during intrinsic apoptosis [J]., 2013, 14: 32.
[14] Pommier Y, O'Connor M J, de Bono J. Laying a trap to kill cancer cells: PARP inhibitors and their mechanisms of action [J]., 2016, 8(362): 362ps17.
[15] 汪小莉, 刘晓, 韩燕全, 等. 中药药效物质基础主要研究方法概述 [J]. 中草药, 2018, 49(4): 941-947.
[16] 鲁思爱. 忍冬藤的化学成分及其药理应用研究进展 [J]. 临沂大学学报, 2012, 34(3): 132-134.
[17] 段金廒. 中药资源化学—理论基础与资源循环利用 [M]. 北京: 科学出版社, 2015: 151.
Mechanism of apoptosis induced byextract on osteosarcoma cells
YAN Bao-fei1, 2, DUAN Jin-ao2, ZHANG Jing-zheng1, LIU Sheng-jin2, LIU Jia1, MAO Yi-bei1, ZENG Qing-qi1, 3
1. Jiangsu Health Vocational College, Nanjing 211800, China 2. Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine, Key Laboratory of Chinese Medicinal Resources Recycling Utilization, State Administration of Traditional Chinese Medicine, Nanjing University of Chinese Medicine, Nanjing 210023, China 3. The First Affiliated Hospital of Nanjing University of Traditional Chinese Medicine, Nanjing 210029, China
To investigate the proliferation and apoptosis effects and mechanism ofextract on human osteosarcoma cells.Chemical constituents ofextract were characterized by UPLC-Q-TOF/MS. MTT method was used to detect the effect ofextract on survival rate of human osteosarcoma cells HOS and 143B and human renal cortex proximal tubule epithelial cells HK-2; Fluorescence microscope was used to observe the effect ofextract on apoptosis of HOS and 143B cells; Annexin V/PI double staining method was used to detect the effect ofextract on apoptosis of HOS cells; JC-1 staining method was used to detect the effect ofextract on mitochondrial membrane potential of HOS cells; Western blotting method was used to detect the effect ofextract on expressions of B cell lymphoma 2 associated X protein (Bax), B cell lymphoma 2 (b-cell lymphoma-2, Bcl-2), activated cysteine protease-3 (cleaved Caspase-3), cleaved poly ADP-ribose polymerase (cleaved PARP), cleaved Caspase-9 and cytochrome-c (Cyt-C) in HOS cells.A total of 36 chemical components of five types, including organic acids, triterpene saponins, flavonoids, iridoids and amino acids, were identified inextract.extract inhibited the survival rate of HOS and 143B cells, and significantly induced HOS cells apoptosis (< 0.01). Caspase-3 inhibitor Z-VAD-FMK significantly inhibited HOS cells apoptosis induced byextract (< 0.05, 0.01);extract significantly increased Caspase-3 activity in HOS cells (< 0.01), changed mitochondrial membrane potential of HOS cells (< 0.05, 0.01), increased expressions of Bax, cleaved Caspase-3, cleaved PARP, cleaved Caspase-9, Cyt-C and Bax/Bcl-2 in HOS cells (< 0.05, 0.01), down-regulated Bcl-2 expression (< 0.05, 0.01).extract can inhibit the proliferation of osteosarcoma cells and induce apoptosis through mitochondrial apoptosis. The mechanism may be related to down-regulation of Bcl-2 expression, up-regulation of Bax, cleaved Caspase-3, cleaved PARP, cleaved Caspase-9 and Cyt-C expression, and activation of Caspase cascade reaction.
Thunb.; osteosarcoma; apoptosis; mechanism; UPLC-Q-TOF/MS
R285.5
A
0253 - 2670(2021)13 - 3923 - 10
10.7501/j.issn.0253-2670.2021.13.016
2021-01-14
国家中医管理局名医验方评价与转化重点研究室开放课题(NZYJDMF-2020001);江苏省自然科学基金资助项目(BK20191498);江苏省卫生健康委医学科研项目重点项目(ZDB2020020);浦口区科技发展社会事业项目(S2020-14);江苏卫生健康职业学院校级课题重点项目(JKA201916)
严宝飞,男,硕士,助教,主要从事中药资源学研究。Tel: (025)68172750 E-mail: baofeiy@163.com
刘 嘉,男,硕士,副教授,主要从事中药资源学研究。Tel: (025)68172750 E-mail: liujia402@163.com
[责任编辑 李亚楠]