装载黄芩苷的溶菌酶-低相对分子质量壳聚糖纳米凝胶的制备及表征
姜玉勤,陆 迅,孙晓怡,唐余燕,刘何晶,刘 扬,魏明刚*
装载黄芩苷的溶菌酶-低相对分子质量壳聚糖纳米凝胶的制备及表征
姜玉勤1,陆 迅2,孙晓怡1,唐余燕1,刘何晶1,刘 扬3,魏明刚1*
1. 苏州大学附属第一医院,江苏 苏州 215006 2. 苏州市立医院北区,江苏 苏州 215000 3. 苏州大学药学院,江苏 苏州 215123
基于蛋白-多糖纳米凝胶的制备技术,通过低相对分子质量壳聚糖对溶菌酶的修饰以及对环境因素的调节筛选,控制溶菌酶的自组装行为,制备一种绿色环保的具备核壳结构的溶菌酶-低相对分子质量壳聚糖纳米凝胶,从而达到减小粒径,提高包封率和载药量的目的,使其更有利于肾靶向。利用Maillard反应将溶菌酶与低相对分子质量壳聚糖按不同比例合成溶菌酶-低相对分子质量壳聚糖枝接物,通过SDS-PAGE蛋白电泳来优选出产量最高的合成比例;对合成的产物进行内源荧光、紫外测定等表征,并通过2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzenesulfonic acid,TNBS)法测定接枝率;以粒径为评价指标,对溶菌酶浓度,反应体系pH值、加热温度等条件进行筛选优化,得到空白纳米凝胶最佳合成条件;选取适宜的载药方法,得到了载黄芩苷纳米凝胶。合成纳米凝胶的最佳工艺为溶菌酶与低相对分子质量壳聚糖比例1∶2、反应体系pH值11、溶菌酶-壳聚糖接枝物质量浓度为0.6 mg/mL、加热温度71 ℃、加热时间51 min。得到的溶菌酶-低相对分子质量壳聚糖枝接物接枝率为(24.7±2.9)%,空白纳米凝胶的粒径范围为16~120 nm、平均粒径为49.02 nm、PDI为0.132,载黄芩苷纳米凝胶的包封率为(95.00±2.54)%、载药量为(17.00±1.26)%。通过Maillard合成了溶菌酶-低相对分子质量壳聚糖纳米凝胶,并找到了最优的合成工艺。制备的纳米凝胶包封率高,粒径小,分布均匀,缓释效果明显。
溶菌酶;低相对分子质量壳聚糖;黄芩苷;Maillard反应;自组装纳米凝胶;肾靶向;SDS-PAGE
靶向给药系统(targeted drug delivery system,TDDS)是使药物能到达靶器官、靶细胞,甚至细胞内的结构,并要求有一定浓度的药物停留相当长的时间,以更好地发挥药效的给药系统。临床上用于肾脏疾病的药物因长期用药,而且靶向性不强,多数具有较大的毒性[1]。为了减少不良反应并提高药物生物利用度,肾靶向给药系统的研究成为人们关注的重点。
纳米凝胶(nanoparticles)纳米凝胶是由亲水性或两亲性高分子链组成的三维网状结构,它能显著的溶胀于水但是不溶解于水,由于水和凝胶网络的亲和性,水可能以束缚水和自由水等形式存在于高分子网络中而失去流动性,因此纳米凝胶能够保持一定的形状。它们可以作为一种药物载体,而且也可以通过盐键、氢键或者疏水作用自发的结合一些生物活性分子[2-3]。溶菌酶(lysozyme,LZM)和壳聚糖都是优良的生物分子材料,具有良好的生物特性和机械性能,是比较热门的研究对象。
溶菌酶在适当条件下,可与多糖在酸或热诱导下形成纳米凝胶,并在药物运输体系中发挥重要作用[4]。溶菌酶属于低相对分子质量蛋白质(low molecular weight protein,LMWP),LMWP相对分子质量比药物大,能够控制所结合药物的动力学性质:可以经肾小球滤过,并被肾近曲小管细胞重吸收。药物与LMWP形成的复合物能够很快离开循环系统,而浓集于近曲小管细胞。在细胞中,LMWP被转运到具有蛋白水解活性的溶酶体中,被水解代谢为短肽和小分子氨基酸,所载药物可被活化和释放出来[5]。
药物可直接通过末端羧基与溶菌酶的赖氨酸相连,也可通过不同的间隔基团,如酸敏感间隔基、寡肽、α-羟基酸、铂(II)通用联动系统(ULS)和pH敏感的顺-乌头碱间隔基与之间接相连[6]。壳聚糖为带阳离子的高分子碱性多糖聚合物,聚合物脱乙酰化小分子壳聚糖(low molecular weight chitosan,LMWC)既有生物相容性又有生物可降解性,近年来已经成功应用于肾靶向载体系统中[7]。
研究表明低相对分子质量壳聚糖和溶菌酶是作为配体与近端肾小管Megalin和Cubilin受体结合而实现靶向[8]的作用,本实验旨在探究通过低相对分子质量壳聚糖对溶菌酶的修饰以及对环境因素的调节筛选,控制溶菌酶的自组装行为,制备一种绿色环保的具备核壳结构的溶菌酶-低相对分子质量壳聚糖纳米凝胶,从而减小纳米凝胶粒径,提高包封率和载药量,使其更有利于肾靶向。
黄芩苷作为黄酮类化合物,具有抗炎、调血脂、抗氧化等广泛的生物活性,在体外可通过阻断脂多糖诱导的血管内皮细胞核因子κB(nuclear factor kappa-B,NF-kB)活化发挥抗炎作用[9]。实验发现在大鼠制模同时给予灌胃黄芩苷可降低体内血脂指标,抑制NF-kB活化,减少人巨噬细胞趋化蛋白-1(human macrophage chemoattractant protein-1,MCP- 1)分泌,表明黄芩苷能较好地改善脂质代谢紊乱,减弱氧化应激和炎症反应,对预防肾小球肾炎,延缓早期肾小球肾炎病理损害及保护肾脏功能具有重要意义[10]。
基于纳米凝胶的优越性,本实验通过低相对分子质量壳聚糖对溶菌酶的修饰以及对环境因素的调节筛选,制备出一种绿色环保的具备核壳结构的溶菌酶-低相对分子质量壳聚糖纳米凝胶(图1),对其进行表征,并选取适宜方法将模型药物黄芩苷包封于其内部,发现溶菌酶-低相对分子质量壳聚糖纳米凝胶给药系统具有较高包封率和载药量。
1 仪器与试剂
1.1 仪器
Min-Protean垂直电泳仪,美国伯乐有限公司;DHG-9023A烘箱,上海精宏实验室设备有限公司;CHEMIDOC粒成像仪,BIO-RAD公司;UV-2600紫外分光光度计,日本岛津精密仪器公司;LS55荧光分光光度计,珀金埃尔默仪器有限公司;Model410圆二色谱仪,美国AVIV公司;Zetasizer Nano ZS90纳米凝胶度及Zeta电位分析仪,英国马尔文有限公司,H-600透射电子显微镜(TEM),日本日立公司;HH-2数显恒温水浴锅,常州智博瑞仪器制造有限公司。
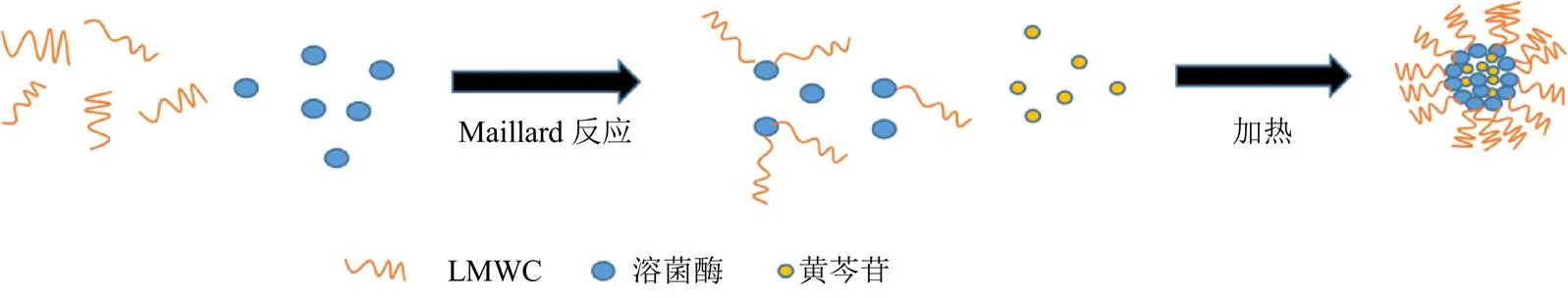
图1 研究总思路
1.2 药品与试剂
低相对分子质量壳聚糖,批号PH170210,平均相对分子质量<5000,上海笛柏化学品技术有限公司;溶菌酶,批号20201025,质量分数大于98%,西格玛奥德里奇(上海)贸易有限公司;考马斯亮蓝R250,上海金穗生物科技有限公司;蛋白电泳试剂盒、十二烷基磺酸钠(sodium dodecyl sulfate,SDS,批号151026),上海碧云天生物技术有限公司;KBr(批号HZB50C)、磷酸二氢钠(批号113091013)、柠檬酸(批号90311)、柠檬酸钠(批号153269),国药集团化学试剂有限公司;2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzenesulfonic acid,TNBS)试剂盒,批号HZB50C,东京化成工业株式会社;黄芩苷,批号PC20170510,质量分数>98%,南京都莱生物技术有限公司。
2 方法与结果
2.1 复合物的制备
壳聚糖与溶菌酶的反应是通过Maillard反应来完成的[11]。Maillard反应也称羰氨反应,它是醛、酮、还原糖以及脂肪氧化生成的羰基化合物与胺类、氨基酸、肽、蛋白质甚至氨水中的氨基之间的反应[12]。本实验利用蛋白质溶菌酶ε-氨基与LMWC还原性末端羰基之间发生的自发Maillard反应,将蛋白与多糖偶联成一体,得到LZM-LMWC复合物。具体操作是将溶菌酶和LMWC的混合物以0.10 g/mL质量浓度溶解于水中并冷冻干燥得到二者的混合粉末。将混合粉末在底部含有饱和KBr溶液的干燥器中(此时的相对湿度为79%),在相对湿度79%、60 ℃下反应4 d[13]。反应过程见图2。
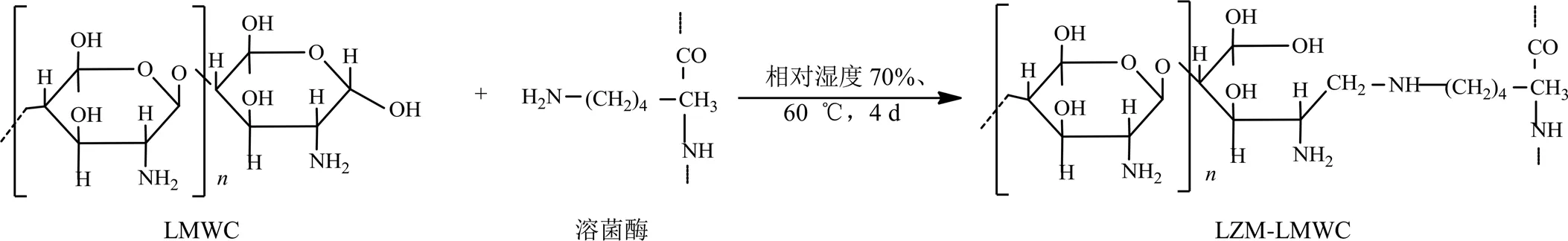
图2 LZM-LMWC反应流程
2.2 溶菌酶与LMWC最优混合物质的量比筛选
将溶菌酶和LMWC按混合物质的量比分别为1∶1、1∶2、1∶3、1∶4的比例,按上述合成方法合成,后将反应后的物质用去离子水溶解,用截留相对分子质量为14 000的透析袋对复合物进行透析,除去游离的溶菌酶和LMWC,透析72 h,后用SDS-PAGE电泳法对复合物含量进行检测。根据溶菌酶和壳聚糖的相对分子质量,选择15%的分离胶,上样量为20 μL,浓缩胶电压80 V,分离胶调节电压为120 V,当蛋白Marker条带即将到达底部的时候,停止电泳,后进行染色和脱色。电泳后通过Bandscan软件程序对高相对分子质量条带和低相对分子质量条带的灰度进行观察分析。
如图3所示,各比例条件下,LZM-LMWC的合成产率基本都随着反应时间(1~4 d)的增加而不断增加,且合成产率最高的比例为1∶2,所以选取溶菌酶与LMWC的混合物质的量比为1∶2的产物作为纳米凝胶的制备原料。
2.3 LZM-LMWC复合物的表征测定
2.3.1 紫外-可见吸收光谱测定 将复合物LZM- LMWC(溶菌酶与LMWC物质的量比1∶2)、物理混合物(溶菌酶与LMWC物质的量比1∶2)、LMWC和溶菌酶分别用水稀释至0.1 mg/mL,使用紫外分光光度计对样品扫描,波长范围为150~400 nm,结果图4。比较图4可见,物理混合物在150~400 nm的吸收为溶菌酶和LMWC吸收的叠加,溶菌酶与LMWC反应后的紫外吸收光谱在260~280 nm处的吸收峰已不明显,吸收峰的几乎消失说明可能有新的化合物的形成,此时溶菌酶与LMWC已经处于结合状态。同时,210~225 nm处的吸收峰移至230 nm附近。吸收峰红移,吸收强度减弱,这可能与蛋白质的二级结构变化有关。
2.3.2 圆二色性光谱(CD)测定 天然溶菌酶与LZM-LMWC(1∶2)分别溶于去离子水中,配制成质量浓度为30 μg/mL的样品液,分别取适量样品液于光径为0.1 cm的比色池中,使用圆二色谱仪进行检测,环境温度为25℃,样品扫描波长范围190~250 nm,扫描速率100 nm/min,谱带宽度1.0 nm,灵敏度为20 mdeg,响应时间为0.25 s。图谱经过仪器本底消除和溶液空白差减,可计算样品的α-螺旋、β-折叠、β-转角和无规卷曲二级结构的百分含量。如图5所示,溶菌酶在200 nm正峰处具有最高椭圆率,表明溶菌酶的天然结构主要以α-螺旋为主,在210~215 nm处有最低椭圆率。合成的LZM- LMWC接枝物正峰位置及负峰位置改变不明显,CD图分析的蛋白质不同二级结构的比例变化如表1所示。在LZM-LMWC的合成过程中,溶菌酶的二级结构α-螺旋比例在降低,β-折叠与无规则卷曲比例升高,可能在60 ℃的加热条件下α-螺旋少量的转化为了β-折叠与无规则卷曲,这与蛋白质的变性有关。
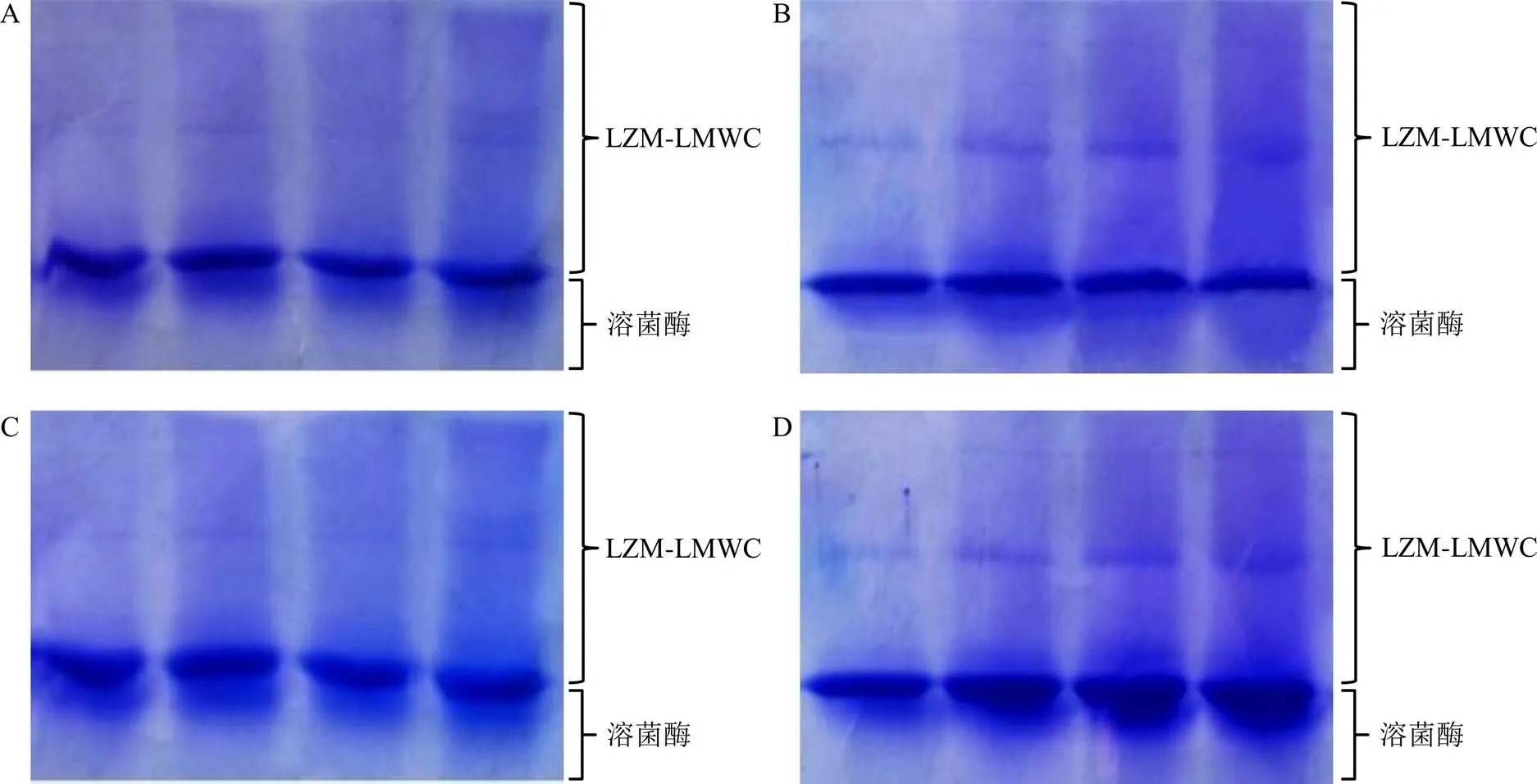
图3 溶菌酶与LMWC不同混合物质的量比(1∶1, A; 1∶2, B; 1∶3, C; 1∶4, D)合成的反应产物的SDS-PAGE电泳图
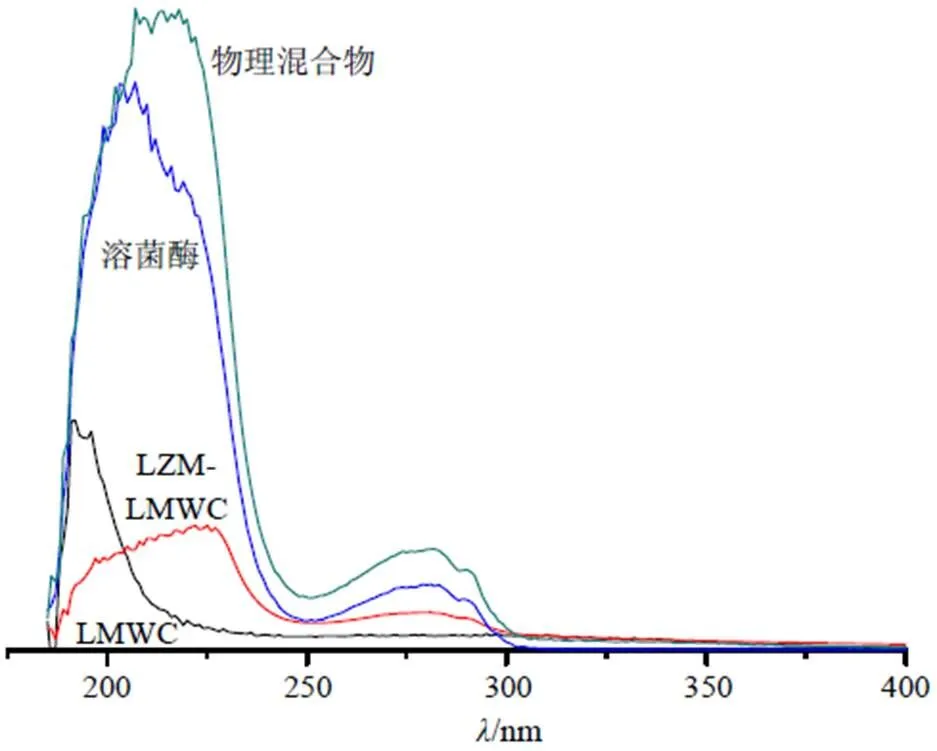
图4 复合物LZM-LMWC和物理混合物的紫外吸收图
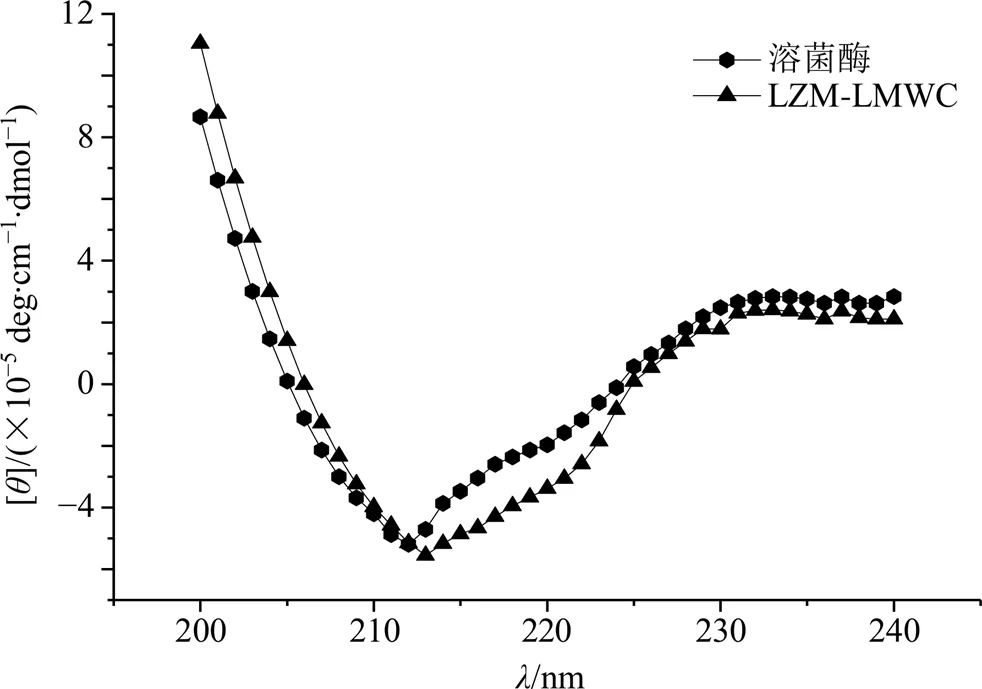
图5 溶菌酶和LZM-LMWC的远紫外CD图
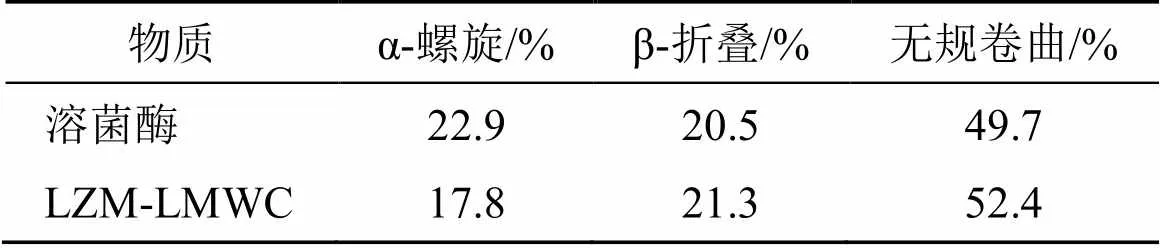
表1 溶菌酶和LZM-LMWC的不同二级结构的比例
2.3.3 内源荧光测定 溶菌酶与LMWC合成后产生褐变现象,褐变是糖基化反应的显著特征。褐变的结果是有色物质的产生,研究表明荧光物质是有色物质的前体物。因此,通过对比反应前后物质的荧光强度可证实溶菌酶与LMWC发生了接枝反应。以0.1 mol/L pH 7.4磷酸盐缓冲液(PBS)为溶剂配制1.0 mmol/L的溶菌酶标准溶液备用,LZM-LMWC使用相同的溶液配成1.0 mmol/L的标准溶液备用。在激发和发射光栅狭缝均为5 nm,激发波长为280 nm条件下,扫描一定波长范围内溶菌酶和LZM-LMWC的荧光光谱。由图6可见,与溶菌酶相比,复合物在340 nm处的荧光强度增大,证实了溶菌酶与LMWC发生了接枝反应。
2.3.4 复合物接枝度测定 采用2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzenesulfonic acid,TNBS)法测定溶菌酶糖基化反应前后自由氨基的含量,从而推算出复合物的接枝度。取1 mL蛋白质量浓度为1 mg/mL的样品溶液分别与1 mL的NaHCO3溶液(0.04 g/mL)、SDS溶液(0.10 g/mL)与TNBS溶液(1 mg/mL)混合。随后置于40 ℃的水浴锅中避光反应2 h,依次加入0.5 mL 1 mol/L的HCl和5 mL 0.01 mol/L HCl以终止反应。冷却后立即在340 nm处测定样品溶液的吸光度()。利用接枝度的计算公式计算载体的接枝度为(24.7±2.9)%。
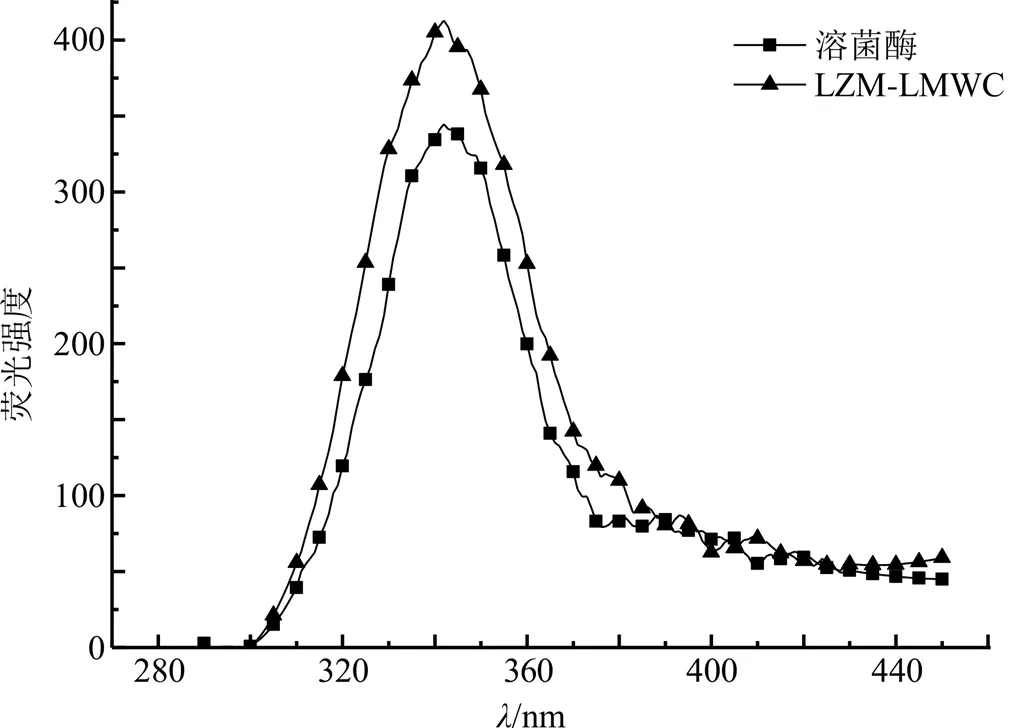
图6 溶菌酶和LZM-LMWC的内源荧光图
接枝度=1-样白/白样
样与白分别为接枝共聚物和溶菌酶的,样与白分别为接枝共聚物和溶菌酶的蛋白质量浓度
2.4 空白纳米凝胶制备工艺的考察
球状蛋白质加热胶化理论是本实验选取的合成方法依据的最根本的理论,对于常见的蛋白质分子来说,加热变性胶化是一个非常重要的性质。球状蛋白质在不加入交联剂的情况下,通过控制反应物的浓度、pH值、加热温度及加热时间即可得到稳定的固态胶体。因此,以空白纳米凝胶粒径及聚合物分散性指数(polymer dispersity index,PDI)为评价指标,选取反应体系pH值、接枝物的质量浓度、加热温度及加热时间进行单因素实验及中心组合设计(central composite design,CCD)实验考察。
2.4.1 pH值对粒径的影响 控制反应物的质量浓度为1 mg/mL,反应温度为80 ℃,反应时间为45 min,在不同pH值的缓冲液中进行合成。在pH值为11缓冲体系中,粒径分布更集中,粒径也更小。所以选取pH值为11的Na2CO3-NaOH缓冲液作为纳米凝胶合成的反应体系。图7中明显可以看出在pH值为11缓冲体系中,粒径分布更加集中,粒径也更加小。所以选取pH值为11的Na2CO3-NaOH缓冲液作为纳米凝胶合成的反应体系。
2.4.2 溶菌酶-壳聚糖质量浓度对粒径影响 控制反应体系pH值为11,反应温度为70 ℃,反应时间为45 min,选取质量浓度分别为0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、2.1 mg/mL的LZM-LMWC接枝物合成空白纳米凝胶。所得空白纳米凝胶粒径分别为69.8、69.1、69.1、69.2、90.0、115.6、140.3、162.3、218.7 nm。可见,随着溶菌酶-壳聚糖质量浓度的降低,纳米凝胶的粒径不断降低,当溶菌酶-壳聚糖质量浓度过低时,合成体系中的粒子数过低,质量浓度达到0.6 mg/mL后,质量浓度对粒径的影响不大。所以最终选取溶菌酶-壳聚糖质量浓度为0.6 mg/mL作为纳米凝胶合成的条件。
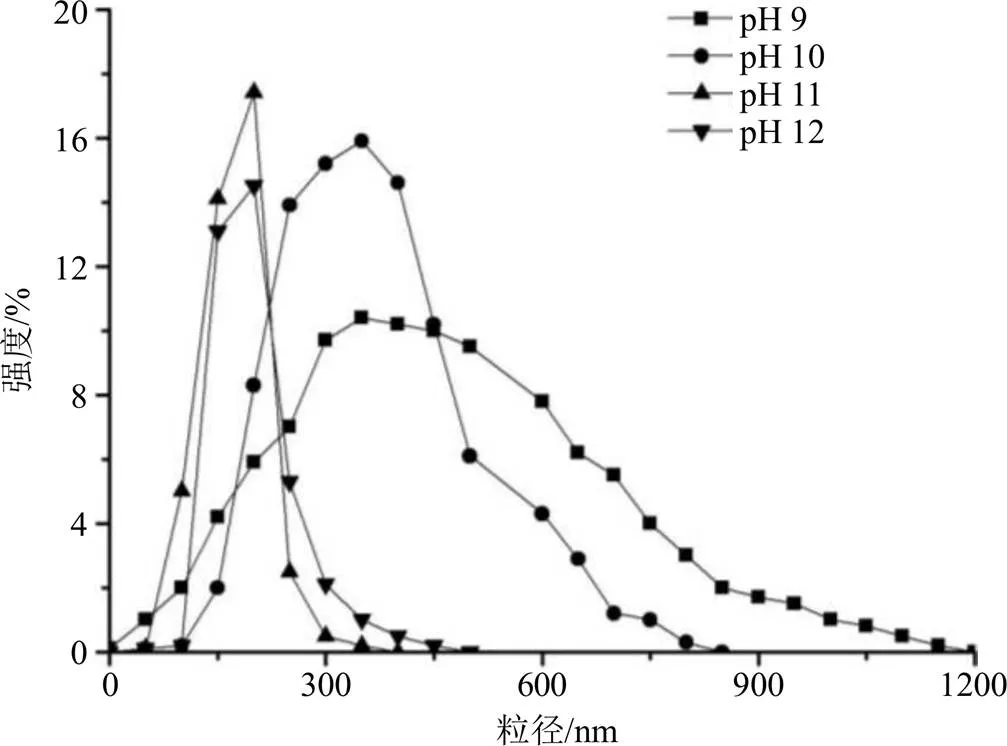
图7 合成体系pH值9~11时的粒径分布图
2.4.3 加热温度和时间对粒径的影响 控制反应体系pH值为11,LZM-LMWC接枝物质量浓度为0.6 mg/mL,加热时间为45 min,加热温度分别设置为30、40、50、60、70、80、90 ℃合成空白纳米凝胶。所得空白纳米凝胶粒径分别为133.4、145.2、153.2、126.7、97.6、180.3、121.0 nm。可见,加热温度对纳米凝胶的粒径影响较为显著,在70 ℃时得到的纳米凝胶粒径最最小。
随后控制反应体系pH值为11,LZM-LMWC接枝物质量浓度为0.6 mg/mL,加热温度为70 ℃,加热时间分别设置为30、40、50、60 min合成空白纳米凝胶。所得空白纳米凝胶粒径分别为125.7、137.5、114.3、116.8 nm。可见,加热时间对空白纳米凝胶粒径的影响并不显著,在加热时间30~60 min,粒径的变化并无太大波动。
2.4.4 空白纳米凝胶的制备条件多因素CCD考察 根据CCD的中心组合实验原理,综合单因素试验结果,选取反应体系pH值(1)、反应物的质量浓度(2)、加热温度(3)和加热时间(4)为响应面的自变量,粒径大小()为指标,实验因素水平、实验设计及结果见表2。
根据实验模型拟合结果及软件统计结果,可以得到最终响应面的二次方程为=41.97+0.321+16.892+0.613+13.344-0.8712-0.9513+0.1814-2.9423+5.4424-5.8134+9.6212+7.3622+19.8832+5.8642。
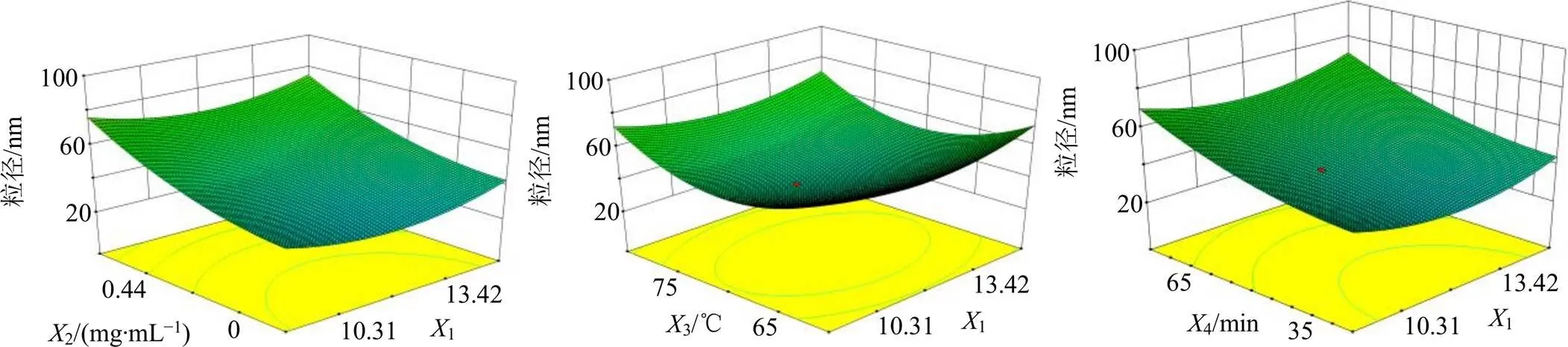
回归模型的方差分析结果见表3。<0.05表明考察因素对于响应值具有显著性。进一步分析各方程中的各项,1、2、3、4对均有显著性影响。应用Design-Expert 8.0.6软件绘制不同考察因素对于各响应值的3D响应面图(图8)。3D响应面图可用来评价各考察因素之间的交互作用以及确定各因素的最佳范围。
通过Design-Expert 8.0.6软件的优化模块,得到空白纳米凝胶制备的最优反应条件为pH值11,质量浓度0.6 mg/mL,温度为71 ℃,反应时间为51 min;纳米凝胶的平均粒径68.28 nm。
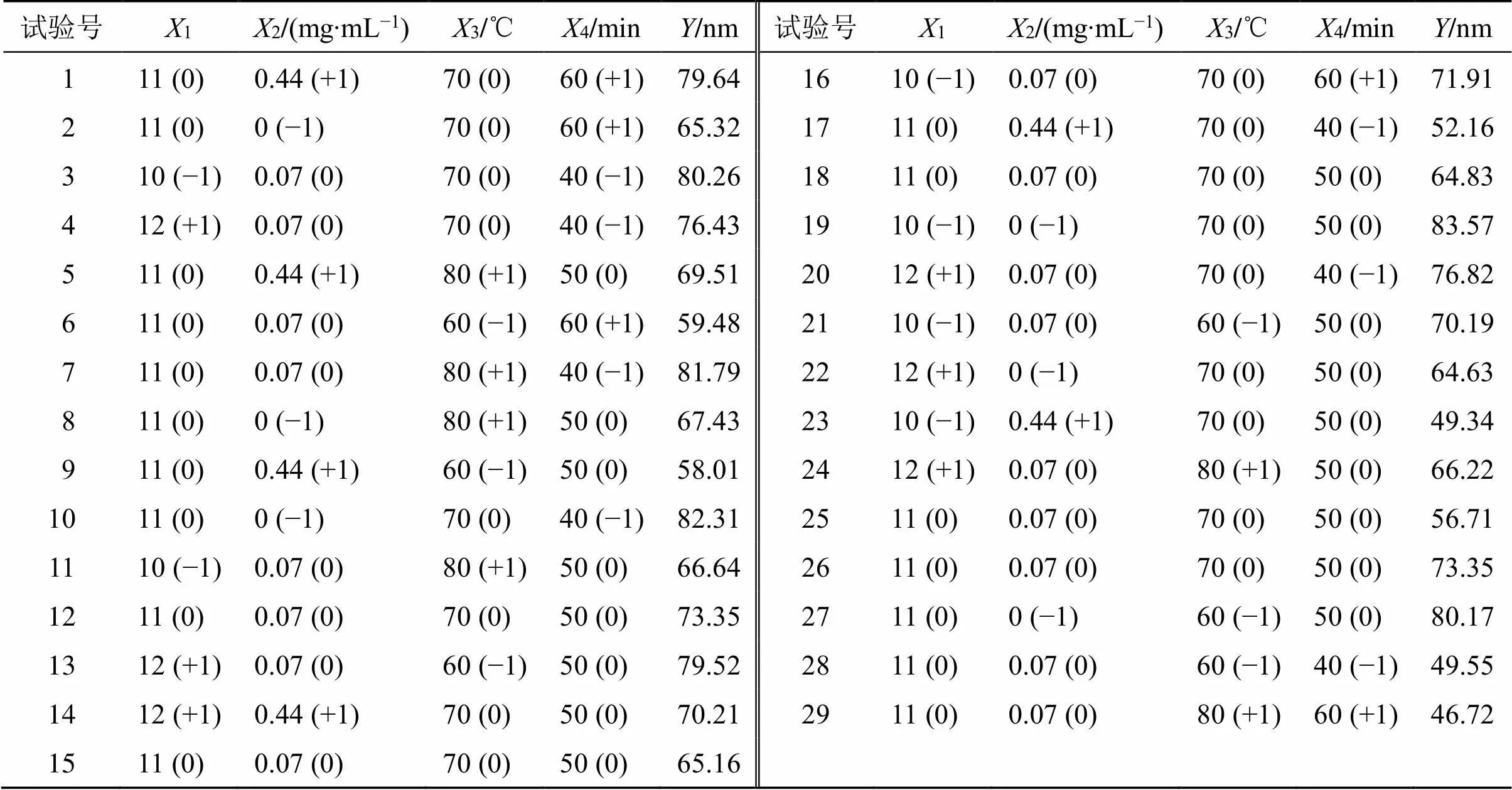
表2 响应面实验因素水平设计及结果
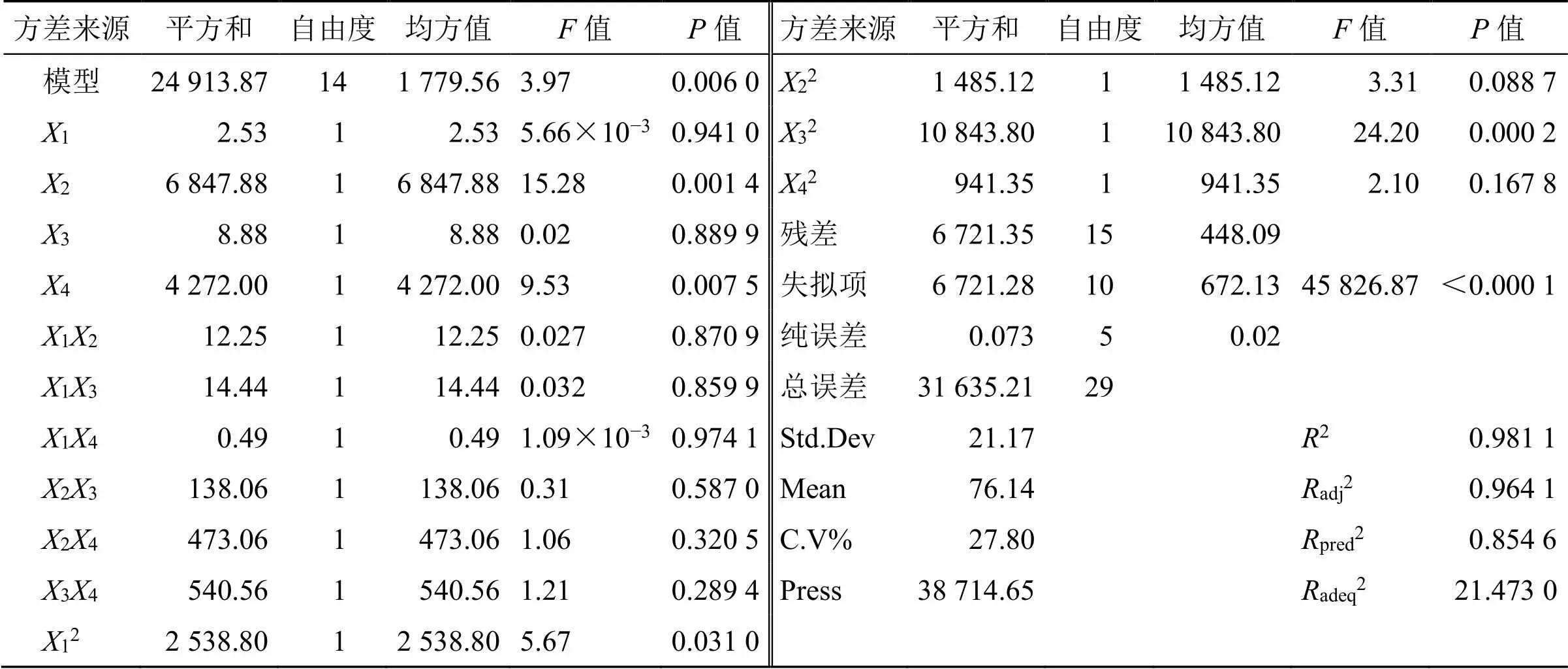
表3 CCD实验设计方差分析
按照上述最优处方条件制备3批溶菌酶- LWMC空白纳米凝胶,测定纳米凝胶粒径、载药量及包封率,结果见表4,平均粒径为69.13 nm,载药量15.79%,包封率94.78%,RSD在2%以内,表明验证结果良好,制备工艺稳定。
2.5 LZM-LMWC空白纳米凝胶(LZM-LMWC- NPs)的制备及表征
2.5.1 LZM-LMWC-NPs的制备 根据上述实验结果,确定LZM-LMWC-NPs的合成方法为将LZM- LMWC溶解于去离子水中配成0.6 mg/mL的溶液,在25 ℃下用超声溶解仪使接枝物充分溶解分散。用0.1 mol/L NaOH-Na2CO3缓冲液缓慢调节溶液pH值至11,随后放置在71 ℃恒温水浴中孵育51 min,用冰浴终止反应。之后,将产物在截留相对分子质量为14 000的透析袋中透析3 d,去除残留的单体及其他杂质。透析完成后,将产物放在真空冷冻干燥机中冷冻干燥48 h去除水分,获得干燥的纳米凝胶温室保存。
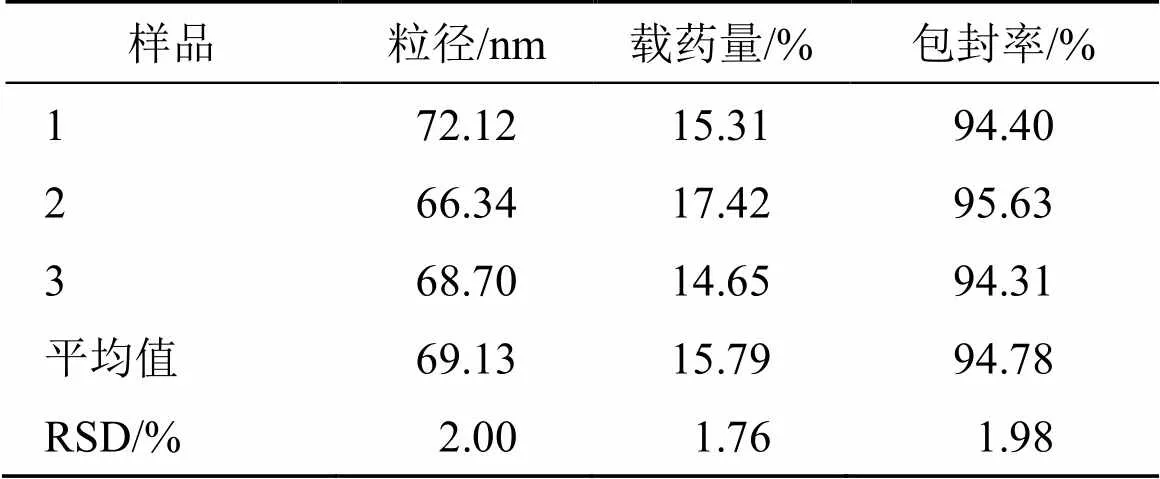
表4 最优条件的验证结果
2.5.2 LZM-LMWC-NPs的表征 采用H-600透射电子显微镜观察LZM-LMWC-NPs形态近为球形,粒径大小分布较均一,如图9。粒径范围为16~120 nm,平均粒径为49.02 nm,PDI为0.132,说明粒径分散性良好,见图10。

图9 LZM-LMWC-NGs的TEM图
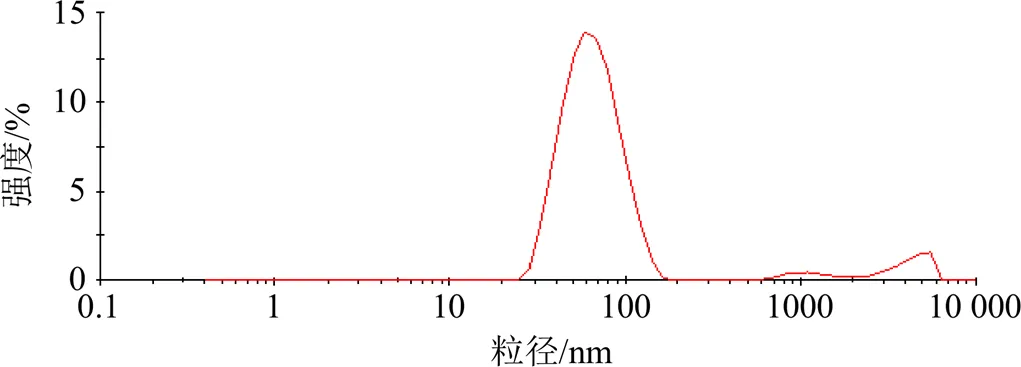
图10 LZM-LMWC-NGs粒径分布
2.6 黄芩苷-溶菌酶-低相对分子质量壳聚糖纳米凝胶(baicalin-lysozyme-low molecular weight chitosan- lysozyme-nanogels,BA-LZM-LMWC-NPs)的制备
2.6.1 载黄芩苷纳米凝胶制备 取0.1 g制备好的LZM-LMWC-NGs复溶分散在10 mL去离子水中,超声震荡15 min后缓慢加入用乙醇溶解的黄芩苷,于磁力搅拌器搅拌,用Na2CO3-NaOH缓冲液调节反应体系pH值为8~9,滴完黄芩苷溶液后继续搅拌10 min。在温度为60 ℃的条件下加热40 min后将混合物小心地转移到离心管中,并以12 000 r/min的速度离心20 min,移去含有未装载黄芩苷的上清液,小心收集底层物质并将其分散在去离子水中,获得装载有黄芩苷的纳米凝胶,即BA-LZM- LMWC-NPs,将其在冷冻干燥机中冷冻干燥48 h,干燥完成后密封保存。
2.6.2 黄芩苷体外测定方法的建立 紫外扫描显示,黄芩苷有244、278、315 nm处3个吸收峰,其中278 nm波长处有最大吸收,所以选定278 nm作为黄芩苷的测定波长。
实验测定黄芩苷回归曲线方程=0.030 6-0.006 7,2=0.999 9,线性范围1~32 μg/mL。取1、8、32 μg/mL高、中、低3个不同质量浓度样品溶液,分别在1 d内5个固定时间点对其值进行测定。并连续5 d进行,然后计算1 d内和5 d内的RSD。高、中、低3个质量浓度的日内精密度和日间精密度分别为1.98%、0.96%、0.55%和1.86%、1.52%、0.88%,RSD均<2%,表明该方法精密度良好。
2.6.3 BA-LZM-LMWC-NPs包封率和载药量的测定 实验采用高速离心的方法测定BA-LZM- LMWC-NPs的包封率。取适量制备好干燥的BA- LZM-LWMC-NPs粉末,向其中加入0.1 mol/L HCl 1 mL使其分散,以12 000 r/min离心20 min,取上层清液。使用紫外分光光度计测量上清液在480 nm处的值,然后基于标准曲线计算游离黄芩苷的量,从而获得负载在纳米凝胶上黄芩苷的量。
包封率=(3-2)/3
载药量=(3-2)/1
3为总药物的量,2为游离的药物的量,1为载药纳米凝胶的总量
根据实验数据和公式计算,载药纳米凝胶包封率为(95.00±2.54)%,载药量(17.00±1.26)%。
2.6.4 黄芩苷及载药纳米凝胶的体外释放 实验研究结果显示,黄芩苷在pH 7.4的PBS缓冲液中的平衡溶解度可达到6.7 mg/mL,故选其作为释放介质。分别称取适量的黄芩苷和BA-LZM-LMWC- NGs置于透析袋,置于500 mL pH值为7.4的PBS中,在(37.0±0.5)℃的恒温水浴振荡器中持续搅拌(100 r/min)。分别在0、0.2、0.5、1、2、4、8、12、24 h取样5 mL,立即用0.45 μm微孔滤膜滤过,取续滤液4 mL待测,同时补充相同温度下保存的新鲜释放介质5 mL。在278 nm波长下采用紫外分光光度计分析检测续滤液中黄芩苷含量,计算黄芩苷的累积释放率()。
设置3个平行实验,药物释放率通过公式计算得到。如图11所示,随着时间的延长,黄芩苷和BA- LZM-LMWC-NGs的累积释放率均逐渐增加。在24 h内,黄芩苷释放了98%,黄芩苷从BA-LZM- LMWC-NGs中72 h内释放了72%,这一结果表明BA-LZM-LMWC-NGs中黄芩苷的释放有一定缓释效果。

0和分别表示释放液体积和每次取样体积,表示第次取样时黄芩苷的释放质量浓度,表示BA-LZM-LMWC- NGs的质量,表示BA-LZM-LMWC-NGs的载药量
图11 黄芩苷及BA-LZM-LMWC-NGs的体外释放曲线
Fig. 11 Baicalin and BA-LZM-LMWC-NGsin vitro release
3 讨论
具有高功能的纳米凝胶因其制造有低成本、低环境负荷、低能耗等特点,成为目前人们研究的热点。目前已采用不同的材料,如高分子聚合物、脂质体/脂质、金属/金以及蛋白质等制成不同类型的纳米载药体系,以提高灌注治疗效果,并降低药物的毒副作用。蛋白质和多糖作为天然、无毒、可降解的天然高分子,更受研究者的青睐[14]。两亲性高分子衍生物,如壳聚糖、羧甲基纤维素等,既可通过电荷与蛋白质质肽类药物相互作用,又可通过其疏水基团与蛋白质质肽类药物的脂溶性基团相互作用,双重作用更有利于纳米载体对蛋白质质肽类药物的负载[15-17]。
基于上述研究结论,本实验用Maillard反应和球状蛋白质加热粒化理论,以溶菌酶和壳聚糖为原料,得到粒径范围为16~120 nm,平均粒径为49.02 nm,PDI为0.132的LZM-LMWC纳米凝胶粒。利用TNBS法通过测定溶菌酶糖基化反应前、后自由氨基的含量,推算出LZM-LMWC的接枝率为(24.7±2.9)%。通过紫外分光光度计测定分析了LZM-LMWC纳米凝胶的载药量和包封率及BA- LZM-LMWC-NGs体外释放率,并通过对比发现LZM-LMWC纳米凝胶对黄芩苷的释放可产生缓释效应,增加药物的生物利用度。LZM-LMWC纳米凝胶粒物理性能稳定,大小分布均匀,为进一步在体实验提供了基础。
利益冲突 所有作者均声明不存在利益冲突
[1] 张俞, 张常然. 肾脏靶向治疗研究进展 [J]. 临床和实验医学杂志, 2010, 9(24): 1901-1903.
[2] Ma Y K, Ge Y X, Li L B. Advancement of multifunctional hybrid nanogel systems: Construction and application in drug co-delivery and imaging technique [J]., 2017, 71: 1281-1292.
[3] Zhang H, Zhai Y J, Wang J,. New progress and prospects: The application of nanogel in drug delivery [J]., 2016, 60: 560-568.
[4] Ren D Y, Qi J R, Xie A Q,. Encapsulation in lysozyme/A. Sphaerocephala Krasch polysaccharide nanoparticles increases stability and bioefficacy of curcumin [J]., 2017, 38: 100-109.
[5] He H N, Ye J X, Liu E G,. Low molecular weight protamine (LMWP): A nontoxic protamine substitute and an effective cell-penetrating peptide [J]., 2014, 193: 63-73.
[6] Lin L F, Xu W, Liang H S,. Construction of pH-sensitive lysozyme/pectin nanogel for tumor methotrexate delivery [J]., 2015, 126: 459-466.
[7] Liang Z, Gong T, Sun X,. Chitosan oligomers as drug carriers for renal delivery of zidovudine [J]., 2012, 87(3): 2284-2290.
[8] He X K, Yuan Z X, Wu X J,. Low molecular weight hydroxyethyl chitosan-prednisolone conjugate for renal targeting therapy: Synthesis, characterization andstudies [J]., 2012, 2(11): 1054-1063.
[9] Wang T M, Shi G X, Shao J,.antifungal activity of baicalin againstbiofilms via apoptotic induction [J]., 2015, 87: 21-29.
[10] 李绚, 阎蓉华, 彭谨. 黄芩苷通过降低高脂血症大鼠肾小球核因子κB及可溶性单核细胞趋化蛋白表达抑制肾脏炎性反应 [J]. 中国动脉硬化杂志, 2010, 18(8): 611-613.
[11] Fu L L, Wang C, Wang J B,. Maillard reaction with ribose, galacto-oligosaccharide or chitosan- oligosaccharide reduced the allergenicity of shrimp tropomyosin by inducing conformational changes [J]., 2019, 274: 789-795.
[12] 魏玉娇, 郭晓强, 周婷. 酪蛋白-羧甲基壳聚糖美拉德产物的制备及表征 [J]. 中国调味品, 2021, 46(2): 19-22.
[13] Song Y T, Babiker E E, Usui M,. Emulsifying properties and bactericidal action of chitosan-lysozyme conjugates [J]., 2002, 35(5): 459-466.
[14] Xie C X, Feng Y J, Cao W P,. Novel biodegradable flocculating agents prepared by phosphate modification of Konjac [J]., 2007, 67(4): 566-571.
[15] Zhang K, Li P, He Y P,. Synergistic retention strategy of RGD active targeting and radiofrequency-enhanced permeability for intensified RF & chemotherapy synergistic tumor treatment [J]., 2016, 99: 34-46.
[16] Zhang K, Xu H, Jia X,. Ultrasound-triggered nitric oxide release platform based on energy transformation for targeted inhibition of pancreatic tumor [J]., 2016, 10(12): 10816-10828.
[17] Jiang T Y, Zhang Z H, Zhang Y L,. Dual-functional liposomes based on pH-responsive cell-penetrating peptide and hyaluronic acid for tumor-targeted anticancer drug delivery [J]., 2012, 33(36): 9246-9258.
Preparation and characterization of lysozyme-low molecular weight chitosan loaded with baicalin
JIANG Yu-qin1, LU Xun2, SUN Xiao-yi1, TANG Yu-yan1, LIU He-jing1, LIU Yang3, WEI Ming-gang1
1. The First Affiliated Hospital of Soochow University, Suzhou 215006, China 2. Suzhou Municipal Hospital, Suzhou 215000, China 3. College of Pharmaceutical Sciences, Soochow University, Suzhou 215123, China
Based on the preparation technology of protein polysaccharide nanomaterials, through the modification of low molecular weight chitosan to lysozyme and the adjustment of environmental factors, by controlling the self-assembly behavior of lysozyme, to prepare a green environment-friendly lysozyme low molecular weight chitosan nanomer gel with core shell structure, thereby reducing gel size, increasing entrapment efficiency and drug loading, and making it more conducive to renal target.Lysozyme and low molecular weight chitosan were synthesized by Maillard reaction and SDS-PAGE was used to optimize the ratio of lysozyme and low molecular weight chitosan with the highest yield; The synthesized products were characterized by endogenous fluorescence and UV detection, and the grafting rate was determined by TNBS method; The particle size was used as the evaluation index, The optimal conditions for the preparation of the blank nanomaterials were screened and optimized by optimizing the conditions of lysozyme concentration, reaction system pH and heating temperature. With the entrapment efficiency, the suitable drug loading methods were selected to obtain the nanogel loaded with baicalin.The content of lysozyme low molecular weight chitosan with a graft ratio of (24.7 ± 2.9)% was obtained, and the blank nanogel with a particle size of 16—120 nm, an average particle size of 49.02 nm and a PDI 0.132, and a baicalin nanogel with a entrapment efficiency of (95.00 ± 2.54)% and a drug loading of (17.00 ± 1.26)% were obtained.Lysozyme low molecular weight chitosan nanoscale gel by Maillard The optimal ratio of lysozyme to low molecular weight chitosan was synthesized by Maillard reaction and the best synthetic process was found. The prepared nano gel has high encapsulation efficiency, small particle size, uniform distribution and obvious sustained release effect.
lysozyme; low molecular weight chitosan; baicalin; Maillard reaction; self-assembled nanogels; kidney targeting; SDS- PAGE
R283.6
A
0253 - 2670(2021)13 - 3831 - 10
10.7501/j.issn.0253-2670.2021.13.007
2020-11-11
国家自然科学基金面上项目(81673896);苏州市科技局应用基础研究项目(SYSD2019205);苏州市科技局应用基础研究项目(SYSD2019210);苏州市科技局应用基础研究项目(SYS2020119)
姜玉勤(1991—),女,硕士研究生,研究方向为中西结合肾脏病基础与临床。Tel: 13675517401 E-mail: 1113899366@qq.com
魏明刚(1975—),男,博士,主任中医师,博士生导师,研究方向为中西结合肾脏病基础与临床。Tel: 13812791993 E-mail: weiminggang@suda.edu.cn
[责任编辑 郑礼胜]