基于偏头痛药效优化青花椒超临界提取物热熔压敏胶贴剂的成型工艺及其安全性评价
袁瑞芳,杨金辉,章津铭,贺亚男,任 涵,张定堃*,杨 明
基于偏头痛药效优化青花椒超临界提取物热熔压敏胶贴剂的成型工艺及其安全性评价
袁瑞芳1,杨金辉2,章津铭1,贺亚男1,任 涵1,张定堃1*,杨 明3*
1. 成都中医药大学药学院,西南特色中药资源国家重点实验室,四川 成都 611137 2. 四川百草精工生物科技有限公司,四川 成都 610000 3. 江西中医药大学,江西 南昌 330004
基于偏头痛药效研究优化青花椒超临界提取部位热熔压敏胶贴剂成形工艺,并对贴剂安全性进行评价。以均匀性、涂展性、渗布程度、皮肤追随性、剥离性、反复揭贴性、残留量等感官评价及初黏力、持黏力、剥离强度为指标,采用单因素试验与Box-Behnken设计-响应面法对热熔压敏胶基质配比进行筛选;采用在体动物评价法,以硝酸甘油型偏头痛大鼠挠头次数为指标筛选贴剂载药量;另外采用小鼠急性毒性试验、家兔皮肤刺激性试验及豚鼠皮肤过敏性试验评价青花椒超临界提取部位热熔压敏胶贴剂的安全性。热熔压敏胶贴剂的最佳基质处方为苯乙烯-异戊二烯-苯乙烯(SIS)弹性体-氢化石油树脂-液体石蜡4∶2∶5;青花椒超临界提取部位贴剂可明显减少硝酸甘油型偏头痛大鼠的挠头次数,70 mg/贴载药量组在30~60 min可将大鼠挠头次数降低81.75%,优选为最佳载药量;该贴剂对小鼠无急性毒性,对新西兰兔完整皮肤和破损皮肤有轻微刺激性,6 h内自行消除,对豚鼠无过敏性。该工艺制备的青花椒超临界提取部位热熔压敏胶贴剂感官性能好,黏附力强,且安全有效。
青花椒;超临界提取部位;热熔压敏胶;贴剂;偏头痛;成型工艺;安全性评价;Box-Behnken设计-响应面法;急性毒性;皮肤刺激性;皮肤过敏性
青花椒为芸香科花椒属植物青花椒Sieb. et Zucc.的干燥成熟果皮[1],与红花椒统称花椒,具有温中散寒止痛、杀虫止痒的功效,在西南地区广泛分布。《药性论》记载:花椒“治头风下泪”,中医学的“头风”包含了现代医学的偏头痛[2],民间亦有使用花椒治疗偏头痛的用法[3]。在传统本草中,花椒主要用于止痛,现代多项药理研究也证实了其镇痛作用[4-5],但对花椒的抗偏头痛作用研究甚少。研究表明青花椒的镇痛效应与持续时间均大于红花椒,毒性低于红花椒[6-7],基于此,本课题组前期对青花椒治疗偏头痛的疗效进行研究,证实外用青花椒超临界提取部位可明显缓解大鼠偏头痛症状。
透皮给药是中医内病外治的经典用法之一[8],具有避开肝脏首过效应、减少胃肠道刺激、降低给药次数及提高患者用药顺应性等优势[9-10],国内外已有多种透皮贴剂的上市产品,临床应用普遍[11]。热熔压敏胶是继溶剂型和乳液型压敏胶之后的第3代压敏胶产品,一般由弹性体、增黏树脂、增塑剂、填料和抗氧化剂组成[12],因其无有机溶剂添加[13],无刺激性[14],在熔融状态下涂布,迅速冷却固化后轻度指压即能粘接,黏附及剥离性好,不污染被粘物表面[15],故在透皮给药体系中应用广泛[12,16]。热熔压敏胶基质不含活性官能团,可减少基质和药物之间的相互作用,现作为一种释药性能良好的骨架型药物储库被使用[17]。此外,该基质的各种成分均为非极性,亲脂性强,制备过程中不需要烘箱固化交联,故尤其适合用于制备含有易挥发性药物的贴剂[18-19],与本实验青花椒药用部位性能契合。基于以上研究,本课题组拟将青花椒超临界提取部位开发为一款缓解偏头痛的热熔压敏胶透皮给药贴剂,使其成为易给药、易揭贴、起效迅速、安全无毒的局部给药产品,促进防治偏头痛产品的创新[20],为青花椒药用价值发掘提供示范,推动西南特色中药资源开发利用。
1 仪器与材料
1.1 仪器
SFE230-50-06 CO2超临界提取装置,海安华达石油仪器有限公司;XKR-XB320D实验室自动涂布机,常州德社精密仪器有限公司;BLD-200N电子剥离试验机、CZY-G初黏力测试仪、CZY-6S持黏力测试仪,济南兰光机电技术有限公司。
1.2 供试药与辅料
干青花椒果皮于2019年购自四川新荷花中药饮片股份有限公司,经成都中医药大学许润春副教授鉴定为芸香科花椒属植物青花椒Sieb. et Zucc.的干燥饮片。对照品柠檬烯(批号DSTDN003701)、芳樟醇(批号DST200618-041质量分数),质量分数均≥97%,均购自成都德思特生物技术有限公司;苯乙烯-异戊二烯-苯乙烯(SIS)弹性体,批号D1163,购于美国科腾聚合物有限公司;C5氢化石油树脂,购于深圳市吉田化工有限公司;液体石蜡,购于上海化学试剂有限公司。
1.3 动物
SPF级SD大鼠60只,体质量220~250 g;SPF级昆明小鼠40只,体质量18~22 g;新西兰家兔8只,体质量2.0~2.2 kg;白色豚鼠30只,体质量260~280 g;所有动物雌雄各半,均由成都达硕实验动物有限公司提供,合格证号SCXK(川)2020- 030,检疫后备用。动物实验经成都中医药大学医院动物实验伦理委员会批准(批准号2019KY-082)。
2 方法与结果
2.1 青花椒超临界提取物的制备
称取青花椒2 kg,打粉后过10目筛,装入超临界CO2萃取装置中,萃取压力26 MPa,温度60 ℃,解析压力7 MPa,温度55 ℃,CO2体积流量3 L/h,萃取6 h后得药用部位。萃取得到的青花椒超临界提取部位呈墨绿色,有较浓清香味,流动性好,萃取率为12.3%。
2.2 青花椒超临界提取物的GC-MS分析
2.2.1 供试品溶液的制备 取上述提取的青花椒超临界提取物1 mL置于10 mL量瓶中,超声10min,0.45 µm微孔滤膜滤过制得样品,平行3份。
2.2.2 对照品溶液的制备 精密吸取柠檬烯对照品10 μL于10 mL量瓶中,经称量为9.68 mg,加入醋酸乙酯定容,配制成质量浓度为0.968 mg/mL的柠檬烯对照品溶液;精密吸取芳樟醇对照品10 μL于10 mL量瓶中,经称量为9.45 mg,加入醋酸乙酯定容,配制成质量浓度为0.945 mg/mL的芳樟醇对照品溶液。
2.2.3 色谱条件 色谱柱为HP-5毛细管色谱柱(30 m×0.25 mm×0.25 μm);采用程序升温方法:60 ℃维持2 min,5 ℃/min升至200 ℃,停留5 min,最后10 ℃/min升至260 ℃,停留0 min,运行时间41 min;载气为高纯氦气,体积流量1 mL/min,压力86.440 kPa(12.537 psi),气化室温度为280 ℃,分流比100∶1,进样量1 µL。
2.2.4 质谱条件 电离方式为EI源,电子能量为70 eV,离子源温度为230 ℃,四级杆温度150 ℃。结果如图1所示,经GC-MS分析,青花椒超临界提取物中共鉴定出31种成分,其中丰度最高的为芳樟醇,占比达到74.16%,质量浓度为13.57 mg/mL,其次为柠檬烯,占比5.45%,质量浓度为1.75 mg/mL。
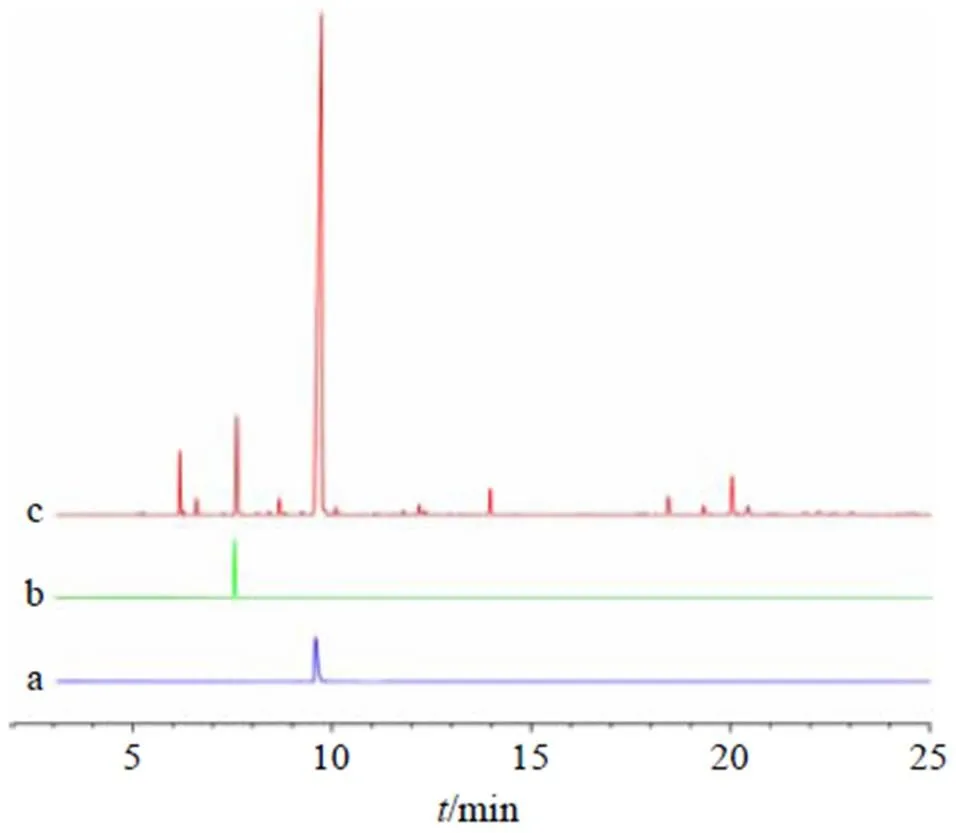
图1 芳樟醇(a)、柠檬烯(b) 对照品及青花椒超临界提取物(c)的总离子流图
2.3 空白基质的制备
根据预实验,热熔压敏胶空白基质的初始制备方法为SIS弹性体6 g、C5石油树脂3 g及液体石蜡6 g加入坩埚中,电热套升温至120 ℃,至混合物完全熔化、搅拌均匀,倒出涂布于无纺布上,冷却后加盖防粘纸,剪成3 cm×4 cm,备用。
2.4 评价指标与检测方法
2.4.1 感官评价 以均匀性、涂展性、渗布程度、皮肤追随性、剥离性、反复揭贴性与残留量的多指标综合评价总分为指标[8,21],评价标准如表1所示。
2.4.2 初黏力 采用《中国药典》2020年版四部通则(0952黏附力测定法)中载入的滚球斜坡停止法测定热熔压敏胶贴剂的初黏力。选用适宜的系列钢球分别滚过置于倾斜板上的供试品黏性面,根据供试品黏性面能够粘住的最大球号钢球,评价其初黏力的大小,球号越大,初黏力越大。根据被粘住的球号进行评分,分值范围为0~10分。
2.4.3 持黏力 采用《中国药典》2020年版四部通则(0952黏附力测定法)中载入的持黏力测定法测定热熔压敏胶贴剂的持黏力。将供试品黏性面粘贴于试验板表面,垂直放置,沿供试品的长度方向悬挂一规定质量的砝码,记录供试品滑移直至脱落的时间,时间越长,持黏力越大。根据供试品脱落的时间进行评分,分值范围为0~10分。
2.4.4 剥离强度 采用《中国药典》2020年版四部通则(0952黏附力测定法)中载入的180°剥离强度试验法测定热熔压敏胶贴剂的剥离强度。将供试品背衬用双面胶固定在试验板上,黏性面用聚脂薄膜覆盖,将聚酯薄膜对折(180°),把薄膜自由端和试验板分别上、下夹持于试验机上,实验机以300 mm/min下降速度连续剥离,记录剥离强度的数值,该值越大表明剥离强度越强。根据剥离强度的数值进行评分,分值范围为0~10分。
2.4.5 综合得分 以均匀性、涂展性、渗布程度、皮肤追随性、剥离性、反复揭贴性、残留量、初黏力、持黏力和剥离强度评分之和作为贴剂的综合得分。
2.5 单因素筛选基质处方
2.5.1 SIS弹性体用量筛选 固定C5氢化石油树脂用量为3 g,液体石蜡用量为6 g,将SIS弹性体的用量设为2、4、6、8、10 g,按“2.3”项下空白基质的制备方法进行制备。通过感官综合评价,不同剂量SIS弹性体制备的热熔压敏胶贴剂的平均综合得分分别为25.0、44.6、52.6、50.3、47.3。可见,SIS弹性体用量为6 g时,热熔压敏胶贴剂的综合感官较好。

表1 综合感官评价标准
2.5.2 C5氢化石油树脂用量筛选 固定SIS弹性体用量为6 g,液体石蜡用量为6 g,将氢化石油树脂的用量设为1、2、3、4、5 g,按“2.3”项下空白基质的制备方法进行制备。通过感官综合评价,不同剂量C5氢化石油树脂制备的热熔压敏胶贴剂的平均综合得分分别为46.3、52.6、52.7、49.9、48.3。可见,C5氢化石油树脂用量为2~3 g时,热熔压敏胶贴剂的综合感官较好。
2.5.3 液体石蜡用量筛选 固定SIS弹性体用量为6 g,C5氢化石油树脂用量为3 g,将液体石蜡的用量设为2、4、6、8、10 g,按“2.3”项下空白基质的制备方法进行制备。通过感官综合评价,不同液体石蜡制备的热熔压敏胶贴剂的平均综合得分分别为44.0、46.6、50.6、52.3、44.6。可见,液体石蜡用量为8 g时,热熔压敏胶贴剂的综合感官较好。
2.6 Box-Behnken设计-响应面法优化基质处方
2.6.1 实验设计及结果 根据Box-Behnken设计原理和单因素试验结果,以SIS弹性体用量(1)、氢化石油树脂用量(2)、液体石蜡用量(3)为自变量,感官评价、初黏力、持黏力和剥离强度的分值总和为响应值,进行3因素3水平15个实验点的Box-Behnken设计-响应面分析实验。因素水平及实验结果如表2所示。
2.6.2 建立模型方程与显著性检验 利用软件Design-Expert 12.0分析对表2中的数据进行多元回归拟合分析,得到基质综合评分与各因素变量的二次方程模型为=47.464+7.2321+17.0022-4.1733-0.52212+1.11813+0.3323-1.05112-2.322-0.25532。
回归模型方差分析结果如表3所示,不同SIS弹性体、氢化石油树脂及液体石蜡用量对综合评分交互影响的等高线及响应面图如图2所示,=0.001 7,=21.83,表明此模型达到显著水平,失拟项(=0.6344)不显著,说明该二次方程能够较好地拟合真实水平,实验误差小,可用此模型对热熔压敏胶贴剂基质进行预测。模型一次项1、2高度显著,3不显著;交互项13高度显著,12、23不显著;二次项12高度显著,22显著,32不显著。根据值可知各基质用量对贴剂基质综合评分的影响程度依次为1>2>3,即SIS弹性体用量>氢化石油树脂用量>液体石蜡用量。
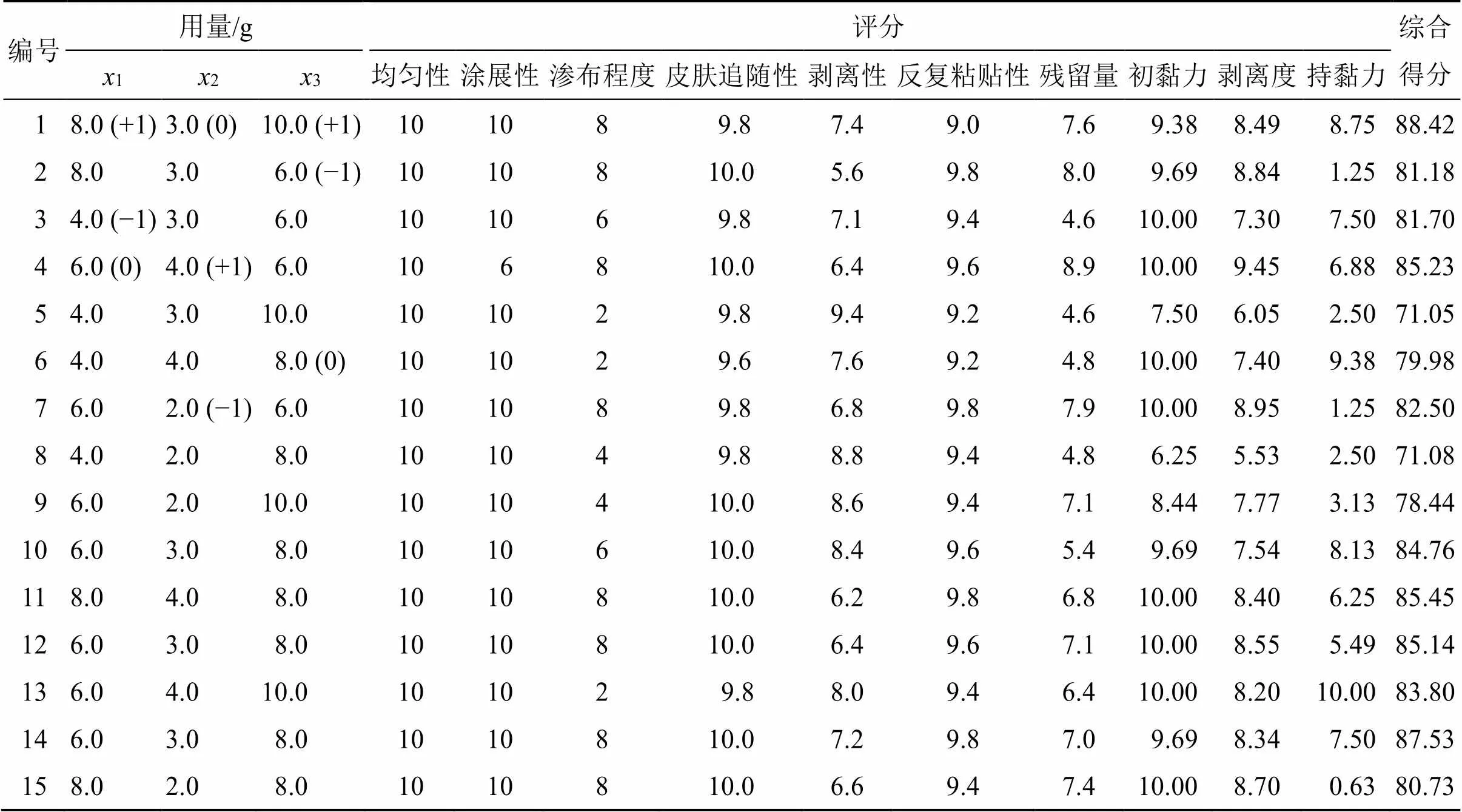
表2 Box-Benhnken设计-响应面法实验因素水平设计及结果(n = 3)
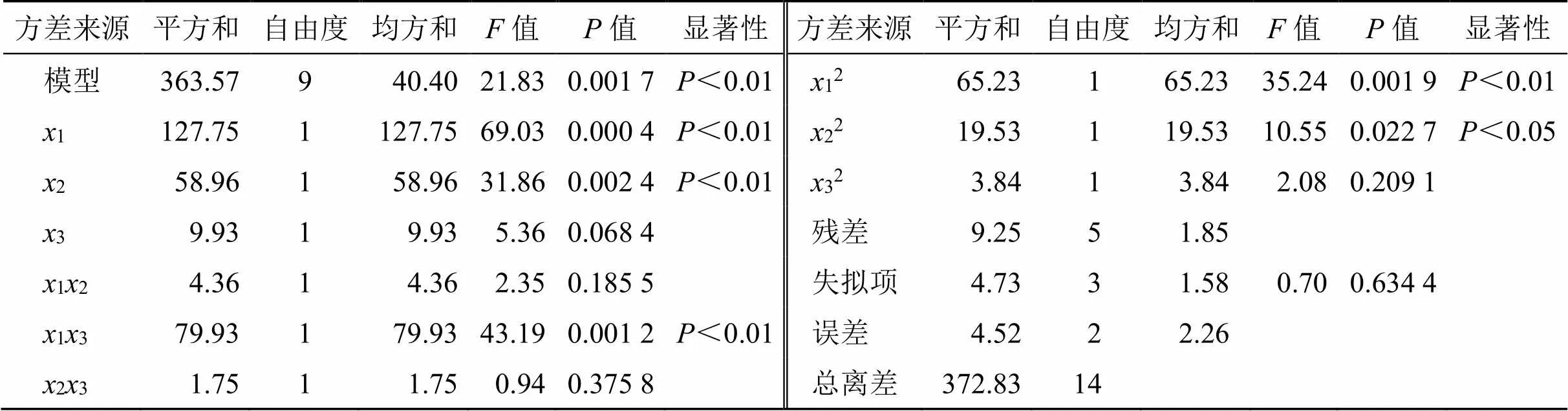
表3 回归模型方差分析结果
2.6.3 实验验证 设定各成分的变化范围以及期望响应值,运行Design-Expert 12.0软件的最优化功能,以各指标综合结果评分曲面得出的最佳处方组成为SIS弹性体7.885 g,氢化石油树脂3.520 g,液体石蜡10.000 g,贴剂基质综合得分的理论值可达88.543。按照最优组合进行了3批验证试验。结果3批贴剂的实际综合评分分别为87.432、85.673、85.491,平均实际综合评分为86.199,RSD为1.244%,与理论值的接近度为97.35%,因此基于响应面法优化的基质配比准确可靠,热熔压敏胶贴剂的最佳基质处方为SIS弹性体-氢化石油树脂-液体石蜡4∶2∶5。
2.7 载药量筛选
2.7.1 青花椒超临界提取部位热熔压敏胶贴剂的制备 根据响应面优化结果,取SIS弹性体8 g、氢化石油树脂4 g、液体石蜡10 g加入坩埚中,电热套升温至120 ℃,至混合物完全熔化、搅拌均匀,加入设计量青花椒挥发油搅拌均匀,倒出涂布于无纺布上,冷却后加盖防黏纸,剪成3 cm×4 cm,分别制备成每贴含青花椒挥发油17.5、35、70、140 mg的贴剂。试验过程中,热熔压敏胶基质与青花椒超临界提取物均匀混合,相容性良好,所制备的青花椒超临界提取部位热熔压敏胶贴剂呈淡绿色,有淡清香味,贴敷后的综合感官及黏附性能与空白基质基本一致。
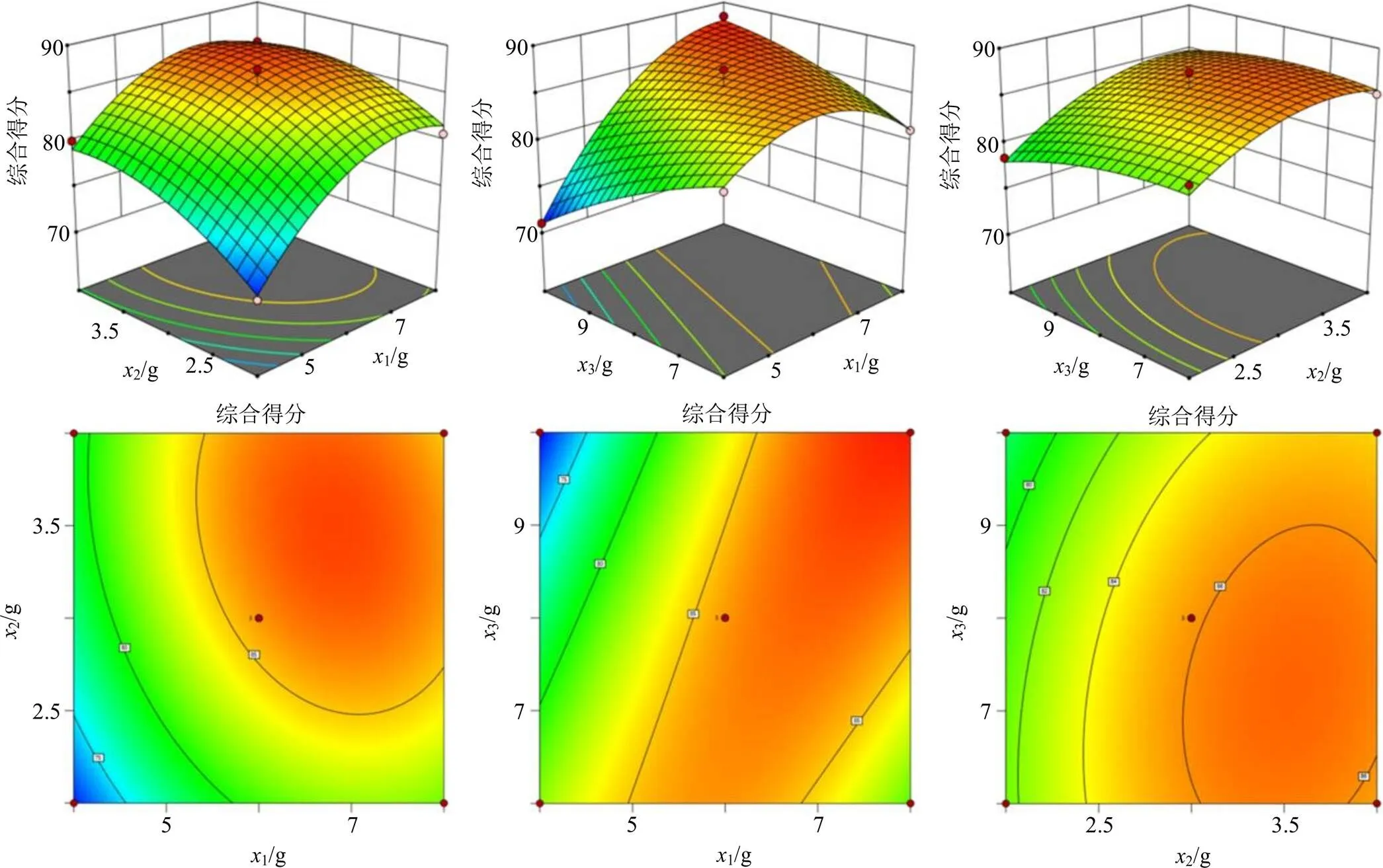
图2 不同SIS弹性体、氢化石油树脂及液体石蜡用量对综合评分交互影响的等高线及响应面图
2.7.2 硝酸甘油型偏头痛大鼠试验[22]SPF级SD大鼠60只,雌雄各半,适应性饲养3 d,随机分为6组(=10),分别为对照组(空白贴剂)、模型组、给药1组(140 mg/贴)、给药2组(70 mg/贴)、给药3组(35 mg/贴)、给药4组(17.5 mg/贴)。实验前1 d大鼠背部脱毛。实验当天除对照组外,各组大鼠后颈背部sc硝酸甘油10 mg/kg复制偏头痛模型,造模30 min后除模型组外,各实验组大鼠在背部脱毛处贴敷青花椒挥发油贴剂1次(给药面积为3 cm×4 cm),从造模开始记录3 h内不同时间段大鼠的搔头次数。结果如表4所示。与对照组相比,模型组与给药组大鼠在给予硝酸甘油后挠头次数明显增加(<0.01),表明急性偏头痛模型制备成功。与模型组相比,青花椒超临界提取部位贴剂可明显减少大鼠挠头次数(<0.01、0.05),进一步验证了青花椒超临界提取部位的抗偏头痛作用。
各给药组之间比较发现,30~60 min随着载药量的增加,大鼠挠头次数逐渐减少(<0.01),但当载药量增加至一定限度时,大鼠挠头次数却逐渐增加。给药1组载药量最大,给药2组次之,但给药2组可在30~60 min内最大限度地将大鼠挠头次数降低81.75%,即抗偏头痛作用最显著。60 min起,给药3、4组大鼠挠头次数的降低趋势较于2组更加明显但4组差异较小。考虑到偏头痛患者对于治疗药物速效的需求,选择给药2组作为贴剂最佳载药量。
表4 不同给药剂量贴剂对硝酸甘油型偏头痛大鼠挠头次数的影响(, n = 10)
与对照组比较:#<0.05##<0.01;与模型组比较:*<0.05**<0.01
#< 0.05##< 0.01control group;*< 0.05**< 0.01model group
2.8 青花椒超临界提取部位热熔压敏胶贴剂安全性评价
2.8.1 小鼠急性毒性试验[23]采用最大给药量法,取小鼠数只,适应性饲养3 d后背部剃毛4 cm×5 cm,24 h后检查去毛皮肤是否完整无受伤,挑选皮肤完整无受伤的小鼠进行实验。
取禁食(不禁水)12 h的小鼠40只,雌雄各半,随机分为空白雌性对照组(=10)、空白雄性对照组(=10)、给药雌性组(=10)和给药雄性组 (=10)。给药组给予青花椒超临界提取物热熔压敏胶贴剂(140 mg/贴),空白对照组给予等体积的空白基质。将供试品1 d 2次贴于脱毛区,用胶带固定,用药24 h后,除去受试物,于30~60 min及24、48、72 h连续观察至14 d。逐一记录每只动物体质量变化和反应情况,如有毒性反应,逐一记录发抖、震颤、流涎、腹泻、懒动、嗜睡、昏迷等表现,如有死亡或濒临死亡的动物进行尸解和病理组织学检查。实验结果如表5所示。揭除贴剂后30~60 min及24、48、72 h至14 d。与空白组比较,给药组小鼠皮毛、眼睛、黏膜、呼吸、粪便及自主活动等均未发现明显变化,未见发抖、震颤、流涎、腹泻、懒动、嗜睡、昏迷等中毒表现及死亡情况。各组间小鼠净增体质量差异无统计学意义,表明该剂量的青花椒超临界提取物热熔压敏胶贴剂无急性皮肤毒性反应。
表5 青花椒超临界提取物热熔压敏胶贴剂急性毒性实验结果(, n = 10)
2.8.2 家兔皮肤刺激试验[24]取成年健康家兔8只,雌雄各半,体质量2.2~2.3 kg。试验通过完整皮肤左右侧同体自身对比进行。于给药前24 h将家兔背部脊柱两侧毛脱掉,脱毛面积每侧约为6 cm×8 cm。随机分为2组,完整皮肤组和破损皮肤组。完整皮肤组左侧去毛区敷给药制剂3 cm×4 cm大小,右侧去毛区敷赋形剂(即不含药的空白贴片)作为对照。破损皮肤组在左侧剃毛皮肤处用砂纸来回擦拭,以皮肤轻微渗血为度,实验方法同完整皮肤组。连续给药1周,并于去除受试药物后1、24、48、72 h内观察去毛区贴药部位有无红斑和水肿等症状,以及上述变化的恢复情况与时间,按红斑和水肿2项指标标准按表6进行评分。计算各组动物刺激反应平均分值,反应平均分值为红斑形成总分和水肿形成总分和与动物数的平均值,分值在0~0.49为无刺激性,0.50~2.99为轻度刺激性,3.00~5.99为中度刺激性,6.00~8.00为强刺激性。结果如表7和图3所示。空白基质组在家兔完整皮肤和破损皮肤用药1周后,在去除药物1 h内无红斑和水肿现象,青花椒超临界提取物热熔压敏胶贴剂组家兔皮肤出现了轻度红斑和水肿,但在24 h内自行消除。皮肤刺激程度平均反应值为1.5、2.0,在0.50~2.99,属于轻度刺激性。

表6 皮肤刺激性反应评分标准
2.8.3 豚鼠皮肤过敏性试验[25]取健康白色豚鼠30只,雌雄各半,体质量260~280 g,分为基质组、给药组、阳性药对照组,每组10只。给药组给予青花椒超临界提取物热熔压敏胶贴剂;基质组给予基质贴剂;阳性对照组给予0.2 mL 1% 2,4-二硝基氯代苯。于给药前24 h用脱毛剂将豚鼠背部脊柱两侧毛除去,单侧去毛面积为4 cm×5 cm。
(1)致敏接触:给药组给予青花椒超临界提取物热熔压敏胶贴剂、基质组给予空白基质、阳性对照组给予0.2 mL 1% 2,4-二硝基氯代苯在左侧脱毛区,用纱布覆盖并以胶布固定,持续6 h后用温水清洗残留药物,分笼饲养,第7天和第14天以同样的方式重复,共3次。
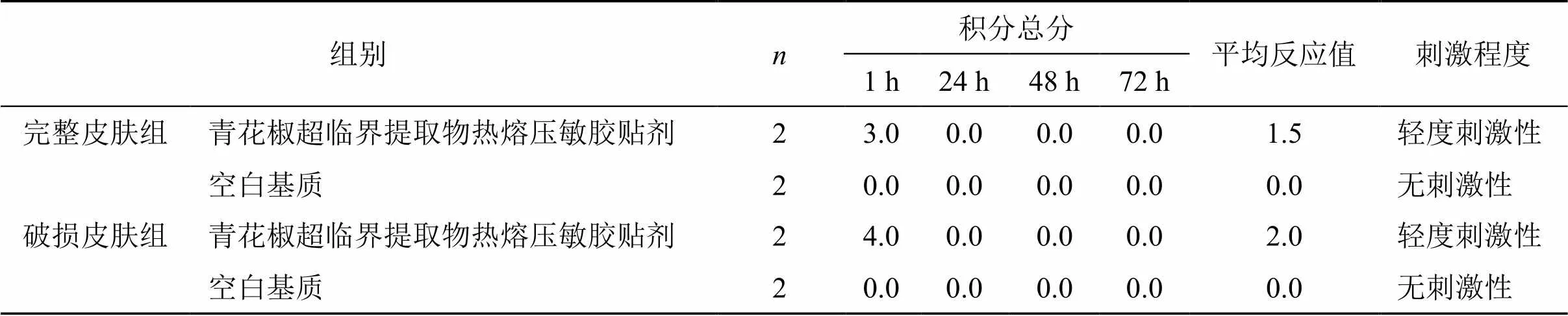
表7 青花椒超临界提取物热熔压敏胶贴剂皮肤刺激性实验结果

A-完整皮肤(青花椒超临界提取物热熔压敏胶贴剂)组 B-完整皮肤(空白基质)组 C-破损皮肤(青花椒超临界提取物热熔压敏胶贴剂)组 D-破损皮肤空白基质组
(2)激发接触:于末次给药致敏后第14天,分别将受试物、空白基质和阳性药物(激发浓度为 0.1% 2,4-二硝基氯代苯)0.2 mL同(1)方法用于3组豚鼠相应的右侧受试皮肤,给药6 h后清除药物并即刻观察,然后于清除药物后24、48、72 h再次观察皮肤过敏反应情况。结果按表8进行评分并作致敏强度评价。同时,注意观察豚鼠是否有哮喘,站立不稳等全身性过敏反应。反应平均分值=(红斑形成总分+水肿形成总分)/动物数,致敏反应发生率=有过敏反应动物数/动物总数,致敏率在0~10%为无致敏性,11%~30%为轻度致敏性,31%~60%为中毒致敏性,61%~80%为高度致敏性,81%~100%为极度致敏性。实验结果如表9所示。空白基质组未见红斑、水肿等皮肤变态反应情况,青花椒超临界提取物热熔压敏胶贴剂组极少数动物除去药物后有轻度红斑和水肿反应,反应平均分值为0.2,致敏率为10%,至第24 h反应均已消退。阳性对照组出现明显的红斑、水肿等皮肤变态反应情况,反应平均分值高,在72 h观察期内致敏率达100%。3组豚鼠均未出现哮喘、站立不稳等全身性过敏反应。实验表明青花椒超临界提取物热熔压敏胶贴剂及基质对豚鼠皮肤基本上无致敏反应。

表8 皮肤致敏反应评分标准
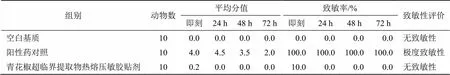
表9 青花椒超临界提取物热熔压敏胶贴剂对豚鼠皮肤致敏性实验结果
3 讨论
青花椒超临界提取物中含有大量挥发油,经GC-MS分析,主要成分芳樟醇的占比达到74.16%,质量浓度为13.57 mg/mL,其次为柠檬烯,占比5.45%,质量浓度为1.75 mg/mL,可见芳樟醇在青花椒超临界提取物占比很高,可能是其发挥药效的成分。挥发油作为一类性质优良的透皮吸收促进剂,能促进药物透皮吸收、对皮肤刺激性小[26]。将其制备为热熔压敏胶贴剂,既能促进自身扩散,又可规避加热挥发的问题。
热熔压敏胶贴剂基质的弹性体一般选用苯乙烯-丁二烯-苯乙烯(SBS)型和SIS型[27-28]。SIS中间嵌段聚异戊二烯结构上具有侧链甲基,使它具有很好的内聚力和优良的黏附性能以及与其他添加物良好的相容性[29]。与SBS相比,SIS具有融熔黏度低、低温柔软性能好、制胶透明度高等特点[30],是制备热熔压敏胶基质的首选。本研究采用经典的Box-Behnken设计-响应曲面法优化热熔压敏胶贴剂基质的组成,最终制备的基质均匀性、涂展性、渗布程度、皮肤追随性、剥离性、反复揭贴性与残留量等感官评价良好,黏附性能适宜。载药后的贴剂呈淡绿色透明状,有淡清香味,贴敷后的综合感官及黏附性能与空白基质基本一致。
经皮给药是指将药物贴剂贴附于皮肤后,药物分子经皮肤的角质层、生长表皮层和真皮层到达皮下组织,被淋巴管和毛细血管吸收进入体循环的过程[31],简而言之,是由浓度差推动的被动扩散过程。贴剂的载药量多采用体外吸收扩散池法确定[32-33],该方法虽简单易行,但无法真正模拟皮肤内环境,所测得实验值与真实值存在一定偏差[1],所以本实验选用在体实验筛选载药量。
硝酸甘油型偏头痛大鼠模型是目前偏头痛研究中常用的经典模型[34-35],硝酸甘油在体内可生成一氧化氮(nitric oxide,NO),过量的NO会导致血管过度扩张,进而激活血管壁内的伤害觉神经纤维并介导降钙素基因相关肽(calcitonin gene-related peptide,CGRP)等血管活性物质释放,进一步触发血管周围神经源性炎症参与偏头痛的发生。该模型诱发的偏头痛大鼠病理生理变化也与人类偏头痛相似。实验结果表明,将青花椒超临界提取物制备为贴剂保留了其抗偏头痛的药效成分,随着载药量的增加,青花椒超临界提取物贴剂抗偏头痛效果增加,但当载药量增加至一定限度时,这种治疗作用有所减弱。综合考虑,最终确定青花椒超临界提取物贴剂每贴载药量为70 mg。
皮肤是药物吸收的重要系统之一,也是人体的天然屏障[36],可对外界刺激做出反应,具有一定敏感性及自愈功能,因此考察贴剂经皮给药的安全性十分重要。本实验选用小鼠急性毒性实验、家兔皮肤刺激试验及豚鼠皮肤过敏性试验考察了青花椒超临界提取物热熔压敏胶贴剂的安全性,从实验结果可以看出该贴剂无急性毒性和致敏性,在家兔皮肤上出现了轻度刺激性,但在24 h内自行消除,因此青花椒超临界提取物热熔压敏胶贴剂安全性可靠。
目前偏头痛的治疗多采用口服给药、针灸、按摩、芳香疗法,或几者相互配合应用[20],尚无贴剂的使用先例,本实验制备的青花椒超临界提取物热熔压敏胶贴剂弥补了这一空缺。实验结果表明,该贴剂外观性状良好、黏附性能适宜且安全有效,可为患者提供新的用药选择。
利益冲突 所有作者均声明不存在利益冲突
[1] 孟宪华, 尚贤毅, 杨军丽. 青花椒中酚类化学成分及其抗氧化活性 [J]. 中草药, 2020, 51(8): 2095-2101.
[2] 徐榛敏, 贾敏, 梁晓, 等. 偏头痛中医临床实践指南(征求意见稿) [J]. 中国中药杂志, 2020, 45(21): 5057-5067.
[3] 蒋良述. 治偏头痛验方 [J]. 四川中医, 1985, 3(11): 36.
[4] 王朝晖. 花椒挥发油镇痛作用的实验研究 [J]. 中国药房, 2011, 22(3): 218-219.
[5] 石雪萍, 张卫明, 张鸣镝, 等. 花椒总生物碱镇痛、抗炎、止痒作用研究 [J]. 中国野生植物资源, 2011, 30(1): 46-49.
[6] 宋丽, 刘友平. 花椒与青椒的镇痛效应和药动学比较研究 [J]. 中药药理与临床, 2009, 25(6): 64-66.
[7] 佟如新, 王普民, 赵金明, 等. 辽宁青花椒与川椒急性毒性药理作用比较研究 [J]. 辽宁中医杂志, 1995, 22(8): 371-373.
[8] 许润春, 贺亚男, 裴瑾, 等. 川乌-花椒挥发油凝胶贴膏的成型工艺及配伍增效机制研究 [J]. 中草药, 2020, 51(6): 1517-1529.
[9] 胡永慧, 佘一鸣, 韩立云, 等. 中药透皮贴剂的临床应用进展 [J]. 中草药, 2017, 48(13): 2787-2792.
[10] 马迅, 左宁, 陈华, 等. 透皮贴剂质量控制与评价研究进展 [J]. 中国新药杂志, 2019, 28(5): 551-557.
[11] Wiedersberg S, Guy R H. Transdermal drug delivery: 30+ years of war and still fighting! [J]., 2014, 190: 150-156.
[12] Yu Z W, Liang Y, Liang W Q. Development and evaluation of α-asarone transdermal patches based on hot-melt pressure-sensitive adhesives [J]., 2013, 14(1): 294-300.
[13] 王承潇, 崔秀明, 韩伟, 等. 热熔压敏胶载药基质中的药物透皮性能 [J]. 华东理工大学学报: 自然科学版, 2014, 40(3): 279-285.
[14] 闫小平, 郑蕊, 官仕杰, 等. 热熔压敏胶在中药透皮吸收制剂中的研究进展 [J]. 中国中药杂志, 2009, 34(12): 1612-1614.
[15] 王婧斯, 王文倩, 王成港, 等. 中药透皮贴剂的研究进展 [J]. 中草药, 2012, 43(5): 1028-1031.
[16] Tombs E L, Nikolaou V, Nurumbetov G,. Transdermal delivery of ibuprofen utilizing a novel solvent-free pressure-sensitive adhesive (PSA): TEPI® technology [J]., 2018, 13(1): 48-57.
[17] 王承潇, 韩伟, 刘然, 等. 热熔压敏胶基质结构对药物释放性能的影响 [J]. 高校化学工程学报, 2014, 28(1): 38-45.
[18] 俞振伟, 应晓英, 梁文权. 热熔压敏胶中药物释放性能的研究 [J]. 中国药学杂志, 2009, 44(24): 1878-1882.
[19] 陶虹. 黄体酮热熔压敏胶透皮贴剂的设计及评价 [D]. 乌鲁木齐: 新疆医科大学, 2015.
[20] Yuan R, Zhang D, Yang J,. Review of aromatherapy essential oils and their mechanism of action against migraines [J]., 2021, 265: 113326.
[21] 吴东盼, 田雪峰, 蔡学军, 等. D-最优混料设计优化寒痹舒凝胶膏剂的基质组成及其体外评价 [J]. 中草药, 2015, 46(10): 1445-1453.
[22] Hou M, Tang Q, Xue Q,. Pharmacodynamic action and mechanism of Du Liang soft capsule, a traditional Chinese medicine capsule, on treating nitroglycerin- induced migraine [J]., 2017, 195: 231-237.
[23] 苏潇潇. 布洛芬巴布剂的生物等效性及安全性研究 [D]. 武汉: 华中科技大学, 2009.
[24] 田庆锷, 王艳平, 肖碧群, 等. 复方麻芥透皮贴剂经皮肤给药的安全性研究 [J]. 中医药导报, 2011, 17(5): 85-87.
[25] 陶虹, 耿文宁, 陈雯雯, 等. 黄体酮热熔胶透皮贴剂皮肤用药安全性研究 [J]. 中国药业, 2015, 24(21): 76-78.
[26] 陆姗姗, 赵玉荣, 姚俊宏, 等. 中药挥发油透皮吸收促进剂制剂技术的研究进展 [J]. 中草药, 2018, 49(10): 2477-2481.
[27] Wang C X, Han W, Tang X Z, et. Evaluation of drug release profile from patches based on styrene-isoprene- styrene block copolymer: The effect of block structure and plasticizer [J]., 2012, 13(2): 556-567.
[28] 王承潇, 汤秀珍, 沈平孃, 等. 热熔压敏胶应用于中药贴剂的研究进展 [J]. 中草药, 2010, 41(3): 496-499.
[29] 张瑞杰. 功能化苯乙烯热塑性弹性体的设计及应用 [D]. 大连: 大连理工大学, 2017.
[30] 黎丽. 热熔压敏胶伤湿止痛膏的实验研究 [D]. 北京: 北京中医药大学, 2012.
[31] 段继雯. 海绵骨针用于胰岛素经皮给药的研究 [D]. 厦门: 厦门大学, 2019.
[32] Saleem M N, Idris M. Formulation design and development of a unani transdermal patch for antiemetic therapy and its pharmaceutical evaluation [J].:, 2016, 2016: 7602347.
[33] Ameen D, Michniak-Kohn B. Development andevaluation of pressure sensitive adhesive patch for the transdermal delivery of galantamine: Effect of penetration enhancers and crystallization inhibition [J]., 2019, 139: 262-271.
[34] Pu Z H, Peng C, Xie X F,. Alkaloids from the rhizomes ofexert antimigraine effects through regulating 5-HT1B receptor and c-Jun [J]., 2019, 237: 39-46.
[35] 沈廷明, 姜溪, 陈芙蓉, 等. 头痛宁滴丸治疗偏头痛的实验研究 [J]. 中草药, 2020, 51(4): 1016-1023.
[36] 夏爱晓, 姚文栋, 陈晓劼, 等. 中华眼镜蛇神经毒素可溶性微针的制备及体外经皮渗透性研究 [J]. 中草药, 2020, 51(3): 625-630.
Optimization of hot melt pressure sensitive adhesive patch with supercritical extract ofbased on migraine efficacy and its safety evaluation
YUAN Rui-fang1, YANG Jin-hui2, ZHANG Jin-ming1, HE Ya-nan1, REN Han1, ZHANG Ding-kun1, YANG Ming3
1. State Key Laboratory of Southwestern Chinese Medicine Resources, School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 2. Sichuan Baicao Jinggong Biotechnology Co., Ltd., Chengdu 610000, China 3. Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
To optimize the forming process of hot-melt pressure-sensitive adhesive patch from the supercritical extraction part of, and evaluate the safety of the patch.Based on the sensory evaluation of uniformity, spreadability, degree of infiltration, skin followability, peelability, repeated peelability, and residual amount, as well as initial adhesion, holding adhesion and peeling strength as evaluation indexes, the matrix ratio of hot melt pressure sensitive adhesive was screened by single factor test and Box-Behnken design-response surface method. Theanimal evaluation method was used to screen the drug loading of the patch according to the number of head scratching in rats with nitroglycerin migraine. In addition, the safety of hot melt pressure sensitive adhesive was evaluated by mouse acute toxicity test, rabbit skin irritation test and guinea pig skin hypersensitivity test.The best matrix prescription of hot melt pressure sensitive adhesive was SIS (styrene-isoprene- styrene) elastomer: hydrogenated petroleum resin: liquid paraffin = 4:2:5.supercritical extract patch could significantly reduce the number of head scratching of migraine rats induced by nitroglycerin, 70 mg drug dosage of each gel patch could reduce the number of head scratching in rats by 81.75% within 30—60 min, which was preferably the best drug loading. The patch had no acute toxicity to mice, slightly irritated to the intact and damaged skin of New Zealand rabbits, eliminated itself within 6 h, and had no allergy to guinea pigs.The hot melt pressure sensitive adhesive for supercritical extraction ofprepared by this process has good sensory properties, strong adhesion, safe and effective.
Sieb. et Zucc.; supercritical fluid extraction; hot melt pressure sensitive adhesive; patch; migraine; molding process; safety evaluation; Box-Behnken design-response surface methodology; acute toxicity; skin irritation; skin sensitization
R283.6
A
0253 - 2670(2021)13 - 3841 - 11
10.7501/j.issn.0253-2670.2021.13.008
2021-03-01
四川省中医药管理局花椒专项项目(2018HJZX023);成都中医药大学中药学学科特色创新科研团队项目(CXTD2018006);成都中医药大学“杏林学者”学科人才科研提升计划项目(BSH2018007)
袁瑞芳,女,硕士研究生,从事中药药剂学研究。Tel: 17393107011 E-mail: 1903023567@qq.com
张定堃,硕士生导师,副教授,从事中药制剂与品质评价新技术研究。Tel: 13568982018 E-mail: 465790643@qq.com
杨 明,博士生导师,教授,从事中药炮制与制剂研究。Tel: 13870608983 E-mail: yangming16@126.com
[责任编辑 郑礼胜]