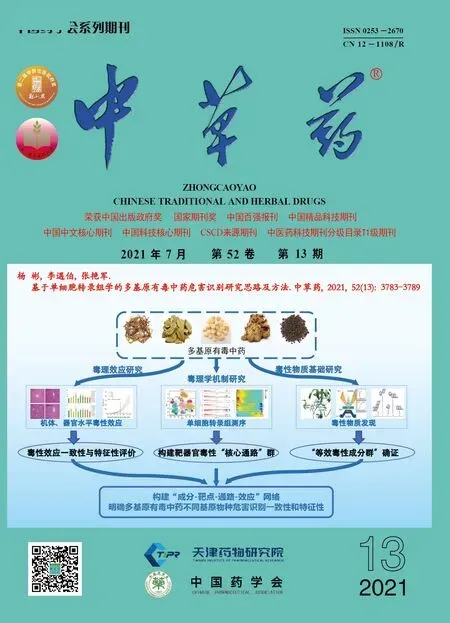
鞣花酸纳米结构脂质载体处方优化和口服生物利用度研究
王小霞,张智强
鞣花酸纳米结构脂质载体处方优化和口服生物利用度研究
王小霞1,张智强2*
1. 郑州大学第一附属医院,河南 郑州 450000 2. 天津药物研究院药业有限责任公司,天津 300301
Box-Behnken设计-效应面法优化鞣花酸(EA)纳米结构脂质载体(EA-NLC)处方,并进行药动学研究。采用乳化超声法制备EA-NLC。以包封率、载药量和粒径为考察指标,采用单因素考察和Box-Behnken设计-效应面法优化EA-NLC的处方。对最佳处方进行表征,并比较体内药动学行为。最佳处方为脂-药比为13.7∶1、固-液脂质比为4.4∶1、泊洛沙姆188的用量为1.2%。EA-NLC包封率为(85.06±0.48)%,载药量为(5.53±0.15)%,粒径为 (166.5±4.6)nm。体外释药具有明显的缓释特征,释药过程符合Weibull模型:lnln[1/(1-M/∞)]=0.682 1 ln-2.028 4,=0.982 7。体内药动学结果显示,EA-NLC的达峰时间(max)、半衰期(1/2)、达峰浓度(max)、时间-曲线下面积 (AUC0~和AUC0~∞)等主要参数与原料药相比均有显著性差异(<0.05、0.01),将鞣花酸口服吸收生物利用度提高至4.67倍。Box-Behnken设计-效应面法所建立的模型能较好地用于EA-NLC处方优化,准确度高,预测效果较好,且EA-NLC显著增加了EA口服吸收生物利用度。
鞣花酸;纳米结构脂质载体;药动学;Box-Behnken设计-效应面法;缓释特征;口服生物利用度
鞣花酸(ellagic acid,EA)是一种天然多酚二内酯,主要存在于坚果及中药材中,研究表明[1-4],鞣花酸具有抗肿瘤、抗氧化、抗过敏、消炎、调节雌激素分泌、抗纤维化等活性,但属于生物药剂学IV类药物[5],在25 ℃水中表观溶解度仅为0.015 mg/mL[6],口服吸收较差[7],从而影响药效发挥。因此,提高鞣花酸的生物利用度具有较大意义,目前,鞣花酸纳米制剂有壳聚糖纳米粒[8]、聚合物纳米粒[7]等研究报道,但存在包封率及载药量低等缺陷。
纳米结构脂质载体(nanostructured lipid carriers,NLC)是从固体纳米粒技术改良发展而来,除了固态脂质外,增加液态脂质共同作为纳米载体而制备的一种纳米给药系统。液态脂质载体打乱了固态脂质的晶格,增加了包裹药物的能力,因而提高了纳米制剂的包封率及载药量,避免在储存过程在药物泄露等问题。该技术可有效增加药物的溶解度及溶出度、改变药物体内分布、促进药物吸收、提高生物利用度,最终为提高药效奠定基础[9-12]。本研究对鞣花酸纳米结构脂质载体(EA-NLC)处方工艺进行研究,采用EA-NLC的包封率(1)、载药量(2)和粒径(3)为响应值,选择脂质与药物用量比例(1)、固态与液态脂质比例(2)、泊洛沙姆188的用量(3)为主要影响因素,通过采用Box-Behnken设计-效应面法[13]期望得到具有理想包封率、载药量和粒径的EA-NLC。进一步制备成EA-NLC冻干粉,考察稳定性及药物体外释药。以鞣花酸原料药为参考,研究体内药动学情况,为鞣花酸纳米制剂研究提供参考。
1 仪器与材料
FA2004B型电子天平,感量为0.01 mg,上海精科科学仪器有限公司;RC-6D型溶出仪,天津创兴电子设备制造股份有限公司;1200型高效液相色谱仪(HPLC),二极管阵列检测器,美国Agilent公司;DBF-86V50型超低温冰箱,山东博科科学仪器有限公司;ZNCL-S-5D型多点数显磁力搅拌器,上海越众仪器设备有限公司;HN10-260B型实验室用双频超声仪,上海汗诺仪器有限公司;Master-sizer型粒度分析仪,英国马尔文仪器公司;FD-1A-50型真空冻干机,杭州川一实验仪器有限公司。
鞣花酸对照品,批号P200215,质量分数99.1%,上海原叶生物科技公司;鞣花酸原料药,批号191205003,质量分数>98%,河南莱尔茵生物科技有限公司;辛酸/癸酸甘油三酯(Miglyol®812),批号161105T,上海特伯化学科技有限公司;泊洛沙姆188,批号WPEE587E,德国巴斯夫有限公司;D36 mm型透析袋,截留相对分子质量为8000~ 14 000,北京鼎国昌盛生物技术有限公司;单硬脂酸甘油酯,批号190915,德国巴斯夫有限公司;其他试剂均为分析纯。
清洁级SD大鼠,体质量(260±20)g,购自河南省动物实验中心,许可证SCXK(豫)2016- 0001。所有动物实验遵循郑州大学第一附属医院有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 含量测定
2.1.1 色谱条件 色谱柱为Angilent SB-C18(250 mm×4.6 mm,5 µm);流动相为甲醇-0.1%磷酸水溶液(45∶55);检测波长为254 nm;体积流量为1.0 mL/min;柱温为35 ℃;进样体积为10 µL。理论塔板数以鞣花酸计不低于10 000,色谱图见图1。鞣花酸对照品质量浓度为10.0 μg/mL(图1-B),EA-NLC供试品样品质量浓度为13.3 μg/mL(图1-C)。
2.1.2 供试品溶液的配制 采用超声破乳法制备供试品溶液。精密量1 mL的EA-NLC转移至50 mL量瓶中,加入30 mL甲醇,超声5 min,得澄清溶液,放置30 min,加入甲醇-0.1%磷酸水溶液(45∶55)定容,即得EA-NLC的供试品溶液。
2.1.3 对照品储备液的配制及线性关系考察 精密称取鞣花酸对照品20 mg,置于50 mL量瓶中,加入30 mL甲醇超声5 min,放置30 min后甲醇定容,得0.4 mg/mL对照品储备液。采用流动相配制40.00、20.00、10.00、5.00、0.50、0.05 μg/mL的鞣花酸对照品溶液,进HPLC。以质量浓度为横坐标(),峰面积为纵坐标(),进行线性回归,得回归方程为=19.912 7-0.810 4,=0.999 7,鞣花酸线性范围为0.05~40.00 μg/mL。

图1 空白溶剂(A)、鞣花酸对照品(B)和EA-NLC样品(C)溶液的HPLC图
2.1.4 重复性试验 取同1份EA-NLC,按照“2.1.2”项下方法分别处理6份供试品溶液,进HPLC分析,计算鞣花酸含量。结果显示鞣花酸质量浓度的RSD值为1.06%,说明方法重复性良好。
2.1.5 稳定性试验 取同1份EA-NLC供试品溶液,分别于0、4、8、12、16、24 h进HPLC分析。结果显示鞣花酸峰面积的RSD值为1.30%,说明供试品溶液稳定性良好。
2.1.6 精密度试验 取质量浓度为0.05、10.00、40.00 μg/mL的鞣花酸对照品溶液,分别连续进HPLC测定6次。结果显示鞣花酸峰面积的RSD值分别为0.39%、0.14%、0.17%,结果表明仪器精密度良好。
2.1.7 加样回收率试验 取9份1 mL的EA-NLC供试品溶液,每组3份,分为3组,分别加入标示量1.2、1.6、2.0 mL的鞣花酸对照品溶液,按照“2.1.2”项下方法操作制备EA-NLC供试品溶液,进HPLC分析,计算鞣花酸含量和加样回收率。结果平均加样回收率为99.62%,RSD为1.65%,表明该方法学准确度较高。
2.2 EA-NLC的制备
前期预实验曾考虑乳化法制备EA-NLC,但该法表面活性剂用量较大,故采用乳化超声法制备EA-NLC。固定鞣花酸用量为40 mg,分别取处方量的固态脂质单硬脂酸甘油酯和液态脂质至三角瓶中,加入15 mL无水乙醇。于转速为1000 r/min、温度为65 ℃水浴中加热溶解得油相。固定水相体积为60 mL,加入处方量的泊洛沙姆188,于1000 r/min转速条件下,65℃水浴加热搅拌溶解。将水相加至油相,持续搅拌1.5 h得初乳,在一定功率下超声一定时间(工作3 s间隔2 s),立即于−15℃冰箱固化15 min,过0.45 μm微孔滤膜,即得EA-NLC。
2.3 包封率、载药量、粒径及Zeta电位的测定
量取1 mL的EA-NLC至超滤管中,14 500 r/min离心45 min(温度为−4 ℃),HPLC测定续滤液中游离药物质量浓度,计算含量(游离)。另取1 mL的EA-NLC转移至50 mL量瓶中,加入30 mL甲醇,超声5 min,得澄清溶液,放置30 min,加入甲醇- 0.1%磷酸水溶液(45∶55)定容,HPLC测定鞣花酸质量浓度,计算鞣花酸总含量(总)。根据参考文献方法[11]计算包封率和载药量。取EA-NLC混悬液0.2 mL,采用蒸馏水按照1∶20稀释,取约3.5 mL置于比色皿中,并测定EA-NLC的粒径和Zeta电位。
2.4 EA-NLC单因素考察
2.4.1 液态脂质种类及比例考察 固定鞣花酸用量为40 mg,药脂比为1∶15,单硬脂酸甘油酯为固态脂质,固液比为4∶1,表面活性剂泊洛沙姆188用量为1%,功率为250 W,超声15 min条件下,分别考察不同液态脂质种类及比例对EA-NLC的包封率、载药量和粒径的影响,结果见表1。液态脂质种类及比例对包封率和载药量有一定影响。单独使用Miglyol®812时,EA-NLC的包封率、载药量及粒径大小均优于油酸,两者合用时虽然包封率及载药量无明显差别,但粒径偏大,故选择单独使用Miglyol®812作为液态脂质。
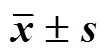
表1 液态脂质种类及比例的考察(, n = 3)
2.4.2 固-液脂质比例考察 固定鞣花酸用量为40 mg,药脂比为1∶15,单硬脂酸甘油酯为固态脂质,Miglyol®812为液态脂质,表面活性剂泊洛沙姆188用量为1%,功率为250 W,超声15 min条件下,分别考察不同固-液脂质比例对EA-NLC包封率、载药量和粒径的影响,结果见表2。固液脂质比对包封率、载药量和粒径大小3个考察指标均有较大影响。当液态脂质比例逐渐减小,固态脂质比例逐渐增加时,对3个指标产生积极影响。但液态脂质比例不可过低,否则会影响包封率及载药量。最终考虑选择固-液脂质比例3∶1、4∶1、5∶1继续进行优化。
2.4.3 脂-药比例考察 固定鞣花酸用量为40 mg,单硬脂酸甘油酯为固态脂质,Miglyol®812为液态脂质,固-液脂质比例为4∶1,表面活性剂泊洛沙姆188用量为1%,功率为250 W,超声15 min条件下,分别考察不同药-脂比对EA-NLC包封率、载药量和粒径的影响,结果见表3。不同脂-药比对这3个考察指标影响较大,由于脂-药比为1∶25时包封率增加不明显,载药量反而下降幅度较大,且粒径有所上升,故后期选择脂-药比1∶10、1∶15、1∶20进行处方优化。
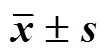
表2 固-液脂质不同比例的考察(, n = 3)
2.4.4 表面活性剂用量考察 固定鞣花酸用量为40 mg,单硬脂酸甘油酯为固态脂质,Miglyol®812为液态脂质,固-液脂质比例为4∶1,脂-药比为1∶15,功率为250 W,超声15 min条件下,分别考察不同泊洛沙姆188用量(0.5%、1.0%、1.5%、2.0%、2.5%)对EA-NLC包封率、载药量和粒径的影响,结果见表4。粒径随着表面活性剂用量增加而逐渐减小。在一定范围内,包封率和载药量随着表面活性剂用量的增加而增加,但过大时反而出现下降,可能是表面活性剂增溶作用使药物进入水相所致。由于过高的表面活性剂用量可能使制剂存在一定的安全隐患[14],故考虑选择0.5%、1.0%、1.5%进行继续优化。
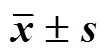
表3 不同脂-药比例的考察(, n = 3)
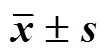
表4 表面活性剂用量的考察(, n = 3)
2.4.5 超声功率考察 固定鞣花酸用量为40 mg,单硬脂酸甘油酯为固态脂质,Miglyol®812为液态脂质,固-液脂质比例为4∶1,脂-药比为1∶15,表面活性剂泊洛沙姆188用量为1%,超声15 min条件下,考察不同超声功率来考察对EA-NLC包封率、载药量和粒径的影响,结果见表5。在功率200 W时粒径较大,功率为350 W时,包封率和载药量出现下降、粒径反而增大。由于功率为300 W时EA-NLC的包封率、载药量和粒径大小均优于250 W,因此,最终选择超声功率为300 W。
2.4.6 超声时间考察 固定鞣花酸用量为40 mg,单硬脂酸甘油酯为固态脂质,Miglyol®812为液态脂质,固-液脂质比例为4∶1,脂-药比为1∶15,表面活性剂泊洛沙姆188用量为1%,超声功率为300 W的条件下,分别考察超声时间对EA-NLC包封率、载药量和粒径的影响,结果见表6。超声时间过长或过短均会则影响EA-NLC的包封率和载药量,且超声时间过短时EA-NLC的粒径较大。综合考虑选择超声时间为15 min。
2.5 Box-Behnken设计-响应面法优化EA-NLC的处方
2.5.1 试验设计 包封率、载药量和粒径是NLC的重要指标,故作为响应参数来优化EA-NLC处方。根据预实验考察情况,发现脂质与药物用量比例(1)、固态与液态脂质比例(2)、泊洛沙姆188的用量(3)对包封率(1)、载药量(2)和粒径(3)影响较大,因此,选择该3个因素进行处方优化,试验设计见表7。以总评分(OD)为响应指标,计算过程为①包封率、载药量和粒径进行归一化处理,其中包封率(1)和载药量(2)越大越好[=(M-min)/(max-min)],粒径(3)越小越好 [=(max-M)/(max-min)],其中M为测量值,max和min为所有试验中最大值和最小值。②将1、2和3进行归一化处理,即总评分OD=(123)1/3。结果见表7。
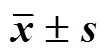
表5 超声功率的影响(, n = 3)
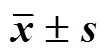
表6 超声时间的影响(, n = 3)
2.5.2 模型的建立和显著性分析 采用Design Expert V8.0.6软件进行拟合,OD二次多元回归方程为OD=0.76-0.0361+0.0942+0.113-0.1212+0.1113+0.1723-0.3612-0.1922-0.2432。模型的=0.002 9<0.01,说明模型具有极显著性意义,失拟项=0.170 0>0.05,说明未知因素对模型干扰很小。另外模型的2=0.939 5,adj2=0.906 9,说明模型与实际吻合度良好,因此,可以采用此模型对EA-NLC处方进行研究,可信度较高。检验结果见表8。模型中2、3、12、22和32均显著或极显著(<0.05、0.01),影响顺序为3>2>1,但其他交互因素不显著。
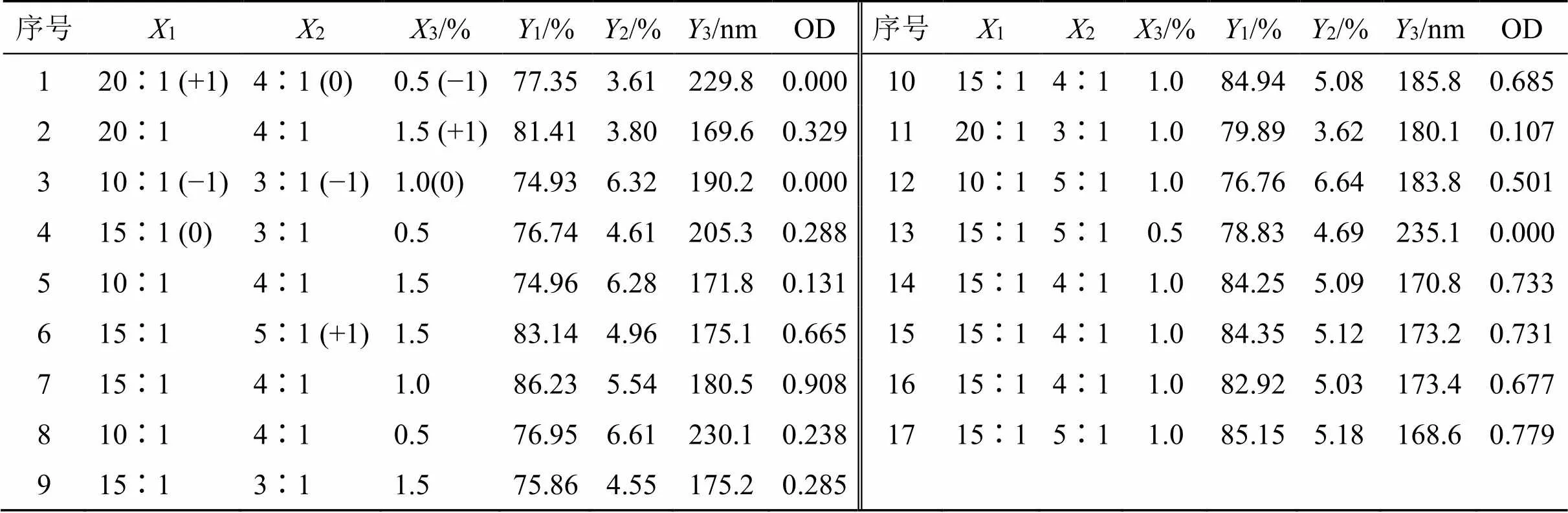
表7 Box-Behnken试验设计与结果
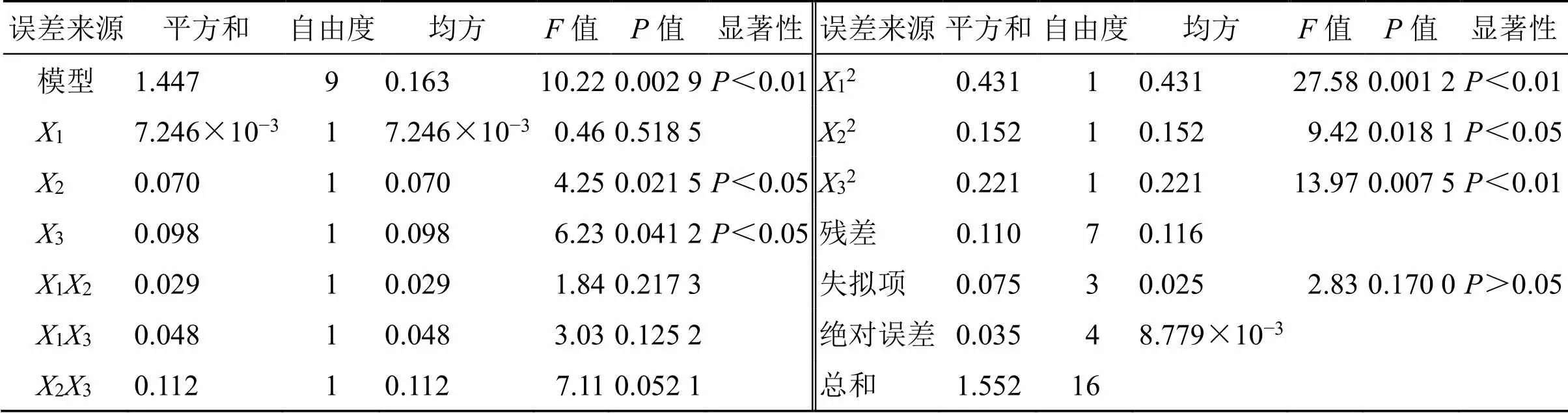
表8 方差分析
2.5.3 效应面优化与预测 根据得出的二次多元回归方程,采用Design Expert V8.0.6绘制因变量对自变量的三维曲面图。分别固定脂质与药物用量比例(1)、固态与液态脂质比例(2)、泊洛沙姆188的用量(3)因素中之一,得到其他2个因素对总评分OD的影响,结果见图2。
根据以上优化结果得到的最佳处方为药物用量比例为13.7∶1、固态与液态脂质比例为4.4∶1、泊洛沙姆188的用量为1.2%,OD值为0.787 1。包封率预测值为85.47%,载药量预测值为5.61%,粒径预测值为169.6 nm。
按照此处方平行制备3批EA-NLC,测得包封率为(85.06±0.48)%,载药量为(5.53±0.15)%,粒径为(166.5±4.6)nm(图3,强度径),分别与预测值较为接近。另测得EA-NLC的Zeta电位为(−36.1±3.8)mV,见图4,其绝对值大于30。
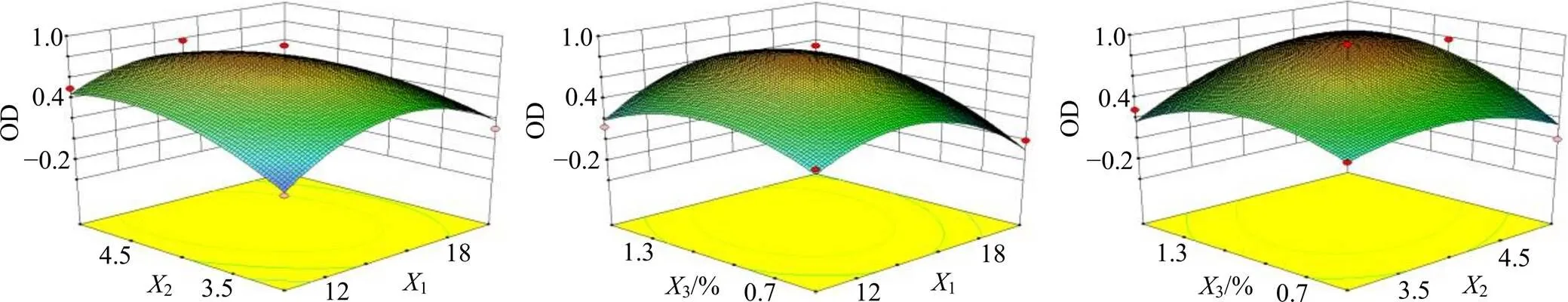
图2 各因素与响应值的三维图
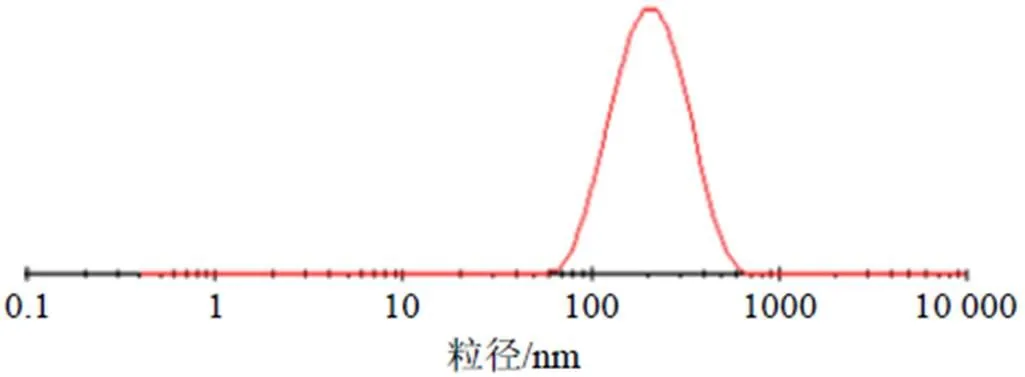
图3 EA-NLC粒径分布
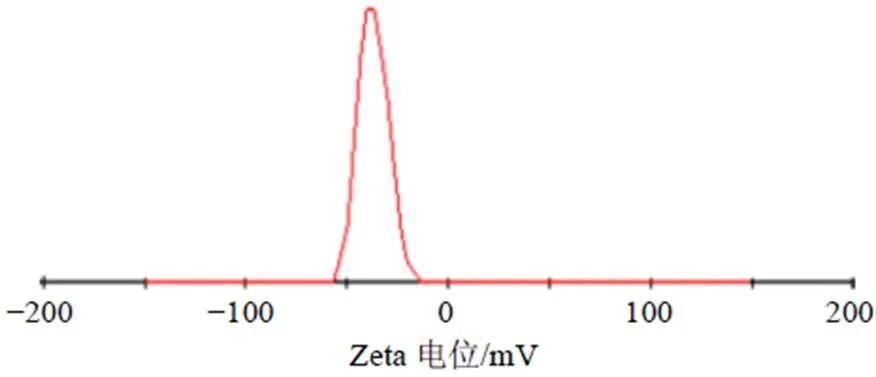
图4 EA-NLC的Zeta电位
2.6 冻干粉的制备
取EA-NLC混悬液加入冻干剂(设置不同种类及用量),混匀,置于−60 ℃超低温冰箱预冻48 h。迅速置于−30℃冷冻干燥机中,冷冻干燥72 h,于6 h内缓慢升温至25℃,并保持3 h,取出即得冻干粉末。蔗糖作为冻干剂时效果往往较差,故不再考察。分别选择乳糖、海藻糖及甘露醇作为冻干剂,并分别设置3%、5%、7%的用量。制得EA-NLC冻干粉后按表10进行评价[15],得分结果见表11,最终选择得分最高的用量为5%甘露醇作为冻干保护剂。复溶后测得包封率为(80.02±0.52)%,载药量为(5.07±0.17)%,Zeta电位为(30.3±2.7)mV,粒径为(228.2±8.6)nm。EA-NLC混悬液、EA-NLC冻干粉及复溶后样品见图5。
2.7 EA-NLC冻干粉稳定性考察
取EA-NLC混悬液置于干燥器中(室温,避光),分别于0、1、3、5、7、14、21、30 d取样0.2 mL,采用蒸馏水按照1∶20稀释,取约3.5 mL置于比色皿中分别测定粒径和多分散指数(polydispersity index,PDI)。取EA-NLC冻干粉置于相同条件,分别于相同时间取相当于0.2 mL的EA-NLC混悬液冻干粉,加入0.2 mL蒸馏水复溶,并按照1∶20稀释,取约3.5 mL置于比色皿中分别测定冻干粉中EA-NLC粒径和PDI,结果见表12。EA-NLC混悬液在30 d内的粒径及PDI均呈现增大趋势;而制备成冻干粉后粒径及PDI变化幅度较小,说明EA- NLC冻干粉稳定性优于EA-NLC混悬液。

表10 评分标准
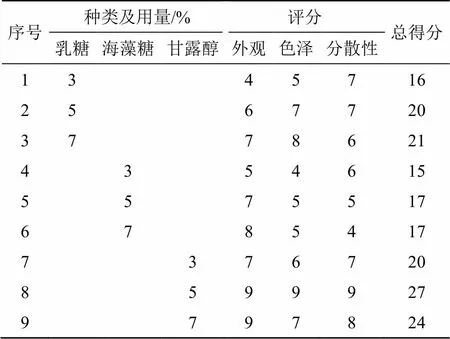
表11 考察结果(n = 3)

图5 EA-NLC样品外观图
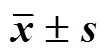
表12 不同样品在放置不同时间后的粒径和PDI(, n = 3)
2.8 体外释药行为研究及模型拟合
取适量EA-NLC冻干粉(含10.0 mg的鞣花酸),加入3 mL的释放介质配制混悬液,转移至透析袋中,另取含10 mg的鞣花酸溶液置于透析袋,扎紧两端。释放介质为1000 mL的pH 6.8磷酸盐缓冲液,温度和转速分别为(37±1)℃和100 r/min。分别在0、0.5、1.0、1.5、2.0、3.0、4.0、6.0、8.0、12.0、24.0、36.0 h分别取样3 mL,并补液3 mL。各样品均过0.45 μm微孔滤膜,进HPLC测定,结果见图6。鞣花酸原料药在6 h内释药较快,累积释放度为96.5%,基本释放完全。而EA-NLC在前8 h释放相对较快,在8~36 h则表现出明显的缓释作用。释药机制拟合结果见表13,EA-NLC与Weibull模型:lnln[1/(1-M/∞)]=0.682 1 ln-2.028 4(=0.982 7)拟合程度最高。
2.9 口服药动学比较
2.9.1 实验方案 取适量的鞣花酸原料药、鞣花酸与辅料的物理混合物和EA-NLC冻干粉末,用0.5% CMC-Na溶液配制ig液,鞣花酸质量浓度均为10 mg/mL。灌胃液均呈混悬状态,可顺利通过灌胃针。
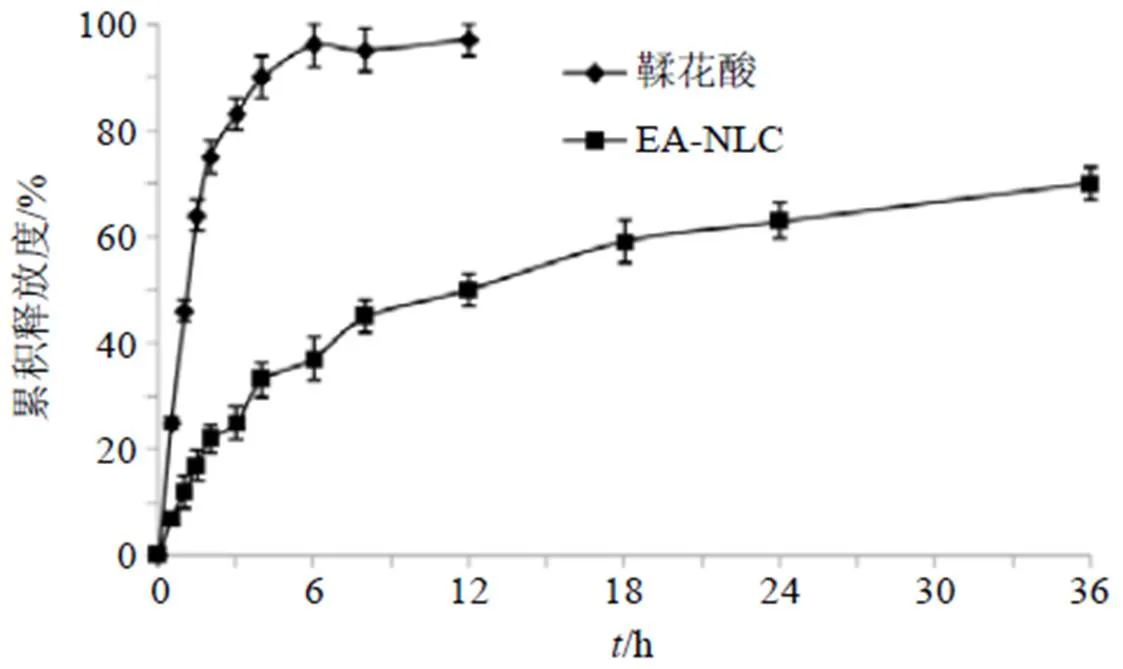
图6 体外释放曲线(n = 6)
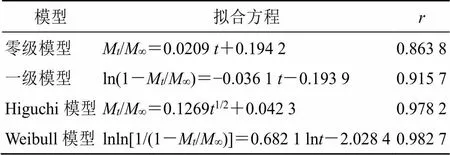
表13 药物释放模型和相关系数
∞为¥时累积释放度;M为时间累积释放度;M/∞为时间累积释放百分率;为时间
∞is accumulative drug-release at time¥,Mis accumulative drug- release at time,M/∞is accumulative release rate at time,is time
取健康SD大鼠18只,实验前12 h禁食不禁水。大鼠随机分为原料药组、物理混合物组和冻干粉末组,按照100 mg/kg进行单剂量单次给药。于0.167、0.5、1、1.5、2、2.5、3、4、6、8、12 h时间点,分别取各组大鼠,3人同时采用乙醚麻醉大鼠,同时眼眶取血0.2~0.3 mL,立即棉球止血。将采到的血样置于肝素抗凝的离心管中,作好标记后分别涡旋5 s,3000 r/min离心3 min,分离血浆后保存在−15 ℃冰箱。
2.9.2 血浆样品处理过程 参考文献方法[16-17],略作改进。取甲醇20 mL和乙腈100 mL超声混匀后作为蛋白沉淀剂及鞣花酸提取液。血浆样品解冻后取100 μL至离心管中,加入150 μL 1 mol/L KH2PO4和15 μL 50%磷酸水溶液,涡旋混合5 min,继续加入提取液1 mL并涡旋混合5 min,5000 r/min离心5 min,收集上清液。继续加入0.3 mL提取液洗涤沉淀,同法操作。合并2次上清液,45 ℃的N2吹干,加入100 μL甲醇复溶后进样测定。
2.9.3 线性关系考察 取鞣花酸对照品储备液,甲醇稀释至1500、1000、500、100、50、25 ng/mL。各种质量浓度分别取100 μL,N2缓慢吹干得残渣,分别加入100 μL空白血浆,密封,作好标记,依次涡旋5 min。按照“2.9.2”方法处理,进样分析。以鞣花酸峰面积为纵坐标(),质量浓度为横坐标(),进行线性回归,得回归方程=0.011 5+0.091 2,=0.994 1,因此血浆对照品线性范围为25~1500 ng/mL。
2.9.4 方法学验证 取空白血浆、血浆对照品溶液和血浆样品溶液,按照“2.9.2”项方法处理,进样分析,典型色谱图见图7,可见专属性较高,其中鞣花酸+空白血浆中鞣花酸质量浓度为25 ng/mL,血浆样品中鞣花酸质量浓度为40.37 ng/mL(EA- NLC ig后12 h的血浆样品)。
取处理后的血浆样品于0、4、8、16、24、48 h进样,计算鞣花酸峰面积的RSD为4.03%,因此稳定性良好。取质量浓度为25 ng/mL(低)、500 ng/mL(中)和1500 ng/mL(高)血浆对照品溶液,分别连续进样6次,鞣花酸峰面积的RSD依次为4.64%、3.71%、2.03%,可见,日内密度度良好。各质量浓度连续进样6 d,每天1次,计算鞣花酸峰面积的RSD依次为7.24%、4.08%、5.23%,可见日间精密度良好。
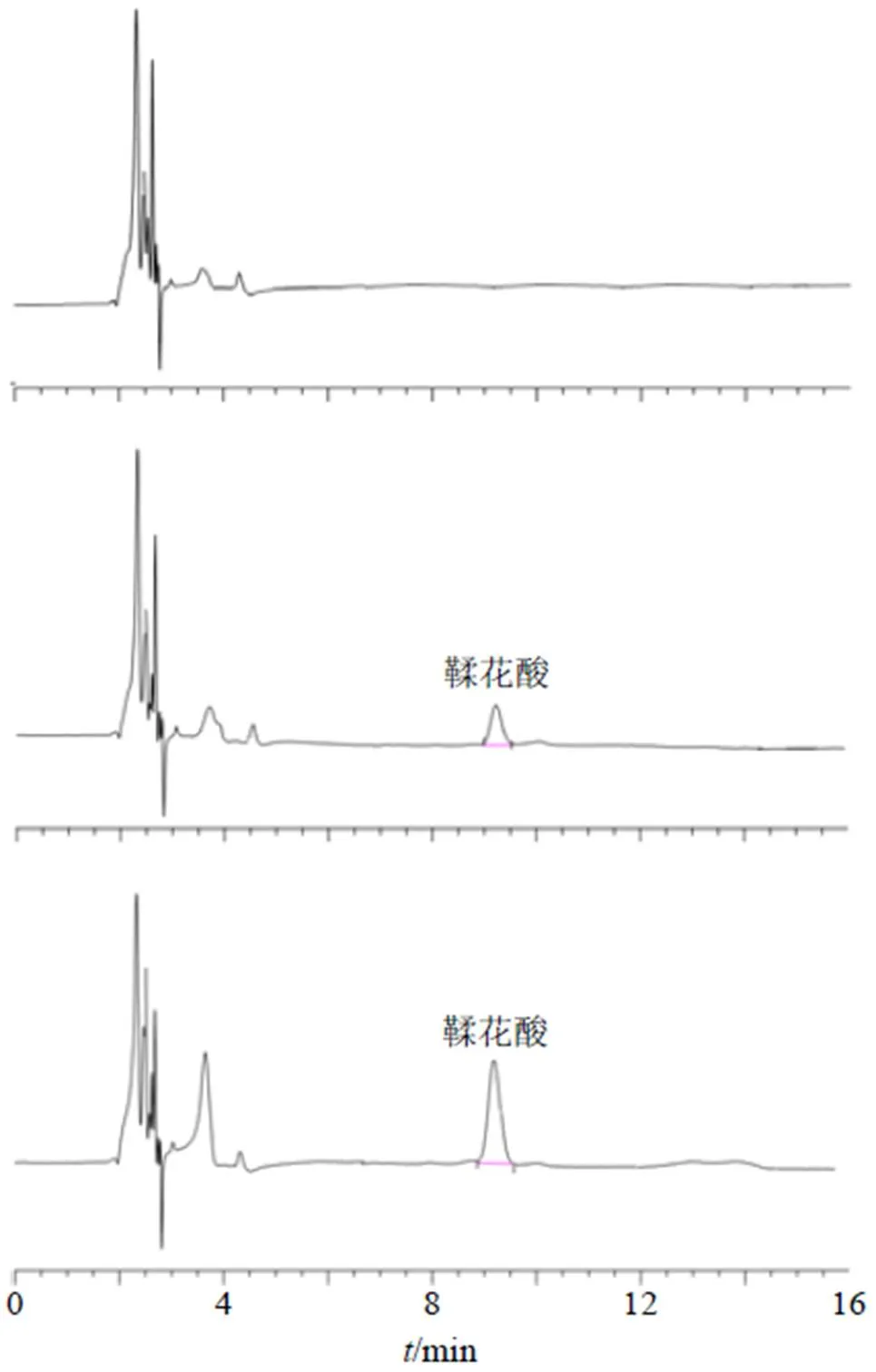
图7 空白血浆(A)、鞣花酸+空白血浆(B) 和血浆样品(C) 的HPLC图
空白血浆配制25、500、1500 ng/mL的血浆样品,各种质量浓度分别制备3份并按照“2.9.2”项方法处理,进HPLC测定峰面积,按照方程=0.011 5+0.091 2计算测定质量浓度,并与配制质量浓度相比计算回收率。低、中、高质量浓度的平均回收率依次为92.07%、89.36%、94.87%,RSD依次为6.04%、3.25%、4.09%,所以回收率较高。
取0.25 ng/mL的血浆对照品溶液,逐步稀释,鞣花酸定量限(信噪比S/N=3)为3.0 ng/mL,鞣花酸检测限(S/N=10)为1.5 ng/mL。
2.9.5 药动学结果 药-时曲线见图8。采用3P97软件处理药动学参数,达峰时间(max)和半衰期(1/2)采用非参数法秩和检验,达峰浓度(max)和时间-曲线下面积(AUC)经对数转换后进行独立样本检验,结果见表14,鞣花酸及EA-NLC均符合二室房室模型。
EA-NLC的max、1/2、max、AUC0~t和AUC0~∞等参数与鞣花酸原料药相比均有显著性差异(<0.05、0.01),其中max由(0.96±0.22)h延后至 (2.32±0.36)h,1/2由(2.11±0.31)h延长至 (5.63±0.94)h,max提高至3.52倍,清除率(CL)下降至(34.61±5.82)mL/(h×kg),说明NLC极大改变了鞣花酸原料药的体内药动学过程,显著延长了药物体内循环时间,促进了药物体内吸收,相对口服吸收生物利用度提高至4.67倍。物理混合物组的max、AUC0~t和AUC0~∞等药动学参数与原料药相比虽有一定程度提高,但无统计学意义(>0.05)。
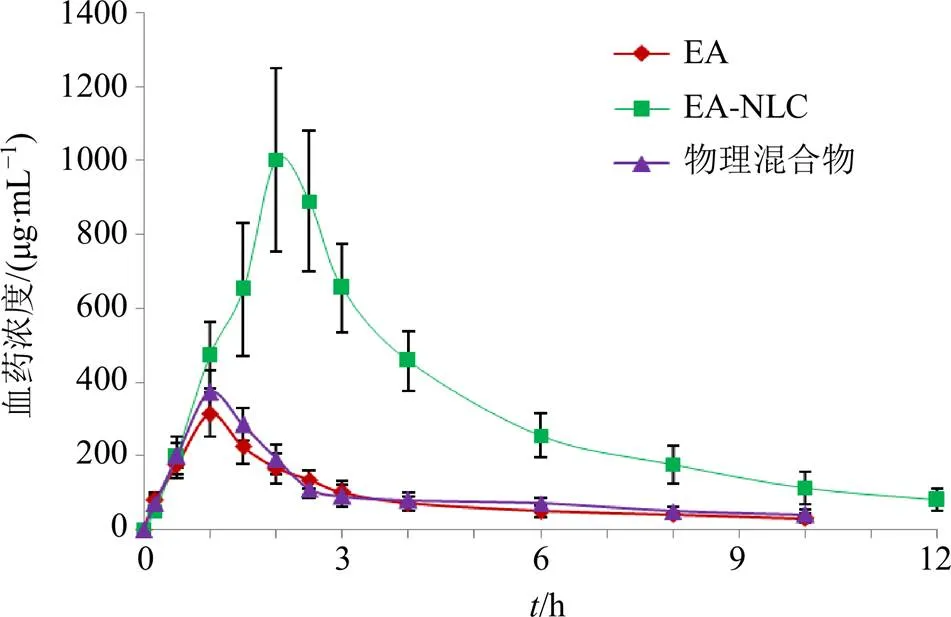
图8 药-时曲线(n = 3)
表14 主要药动学参数(, n = 3)
与鞣花酸比较:*<0.05**<0.01;与物理混合物比较:#<0.05##<0.01
*< 0.05**< 0.01ellagic acid;#<0.05##<0.01physical mixture
3 讨论
分离纳米药物和游离药物对测定包封率和载药量至关重要。课题组曾采用14 500 r/min高速离心40 min后仍未达到有效分离,可能是由于EA-NLC处方中加入了密度较小的液态脂质所致。由于凝胶柱色谱法不仅操作较为繁琐,且可能会对NLC产生吸附作用[18],进而会影响测定结果。因此选用超滤法来测定EA-NLC包封率和载药量。
为了提高EA-NLC的稳定性,本研究进一步制备成了冻干粉,其过程是一个非常复杂的相变过程。经过考察发现,5%甘露醇作为冻干剂时效果最佳,可最大程度发挥骨架支撑作用。这可能是由于在冻干过程中甘露醇结构中的OH−与NLC表面形成氢键[19],从而在脱水过程中与水进行交换,有助于维持NLC的微观结构,抑制NLC聚集。
Box-Behnken设计-效应面法具有精确度高、结果可靠性强等优势,在处方筛选中应用较多,本研究采用Box-Behnken设计-效应面法得到EA-NLC最佳处方工艺,其包封率、载药量及粒径的预测值与实际测定值较为接近。EA-NLC体外释药包含快速释药阶段(0~6 h)和缓释阶段(6~36 h)。快速释药阶段可能与NLC吸附方式载药有关[18],药物由于表面活性剂的作用主要分布在NLC表面乳化层、纳米粒子的浅表层或表层,释药相对容易,因而出现快速释药阶段。缓释阶段可能是由于药物分散于液态脂质、固态脂质或固-液脂质形成的晶体缺陷空间,药物释放出去需经过的屏障较多,因而出现缓慢释药阶段。
在血浆样品处理时难免造成药物损失,因而一般采用内标法进行含量分析。杨媛等[16]研究结果显示鞣花酸在酸性条件下提取效率最高,且本研究的方法学验证试验结果表明,在酸性条件下采用外标法[7,16-17]来测定鞣花酸含量时不仅专属性较高,内源性物质不对鞣花酸色谱峰产生干扰,回收率满足《中国药典》2020年版四部9012项下对生物样品分析的要求。可能是由于在酸性条件下更有利于鞣花酸进入有机溶剂中而被高效提取出来。外标法处理较为简单、快速,故采用酸性条件下的外标法对鞣花酸血浆样品进行含量测定。
鞣花酸及其NLC的药动学结果显示,max发生显著性延后,可能与EA-NLC具有缓释特征有关。也可能由于EA-NLC粒径较小,容易黏附于胃肠道,甚至进入绒毛间隙,增加了在胃肠道的滞留时间,从而使max发生显著性延后。生物利用度的提高可能是由于NLC粒径较小,增加了与胃肠道接触面积;1/2延长至(5.63±0.94)h,CL下降至(34.61±5.82)mL/(h×kg),明显增加了药物体循环时间,有助于药物被充分吸收[20-21];NLC可在淋巴结构Peyer’s parches中聚集,经M细胞吸收进入体循环,使药物被高效吸收[22-23];NLC处方中的非离子表面活性剂泊洛沙姆188可提高胃肠道黏膜的通透性[24],最终使鞣花酸的口服吸收生物利用度提高至4.67 倍[25-27]。接下来将研究重点放在注射给药的药动学、药效学评价等,进一步完善质量标准,为EA-NLC提供更为全面的研究资料。
利益冲突 所有作者均声明不存在利益冲突
[1] Ortiz-Ruiz C V, Berna J, Tudela J,. Action of ellagic acid on the melanin biosynthesis pathway [J]., 2016, 82(2): 115-122.
[2] Abdelazeem K N M, Singh Y, Lang F,. Negative effect of ellagic acid on cytosolic pH regulation and glycolytic flux in human endometrial cancer cells [J]., 2017, 41(6): 2374-2382.
[3] 于娅, 李利民, 潘嘉, 等. 鞣花酸抗S180, H22肿瘤及其抑制新生血管机制探讨 [J]. 中国实验方剂学杂志, 2015, 21(8): 145-150.
[4] 韩奇亨, 张春红, 龚雪, 等. 鞣花酸类化合物在野牡丹科植物中的分布与药理活性研究 [J]. 中药材, 2018, 41(12): 2962-2967.
[5] Bala I, Bhardwaj V, Hariharan S,. Analytical methods for assay of ellagic acid and its solubility studies [J]., 2006, 40(1): 206-210.
[6] 范高福, 刘修树, 汤洁, 等. 石榴鞣花酸-羟丙基-β-环糊精包合物的制备 [J]. 中成药, 2018, 40(6): 1388- 1392.
[7] Mady F M, Shaker M A. Enhanced anticancer activity and oral bioavailability of ellagic acid through encapsulation in biodegradable polymeric nanoparticles [J]., 2017, 12: 7405-7417.
[8] Gopalakrishnan L, Ramana L N, Sethuraman S,. Ellagic acid encapsulated chitosan nanoparticles as anti-hemorrhagic agent [J]., 2014, 111: 215-221.
[9] 郑娟, 沈成英, 庞建云, 等. 丹参酮IIA纳米结构脂质载体的体外评价及其对HaCaT细胞增殖的影响 [J]. 中草药, 2016, 47(24): 4340-4344.
[10] 管庆霞, 张伟兵, 张喜武, 等. 马钱子碱纳米结构脂质载体处方与制备工艺的优化 [J]. 中草药, 2018, 49(11): 2557-2563.
[11] 李月灵, 王丽华, 周竞. 青藤碱磷脂复合物纳米结构脂质载体的制备、表征及药动学研究 [J]. 天然产物研究与开发, 2019, 31(4): 669-674.
[12] 庞建云, 沈成英, 周敏, 等. 异补骨脂素纳米结构脂质载体的体外溶出及其抗白癜风活性研究 [J]. 中草药, 2018, 49(8): 1796-1801.
[13] 颜洁, 关志宇, 朱卫丰, 等. Box-Behnken效应面法优化自组装法制备葛根素壳聚糖/海藻酸钠口服纳米粒的处方与工艺研究 [J]. 中草药, 2019, 50(23): 5706-5713.
[14] 荆玲, 范炎峰, 邹梦梦, 等. 延胡索乙素聚乳酸纳米粒的制备及其体内药动学研究 [J]. 中成药, 2021, 43(3): 579-584.
[15] 姚艳胜, 季鹏, 刘畅, 等. 柚皮素固体脂质纳米粒冻干粉的制备及其大鼠肺部给药药动学研究 [J]. 中草药, 2016, 47(4): 591-598.
[16] 杨媛, 石磊, 杨军军, 等. 超高效液相色谱-质谱联用法测定草莓中鞣花酸 [J]. 分析测试学报, 2016, 35(12): 1591-1595.
[17] 张笑颜, 薛璇玑, 王兴斌, 等. 九牛造提取物与鞣花酸单体在大鼠体内药动学比较研究 [J]. 中国现代应用药学, 2020, 37(10): 1182-1186.
[18] 毛艳婷, 马姝丽, 白朝辉, 等. 木犀草素纳米结构脂质载体及其冻干粉的制备和体外释药研究 [J]. 中国医院药学杂志, 2020, 40(23): 2423-2429.
[19] 胡瑞瑞, 张家梁, 郝海军. 葫芦素B磷脂复合物纳米结构脂质载体的制备 [J]. 中成药, 2019, 41(11): 2571-2576.
[20] 郜娜, 范明松, 杨庆宇, 等. 二氢杨梅素磷脂复合物纳米结构脂质载体的制备、表征及药动学研究 [J]. 中草药, 2019, 50(17): 4060-4067.
[21] 王震芳, 张智强, 葛振华. 蛇床子素3种制剂的制备、表征及药动学比较研究 [J]. 中草药, 2019, 50(15): 3615-3621.
[22] 高彩芳, 夏加璇, 朱颖, 等. 纳米技术在改善中药有效成分成药性中的应用 [J]. 中草药, 2018, 49(12): 2754-2762.
[23] 徐凯, 魏永鸽. 高乌甲素磷脂复合物纳米粒的制备、表征及药动学研究 [J]. 天然产物研究与开发, 2018, 30(5): 870-874.
[24] 任少琳, 符馨尹, 裔文静. 肝素-泊洛沙姆407新材料应用进展 [J]. 医药导报, 2019, 38(1): 75-78.
[25] Singh A, Neupane Y R, Mangla B,. Nanostructured lipid carriers for oral bioavailability enhancement of exemestane: Formulation design,,, andstudies [J]., 2019, 108(10): 3382-3395.
[26] IparV S, Dsouza A, Devarajan P V. Enhancing curcumin oral bioavailability through nanoformulations [J]., 2019, 44(4): 459-480.
[27] Agarwal S, HariKumar S L, Negi P,. Quetiapine fumarate loaded nanostructured lipid carrier for enhancing oral bioavailability: Design, development and pharmacokinetic assessment [J]., 2021, 18(2): 184-198.
Formulation optimization of ellagic acid nanostructured lipid carriers and oral bioavailability study
WANG Xiao-xia1, ZHANG Zhi-qiang2
1. The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450000, China 2. Tianjin Institute of Pharmaceutical Research Pharmaceutical Co., Ltd., Tianjin 300301, China
To optimize the formulation of ellagic acid (EA) nanostructured lipid carriers (EA-NLC) using Box-Behnken design-response surface method, and conduct its pharmacokinetics studies.Emulsion ultrasonic method was used to prepare EA-NLC. Encapsulation rate, drug loading and particle size were taken as evaluation index, univariate investigation and Box-Behnken response surface design method were used to optimize the formulation of EA-NLC. The optimal formulation was characterized and pharmacokinetics behaviorwas also compared.The optimal formulation: lipid- drug ratio was 13.7∶1, solid-liquid lipid ratio was 4.4∶1 and surfactant concentration was 1.2%. Envelopment efficiency, drug loading and particle size of EA-NLC were (85.06 ± 0.48)%, (5.53 ± 0.15)%, and (166.5 ± 4.6) nm, respectively. The drug releasehas obvious sustained-release characteristics, and the release process conformed to the Weibull model: lnln[1/(1-M/∞)]=0.682 1 ln-2.028 4,= 0.982 7. The main pharmacokinetic parameters such asmax,1/2,max, AUC0—tand AUC0—∞of EA-NLC had significant difference compared to ellagic acid (< 0.05, 0.01). The oral bioavailability of ellagic acid was enhanced to 4.67 times.The model established by the Box-Behnken design-response surface method could be used to optimize the formulation of EA-NLC with high accuracy and good prediction effect. And the oral bioavailability of ellagic acid was increased by EA-NLC effectively.
ellagic acid; nanostructured lipid carriers; pharmacokinetics; Box-Behnken design-response surface method; sustained- release characteristics; oral bioavailability
R283.6
A
0253 - 2670(2021)13 - 3862 - 10
10.7501/j.issn.0253-2670.2021.13.010
2021-02-19
国家重大科技专项(2017ZX0911002-001-005);河南省重大科技专项(182102731003)
王小霞(1976—),女,本科,主管药师,研究方向为医院药学。Tel: (0371)66912639 E-mail: wxx1888fafa@126.com
张智强(1984—),男,硕士,高级工程师,研究方向为新药开发与设计。Tel: (022)29481572 E-mail: zhangzq1985@163.com
[责任编辑 郑礼胜]