急性淋巴细胞白血病儿童治疗失败原因的分析
朱嘉莳,李 红,邵静波,张 娜,杨静薇,陈 凯,王 真,蒋 慧
上海市儿童医院,上海交通大学附属儿童医院血液肿瘤科,上海200040
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是我国最常见的儿童恶性血液病,占儿童急性白血病的65%~70%。目前儿童和青少年的ALL 的无事件生存率(event free survival,EFS)为70%~80%[1],但仍有20%~30%的患儿治疗失败;降低治疗失败的比例,可提高患者的长期生存率。治疗失败的主要原因包括疾病复发、严重感染导致的死亡和第二肿瘤发生等。儿童ALL疾病复发率约为20%,ALL 复发是最常见的治疗失败原因[2];而一旦出现疾病复发,治疗难度大,患儿长期生存率低[3]。严重感染是治疗过程中威胁患儿生命的并发症。本研究回顾性分析2006 年1 月至2017 年6 月上海市儿童医院收治的初诊ALL 且经正规化学治疗(化疗)后失败的病例,探讨儿童ALL 治疗失败的原因,期望通过早期临床干预,提高患儿总体生存率。
1 对象与方法
1.1 研究对象
入组标准:①初诊年龄小于18 岁。②符合儿童ALL诊断标准[4]。③临床资料完整并接受标准化疗疗程。排除标准:①成熟B 细胞系列ALL。②骨髓增生异常综合征转化白血病。③合并第二肿瘤。④患有免疫缺陷病。⑤非初治患儿。⑥确诊即放弃治疗者。2006 年1 月至2017 年6 月上海市儿童医院收治的初诊ALL 患儿341 例,其中符合标准的330例纳入统计。随访终点为2020年6月30日。
1.2 诊断
所有患儿诊断均通过细胞形态学、免疫学、细胞遗传学及分子生物学 (morphology, immunology,cytogenetics,molecular biology,MICM)检查。形态学检查采用骨髓细胞学涂片及免疫组织化学染色。免疫分型采用直接免疫荧光标记法,流式细胞仪进行标准化检测。染色体核型分析采用G 显带技术,核型描述按《人类细胞遗传学国际命名体制(ISCN2009)》[5]。基因检测采用原位荧光杂交法,选用TEL-AML1融合基因探针、MLL基因重排探针、BCR-ABL融合基因探针。所有患儿根据初诊时临床及实验室资料和患儿对早期治疗的反应进行临床危险度评估[6]。
1.3 治疗
所有入组ALL 患儿参照CCCG-ALL2005 方案[7](2009 年1 月—2014 年12 月患儿)或CCCG-ALL2015 方案[8](2015年1月—2017年6月患儿)进行化疗。复发后的治疗包括再诱导化疗,化疗联合造血干细胞移植、颅脑放射治疗(24~30 Gy)等个体化治疗。
1.4 疗效判断
疗效判断标准及ALL 复发标准参照《血液病诊断及疗效标准》(第3 版)[4]。治疗失败定义为疾病出现复发、第二肿瘤以及各种原因导致的死亡。很早期复发定义为初诊18 个月内复发,早期复发定义为初诊18~36 个月内复发,晚期复发定义为初诊36 个月后复发。无复发生存(relapse free survival,RFS)期定义为疾病缓解后至白血病复发的时间。总生存(overall survival,OS)期定义为自诊断起至死亡或末次随访时间。
1.5 统计学分析
所有数据采用SPSS 25.0 软件进行分析。非正态分布定量资料用中位数(最小值~最大值)表示,复发率和生存率用(样本率±标准误)表示。采用Kaplan-Meier 生存曲线分析RFS 率及OS 率,组间生存率的比较采用Logrank 检验;多因素分析采用COX 回归模型;采用χ2检验比较不同危险度患儿感染出现阶段的差异。P<0.05 认为差异具有统计学意义。
2 结果
2.1 总体临床资料
330例ALL 患儿中,84例(占25.5%)治疗失败,其中58 例疾病复发,19 例因严重感染死亡,2 例出现第二肿瘤,余5例因其他原因死亡。
84例治疗失败患儿中,男53例,女31例,初诊时中位年龄5 岁(3 月龄~15 岁);B 细胞系列ALL(B-ALL)78 例,T 细胞系列ALL(T-ALL)6 例。共有72 例患儿获得染色体核型分析结果,其中46 例为正常核型,6 例为多倍体,19 例为染色体结构或数目异常,1 例为复杂核型。这84 例患儿中,6 例t(12;21)和/或TEL-AML1阳性,4 例11q23 和/或MLL基因重排,3 例t(9;22)和/或BCR-ABL阳性。根据不同的临床危险度评估分组,低危组患儿18例,中高危组患儿66例。
2.2 复发患儿的临床分析
2.2.1 复发患儿的一般情况 至随访终点,共有58 例患儿出现复发,其中男34 例,女24 例,初诊时中位年龄5.5 岁(10 月龄~14 岁);初诊时外周血白细胞数为7.1(1.2~483.9) ×109/L,血红蛋白78.5(42.0~150.0) g/L,血小板62(3~461)×109/L。35 例(占60.3%)患儿初诊时存在外周血幼稚细胞。根据免疫分型,58 例复发患儿中,B-ALL 54例(占93.1%),T-ALL 4例(6.9%)。58例复发患儿中49 例获得染色体核型分析结果,其中33 例为正常核型,3 例为多倍体,12 例为染色体结构或数目异常,1例为复杂核型。58例患儿中4例为TEL-AML1阳性,2 例为BCR-ABL阳性,4 例为MLL基因重排。初诊时,2例患儿出现中枢神经系统浸润,无睾丸浸润病例。骨髓复发患儿的骨髓细胞学形态均未发生漂移。
2.2.2 复发患儿的远期转归 58 例复发患儿,中位复发时间27(2~95)个月,5 年累积复发率为(18.2±2.3)%,10 年累积复发率为(22.4±2.9)%(图1)。58 例复发患儿中,20 例长期存活,29 例复发后死亡。长期存活患儿中9 例行异基因造血干细胞移植,10 例行化疗,1 例行化疗及颅脑放射治疗;复发后死亡患儿中,22 例骨髓复发后放弃治疗死亡,5例行异基因造血干细胞移植后再复发死亡,2 例因移植相关并发症死亡;另有9 例患儿转至外院治疗后失访。截至随访终点,58 例复发患儿的中位生存时间为38.5 (4~172) 个月,复发后3 年的OS 率为(50.0±6.6)%,5 年OS 率为(38.5±6.5)%,10 年OS 率为(30.0±6.7)%(图2)。
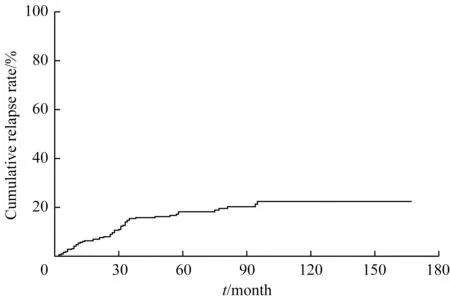
图1 330例ALL患儿的累积复发曲线Fig 1 Cumulative recurrence curve of 330 children with ALL
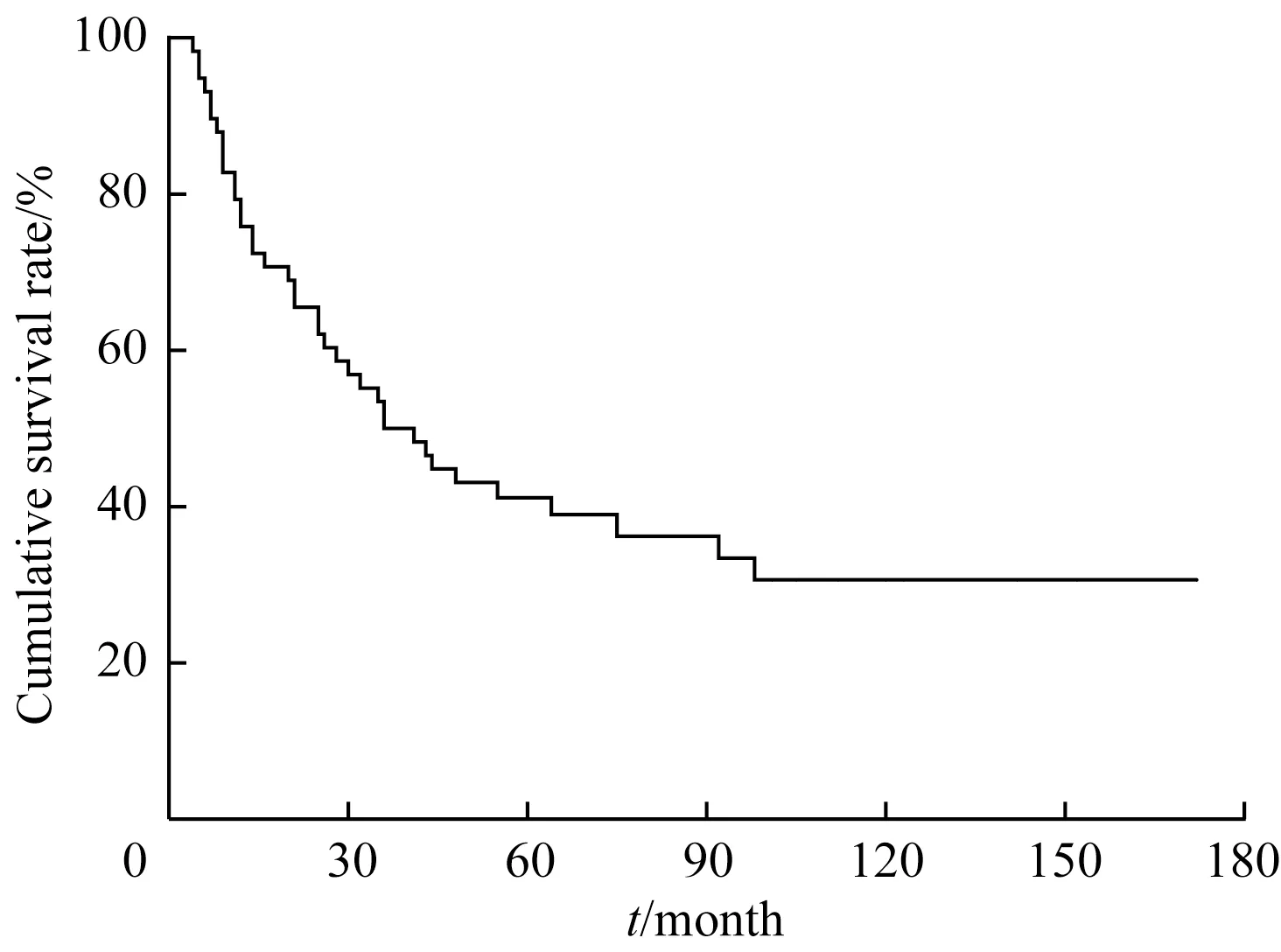
图2 58例复发患儿的生存曲线Fig 2 Survival curve of 58 children with relapse
2.2.3 复发与初始临床特征的关系 分析患儿性别、年龄、初诊时外周血白细胞数、初诊时外周血是否存在幼稚细胞、发病时有无髓外浸润、免疫分型、早期泼尼松治疗反应、疾病危险度与疾病复发的关系。通过单因素分析发现,年龄≥10岁,初诊时外周血存在幼稚细胞,早期泼尼松治疗反应不佳,中高危险度是ALL 复发的危险因素(均P<0.05,表1)。
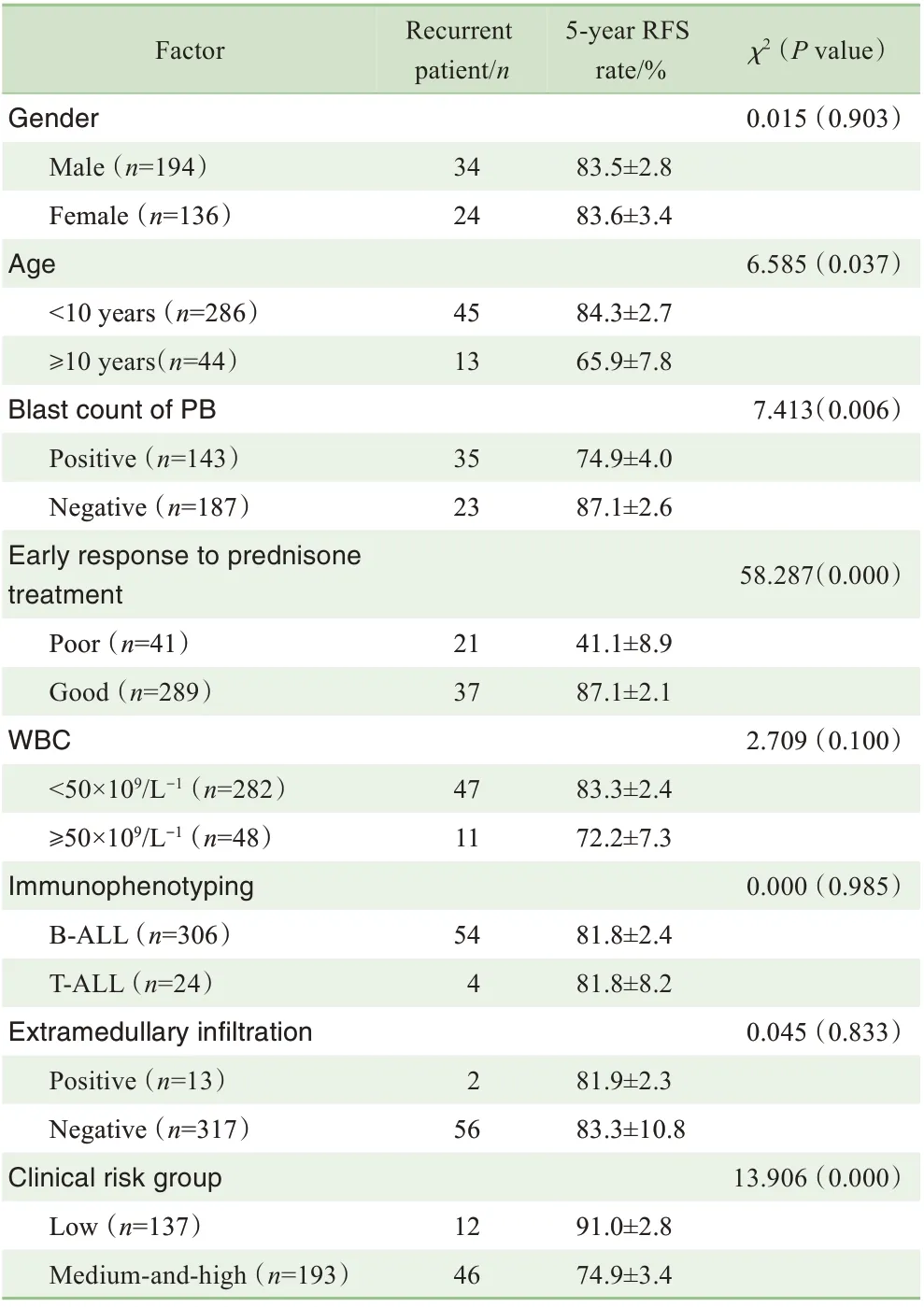
表1 初始临床特征与疾病复发关系的单因素分析Tab 1 Univariate analysis of the relationship between initial clinical features and disease recurrence
COX 多因素回归模型中,纳入上述单因素分析中差异有统计学意义的因素,结果显示,早期泼尼松治疗反应不佳(HR=5.43,95%CI2.76~10.72,P=0.000)、中高危险度(HR=2.26,95%CI1.16~4.44,P=0.017)是ALL复发的独立危险因素。
2.2.4 复发时间与长期生存的关系 复发患儿中,很早期复发患儿20 例(占34.5%),截至随访终点,复发后生存时间为0~60个月,5年OS率为(16.7±10.2)%;早期复发患儿27例(占46.6%),复发后生存时间为0~116个月,5 年OS 率为(44.2±11.1)%;晚期复发患儿11 例(占19.0%),复发后生存时间为0~125 个月,患儿5 年OS 率为(77.8±13.9)%。两两比较不同复发时间患儿的长期生存情况(图3),发现很早期复发患儿的长期生存率显著低于早期复发(χ2=15.788,P=0.000)和晚期复发患儿(χ2=18.524,P=0.000),早期复发与晚期复发患儿之间差异无统计学意义(P>0.05)。

图3 不同复发时间患儿的生存曲线Fig 3 Survival curves of the children with different recurrence time
2.2.5 复发部位与长期生存的关系 单纯骨髓复发患儿44 例(占75.9%),截至随访终点,复发后生存时间为0~116 个月,5 年OS 率为(42.0±10.2)%。单纯髓外复发患儿11例(占19.0%),其中4例中枢神经系统复发,6例睾丸复发,1 例中枢神经系统合并睾丸复发;其中4 例流式细胞术检测到的骨髓微小残留病灶(minimal residual disease,MRD) <0.01%,余7 例骨髓MRD 为0.03%~1.20%;截至随访终点,复发后生存时间为1~125 个月,5年OS率为(68.0±15.8)%。骨髓合并髓外复发患儿3例(占5.2%),其中合并睾丸复发2 例,合并中枢神经系统复发1 例;截至随访终点,复发后生存时间为8~88 个月,5 年OS 率为(66.7±27.2)%。两两比较不同复发部位患儿的长期生存情况(图4),单纯骨髓复发患儿的长期生存率低于单纯髓外复发患儿(χ2=4.059,P=0.044);其他各组间差异无统计学意义(P>0.05)。
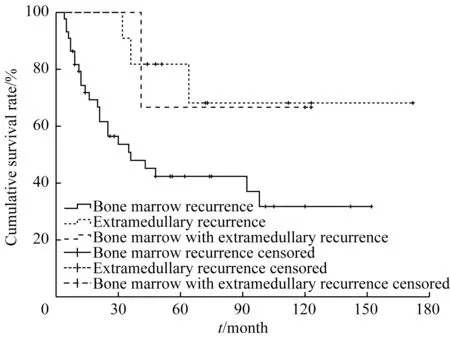
图4 不同复发部位患儿的生存曲线Fig 4 Survival curves of the children with different recurrence sites
2.3 感染死亡
330 例患儿中共有55 例(占16.7%)并发严重感染,其中26 例为脓毒症,20 例为呼吸道感染合并急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),9 例为严重肠道感染。低危组患儿中并发严重感染20 例(占14.6%),其中发生于诱导巩固治疗阶段9 例、中期强化治疗阶段8 例、维持治疗阶段3 例;中高危组并发严重感染35 例(占17.8%),其中发生于诱导巩固治疗阶段5 例、中期强化治疗阶段25 例、维持治疗阶段5 例。2 组感染发生的阶段分布差异有统计学意义(χ2=6.331,P=0.019);进一步比较2 组感染发生的阶段,低危组患儿在诱导巩固治疗阶段更易并发严重感染(χ2=6.331,P=0.022),中高危组患儿在中期强化治疗阶段更易并发严重感染(χ2=5.242,P=0.044)。
55 例并发严重感染患儿中,19 例(占34.5%)死亡,其中2 例并发脓毒症(1 例为铜绿假单胞菌感染,1 例为肺炎克雷伯菌感染),14 例并发ARDS,3 例并发严重肠道感染。感染事件发生时间分布上,4例发生于诱导巩固治疗阶段(1例脓毒症、2例ARDS、1例严重肠道感染),12 例发生于中期强化治疗阶段(1 例脓毒症、10 例ARDS、1 例严重肠道感染),3 例发生于维持治疗阶段(2例ARDS、1例严重肠道感染)。
2.4 第二肿瘤
330 例患儿中共有2 例(占0.6%)出现第二肿瘤。1例低危组患儿,骨髓持续缓解,于白血病治疗11个月时发现盆腔占位,手术活检提示横纹肌肉瘤,1个月后因疾病进展死亡;1 例中高危组患儿,停药后3 年出现胃腺癌,至本研究随访结束患儿仍存活(>36个月)。
2.5 其他原因死亡
其他原因死亡的5 例患儿中,1 例因肿瘤溶解死亡;1例因药物不良反应死亡(培门冬酶相关的急性出血性坏死性胰腺炎);2 例因诱导治疗未缓解,遂放弃治疗后死亡;1例于外院行造血干细胞移植过程中因并发症死亡。
3 讨论
近20 年来,随着儿童ALL 的诊断与治疗技术的飞速发展,发达国家儿童ALL 的长期OS 率可接近甚至超过90%[9],10 年EFS 率也可达70%~80%[1],其改善的原因归结于基于危险度分层的针对性治疗以及支持治疗的改善[10],但仍有20%~30%患儿因各种原因治疗失败。
复发是导致治疗失败的主要原因。本中心的5年累积复发率为(18.2±2.3)%,10 年累积复发率为(22.4±2.9)%,复发后患儿的3年OS率约为50%,均与发达国家相近[11-13]。本研究的单因素分析发现,年龄≥10岁的ALL患儿较年龄<10 岁患儿更易复发。已有的研究[14-15]显示,大龄儿童、青少年ALL 患者与低龄儿童ALL 患者相比,表现出的生物学特征有所不同,疗效较差,复发率更高。此外,经多因素分析发现,早期泼尼松治疗反应不佳及危险度分组为中高危组患儿是复发的独立危险因素。本研究还发现复发患儿中,复发时间上以早期复发为主,复发部位上以纯骨髓复发为主,很早期复发患儿以及单纯骨髓复发患儿长期生存率极低。一项来自美国儿童肿瘤学组(Children’s Oncology Group,COG) 的临床研究[16]也发现了类似的现象,早期复发患儿的长期生存率仅为30%,而晚期复发患儿的长期生存率可达50%,单纯髓外复发患儿的长期生存率优于单纯骨髓复发患儿。
此外近年来的研究也发现,儿童ALL 的复发及药物耐药与基因突变有关:ALL 复发时调节B 细胞分化的基因(IKZF1、EBF1、CDKN2A/2B) 的表达增加,而IKZF1及EBF1的缺失通常发生在费城染色体样ALL(Philadelphia chromosome-like ALL,Ph-like ALL)中[17];50%ALL 复发患儿的抑癌基因TP53存在突变或缺失[18];18%复发患儿存在CREBBP突变,而CREBBP编码CREB结合蛋白,CREBBP突变患儿易出现对糖皮质激素的耐药[19]。
复发ALL 儿童的治疗一直是近年来的难点和热点。来自德国的柏林-法兰克福-蒙斯特协作组(Berlin-Frankfurt-Münster,BFM)、COG 以及St.Jude儿童医院分别根据复发时间、复发部位以及免疫表型制定了不同的治疗方案。BFM 将患儿分为4 个危险组S1、S2、S3 和S4,5 年OS 率分别为60%~70%、60%、30%和25%,其中S3、S4 组以及MRD 水平较高的S2 组部分患儿进行了异基因造血干细胞移植[20]。此外,随着对复发及耐药生物学机制的不断探索及认识,近年来出现了分子靶向治疗及新型免疫疗法,如酪氨酸激酶抑制剂用于治疗Phlike ALL、组蛋白脱乙酰基酶抑制剂用于治疗CREBBP突变并对糖皮质激素耐药的ALL,其他还包括CD19/CD3双特异性抗体、CD22 单克隆抗体、嵌合抗原受体T 细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy,Car-T)等[21]。目前这些治疗方法中部分已经在国内多个临床中心开展试验,期待这些治疗可改善复发ALL 患儿的治疗结局及长期生存。
非疾病进展导致的死亡是另一个导致治疗失败的重要原因,其中最主要的为感染。本研究55 例ALL 患儿在治疗的各阶段并发严重感染,最终19 例死亡,低危患儿及中高危患儿分别在治疗早期(诱导巩固治疗阶段)及治疗中期(中期强化治疗阶段)更易出现严重感染。分析其原因可能如下:在治疗早期,低危组与中高危组化疗方案差异不大,但低危组患儿对化疗方案更加敏感,故出现骨髓抑制、中性粒细胞缺乏概率更高,感染风险更大;而中高危组患儿在治疗中期化疗强度和频度较低危组明显加强,故出现骨髓抑制、中性粒细胞缺乏概率更高,感染风险更大。因此,在治疗早期应根据临床表现、分子遗传学等及早识别低危ALL 患儿,避免过度化疗,有助于减少感染的发生[22]。
本组病例中,共有2例患儿出现第二肿瘤,发生率为0.6%,与文献[23]报道的未经放射治疗ALL 患者的第二肿瘤发生率不超过1%相近。ALL患者合并第二肿瘤可能与疾病、药物相关免疫缺陷、病毒感染及基因异常等因素相关[23]。
综上所述,复发及感染死亡是ALL 患儿治疗失败的主要构成因素,复发部位以单纯骨髓复发为主。早期泼尼松治疗反应不佳、中高危险度是复发的危险因素。很早期复发患儿的长期生存率低,减少此类复发有助于提高长期生存率。低危患儿及中高危患儿分别在治疗早期及治疗中期更易出现严重感染,积极防治感染可降低治疗失败发生率,延长患儿生存期。
参·考·文·献
[1] Silverman LB, Stevenson KE, O'Brien JE, et al. Long-term results of Dana-Farber Cancer Institute ALL Consortium protocols for children with newly diagnosed acute lymphoblastic leukemia (1985-2000)[J]. Leukemia, 2010,24(2):320-334.
[2] Inaba H,Pui CH. Immunotherapy in pediatric acute lymphoblastic leukemia[J].Cancer Metastasis Rev,2019,38(4):595-610.
[3] Vrooman LM, Silverman LB. Treatment of childhood acute lymphoblastic leukemia: prognostic factors and clinical advances[J]. Curr Hematol Malig Rep,2016,11(5):385-394.
[4] 张之南, 沈悌. 血液病诊断及疗效标准[M]. 3 版. 北京: 科学出版社,2008.
[5] Shaffer LG, Slovak ML, Campbell LJ. ISCN 2009: an international system for human cytogenetic nomenclature[M]. Basel:Karger,2009:6-128.
[6] 李红,蒋慧,朱嘉莳,等. CCCG-ALL 2005 方案单中心10 年随访研究[J].中国小儿血液与肿瘤杂志,2020,25(2):60-64.
[7] 蔡娇阳,王宁玲,蒋慧,等. 儿童急性淋巴细胞白血病2005 方案多中心远期临床报告[J]. 中华儿科杂志,2018,56(7):511-517.
[8] 林嘉乐,刘亢亢,储金华,等. 急性淋巴细胞白血病儿童营养状况与医院感染相关性研究[J]. 中国实验血液学杂志,2020,28(3):767-774.
[9] Vora A,Goulden N,Mitchell C,et al. Augmented post-remission therapy for a minimal residual disease-defined high-risk subgroup of children and young people with clinical standard-risk and intermediate-risk acute lymphoblastic leukaemia (UKALL 2003): a randomised controlled trial[J]. Lancet Oncol,2014,15(8):809-818.
[10] Pui CH, Yang JJ, Hunger SP, et al. Childhood acute lymphoblastic leukemia: progress through collaboration[J]. J Clin Oncol, 2015, 33(27):2938-2948.
[11] Sutton R, Venn NC, Law T, et al. A risk score including microdeletions improves relapse prediction for standard and medium risk precursor B-cell acute lymphoblastic leukaemia in children[J]. Br J Haematol, 2018, 180(4):550-562.
[12] Abdelmabood S, Fouda AE, Boujettif F, et al. Treatment outcomes of children with acute lymphoblastic leukemia in a middle-income developing country:high mortalities,early relapses,and poor survival[J]. J Pediatr(Rio J),2020,96(1):108-116.
[13] Oskarsson T, Söderhäll S, Arvidson J, et al. Relapsed childhood acute lymphoblastic leukemia in the Nordic countries: prognostic factors,treatment and outcome[J]. Haematologica,2016,101(1):68-76.
[14] 张娜,沈树红,王宁玲,等. 年长儿童及青少年急性淋巴细胞白血病多中心临床研究[J]. 中华血液学杂志,2018,39(9):717-723.
[15] 蒋慧,汤静燕,张娜,等. 年长儿童急性淋巴细胞白血病多中心疗效分析[J].中华血液学杂志,2013,34(7):581-586.
[16] Nguyen K, Devidas M, Cheng SC, et al. Factors influencing survival after relapse from acute lymphoblastic leukemia: a Children's Oncology Group study[J]. Leukemia,2008,22(12):2142-2150.
[17] Hogan LE,Meyer JA,Yang J,et al. Integrated genomic analysis of relapsed childhood acute lymphoblastic leukemia reveals therapeutic strategies[J].Blood,2011,118(19):5218-5226.
[18] Hof J,Krentz S,van Schewick C,et al. Mutations and deletions of the TP53 gene predict nonresponse to treatment and poor outcome in first relapse of childhood acute lymphoblastic leukemia[J]. J Clin Oncol, 2011, 29(23):3185-3193.
[19] Inthal A, Zeitlhofer P, Zeginigg M, et al.CREBBPHAT domain mutations prevail in relapse cases of high hyperdiploid childhood acute lymphoblastic leukemia[J]. Leukemia,2012,26(8):1797-1803.
[20] Locatelli F, Schrappe M, Bernardo ME, et al. How I treat relapsed childhood acute lymphoblastic leukemia[J]. Blood, 2012, 120(14): 2807-2816.
[21] Pierro J, Hogan LE, Bhatla T, et al. New targeted therapies for relapsed pediatric acute lymphoblastic leukemia[J]. Expert Rev Anticancer Ther,2017,17(8):725-736.
[22] 王真,刘青,蒋慧,等. 儿童急性淋巴细胞白血病中性粒细胞缺乏伴发热单中心血流感染病原菌分析[J]. 中国循证儿科杂志,2019,14(3):186-190.
[23] Pui CH, Cheng C, Leung W, et al. Extended follow-up of long-term survivors of childhood acute lymphoblastic leukemia[J]. N Engl J Med,2003,349(7):640-649.

