钠钙交换体阻滞剂CB-DMB对人胶质母细胞瘤细胞生长的抑制作用
刘景景,胡慧洁,刘子楷,宋明柯
上海交通大学基础医学院药理学与化学生物学系,上海200025
胶质瘤是临床上常见的原发性中枢神经系统肿瘤,其中恶性程度较高的胶质母细胞瘤占全部胶质瘤患者的一半以上[1]。近年来,胶质母细胞瘤的手术切除、放射治疗和化学治疗(化疗)等手段取得了一些进展,但是对患者总体生存率的改善非常有限[2]。替莫唑胺(temozolomide,TMZ)是胶质瘤临床治疗的常用化疗药,但胶质母细胞瘤对TMZ 耐药严重,成为胶质瘤化疗失败的主要原因[3]。因此迫切需要开发新的治疗药物和方法。
细胞内钙离子(Ca2+)在决定细胞命运中起重要作用,在脑肿瘤研究中也受到越来越多的关注[4-7]。Na+/Ca2+交换体(Na+/Ca2+exchanger,NCX)是一种Ca2+转运蛋白,参与维持细胞内Ca2+稳态。NCX 的激活是细胞内Ca2+外排的主要途径,可保护大鼠胶质瘤C6 细胞免受化学性低氧(无糖培养基中加入寡霉素和2-脱氧-D-葡萄糖而造成的细胞缺氧环境)引起的损伤[8]。研究[9]发现NCX 阻滞剂bepridil 和KB-R7943 可引起Ca2+介导的胶质母细胞瘤细胞损伤。但是,bepridil 和KB-R7943 对NCX的选择性相对较低,它们还阻断钾离子通道和受体型离子通道[10-12]。阻滞NCX 的抗肿瘤策略在治疗胶质母细胞瘤方面具有较好的前景,仍需开发选择性更高的阻滞剂。NCX 的转运模式受细胞膜电位和膜两侧Ca2+和Na+浓度的影响。NCX 的3 种异构体均能以正向(Ca2+外排)或反向(Ca2+内流)转运模式工作。5-(N-4-氯苄基)-N-(2',4'-二甲基)氨苯蝶啶(CB-DMB)是一种选择性较高的NCX 双向转运阻滞剂[13],已被报道在纳摩尔至毫摩尔浓度范围内选择性地抑制NCX 的活动,同时其对其他离子通道转运体不起作用[14]。CB-DMB 抑制NCX 的活动会加剧由化学性低氧引起的C6 细胞损伤[8]。本研究观察CB-DMB 对胶质母细胞瘤细胞活力的影响,探究以NCX 为靶点的策略对于抑制胶质母细胞瘤的有效性,以及CB-DMB 与TMZ 联合用药对TMZ 药效的增强作用。
1 材料与方法
1.1 实验材料
1.1.1 细胞 人胶质母细胞瘤细胞系U87(货号HTB-14)购自美国模式培养物集存库(American Type Culture Collection,ATCC);胶质母细胞瘤细胞系U251(货号TCHu 58)购自中国科学院典型培养物保藏委员会细胞库;儿童胶质母细胞瘤细胞系SF188 来自上海交通大学基础医学院唐玉杰研究员和美国斯坦福大学医学院Yoon-Jae Cho教授的馈赠[15]。以上细胞系均由本实验室扩增和保存。人星形胶质细胞(货号1800)购自上海中乔新舟生物科技有限公司。
1.1.2 主要仪器 自动酶标仪(Molecular Devices,美国),Leica TCS SP8 共聚焦系统(Leica Microsystems,Wetzlar, 德国), Odyssey Fc 成像系统(LI-COR Biosciences,美国),Coulter CytoFlexS 流式细胞仪(Beckman Coulter,美国)。
1.1.3 主要试剂及材料 CB-DMB(货号C5374)购自美国Sigma Aldrich公司。YM-244769(货号4544)、SN-6(货号2184)、SEA0400 (货号6164) 购自美国Tocris Bioscience 公司。DMEM 培养基和胎牛血清(fetal bovine serum,FBS)购自美国Gibco 公司,星形胶质细胞培养基购自上海中乔新舟生物科技有限公司。Cell counting kit-8(CCK-8)和Annexin V-FITC/PI 细胞凋亡检测试剂盒购自日本Dojindo 公司。钙成像染料Fluo-4 AM 购自美国Invitrogen 公司。胞外信号调节激酶(extracellular signal regulated kinase,ERK)、磷酸化ERK(p-ERK)、c-Jun 氨基末端激酶(c-Jun N-terminal kinases,JNK)、磷酸化JNK (p-JNK)、p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38-MAPK) 和磷酸化p38-MAPK(p-p38)的一抗以及小鼠α-微管蛋白抗体均购自美国Cell Signaling Technology 公司(货号分别为4348、8544、9252、9251、9212、9211、2144)。RIPA 缓冲液购自上海碧云天生物技术有限公司。BCA 蛋白质检测试剂盒购自生工生物工程(上海)股份有限公司。聚偏二氟乙烯(polyvinylidenefluoride,PVDF)膜上购自美国Millipore 公司。IRDye 680LT 荧光二抗购自美国LICOR Biosciences公司。
1.2 实验方法
1.2.1 细胞培养 U87、U251、SF188 细胞在含有L-谷氨酰胺和10%FBS 的DMEM 培养基中进行培养。人星形胶质细胞在补充10% FBS 和星形胶质细胞生长因子的星形胶质细胞培养基中培养。细胞均置于5%CO2和饱和湿度的37 ℃恒温培养箱中培养。将NCX阻滞剂溶解在二甲基亚砜(dimethyl sulfoxide,DMSO)中制成储备液,并稀释至所需浓度。细胞培养基中DMSO 的体积分数(φ)为1/1 000,对实验体系中的细胞活力不会产生影响。研究严格参照药理学研究的相关要求和规范进行[16]。
1.2.2 细胞活力测定 收集细胞,以5×103个/孔的密度接种于96 孔培养板中,37 ℃培养过夜。设置实验组和对照组:实验组细胞用NCX 阻滞剂孵育48 h,对照组细胞用含10% FBS 的DMEM 培养基孵育48 h。每组设置5 个复孔,并进行5 次独立重复实验。另设置仅加入细胞培养基的空白孔。之后每孔加入10 μL CCK-8 溶液,37 ℃孵育30 min。使用自动酶标仪在450 nm 下测量吸光度值[D(450 nm)],根据以下公式计算细胞存活率:细胞存活率= [(D(450 nm)实验组-D(450 nm)空白]/[(D(450 nm)对照组-D(450 nm)空白)]×100%。通过GraphPad Prism 7.0 软件绘制药物量效曲线图,计算IC50。药物浓度和效应关系用公式V/V0×100%=1/{1+[C/IC50]n}进行拟合分析,获得NCX阻滞剂的IC50值,其中V0和V表示对照组和实验组的细胞活力,C 为药物浓度,n为希尔(Hill)系数。
为观察TMZ与CB-DMB联合给药对细胞生长的影响,收集U87细胞,以5×103个/孔的密度接种于96孔细胞培养板中,37 ℃培养过夜。设置单给药组和联合给药组:单给药组用TMZ(100、200、400、800、1 000 μmol/L)或CB-DMB(2.5 μmol/L)单独孵育细胞48 h;联合给药组则以TMZ(100、200、400、800、1 000 μmol/L)与CBDMB(2.5 μmol/L)共同孵育细胞48 h。细胞存活率计算方法同上。
1.2.3 钙成像实验 将细胞以8×103个/孔的密度接种在96 孔板中培养24 h 后,每孔以100 μL 含Ca2+指示剂Fluo-4 AM(终浓度5 μmol/L)的无Ca2+的4-羟乙基哌嗪乙磺酸[4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid,HEPES]缓冲液处理50 min。该缓冲液包括135 mmol/L NaCl、3 mmol/L KCl、1 mmol/L 乙二醇双(2-氨基乙基醚)四乙酸[ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA]、1 mmol/L MgCl2、10 mmol/L 葡萄糖、10 mmol/L HEPES、1% FBS,pH 值为7.4。U87 细胞与Fluo-4 AM 共孵育1 h 后,将CB-DMB 加入到含2 mmol/L Ca2+和1% FBS 的溶液中。之后将细胞培养板置于Leica TCS SP8 共聚焦显微镜下,在将NCX 阻滞剂添加到细胞孔中的同时激发动态荧光信号。在室温下进行荧光成像,进行3 次独立实验,每次实验对22~24 个细胞成像。使用LAS-AF-Lite 2.5 软件(Leica Microsystems,德国)分析成像数据。
1.2.4 Western blotting 收集以CB-DMB 孵育10、30、60和90 min的细胞,在添加蛋白酶抑制剂的RIPA 缓冲液中进行裂解。提取总蛋白,使用BCA 蛋白质检测试剂盒进行蛋白定量。取45 μg总蛋白上样,通过SDS聚丙烯酰胺凝胶电泳进行蛋白分离后将蛋白质转移至PVDF 膜上;将PVDF膜置于含5%脱脂奶粉的封闭液中室温封闭1~2 h,按照相对分子质量剪开蛋白条带,放入稀释好的一抗中孵育,置于4 ℃冰箱摇床上振荡过夜。一抗孵育结束后用TBST 洗膜3 次,用IRDye 680LT 荧光二抗于室温下孵育PVDF 膜2 h。使用Odyssey Fc成像系统进行显色曝光,测定蛋白条带灰度值,以小鼠α-微管蛋白作为蛋白内参。1.2.5 细胞凋亡测定 将U87细胞以1×106个/孔的密度接种至6 孔板中,分别用2.5 μmol/L CB-DMB、330 μmol/L TMZ 孵育细胞。分别孵育6、12、18、24、30、36、48 h后,收集细胞并用预冷PBS 洗2 次,用试剂盒提供的Annexin V 结合溶液制备1×106个/mL 的细胞悬液。取100 μL 上述细胞悬液,向其中加入5 μL Annexin V-FITC和5 μL PI工作液;室温下避光孵育15 min 后,将400 μL Annexin V 结合溶液加至每个样品中。通过Coulter CytoFlexS流式细胞仪进行细胞凋亡分析。实验重复5次。使用CyExpert 2.0 软件(Beckman Coulter,美国)分析数据。
1.3 统计学分析
采用GraphPad Prism 7.0 软件对数据进行分析。定量数据以±s表示。2组间细胞存活率的比较采用独立样本t检验,凋亡率的比较采用双因素方差分析(two-way ANOVA),2组间蛋白表达水平的比较用单因素方差分析(one-way ANOVA)。P<0.05表示差异有统计学意义。
2 结果
2.1 NCX阻滞剂对胶质母细胞瘤细胞活性的影响
U87、U251 和SF188 细胞分别与0.1、1、2、3 和5 μmol/L CB-DMB 孵育48 h,CCK-8 结果表明CB-DMB有效地抑制了各胶质母细胞瘤细胞的生长活性。在3 μmol/L CB-DMB 作用下,U87、U251 和SF188 细胞的活力约降低至对照组的10%(图1A)。通过公式拟合分析获得CB-DMB 对U87、U251 和SF188 细胞的IC50值分别为2.06、2.19 和1.82 μmol/L。U87、U251 和SF188 细胞分别与5、10、20和50 μmol/L的NCX反向转运阻滞剂共孵育48 h,发现SN-6、YM244769 和SEA0400 对胶质母细胞瘤的存活率均没有明显影响(图1B~D)。
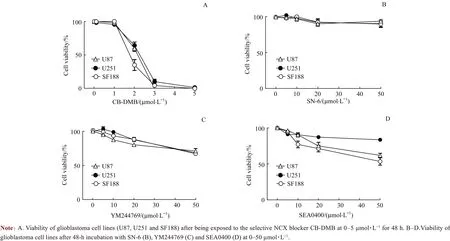
图1 4种NCX阻滞剂对胶质母细胞瘤细胞活力的影响Fig 1 Effects of four NCX blockers on the viability of glioblastoma cells
2.2 CB-DMB对胶质母细胞瘤细胞内Ca2+信号的影响
通过Ca2+成像实验探究CB-DMB对胶质母细胞瘤细胞内Ca2+水平的影响。CB-DMB(2.5 μmol/L和5 μmol/L)灌注后约60 s时,U87细胞内Ca2+信号强度显著增加(图2),说明细胞内Ca2+浓度(intracellular Ca2+concentration,[Ca2+]i)升高。
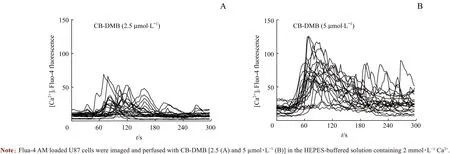
图2 CB-DMB对U87细胞内Ca2+水平的影响Fig 2 Effect of CB-DMB on intracellular Ca2+level in U87 cells
2.3 CB-DMB对胶质母细胞瘤细胞内MAPK 信号通路的影响
U87 细胞用2.5 μmol/L CB-DMB 孵育10、30、60 和90 min 后,分别检测ERK、p38-MAPK 及JNK 信号通路蛋白的激活情况。Western blotting 结果显示,U87 细胞与CB-DMB 孵育10 min 后,p-ERK 蛋白表达水平略有升高,而p-p38 蛋白和p-JNK 蛋白的表达水平显著上升,相应总蛋白的表达水平未受影响(图3)。该结果表明JNK 和p38-MAPK 信号通路被激活,可能参与了CB-DMB 诱导的细胞凋亡。
2.4 CB-DMB对胶质母细胞瘤细胞凋亡的影响
将U87 细胞用2.5 μmol/L CB-DMB 处理6、12、18、24、36 和48 h,发现凋亡细胞(Annexin V+)的比例随时间延长而增加(图4A)。以330 μmol/L TMZ作为对照,在相同的时间点测定U87 细胞凋亡情况,结果显示,由CB-DMB 引起的细胞凋亡速度较TMZ 更快(P=0.002,图4B)。
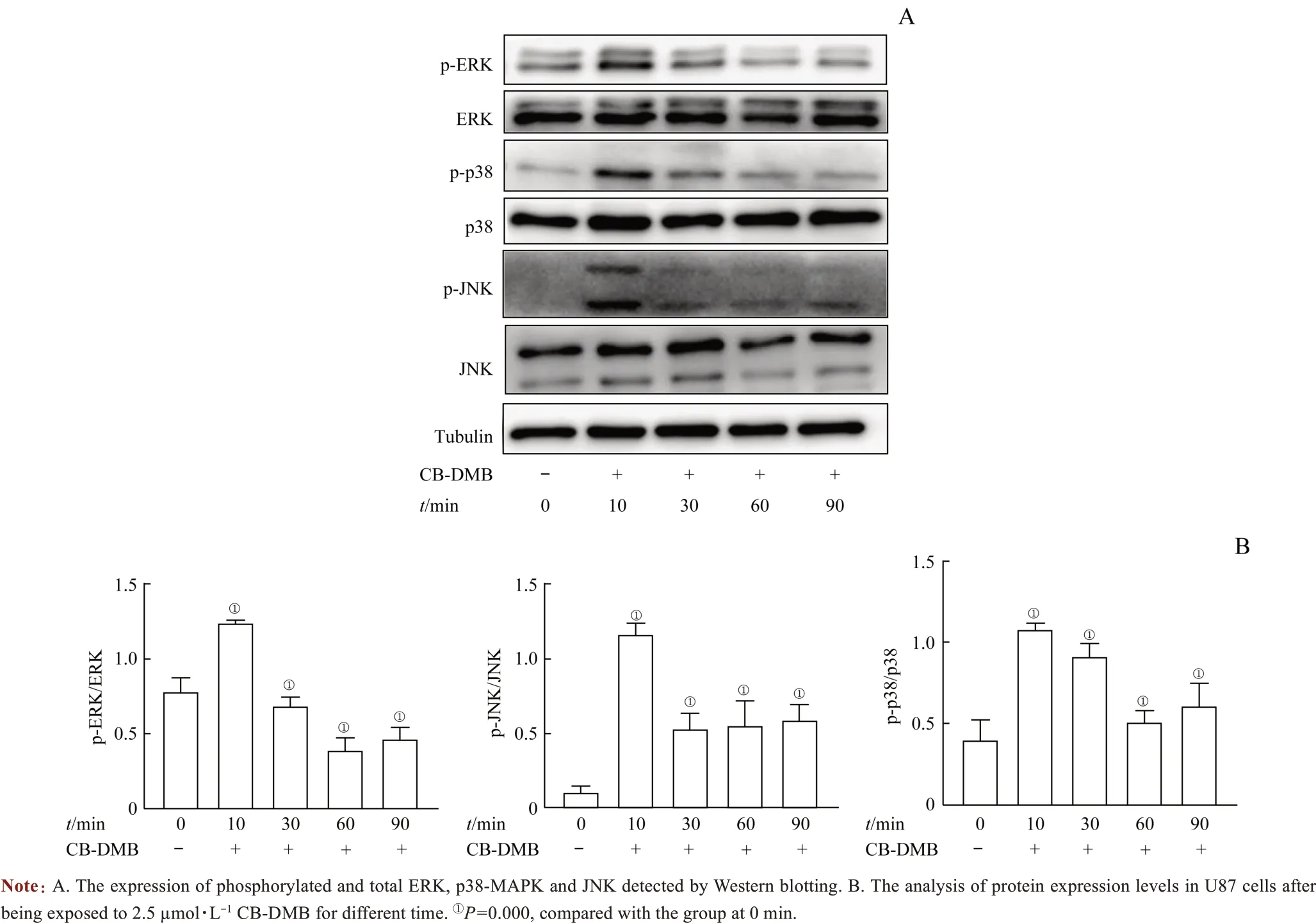
图3 CB-DMB对胶质母细胞瘤细胞MAPK信号通路的影响Fig 3 Effect of CB-DMB on MAPK signaling in U87 cells
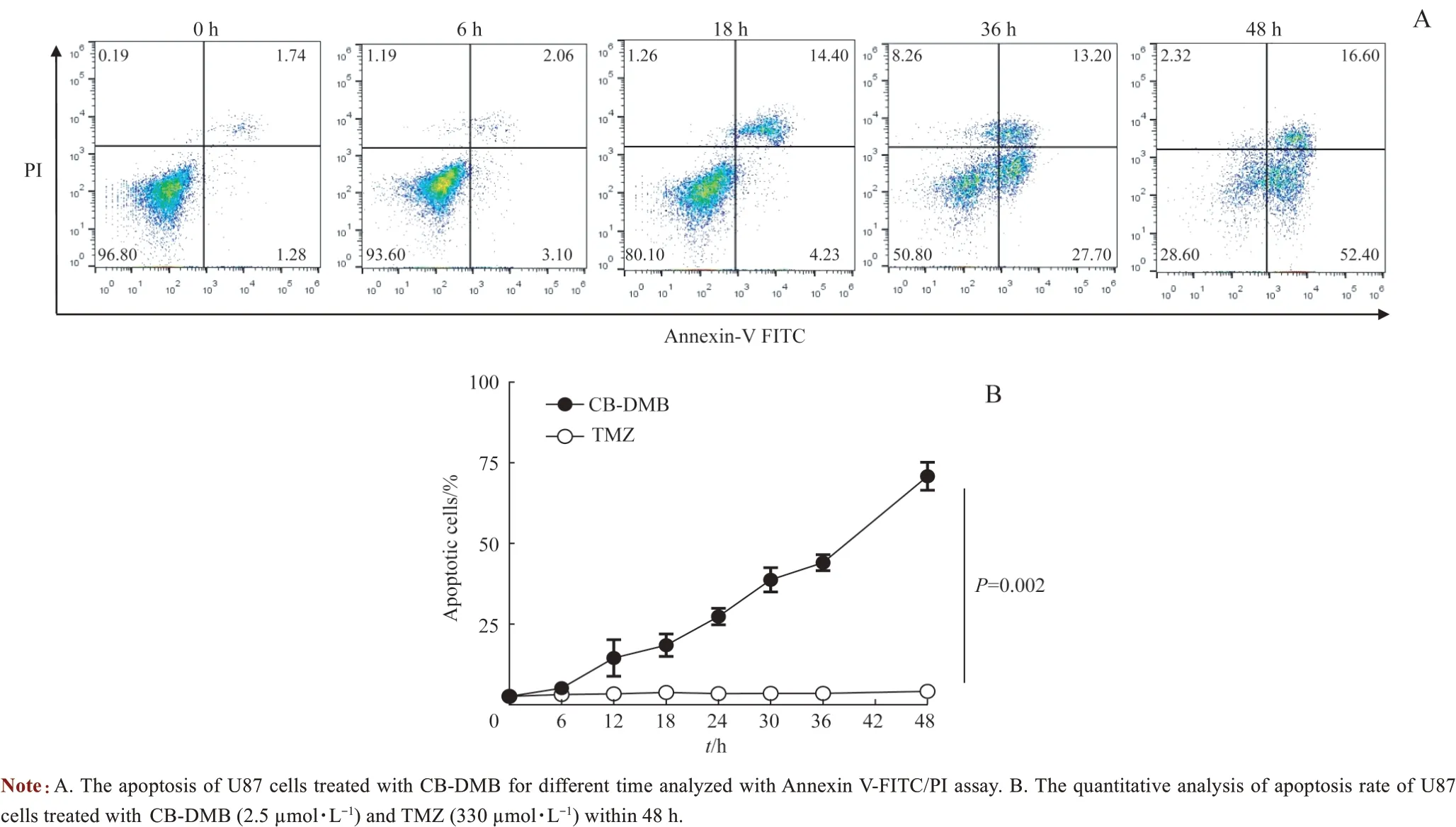
图4 CB-DMB对胶质母细胞瘤细胞的快速杀伤作用Fig 4 Rapid killing effect of CB-DMB on glioblastoma cells
2.5 CB-DMB 联合TMZ 对胶质母细胞瘤细胞的生长抑制作用
以100、200、400、800、1 000 μmol/L TMZ 对U87、U251 和SF188 细胞分别处理48 h,发现TMZ 对细胞的生长抑制作用呈浓度依赖性。经过估算,TMZ 对U87、U251 和SF188 细胞的IC50值分别约为801.6、907.4 和331.2 μmol/L。TMZ 与CB-DMB(2.5 μmol/L)联合给药后,发现TMZ 对细胞生长的抑制作用大大增强,TMZ 对U87、U251 和SF188 细胞的IC50值分别降至约171.5、450.0 和110.0 μmol/L(图5A~C)。进一步确认CB-DMB对正常人星形胶质细胞是否有毒性,发现与CB-DMB(3.5 μmol/L)孵育48 h 后星形胶质细胞的存活率降低至对照组的76%,而胶质母细胞瘤细胞(U87、U251 和SF188)的活性则降低至对照组的10%以下(图5D)。
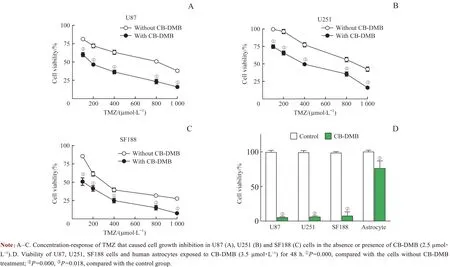
图5 CB-DMB对TMZ细胞毒性的增强作用以及CB-DMB对星形胶质细胞活力的影响Fig 5 Enhancement of cytotoxicity of CB-DMB to TMZ and effect of CB-DMB on the viability of human astrocytes
3 讨论
胶质瘤是中枢神经系统中常见的原发性恶性肿瘤,大多数胶质瘤患者在诊断15~18个月后死亡,高级别胶质瘤目前仍属于难以治愈的疾病[17-18]。寻找有效的治疗胶质瘤的方法仍是当前急需解决的问题。细胞内Ca2+的积累是引起缺血/缺氧细胞死亡的关键步骤。细胞内升高的Ca2+浓度对肿瘤细胞也可能是致命的。NCX 是一种双向离子转运体,可在正向(Ca2+外排)和反向(Ca2+内流)2 种模式下工作。阻断NCX 的正向模式或激活NCX 的反向模式可引起胞内Ca2+超载。既往关于NCX 及其阻滞剂的研究主要集中在脑[19-20]和心肌[21-22]等组织缺氧损伤疾病中,以及探讨NCX 在神经保护方面的价值;但有关NCX 在胶质母细胞瘤进展中的作用的研究较少,更鲜有研究者从Ca2+介导细胞损伤的角度探讨NCX 抑制对胶质母细胞瘤生长的杀伤作用。
CB-DMB 是一种对NCX 选择性较高的阻滞剂,可以阻断NCX 的2 种工作模式。本研究发现CB-DMB 对胶质母细胞瘤细胞的体外生长有明显的抑制作用,且对正常星形胶质细胞的活力影响较小。为了确定NCX 的哪种阻滞模式介导了CB-DMB对胶质母细胞瘤细胞的抑制作用,我们选择了3 种选择性抑制NCX 反向转运模式的阻滞剂——SN-6、YM244769和SEA0400作为对照。这3种化合物可在微摩尔浓度范围内选择性地阻断NCX 的反向转运模式,但对NCX 正向转运模式不起作用[23-26]。本研究结果发现:即便把这3 种NCX 反向转运阻滞剂的浓度(50 μmol/L)提高到CB-DMB 的10 倍,它们对胶质母细胞瘤细胞的杀伤作用也不明显,推测阻断NCX的反向转运模式可能不会引起胶质母细胞瘤细胞的显著凋亡;但低浓度(2.5 μmol/L)NCX双向模式阻滞剂CB-DMB即可引起胶质母细胞瘤细胞的快速凋亡,推测CB-DMB 可能是通过阻断NCX 的正向转运模式来杀伤胶质母细胞瘤细胞。钙成像实验进一步证实,CB-DMB 通过阻滞NCX 的正向转运模式(Ca2+外排)提高了细胞内Ca2+的水平,推测CB-DMB 对胶质母细胞瘤的生长抑制和凋亡诱导作用很可能是由胞内Ca2+浓度升高介导的。
已知细胞内Ca2+的增加可能直接或间接引起MAPK信号通路的激活[27]。本研究发现CB-DMB 可导致胶质母细胞瘤细胞内p38-MAPK 和JNK 信号通路被激活。p38-MAPK和JNK信号的持续活化是诱导细胞凋亡的常见分子机制。CB-DMB(2.5 μmol/L)作用6~48 h 导致胶质母细胞瘤细胞凋亡的比例迅速增加,然而TMZ(330 μmol/L)未引起肿瘤细胞明显的凋亡反应。与TMZ 较缓慢的抗肿瘤作用相比,选择性阻滞NCX 的正向转运模式会诱导细胞更快地凋亡;且CB-DMB 与TMZ 合用能增强TMZ 对胶质母细胞瘤的生长抑制作用。由于胶质瘤对TMZ 耐药的机制较复杂,有关CB-DMB 提高TMZ 敏感性的分子机制还需深入研究。
综上,CB-DMB 对NCX 的选择性阻滞作用导致胶质母细胞瘤细胞快速凋亡,并且增强了TMZ 对胶质母细胞瘤细胞的生长抑制作用。细胞膜NCX 可能是治疗胶质母细胞瘤的有价值靶标,而NCX 阻滞剂CB-DMB 可用作研发这一治疗策略的先导化合物。
参·考·文·献
[1] Carter JH, McNulty SN, Cimino PJ, et al. Targeted next-generation sequencing in molecular subtyping of lower-grade diffuse gliomas:application of the World Health Organization's 2016 revised criteria for central nervous system tumors[J]. J Mol Diagn,2017,19(2):328-337.
[2] Pessina F, Navarria P, Cozzi L, et al. Value of surgical resection in patients with newly diagnosed grade Ⅲglioma treated in a multimodal approach:surgery, chemotherapy and radiotherapy[J]. Ann Surg Oncol, 2016, 23(9):3040-3046.
[3] Yamashiro K, Nakao K, Ohba S, et al. Human glioma cells acquire temozolomide resistance after repeated drug exposureviaDNA mismatch repair dysfunction[J]. Anticancer Res,2020,40(3):1315-1323.
[4] Yamamura M, Amano Y, Sakagami H, et al. Calcium mobilization during nicotine-induced cell death in human glioma and glioblastoma cell lines[J].Anticancer Res,1998,18(4A):2499-2502.
[5] Robil N, Petel F, Kilhoffer MC, et al. Glioblastoma and calcium signaling:analysis of calcium toolbox expression[J]. Int J Dev Biol, 2015, 59(7/8/9):407-415.
[6] Zhang Y, Cruickshanks N,Yuan F, et al. Targetable T-type calcium channels drive glioblastoma[J]. Cancer Res,2017,77(13):3479-3490.
[7] Song M, Chen D, Yu SP. The TRPC channel blocker SKF 96365 inhibits glioblastoma cell growth by enhancing reverse mode of the Na+/Ca2+exchanger and increasing intracellular Ca2+[J]. Br J Pharmacol,2014,171(14):3432-3447.
[8] Amoroso S, de Maio M, Russo GM, et al. Pharmacological evidence that the activation of the Na+-Ca2+exchanger protects C6 glioma cells during chemical hypoxia[J]. Br J Pharmacol,1997,121(2):303-309.
[9] Hu HJ, Wang SS, Wang YX, et al. Blockade of the forward Na+/Ca2+exchanger suppresses the growth of glioblastoma cells through Ca2+-mediated cell death[J]. Br J Pharmacol,2019,176(15):2691-2707.
[10] Abrunhosa-Branquinho AN, Bar-Deroma R, Collette S, et al. Radiotherapy quality assurance for the RTOG 0834/EORTC 26053-22054/NCIC CTG CEC.1/CATNON intergroup trial concurrent and adjuvant temozolomide chemotherapy in newly diagnosed non-1p/19q deleted anaplastic glioma :individual case review analysis[J]. Radiother Oncol,2018,127(2):292-298.
[11] Watanabe Y, Kimura J. Blocking effect of bepridil on Na+/Ca2+exchange current in Guinea pig cardiac ventricular myocytes[J]. Jpn J Pharmacol,2001,85(4):370-375.
[12] Cheng H,Zhang Y,Du C,et al. High potency inhibition of hERG potassium channels by the sodium-calcium exchange inhibitor KB-R7943[J]. Br J Pharmacol,2012,165(7):2260-2273.
[13] Secondo A, Pannaccione A, Molinaro P, et al. Molecular pharmacology of the amiloride analog 3-amino-6-chloro-5-[(4-chloro-benzyl)amino]-n-[[(2,4-dimethylbenzyl)-amino]iminomethyl]-pyrazinecarboxamide (CB-DMB) as a pan inhibitor of the Na+-Ca2+exchanger isoforms NCX1, NCX2, and NCX3 in stably transfected cells[J]. J Pharmacol Exp Ther,2009,331(1):212-221.
[14] Zhao YT, Valdivia CR, Gurrola GB, et al. Arrhythmogenesis in a catecholaminergic polymorphic ventricular tachycardia mutation that depresses ryanodine receptor function[J]. Proc Natl Acad Sci USA, 2015,112(13):E1669-E1677.
[15] Bender S, Tang YJ, Lindroth AM, et al. Reduced H3K27me3 and DNA hypomethylation are major drivers of gene expression in K27M mutant pediatric high-grade gliomas[J]. Cancer Cell,2013,24(5):660-672.
[16] Tveden-Nyborg P, Bergmann TK, Lykkesfeldt J. Basic & clinical pharmacology & toxicology policy for experimental and clinical studies[J].Basic Clin Pharmacol Toxicol,2018,123(3):233-235.
[17] 程哲,汪潮潮,吴娟,等. BFAR在胶质瘤中的表达及其与胶质瘤预后的关系[J]. 医学信息,2021,34(7):78-81.
[18] Li JH, Li SY, Shen MX, et al. Anti-tumor effects ofSolanum nigrumL.extraction on C6 high-grade glioma[J]. J Ethnopharmacol, 2021, 274:114034.
[19] Li LL, Sun LN, Zhou HY, et al. Selective alteration of expression of Na+/Ca2+exchanger isoforms after transient focal cerebral ischemia in rats[J].Neurosci Lett,2006,404(3):249-253.
[20] Tomimoto H, Yanagihara T. Immunoelectron microscopic study of tubulin and microtubule-associated proteins after transient cerebral ischemia in gerbils[J]. Acta Neuropathol,1992,84(4):394-399.
[21] Zhang B, Liu B, Roos CM, et al. TRPC6and TRPC4heteromultimerization mediates store depletion-activated NCX1 reversal in proliferative vascular smooth muscle cells[J]. Channels(Austin),2018,12(1):119-125.
[22] Zhang J. New insights into the contribution of arterial NCX to the regulation of myogenic tone and blood pressure[J]. Adv Exp Med Biol,2013,961:329-343.
[23] Pignataro G, Gala R, Cuomo O, et al. Two sodium/calcium exchanger gene products, NCX1 and NCX3, play a major role in the development of permanent focal cerebral ischemia[J]. Stroke,2004,35(11):2566-2570.
[24] Hu HJ, Song M. Disrupted ionic homeostasis in ischemic stroke and new therapeutic targets[J]. J Stroke Cerebrovasc Dis,2017,26(12):2706-2719.
[25] Goto Y, Ogata M, Kita S, et al. YM-244769, a novel Na+/Ca2+exchange inhibitor, efficiently improves ischemia/reperfusion-induced renal injury[J].Biophys J,2012,102(3):662a-663a.
[26] Watanabe Y, Koide Y, Kimura J. Topics on the Na+/Ca2+exchanger:pharmacological characterization of Na+/Ca2+exchanger inhibitors[J].J Pharmacol Sci,2006,102(1):7-16.
[27] White CD, Sacks DB. Regulation of MAP kinase signaling by calcium[J].Methods Mol Biol,2010,661:151-165.

