钙磷涂层的JDBM 镁合金多孔支架促进血管新生及骨缺损修复的效果评估
王 青,王 伟,姜达君,贾伟涛
上海交通大学附属第六人民医院骨科,上海200233
随着经济社会的快速发展,由高能量损伤、骨肿瘤切除、人工关节周围骨溶解等引起的骨缺损患者越来越多。而大块骨缺损常造成骨折延迟愈合或不愈合,最终导致肢体功能障碍,严重影响患者生活质量。目前骨缺损的治疗以植骨术为主,植骨来源包括自体骨、异体骨及人工骨等。在临床上,自体骨移植是修复骨缺损的“金标准”,但自体骨移植来源有限。异体骨虽然来源较广,但易导致免疫排斥反应并有疾病传播等风险,因而应用受限[1-3]。随着组织工程学的发展,可降解并且可塑性大的人工生物修复材料越来越受到临床医师的关注。组织工程支架植入体内之后的成骨效果取决于移植物早期血管化的程度,新生血管除了可以为成骨活动提供各种必需的营养物质外,还在骨与邻近组织器官相互作用中发挥不可或缺的作用[4]。在骨生长过程中,内皮细胞侵入生长板区域的软骨,形成营养供应的血管通道,并作为新骨的支架促进生长[5];而在骨重塑过程中,毛细血管进一步促进成骨和破骨活动,加速骨重塑[6]。但目前常见的组织工程支架在物质传递交换方面仍然受到很大的限制[7-9],新生血管主要集中在支架周围,而在支架内部缺失,使得营养物质与氧气难以运输到支架内部,从而导致支架内部的细胞难以生长、迁移和扩增,出现支架内部空化区或坏死区[10]。
近些年镁合金作为一种新型可植入性生物材料,具有良好的生物相容性、机械性能、生物降解性而开始广泛用于骨外科材料的研发[11]。镁是一种活泼金属,质量很轻,密度在1.74~2.00 g/cm3,与人体骨密度(1.80~2.10 g/cm3)较为接近[12],并且镁的弹性模量较小(41~45 GPa),相比于钛合金(110~117 GPa) 更接近人骨(3~20 GPa),可以有效降低应力遮挡,在骨折愈合期间提供稳定的力学环境[13]。此外,镁在人体内存在吸收和排泄的动态平衡,生物安全性较高[14]。近年来JDBM(Mg-Nd-Zn-Zr)镁合金系列生物材料被广泛研究。本课题组前期研究[15-17]结果表明,该合金生物相容性较好,具备优良的强度和延展性以及独特的均匀降解行为,同时具备良好的成骨功能。在JDBM 合金表面复合可生物降解的钙磷(CaHPO4·2H2O,DCPD)涂层,提高生物相容性和生物安全性的同时,还具备优良的诱导成骨以及成血管能力,可以进一步地促进骨与血管再生;此外,通过调整DCPD涂层厚度,可以控制其降解速度[17-20]。
血管化是骨组织工程支架实现骨修复的一个关键环节。随着近些年来成血管与成骨的双向反馈作用被揭示,组织工程支架血管化也成为了研究人员关注的重点内容。因此,本课题组在前期研究[21]JDBM-DCPD 直接成骨分化的基础上,进一步探索JDBM-DCPD 支架的体内外成血管能力。本研究中,将覆有MgF2涂层的JDBM(JDBM-MgF2)支架作为参照,体外评估JDBM-DCPD 对内皮细胞成血管能力的影响,并通过大鼠股骨髁临界性骨缺损模型研究JDBM-DCPD 多孔支架植入骨缺损区域后支架内部新生血管长入和成骨情况,为今后多孔JDBM镁合金支架的研发应用开拓思路、奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器 磷酸盐缓冲液(PBS),α-MEM、DMEM 细胞培养基(美国Hyclone);胎牛血清(FBS,以色列BI);青霉素-链霉素双抗、0.25%胰蛋白酶消化液(美国Gibco);碱性磷酸酶(alkaline phosphatase,ALP)细胞染色试剂盒(中国Beyotime);2%茜素红(ARS)染料(中国Cyagen);血管造影剂Microfil(MV-122,美国Flow Tech Inc);CD31 抗体(货号ab24590)、骨钙素(osteocalcin, OCN) 抗体(货号ab13420)(英国Abcam);Transwell 小室(美国Corning);血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体、Alexa Fluor484 荧光染料(美国Proteintech);罗丹明标记的鬼笔环肽(美国Sigma);细胞核荧光染料DAPI(中国Solarbio);CCK-8 试剂盒(日本Dojindo);Matrigel 胶(美国Corning)。
倒置光学显微镜(DMi3000B,德国Leica),扫描电子 显 微 镜 (scanning electron microscope, SEM,SIGMA500,德国Zeiss),数字X 线摄影系统(Digital Diagnost C50,荷兰Philips),小动物活体CT 成像系统(Skyscan 1176 Micro-CT,德国Bruker),单轴试验机(AG-100 kN,德国Zwick),火花等离子烧结系统(HPW100/150-220-50,德国FCT)
1.1.2 实验细胞 骨髓干细胞(bone marrow stem cell,BMSC)取自鼠龄6 周、体质量为160~200 g 的雄性SD 大鼠。原代细胞用α-MEM 完全培养基(α-MEM 培养基+10%FBS+1%青霉素-链霉素双抗)在37 ℃、5%CO2的培养箱中培养;2 d 后,半量更换培养基,镜下观察细胞形态,之后至少每3 d 更换一次培养基。当细胞生长至覆盖培养皿底部80%~90%时用胰酶消化传代,取第3~5 代细胞用于细胞实验。内皮细胞系Ea.hy926 细胞购自中国科学院上海细胞库,细胞用完全培养基(DMEM+10%FBS+1%青霉素-链霉素双抗)在37 ℃、5%CO2的培养箱中培养。
1.1.3 实验动物 SPF 级雄性6 周龄(160~200 g,用于提取原代BMSC)和8 周龄(250~300 g,用于动物实验)SD 大鼠购自上海市计划生育科学研究所实验动物经营部,生产许可证号为SCXK(沪)2018-0006。SD 大鼠饲养于上海交通大学附属第六人民医院SPF 级动物房,使用许可证号为SYXK(沪)2016-0020。
1.2 实验方法
1.2.1 JDBM 多孔支架的制备以及结构表征、力学特征的测定 JDBM 支架的制备采用模板复制法[21],通过火花等离子烧结系统将直径400~450 μm 的球形纯钛颗粒烧结成多孔模板,将浸渗铸造后的胚体浸在40%氢氟酸溶液中溶解模板,同时形成MgF2涂层。制备60 g/L NaNO3、15 g/L CaHPO4·2H2O 和0.8 mol/L H2O2的混合溶液,采用化学沉积的方法在多孔支架的表面形成DCPD 涂层。在先前的研究[21]中,DCPD 沉积时间为24 h,结果发现在培养基中浸泡7 d 后出现了支架破碎;为了进一步提高支架在培养基中的稳定性,本研究将DCPD 的沉积时间延长至48 h。采用SEM 观察支架的多孔结构和涂层的表面形貌。通过Micro-CT 重建大小为Φ10 mm×2 mm(表示直径10 mm,高度2 mm)的JDBM-DCPD 和JDBM-MgF2三维图像并计算支架的孔隙率,实验重复3次。用单轴试验机对支架的力学性能进行测试。细胞实验材料尺寸为Φ10 mm×2 mm,大鼠骨缺损模型中材料尺寸为Φ3 mm×5 mm。
1.2.2 JDBM-DCPD 支架表面细胞的黏附与增殖 将约含5×104个细胞的1 mL BMSC 悬液分别接种到JDBMMgF2和JDBM-DCPD 支架上。培养7 d 后,利用SEM 对多孔支架表面的细胞进行观察。同时,对支架表面培养的细胞通过CCK8试剂盒检测细胞的活力。
1.2.3 支架浸提液作用下内皮细胞迁移实验 首先将尺寸为Φ10 mm×2 mm 的JDBM-MgF2和JDBM-DCPD 2 组支架放入75%乙醇中消毒30 min。然后,将每组多孔支架按照3 mL/个浸泡在DMEM 培养基中,并置于37 ℃恒温培养箱中。3 d 后收集每组条件培养基,经0.22 μm微孔滤膜过滤后得到支架浸提液,保存于4 ℃冰箱备用。
将约含1×105个Ea.hy926 细胞的悬液100 μL 接种于24 孔Transwell 小室的上室,然后将600 μL 不同涂层的JDBM 支架浸提液加到Transwell 小室的下室中,普通DMEM 培养基作为阴性对照。孵育24 h 后,将上室轻轻移开,并用棉签将膜的上表面细胞尽量拭去。然后用4%多聚甲醛将迁移至膜下表面的细胞固定,0.5%结晶紫染色10 min 后用光学显微镜观察拍照,并使用Image-J 软件进行定量分析[22]。
1.2.4 支架浸提液作用下内皮细胞成管实验 制备JDBM-MgF2和JDBM-DCPD 的支架浸提液,方法同前。在24 孔板中加入Matrigel 胶100 μL/孔,37 ℃温箱孵育30 min,然后在每孔中加入约含6×104个Ea.hy926 细胞的浸提液继续培养,普通DMEM 培养基作为阴性对照,分别于培养3 h 和6 h 时在光学显微镜下观察内皮细胞体外成管情况,并使用Image-J软件进行定量分析。
1.2.5 支架浸提液作用下内皮细胞VEGF 分泌情况 制备JDBM-MgF2和JDBM-DCPD的支架浸提液,方法同前。将Ea.hy926 细胞以2×104/mL 的密度接种在24 孔板中,加入JDBM-MgF2和JDBM-DCPD 的支架浸提液培养3 d,普通DMEM 培养基作为阴性对照。然后将细胞在室温下用4%多聚甲醛固定15 min,并与VEGF 抗体(1∶200)在4 ℃孵育过夜,之后用Alexa Fluor488 标记的二抗(1∶200)孵育1 h,最后分别用罗丹明标记的鬼笔环肽(1∶200)和DAPI(1∶200)处理40 min 和10 min。利用荧光显微镜观察细胞中VEGF的表达情况。
1.2.6 支架浸提液作用下BMSC 成骨分化实验 制备JDBM-MgF2和JDBM-DCPD 的支架浸提液,方法同前。将BMSC 按1×104/孔接种于24 孔板中,分别用JDBMMgF2和JDBM-DCPD 2 组支架浸提液培养,普通培养基作为阴性对照,在37 ℃细胞培养箱中分别培养7 d 和14 d。根据试剂盒说明书进行ALP 染色和茜素红染色。实验操作重复3次。
1.2.7 大鼠股骨髁临界性骨缺损模型制备及支架的植入 本动物实验按照上海交通大学附属第六人民医院动物伦理委员会动物实验的规定,经批准后进行。用体质量为250~300 g 的雄性SD 大鼠建立股骨髁临界性骨缺损模型,16 只大鼠随机分为JDBM-MgF2组和JDBM-DCPD组,每组8 只。采用0.5%戊巴比妥钠溶液(9 mL/kg)经腹腔注射诱导麻醉成功后,在大鼠双侧股骨髁的内侧分别行1.5 cm 长纵行切口,暴露内侧髁,使用牙科高速环钻制造直径3 mm、深度5 mm 的骨缺损模型。然后按分组情况将支架材料植入骨缺损区域,再逐层缝合肌肉和皮肤,肌肉注射青霉素预防感染。
1.2.8 影像学检查 术后8 周,每组取4 只进行血管灌注。采用0.5%戊巴比妥钠溶液(9 mL/kg)经腹腔注射诱导麻醉成功后,打开胸腔,将含有肝素钠的生理盐水溶液沿左心室注入,同时剪开右心耳,待右心耳流出澄清生理盐水后,使用20 mL 的Microfil 灌注液灌注血管,待双下肢皮肤变黄表示灌注成功,丝线结扎腹主动脉。然后将死亡的大鼠标记后置于4 ℃冰箱过夜血管塑化。次日将大鼠股骨髁标本取下并放入10%中性甲醛固定液中固定48 h以上,最后将标本在10%EDTA 脱钙溶液中持续脱钙4 周。脱钙成功的样本放在Micro-CT 卡槽并固定,设置分辨率为9 μm 进行扫描,使用配套软件重建缺损区血管三维影像。
另外,术后8 周,对每组余下4 只SD 大鼠使用过量的0.5%戊巴比妥钠溶液处死,股骨髁部位首先采用X 射线观察缺损区修复情况,然后将股骨髁标本取下并在10%中性甲醛固定液中固定48 h,固定后的标本再使用micro-CT(18 μm分辨率)扫描并重建三维影像观察缺损修复以及支架降解情况
1.2.9 缺损区的组织学观察 将未经Microfil灌注的股骨髁标本经Micro-CT 扫描后分组标记并在10%EDTA 溶液中脱钙4 周,梯度乙醇脱水,石蜡包埋,切片厚度4 μm。通过苏木精-伊红(hematoxylin-eosin,H-E)染色和免疫组织化学(immunohistochemistry,IHC)染色(OCN 和CD31)评估成骨和血管生成情况[23]。
1.3 统计学分析
2 结果
2.1 JDBM-DCPD多孔支架的表征
从JDBM-MgF2和JDBM-DCPD 2 组支架的三维重建影像可以看到支架具有多孔互连结构(图1A)。低倍SEM下可看到多孔互连结构高度规则,2组支架的球形主孔径在400~450 μm,主孔之间有8~11 个大小不等的小孔相互连接;并且在高倍SEM 镜下观察到MgF2涂层表面光滑,而DCPD涂层表面粗糙,在DCPD涂层支架中,钙磷颗粒均匀分布在孔壁上,大小为15~25 μm(图1B)。通过micro-CT 扫描及相关软件计算JDBM-MgF2支架的孔隙率为(79.40±0.62)%,而JDBM-DCPD 支架的孔隙率为(69.79±0.40)% (图1C),2 组间差异具有统计学意义(P=0.000)。JDBM-MgF2的弹性模量为(0.34±0.07)GPa,屈服强度(5.05±0.30)MPa;JDBM-DCPD 的弹性模量为(0.41±0.09)GPa,屈服强度(6.92±0.17)MPa。2组间支架的弹性模量及屈服强度的差异均具有统计学意义(均P=0.000)。
2.2 JDBM-DCPD支架的生物相容性
本研究中,支架在培养基中浸泡7 d 后仍然结构完整,可见DCPD 沉积48 h 相较24 h 可以提高支架在溶液中的稳定性。如图2A 所示,细胞接种于支架上7 d 后,CCK-8试剂盒检测结果显示,JDBM-DCPD组D(450 nm)值显著高于JDBM-MgF2组(P=0.000)。SEM 观察发现,在MgF2涂层的支架表面仅有少量舒展以及较多死亡的BMSC;而在DCPD 涂层的支架上培养的BMSC具有良好的舒展状态,基本完全覆盖孔壁表面(图2B)。

图2 JDBM-DCPD与JDBM-MgF2支架生物相容性的比较Fig 2 Comparison of JDBM-DCPD and JDBM-MgF2 in biocompatibility
2.3 JDBM-DCPD浸提液在体外对内皮细胞成管的影响
Transwell 内皮细胞迁移实验结果显示,Ea.hy926 细胞在含有2种不同涂层的JDBM 支架浸提液中的迁移能力均好于对照组,而在JDBM-DCPD 浸提液中的迁移能力又强于其在JDBM-MgF2浸提液中的迁移能力(图3A、B)。不同涂层的JDBM 浸提液作用下的Ea.hy926 细胞成管实验结果显示:在3 h和6 h这2个时间点,Ea.hy926细胞在含不同涂层JDBM 浸提液中的成管能力(伸展的管状结构)要好于其在普通培养液中的成管能力(不完全的和零星的管状结构);而与JDBM-MgF2浸提液相比,JDBM-DCPD浸提液作用下的Ea.hy926细胞形成完整伸展的管状结构的数量更多,证明相较于JDBM-MgF2,JDBM-DCPD 浸提液促内皮细胞的成管能力更强(图3C、D)。
此外,免疫荧光成像进一步证实了不同涂层的JDBM支架组和对照组Ea.hy926 细胞均有VEGF 的表达(图4A)。荧光半定量分析显示,在含有JDBM 涂层浸提液2个组中Ea.hy926 细胞的VEGF 水平表达均高于对照组,而JDBM-DCPD 组的VEGF 表达量又高于JDBM-MgF2组(图4B),而且从细胞骨架(肌动蛋白)染色中可以看到3 组内皮细胞形态相似。上述结果表明JDBM-DCPD 在体外具有良好促内皮细胞成血管能力,而支架的浸提液对内皮细胞没有明显细胞毒性。
2.4 JDBM-DCPD对BMSC成骨分化的影响
图5A 显示BMSC 中ALP 的表达量随着培养时间的延长而增多,在7 d 和14 d 两个时间点JDBM-DCPD 组ALP染色最深,而对照组只有少量的ALP 表达。同时,茜素红染色结果也显示,BMSC培养14 d后JDBM-DCPD组矿化水平更高,有更多的钙结节被染成红色(图5B)。
2.5 影像学分析JDBM-DCPD 支架对大鼠骨缺损模型新骨再生的作用以及支架在体内的降解情况
建模后,大鼠均未出现感染或死亡等并发症。X射线检查(图6A)观察到JDBM-DCPD组缺损区呈高密度影,而JDBM-MgF2组缺损区的密度较周围宿主骨明显降低,这一结果说明JDBM-DCPD 组骨缺损区有更多的新骨再生。三维重建影像显示,JDBM-DCPD支架表面被大量新骨覆盖,而在JDBM-MgF2组仍可观察到支架的轮廓;矢状面影像中观察到JDBM-DCPD 组显示出良好的界面结合,而JDBM-MgF2组骨界面有部分空腔形成(图6B)。
Microfil 血管灌注检测观察到JDBM-DCPD 组的骨缺损区较JDBM-MgF2组有更多、更密集的血管网形成(图6C),良好的血管网有利于营养物质的运输从而有效地促进缺损区骨组织的再生。通过micro-CT扫描计算,术后8周JDBM-MgF2组支架降解了(23.95±2.74)% , 而JDBM-DCPD组支架降解了(14.53±2.23)%,2组间差异具有统计学意义(P=0.000)。
2.6 免疫组织化学染色分析大鼠骨缺损区新血管和新骨的形成
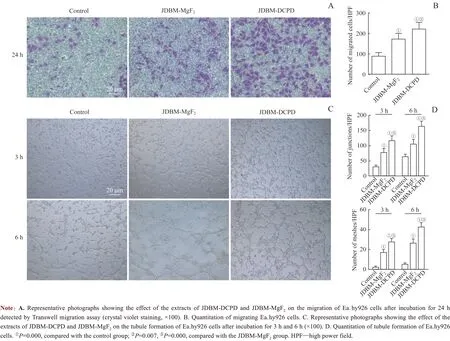
图3 JDBM-DCPD与JDBM-MgF2支架浸提液对Ea.hy926细胞迁移能力和成管情况影响的比较Fig 3 Comparison of the effects of JDBM-DCPD and JDBM-MgF2 scaffold extracts on Ea.hy926 cell migration and tube formation
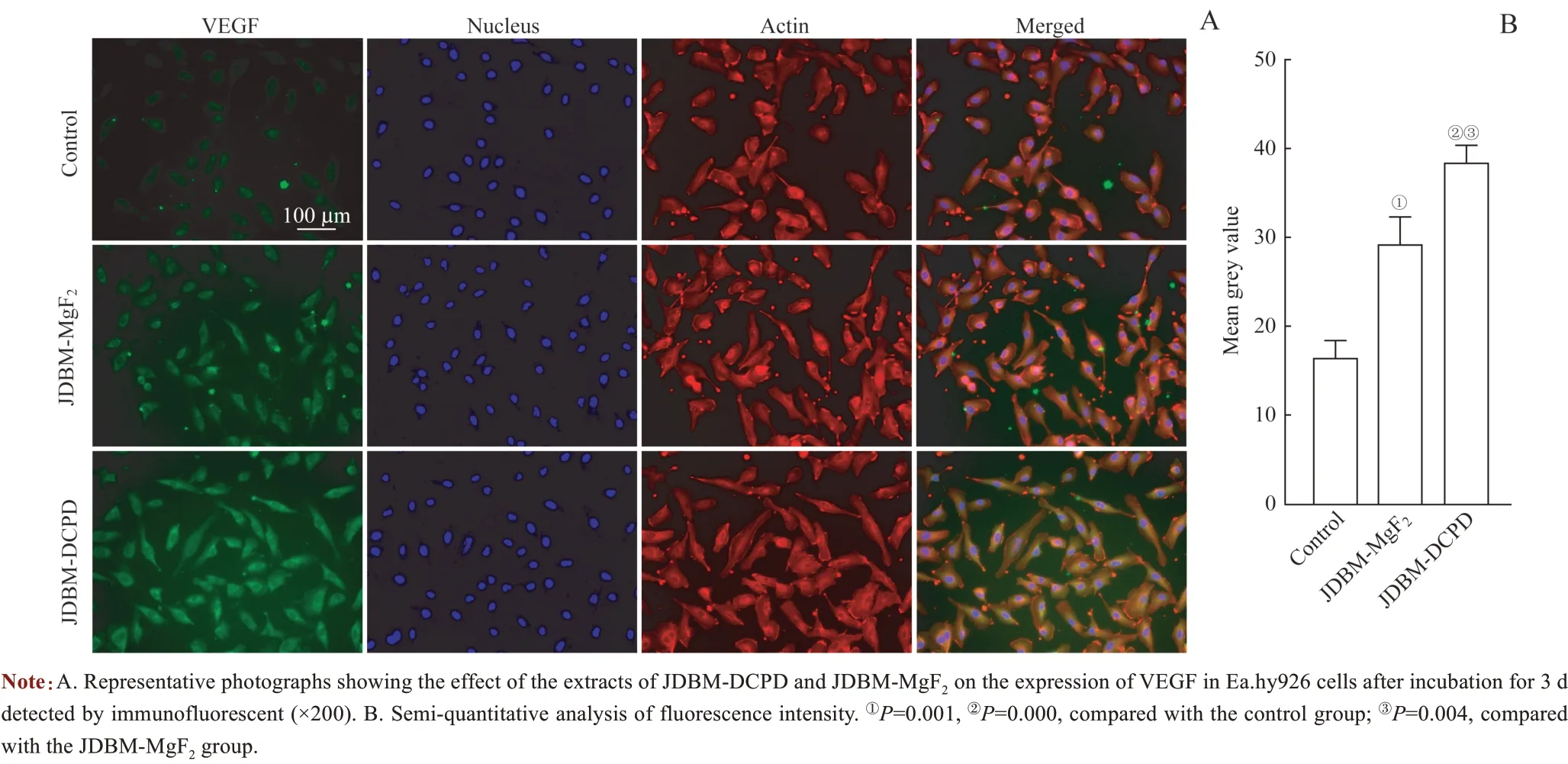
图4 JDBM-DCPD与JDBM-MgF2支架浸提液对Ea.hy926细胞VEGF表达水平影响的比较Fig 4 Comparison of the effects of JDBM-DCPD and JDBM-MgF2 scaffold extracts on the expression of VEGF in Ea.hy926 cells
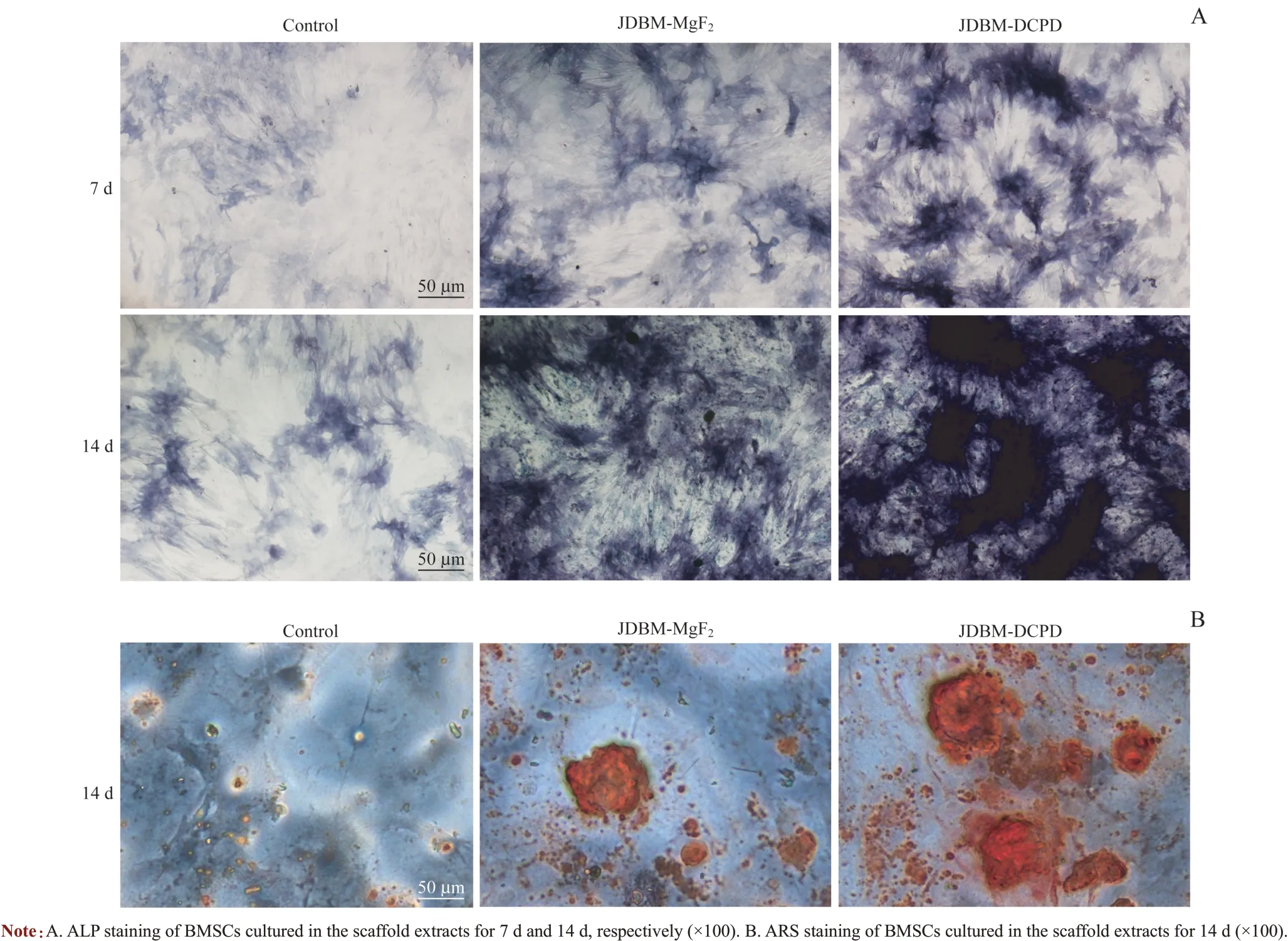
图5 JDBM-DCPD与JDBM-MgF2支架浸提液对BMSC成骨分化影响的比较Fig 5 Comparison of effects of JDBM-DCPD and JDBM-MgF2 scaffold extracts on osteogenic differentiation of BMSCs
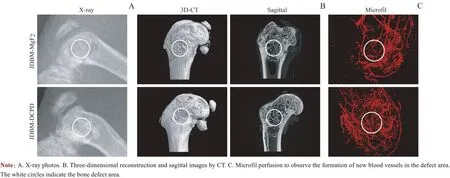
图6 植入8周后影像学检测JDBM-DCPD与JDBM-MgF2支架的体内成骨、成血管作用Fig 6 Osteogenesis and angiogenesis of JDBM-DCPD and JDBM-MgF2 scaffolds in vivo detected by radiography 8 weeks after implantation
2组大鼠股骨髁标本在脱钙4周后分别进行H-E染色,以及成骨标志物OCN 和成血管标志物CD31 的免疫组织化学染色。H-E染色结果显示JDBM-DCPD 组孔壁有更多被染成红色的骨胶原,并且在放大图中可以看到明显的血管形成(图7A)。免疫组织化学染色结果显示JDBMDCPD 组OCN 染色较JDBM-MgF2组更深(图7B);并且在JDBM-DCPD 组球形孔的中间有更多血管生成标志物CD31 的表达,而JDBM-MgF2组仅在球形孔壁周围可见CD31 的表达(图7C),这一结果与Microfil 血管灌注显示的结果一致。
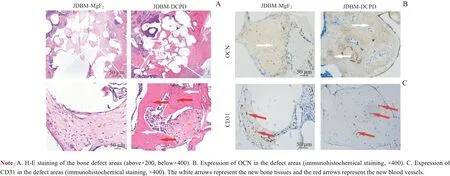
图7 植入8周后JDBM-DCPD组与JDBM-MgF2组大鼠骨缺损区的组织学观察Fig 7 Histological observation of the bone defect areas in JDBM-DCPD group and JDBM-MgF2 group rats 8 weeks after implantation
3 讨论
理想的骨组织工程支架需要具有合适的孔径。有文献[24-25]报道材料孔径为100~1 000 μm时,支架的逐渐降解有利于血管和新骨的生成。此外,据报道,多孔支架孔径在300~500 μm的范围内对血管再生、类骨和矿化骨形成最佳[26]。本研究所使用的JDBM镁合金支架为规则的高度互连多孔结构,主孔直径为400~450 μm,相互连接的孔径为150~250 μm。组织工程支架还需要具有一定的孔隙率才能更好地促进营养物质以及细胞代谢产物的运输从而促进组织的生长。当多孔支架孔隙率约为90%时更为理想,能够为细胞外基质的合成提供足够空间,为细胞与材料的相互作用提供高比表面积。因此,支架的孔隙率和互连性是促进组织生长和整合的关键因素[26]。然而,孔隙率越高意味着力学性能越低。在本研究中,JDBM-DCPD支架的孔隙率约为70%,与人骨小梁的孔隙率相似,并且JDBM-DCPD支架的力学性能与松质骨相匹配。本研究相较于前期研究[21]在涂层制备方面延长了钙磷沉积的时间,结果表明JDBM-DCPD支架在培养基中更加稳定,浸泡7 d宏观结构未出现明显改变,但支架的孔隙率以及力学性能相较前期并未发生显著的变化。
支架表面的细胞黏附直接影响细胞的生长、迁移和分化。因此,细胞黏附是骨整合的关键和先决条件[13]。体外实验发现,单纯MgF2涂层支架不利于BMSC 的黏附,这可能是由于MgF2涂层支架在培养基中降解相对较快并会产生过多的氢气,使局部环境pH 值增高而不利于细胞的黏附;体内实验中,可能同样由于MgF2涂层支架在降解过程中产生的氢气过多,气体聚集在组织周围,导致支架与宿主骨之间形成空腔,这一现象在MgF2涂层的AZ31 合金多孔支架修复股骨髁缺损时也被观察到[27]。与MgF2涂层支架相比,DCPD 涂层支架在体外明显更有利于细胞的黏附和生长;另外,JDBM-DCPD支架也能明显促进BMSC 的成骨分化。这可能是由于DCPD 涂层能延缓镁合金支架的降解。适量的Mg2+可以调节吸附的纤维连接蛋白,增强其与受体结合亲和力,上调BMSC 整合素α5β1的表达,从而增强细胞黏附和成骨分化[14]。此外,与骨矿物质类似的成分亦赋予DCPD 强大的细胞生物活性[28-29]。在降解过程中DCPD 涂层向培养基释放的钙离子和磷离子能进一步促进细胞增殖和分化[30],这与我们之前的研究结果一致[16-17,31]。
然而骨组织的再生离不开营养物质的供应,骨组织内的血管再生对于骨组织的修复至关重要[4]。传统观点认为成骨和成血管之间的关系是单向的,主要表现为血管再生为骨组织的再生和修复提供必要的营养物质并代谢废物[32]。但近年的研究[33-34]表明骨组织的再生对骨内血管的再生同样有着极为重要的作用,因而非常有必要在研究骨再生的同时关注血管再生情况。一方面血管再生可以促进骨再生,另一方面良好的骨再生也可以促进骨内血管的再生,从而形成良性循环,更好地达到骨修复的目的。我们的体外研究结果显示JDBM-DCPD 具有优良的促血管再生的作用,可能是JDBM-DCPD 镁合金支架缓释出来的适宜的Mg2+浓度促进了Src/JAK2 信号通路上前体破骨细胞分泌的血小板衍生生长因子BB(Platelet derived growth factor BB,PDGF-BB) 的表达,使得其成血管的作用增强[35-37]。同时,钙磷涂层释放的钙离子和磷离子同样具有促进血管再生的作用[38],因而相较于MgF2涂层的JDBM 镁合金支架,JDBM-DCPD 镁合金支架浸提液展现出更加优越的成血管能力。
在本研究中,虽然JDBM-DCPD多孔互连支架显示出合适的Mg2+释放、细胞相容性以及体内外优良的成血管性能,然而仍需要进行大动物实验进一步检测JDBM-DCPD的成血管能力,并进一步研究JDBM-DCPD支架在促进成骨-成血管交联方面的内在机制。另外也有多项研究强调,动物体内使用的模拟环境与人体不同,实验难以完美再现人体微环境,实际应用于人体时支架降解速率还是会受到一定影响[39-41]。因此,如何控制镁合金的降解,抑制氢气的产生,也是进一步扩大可生物降解镁合金应用的关键。
致谢衷心感谢上海交通大学材料学院袁广银教授和贾高智博士在JDBM 合金多孔支架制备和表征检测过程中提供的大力帮助及指导。
参·考·文·献
[1] Giannoudis PV, Dinopoulos H, Tsiridis E. Bone substitutes: an update[J].Injury,2005,36(Suppl 3):S20-S27.
[2] Moore WR, Graves SE, Bain GI. Synthetic bone graft substitutes[J]. ANZ J Surg,2001,71(6):354-361.
[3] Samartzis D, Shen FH, Goldberg EJ, et al. Is autograft the gold standard in achieving radiographic fusion in one-level anterior cervical discectomy and fusion with rigid anterior plate fixation?[J]. Spine, 2005, 30(15): 1756-1761.
[4] Jin L, Li P, Wang YC, et al. Studies of superb microvascular imaging and contrast-enhanced ultrasonography in the evaluation of vascularization in early bone regeneration[J]. J Ultrasound Med,2019,38(11):2963-2971.
[5] Brandi ML, Collin-Osdoby P. Vascular biology and the skeleton[J]. J Bone Miner Res,2006,21(2):183-192.
[6] Parfitt AM. The mechanism of coupling:a role for the vasculature[J]. Bone,2000,26(4):319-323.
[7] Novosel EC, Kleinhans C, Kluger PJ. Vascularization is the key challenge in tissue engineering[J]. Adv Drug Deliv Rev,2011,63(4/5):300-311.
[8] Rouwkema J, Rivron NC, van Blitterswijk CA. Vascularization in tissue engineering[J]. Trends Biotechnol,2008,26(8):434-441.
[9] Kanczler JM, Oreffo RO. Osteogenesis and angiogenesis: the potential for engineering bone[J]. Eur Cell Mater,2008,15:100-114.
[10] Thevenot P, Nair A, Dey J, et al. Method to analyze three-dimensional cell distribution and infiltration in degradable scaffolds[J]. Tissue Eng Part C Methods,2008,14(4):319-331.
[11] Staiger MP, Pietak AM, Huadmai J, et al. Magnesium and its alloys as orthopedic biomaterials:a review[J]. Biomaterials,2006,27(9):1728-1734.
[12] Velasco MA,Narváez-Tovar CA,Garzón-Alvarado DA. Design,materials,and mechanobiology of biodegradable scaffolds for bone tissue engineering[J].Biomed Res Int,2015,2015:729076.
[13] Kunjukunju S, Roy A, Ramanathan M, et al. A layer-by-layer approach to natural polymer-derived bioactive coatings on magnesium alloys[J]. Acta Biomater,2013,9(10):8690-8703.
[14] Zhang J, Ma X, Lin D, et al. Magnesium modification of a calcium phosphate cement alters bone marrow stromal cell behaviorviaan integrinmediated mechanism[J]. Biomaterials,2015,53:251-264.
[15] Qin H,Zhao Y,An Z,et al. Enhanced antibacterial properties,biocompatibility,and corrosion resistance of degradable Mg-Nd-Zn-Zr alloy[J]. Biomaterials,2015,53:211-220.
[16] Kong X, Wang L, Li G, et al. Mg-based bone implants show promising osteoinductivity and controllable degradation: a long-term study in a goat femoral condyle fracture model[J]. Mater Sci Eng C Mater Biol Appl,2018,86:42-47.
[17] Guan X, Xiong M, Zeng F, et al. Enhancement of osteogenesis and biodegradation control by brushite coating on Mg-Nd-Zn-Zr alloy for mandibular bone repair[J]. ACS Appl Mater Interfaces, 2014, 6(23): 21525-21533.
[18] Tamimi F, Sheikh Z, Barralet J. Dicalcium phosphate cements: brushite and monetite[J]. Acta Biomater,2012,8(2):474-487.
[19] Apelt D, Theiss F, El-Warrak AO, et al.In vivobehavior of three different injectable hydraulic calcium phosphate cements[J]. Biomaterials,2004,25(7):1439-1451.
[20] Malhotra A, Habibovic P. Calcium phosphates and angiogenesis:implications and advances for bone regeneration[J]. Trends Biotechnol,2016,34(12):983-992.
[21] Wang W,Jia G,Wang Q,et al. Thein vitroandin vivobiological effects and osteogenic activity of novel biodegradable porous Mg alloy scaffolds[J].Mater Des,2020,189:108514.
[22] Pijuan J, Barceló C, Moreno DF, et al.In vitrocell migration, invasion, and adhesion assays: from cell imaging to data analysis[J]. Front Cell Dev Biol,2019,7:107.
[23] Hu H, Chen Y, Zou Z, et al.Panax notoginsengsaponins prevent bone loss by promoting angiogenesis in an osteoporotic mouse model[J]. Biomed Res Int,2020,2020:8412468.
[24] Dai C,Guo H,Lu J,et al. Osteogenic evaluation of calcium/magnesium-doped mesoporous silica scaffold with incorporation of rhBMP-2 by synchrotron radiation-based μCT[J]. Biomaterials,2011,32(33):8506-8517.
[25] Griffith LG. Emerging design principles in biomaterials and scaffolds for tissue engineering[J]. Ann N Y Acad Sci,2002,961:83-95.
[26] Karageorgiou V, Kaplan D. Porosity of 3D biomaterial scaffolds and osteogenesis[J]. Biomaterials,2005,26(27):5474-5491.
[27] Chiesa R, Sandrini E, Santin M, et al. Osteointegration of titanium and its alloys by anodic spark deposition and other electrochemical techniques:a review[J]. J Appl Biomater Biomech,2003,1(2):91-107.
[28] Liang C, Wang H, Yang J, et al. Femtosecond laser-induced micropattern and Ca/P deposition on Ti implant surface and its acceleration on early osseointegration[J]. ACS Appl Mater Interfaces,2013,5(16):8179-8186.
[29] Ma H, Luo J, Sun Z, et al. 3D printing of biomaterials with mussel-inspired nanostructures for tumor therapy and tissue regeneration[J]. Biomaterials,2016,111:138-148.
[30] Xu F, Ding H, Song F, et al. Effects of preparation methods on the bone formation potential of apatite-coated chitosan microspheres[J]. J Biomater Sci Polym Ed,2014,25(18):2080-2093.
[31] Yu W, Zhao H, Ding Z, et al.In vitroandin vivoevaluation of MgF2coated AZ31 magnesium alloy porous scaffolds for bone regeneration[J]. Colloids Surf B Biointerfaces,2017,149:330-340.
[32] Lafage-Proust MH, Prisby R, Roche B, et al. Bone vascularization and remodeling[J]. Joint Bone Spine,2010,77(6):521-524.
[33] Kusumbe AP, Ramasamy SK, Adams RH. Coupling of angiogenesis and osteogenesis by a specific vessel subtype in bone[J]. Nature,2014,507(7492):323-328.
[34] Dhandapani R, Krishnan PD, Zennifer A, et al. Additive manufacturing of biodegradable porous orthopaedic screw[J]. Bioact Mater,2020,5(3):458-467.
[35] Xie H, Cui Z, Wang L, et al. PDGF-BB secreted by preosteoclasts induces angiogenesis during coupling with osteogenesis[J]. Nat Med, 2014, 20(11):1270-1278.
[36] Liu Q,Zhou YF,Li ZB. PDGF-BB promotes the differentiation and proliferation of MC3T3-E1 cells through the Src/JAK2 signaling pathway[J]. Mol Med Rep,2018,18(4):3719-3726.
[37] Liu W, Guo S, Tang Z, et al. Magnesium promotes bone formation and angiogenesis by enhancing MC3T3-E1 secretion of PDGF-BB[J]. Biochem Biophys Res Commun,2020,528(4):664-670.
[38] Saghiri MA,Asatourian A,Orangi J,et al. Functional role of inorganic trace elements in angiogenesis—part Ⅰ: N, Fe, Se, P, Au, and Ca[J]. Crit Rev Oncol Hematol,2015,96(1):129-142.
[39] Song GL,Song SZ. A possible biodegradable magnesium implant material[J].Adv Eng Mater,2007,9(4):298-302.
[40] Gu XN, Zheng YF, Chen LJ. Influence of artificial biological fluid composition on the biocorrosion of potential orthopedic Mg-Ca,Az31,Az91 alloys[J]. Biomed Mater,2009,4(6):065011.
[41] Fischer J,Prosenc MH,Wolff M,et al. Interference of magnesium corrosion with tetrazolium-based cytotoxicity assays[J]. Acta Biomater, 2010, 6(5):1813-1823.

