Ras 相关结构域家族成员5 对头颈鳞癌细胞迁移和侵袭能力的影响
鲁昱晟,杨文艺,马海龙,胡镜宙
上海交通大学医学院附属第九人民医院口腔颌面头颈肿瘤科,上海交通大学口腔医学院,国家口腔医学中心,国家口腔疾病临床研究中心,上海市口腔医学重点实验室,上海200011
头颈癌是世界范围内发病率排名第七位的肿瘤[1],其中以头颈鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)最为多见。曾有研究估计,2020 年美国新增头颈癌5.33 万例,死亡1.08 万例[2]。尽管有包括手术、放射治疗和化学治疗在内的多种治疗方案,患者预后仍然不够理想,5年生存率约为65%[2],超过50%的晚期患者在治疗3年内出现复发或转移[3]。因此,寻找调控HNSCC 侵袭转移的分子标志物是亟待完善的工作。上皮间质转化(epithelial-mesenchymal transition,EMT)被认为是肿瘤发生侵袭转移的重要机制之一,常见的标志分子包括上皮型钙黏蛋白(epithelial cadherin,Ecadherin)等下调以及锌指转录因子Snail 等上调。Ras 相关结构域家族成员(Ras association domain family,RASSF)是Ras 蛋白的效应分子,通过Ras 相关结构域与之结合。研究显示RASSF 蛋白在多种肿瘤中表观遗传沉默[4],且往往与肿瘤的恶性特征相关联[5]。RASSF5 是RASSF 蛋白中唯一同时具有Ras 相关结构域和SARAH(Sav-RASSF-Hippo)结构域的成员,其编码基因位于1q32.1,常因启动子发生甲基化而表达受到抑制。在骨肉瘤中,RASSF5的低表达水平与肿瘤发生远处转移密切相关[6]。而在肝细胞癌中,RASSF5表达水平降低与血管浸润和肿瘤包膜不完整等因素相关[7]。在HNSCC 中,RASSF5因高甲基化而表达受限,推测RASSF5可能也参与HNSCC 的侵袭转移过程[8]。本研究通过体内外实验探讨RASSF5对HNSCC 细胞迁移和侵袭能力的影响,以期为HNSCC的治疗提供新的潜在靶点。
1 材料与方法
1.1 主要试剂和仪器
高糖DMEM 培养基(Hyclone 公司, 美国),NcmColor 彩色预染蛋白质分子量标准、青霉素-链霉素(100×)、超敏增强化学发光(enhanced chemiluminescent,ECL)试剂和0.25%胰蛋白酶消化液(新赛美生物科技有限公司,中国),过氧化物酶标记二抗(Jackson ImmunoResearch 公司,美国),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(Cell Signaling Technology,美国),糖原合酶激酶3β(glycogen synthase kinase 3β,GSK-3β)抗体、N 端第9位丝氨酸(serine,Ser) 残基发生磷酸化的GSK-3β(phosphorylated GSK-3β,p-GSK-3β) 抗体[p-GSK-3β(Ser9)抗体]、E-cadherin 抗体和Snail 抗体(Abcam 公司,美国),RASSF5抗体(爱博泰克生物科技有限公司,中国),RIPA裂解液、蛋白酶抑制剂混合物、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶试剂盒和蛋白质上样缓冲液(上海碧云天生物技术有限公司,中国),TRIzol 试剂(Invitrogen 公司,美国),反转录试剂盒和实时荧光定量聚合酶链式反应(quantitative realtime polymerase chain reaction,qPCR)试剂盒(Takara公司,日本)。
Quick Drop 超微量分光光度计(Molecular Devices 公司,美国),振荡摇床混合器(KB-5010 型,海门市其林贝尔仪器制造有限公司,中国),热循环基因扩增PCR 仪(T100 型,Bio-Rad 公司,美国),电热恒温水槽(DK-8AX 型,上海精其仪器有限公司,中国),倒置显微镜系统(Axio Vert A1 型,Carl Zeiss 公司,德国),台式离心机(Allegra X-12 型,贝克曼库尔特有限公司,美国),化学发光成像仪(Tanon-5200 型,上海天能科技有限公司,中国),实时荧光定量PCR 仪(LightCycler96 型,Roche公司,美国)
1.2 细胞培养及病毒转染
HNSCC 细胞系Cal27 来自美国模式培养物集存库(American Type Culture Collection,ATCC);HN30 由美国马里兰大学提供。细胞在5% CO2、37 ℃恒温培养箱中,以含10%胎牛血清和1×青霉素-链霉素双抗的高糖DMEM 培养基进行培养。RASSF5过表达慢病毒(lentivirus overexpressingRASSF5,LVRASSF5) 及慢病毒空表达载体(LV vector)的构建包装由吉满生物科技(上海)有限公司协助完成。根据RASSF5基因序列,设计引物扩增获得RASSF5基因片段,并构建到CMV-MCSPGK-Puro(PGMLV-PA6)载体上的XhoⅠ和BamHⅠ酶切位点之间;上游引物序列为5'-TACCGGACTCAGATC TCGAGCCACCATGGCCATGGCGTCCCCGG-3',下游引物序列为5'-TATCTAGATCCGGTGGATCCTTACCCAGG TTTGCCCTGGGATTCTCTTAAGG-3'。将Cal27 及HN30细胞分别接种于6孔板,控制培养密度至50%。在培养基中加入LVRASSF5或LV vector 慢病毒原液,控制感染复数(multiplicity of infection,MOI)为50;摇匀后加入浓度为5 μg/mL的聚凝胺。感染24 h后更换新鲜培养基继续培养;感染48 h 后将细胞传代,控制细胞铺展面积为培养皿面积的40%,并在完全培养基中加入嘌呤霉素(2.5 μg/mL)以筛选感染成功后具有嘌呤霉素抗性的细胞。
1.3 总RNA提取及qPCR
在贴壁培养的细胞中加入适量TRIzol,室温裂解5 min并收集至Eppendorf(EP)管,加入体积为TRIzol体积1/5的氯仿后颠倒混匀。12 000×g低温离心15 min后收集上清液,加入等体积异丙醇后混匀。继续12 000×g低温离心15 min,弃上清液并加入75%乙醇。7 500×g低温离心5 min 后弃上清液,加入无水乙醇重复前一步骤。移除乙醇并自然干燥RNA 沉淀,及时溶解于焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)水并测定RNA 浓度。使用反转录试剂Takara PrimeScript™RT Master Mix 将RNA反转录为40 μL体系cDNA。按两步法,每孔以2 μL cDNA为模板,0.8 μL 上、下游引物(预稀释成10 μmol/L),10 μL TB Green®Premix Ex Taq™Ⅱ(Tli RNaseH Plus)和6.4 μL 无核酸酶(RNase free)水组成20 μL 反应体系,在罗氏LightCycler®96 系统进行qPCR 反应。引物序列如下:GAPDH正向引物5'-ACAACTTTGGTATCGTG GAAGG-3',反向引物5'-GCCATCACGCCACAGTTTC-3';RASSF5正向引物5'-GGGCATGAAACTGAGTGAAG A-3',反向引物5'-TGGCATCATAGATGGACTGGG-3'。
1.4 总蛋白提取及Western blotting
待细胞增长至培养皿面积80%左右,裂解和收集蛋白,12 000×g、4 ℃离心10 min,保留上清液。将蛋白稀释至统一浓度,加入1/4 体积蛋白质上样缓冲液并加热变性,以20 μg 的蛋白质量上样于4%~20% SDS-PAGE 凝胶,恒压电泳至彩色预染蛋白质标准品分离至适当位置。随后采用湿转法,300 mA 恒流条件将凝胶内蛋白质转至甲醇激活的聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜,5%脱脂牛奶室温封闭非特异性抗原1 h。裁剪含目的蛋白质条带并4 ℃孵育相应抗体过夜。TBST 洗膜3 次,每次10 min,室温孵育过氧化物酶标记二抗1 h,前述步骤洗膜。加入超敏ECL 化学发光液,在化学发光成像分析系统中显影成像并扫描。通过Image J 软件对条带进行灰度分析。
1.5 划痕实验
将转染LVRASSF5或者LV vector 的Cal27 和HN30 细胞,按转染病毒不同分为4 组,分别接种于灭菌6 孔板,在新鲜的完全培养基中生长至铺满皿底。随后在使用灭菌的移液枪头在皿底细胞表面划痕。经PBS 轻轻洗涤后改用无血清培养基培养。划痕后0 h 为起点,间隔12 h 倒置显微镜下明场拍照观察(40倍视野),以划痕两侧细胞相互接触作为观察终点。通过Image J 软件对各观察时间点的划痕面积进行分析。
1.6 Transwell迁移和侵袭实验
Transwell迁移实验中,将转染LVRASSF5或LV vector的Cal27和HN30细胞按照病毒类型分为4组。细胞消化离心后制备细胞悬液,调整细胞密度为5×105个/mL。将细胞悬液轻轻吹打后吸取100 μL 细胞悬液加入普通Transwell小室。下室加入600 μL 含10% FBS 的高糖DMEM 培养基。在Transwell 侵袭实验中,设置相同分组,将细胞悬液加入铺有基质胶的Transwell 小室,其余步骤同迁移实验。36 h(迁移实验)或72 h(侵袭实验)后轻轻吸走上下室培养基,加入4%多聚甲醛固定30 min,随后用结晶紫染色。棉签擦去上室细胞,并在显微镜下观察小室下方膜上的染色细胞。随机选取5 个视野,使用Image J 软件进行细胞计数分析。
1.7 裸鼠肺转移模型
10只6周龄雄性BALB/c裸小鼠购自上海西普尔-必凯实验动物有限公司,饲养于上海交通大学医学院附属第九人民医院实验动物中心。动物生产许可证SCXK(沪)2018-0006),实验动物使用许可证SYXK(沪) 2016-0016。研究获得上海交通大学医学院附属第九人民医院动物伦理委员会批准,实验动物伦理编号HKDL2018132。扩增转染LVRASSF5和LV vector的Cal27细胞,消化收集细胞并调整细胞密度为1×107个/mL。将裸鼠分为2 组,每组5 只,经尾静脉分别缓慢注射转染LVRASSF5或LV vector 的Cal27 细胞悬液100 μL。8 周后,将实验鼠于麻醉状态下实施安乐死。打开小鼠胸腔,小心解剖并取出肺部,清洗后置于波恩染色液染色,记录肺部瘤结节数量。
1.8 生物信息学分析
利用GEPIA 平台,基于TCGA 数据进行HNSCC 的RASSF5表达图谱分析和生存分析,并进行RASSF5表达与E-cadherin 编码基因——钙黏蛋白1 基因(cadherin 1,CDH1)表达的相关性分析。TCGA 数据库HNSCC 的RASSF5表达图谱分析策略:基因选择RASSF5,选择TCGA HNSCC 数据库(519 例),对应TCGA 正常组织数据(44 例),差异倍数(fold change,FC)设为1.5,P值临界值设为0.001,统计学方法为单因素方差分析(oneway ANOVA)。生存分析策略:选择TCGA HNSCC 数据库(519 例),生存方法分别选择总体生存期(overall survival,OS) 和无病生存期(disease free survival,DFS),RASSF5 高表达或低表达队列分割阈值分别设置为75%和25%。RASSF5与CDH1基因表达相关性分析策略:选择TCGA HNSCC 数据库(519 例)和对应TCGA正常组织数据(44 例),Pearson 相关系数分析RASSF5与CDH1基因表达的相关性。
1.9 统计学分析
采用SPSS Statistic 22 软件包进行统计分析。定量资料采用±s表示,通过独立样本t检验对数据进行统计分析。生存分析采用Kaplan-Meier 法绘制生存曲线,使用Log-rank 检验不同生存曲线的生存率。P<0.05 为差异具有统计学意义。
2 结果
2.1 RASSF5表达水平与HNSCC患者预后的相关性
HNSCC 的RASSF5表达图谱分析显示肿瘤组织中RASSF5表达水平显著低于正常组织(FC>1.5,P<0.001,图1A)。生存分析显示,RASSF5低表达患者的DFS 低于RASSF5高水平患者(Log-rankP=0.005);RASSF5低表达患者的OS 低于RASSF5高水平患者(Log-rankP=0.004,图1B)。

图1 在HNSCC中RASSF5基因表达水平以及生存分析Fig 1 Gene expression of RASSF5 in HNSCC and the related survival analysis
2.2 RASSF5对HNSCC细胞迁移和侵袭能力的影响
为研究RASSF5是否能影响HNSCC 细胞迁移及侵袭,首先向Cal27 及HN30 细胞分别转染LVRASSF5和LV vector。经qPCR 检测证实,Cal27 和HN30 细胞在转染LVRASSF5后,其RASSF5mRNA 表达水平相比对照组显著提高,分别达(44.8±0.8) 倍和(60.6±0.6) 倍(图2A)。通过划痕实验和Transwell 迁移实验分别测试RASSF5对迁移能力的影响。以起始划痕面积为1,HN30在24 h 到达观测终点,LV vector 组和LVRASSF5组划痕面积与0 h差异有统计学意义(P=0.004,P=0.001),并且LVRASSF5组在观察终点的相对划痕面积也显著高于LV vector 组(P=0.003,图2B)。Cal27 迁移速度较慢,在36 h 到达观测终点,LV vector 组和LVRASSF5组细胞划痕面积与0 h 差异有统计学意义(P=0.001,P=0.016),LVRASSF5组在观察终点的相对划痕面积显著高于对照组(P=0.015,图2C)。Transwell 迁移实验结果显示,过表达RASSF5的HN30细胞和Cal27细胞在实验终点(36 h)穿出小室膜的细胞数量均低于相应对照组,差异具有统计学意义(P=0.001,P=0.005;图2D),提示过表达RASSF5对肿瘤细胞迁移能力具有抑制作用。进一步通过预铺基质胶的Transwell 小室进行细胞侵袭实验,探究RASSF5对HNSCC 细胞侵袭能力的影响。结果显示过表达RASSF5的HN30 细胞和Cal27 细胞在实验终点(72 h)穿出小室膜的细胞数量均低于对照组,差异具有统计学意义(P=0.001,P=0.001;图2E),提示过表达RASSF5可抑制Cal27及HN30的侵袭能力。
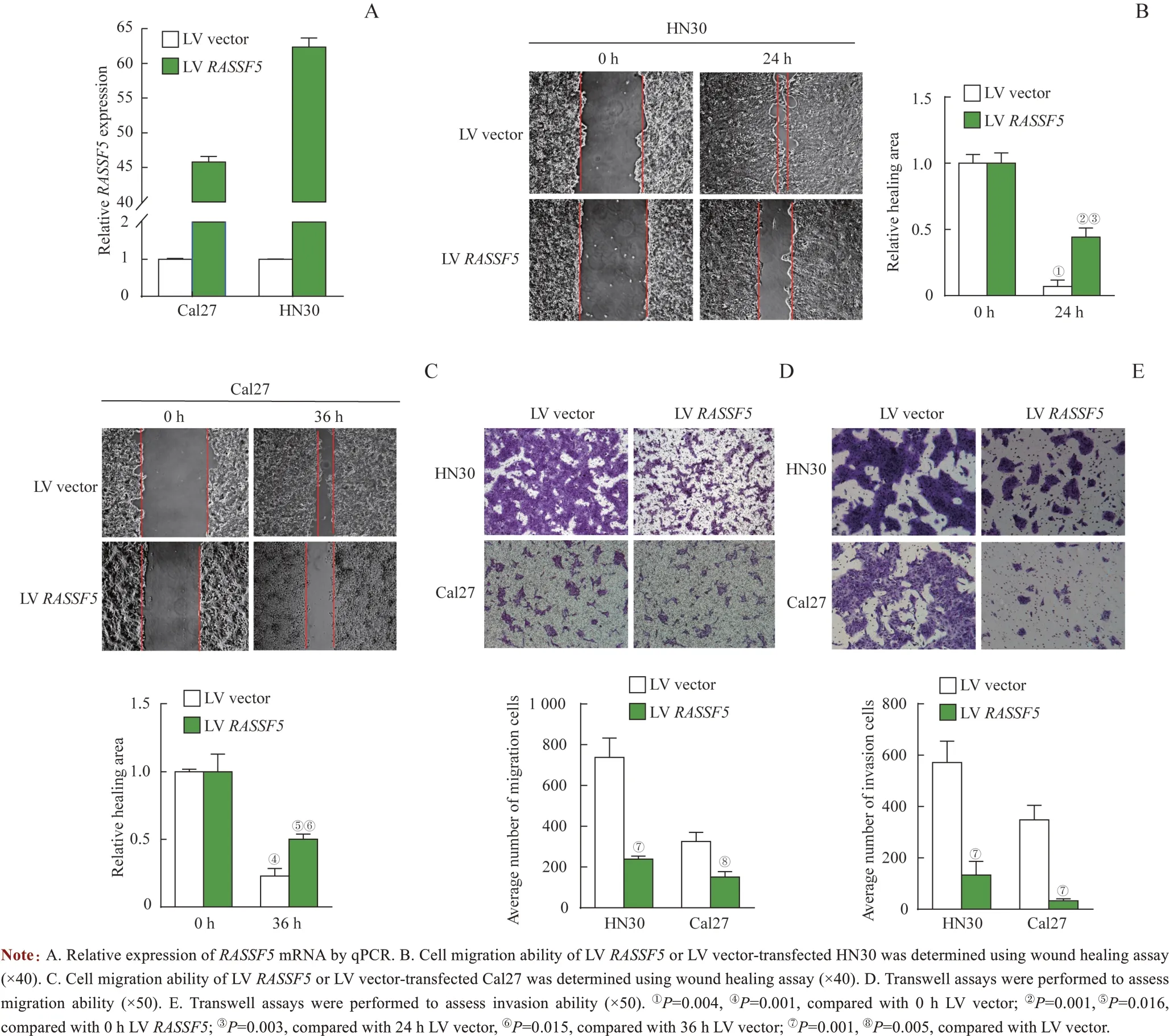
图2 RASSF5对Cal27和HN30迁移和侵袭能力的影响Fig 2 Effect of RASSF5 on the ability of cell migration and invasion
2.3 过表达RASSF5对EMT相关蛋白质表达水平的影响
通过GEPIA2 平台检索HNSCC 的TCGA 样本库,分析RASSF5和CDH1基因表达相关性。Pearson相关系数分析提示RASSF5与CDH1基因表达呈正相关(R=0.260,P=0.000;图3A)。Western blotting 分析过表达RASSF5后Cal27 和HN30 细胞中EMT 相关蛋白表达水平改变,结果显示RASSF5表达上调后CDH1表达产物E-cadherin蛋白表达水平增加,p-GSK-3β/GSK-3β 比值和Snail 表达水平均下调(图3B、C)。
2.4 动物实验验证RASSF5抑制肿瘤转移
为了进一步检测RASSF5对肿瘤侵袭转移能力的影响,本研究分别构建Cal27 过表达RASSF5组和对照组裸鼠肺转移模型,通过肺部瘤结节数量评估肿瘤转移。结果显示过表达RASSF5组的裸鼠肺部转移瘤结节少于对照组,差异具有统计学意义(P=0.049,图4)。
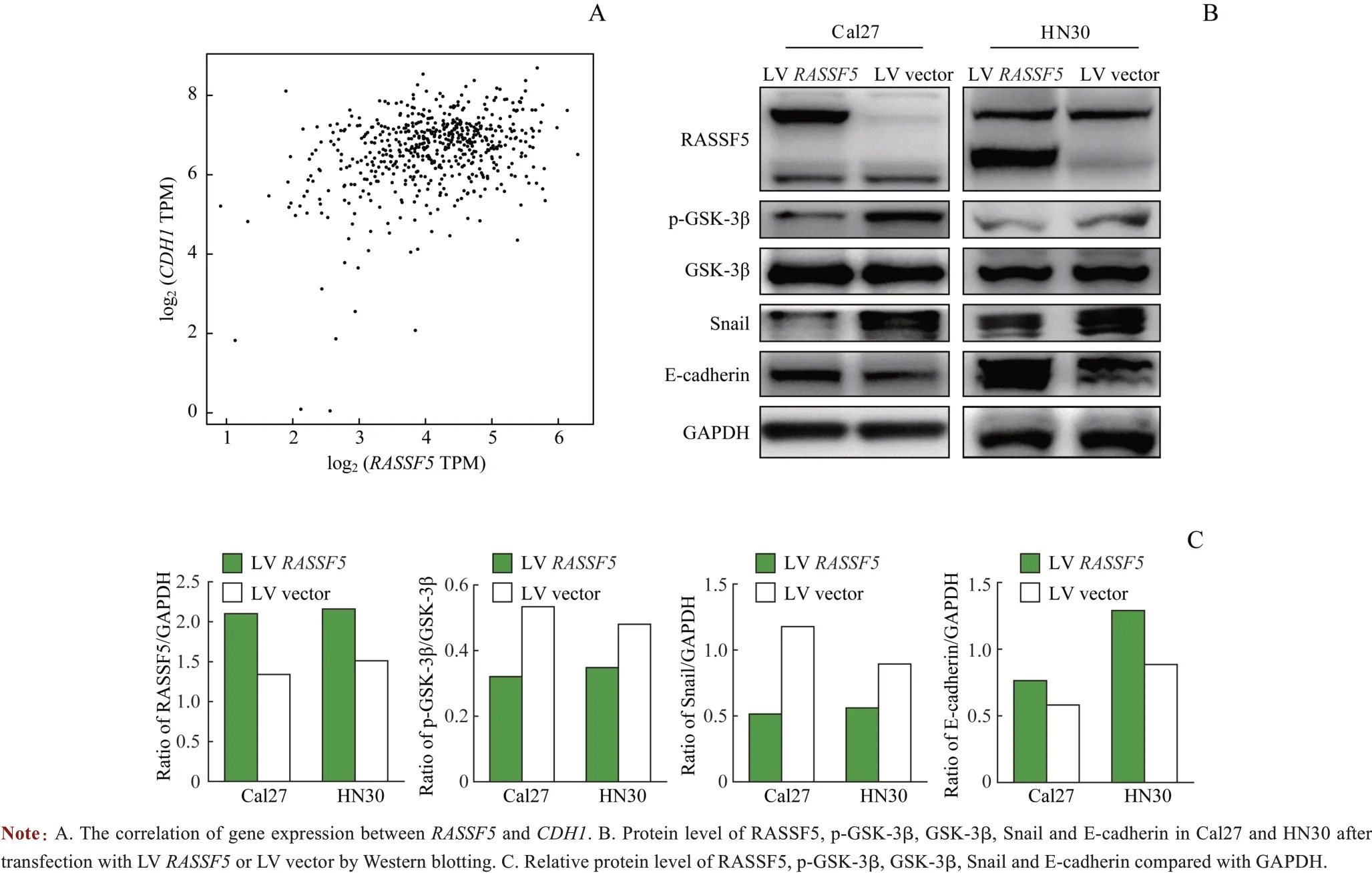
图3 过表达RASSF5对EMT相关蛋白表达的影响Fig 3 Effects of RASSF5 overexpression on protein expression of EMT-related proteins

图4 RASSF5对Cal27细胞肺转移的影响Fig 4 Effect of RASSF5 on lung metastasis of Cal27 cells
3 讨论
本研究通过GEPIA2平台分析TCGA 数据库,发现在HNSCC 中RASSF5基因表达呈低水平,且低表达RASSF5的患者有着较差的OS 和DFS。以往的文献报道RASSF5基因表达水平在多种肿瘤中下降,其中包括HNSCC[8]、胃贲门腺癌[9]和小儿肝母细胞瘤[10]等。此外,RASSF5的低表达水平还与包括食管鳞癌[11]在内的肿瘤患者不良预后相关。
本研究选用了2 种常用的HNSCC 细胞系Cal27 和HN30,通过划痕实验、Transwell 迁移和侵袭实验发现,转染RASSF5过表达慢病毒使细胞获得高水平的RASSF5后,Cal27 和HN30 的迁移和侵袭能力明显受到抑制,提示RASSF5可能参与调控HNSCC 的侵袭转移能力。EMT是上皮细胞经过特定转化程序后获得间充质细胞表型的过程,被认为是肿瘤发生和发展过程中获得恶性表型(尤其是浸润转移)的重要机制之一。经过EMT 的肿瘤细胞表现出上皮细胞表型丢失,典型的特征为E-cadherin表达水平下降。本研究通过GEPIA2 库分析显示RASSF5和CDH1的基因表达在HNSCC 中呈正相关,而Western blotting 结果也表明过表达RASSF5后,E-cadherin 蛋白的表达水平也随之提高。
在肿瘤发展过程中,E-cadherin 表达下调主要由转录抑制导致,参与的转录因子包括锌指蛋白Snail/Slug 家族和碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)E12/E47 因子等[12]。Snail 是一种含有锌指结构的转录因子。有研究[13]显示Snail 能特异性地结合编码E-cadherin基因CDH1的启动子区域“CAGGTG”序列(E-box),同时募集组蛋白去乙酰基酶1 (histone deacetylase 1,HDAC1)、HDAC2和甲基转移酶EZH2对组蛋白3上的第27 位赖氨酸(histone H3 lysine 27,H3K27)和组蛋白3上的第9 位赖氨酸(histone H3 lysine 9,H3K9)进行甲基化和去乙酰化修饰,继而抑制CDH1转录。Snail 上具有2 个保守的富含丝氨酸(serine,S)的模体(motif),为GSK-3β的作用位点[14]。GSK-3β磷酸化motif 1可促进Snail泛素化降解过程,而磷酸化motif 2则可调节Snail的胞内定位从胞核向胞质变化[12]。GSK-3β 的活性受到不同的磷酸化方式调控,其中GSK-3β 的N 端第9 位Ser 残基发生磷酸化起到抑制其活性的作用[15-16]。为此本研究从蛋白水平检测Snail、p-GSK-3β (Ser9) 及GSK-3β,发现RASSF5上调与Snail 表达水平降低有关,同时p-GSK-3β(Ser9)水平显著下降,而GSK-3β 总蛋白水平无明显变化。因此,RASSF5可能通过抑制GSK-3β 的Ser9 磷酸化失活途径,促进了Snail 泛素化降解,继而降低对E-cadherin的转录抑制。
除了对细胞迁移和侵袭能力的抑制作用外,近年来还有研究报道RASSF5可促进肿瘤细胞凋亡[17]和衰老[18],提示RASSF5可能在多方面起到肿瘤抑制作用。而Li 等[19]报道的Tet 甲基胞嘧啶双加氧酶1(ten-eleven translocation methylcytosine dioxygenase 1,TET1) 靶向RASSF5启动子区域以及Sun 等[20]报道的特异性去甲基酶含Jumonji 结构域蛋白3(Jumonji domain-containing 3,Jmjd3)降低RASSF5启动子区域组蛋白3 上的第27 位赖氨酸的三甲基化(trimethylation on histone H3 lysine 27,H3K27me3)等,均可调控RASSF5表达升高,为靶向RASSF5位点的研究提供一定思路。
综上所述,本研究通过体内外实验发现RASSF5抑制HNSCC 细胞迁移和侵袭能力,其机制可能为RASSF5通过GSK-3β/Snail 通路抑制EMT 进而抑制侵袭转移。该研究有望为HNSCC的治疗提供新的潜在靶点。
参·考·文·献
[1] Chow LQM. Head and neck cancer[J]. N Engl J Med,2020,382(1):60-72.
[2] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020[J]. CA A Cancer J Clin,2020,70(1):7-30.
[3] Cohen EEW, Soulières D, Le Tourneau C, et al. Pembrolizumab versus methotrexate, docetaxel, or cetuximab for recurrent or metastatic head-andneck squamous cell carcinoma (KEYNOTE-040): a randomised, open-label,phase 3 study[J]. The Lancet,2019,393(10167):156-167.
[4] Barnoud T, Schmidt ML, Donninger H, et al. The role of the NORE1A tumor suppressor in oncogene-induced senescence[J]. Cancer Lett, 2017,400:30-36.
[5] Donninger H, Schmidt ML, Mezzanotte J, et al. Ras signaling through RASSF proteins[J]. Semin Cell Dev Biol,2016,58:86-95.
[6] Zhou XH,Yang CQ,Zhang CL,et al. RASSF5 inhibits growth and invasion and induces apoptosis in osteosarcoma cells through activation of MST1/LATS1 signaling[J]. Oncol Rep,2014,32(4):1505-1512.
[7] Liu LL, Zhang MF, Pan YH, et al. NORE1A sensitises cancer cells to sorafenib-induced apoptosis and indicates hepatocellular carcinoma prognosis[J]. Tumor Biol,2014,35(3):1763-1774.
[8] Steinmann K, Sandner A, Schagdarsurengin U, et al. Frequent promoter hypermethylation of tumor-related genes in head and neck squamous cell carcinoma[J]. Oncol Rep,2009,22(6):1519-1526.
[9] Han L, Dong Z, Wang C, et al. Decreased expression and aberrant methylation of RASSF5A correlates with malignant progression of gastric cardia adenocarcinoma[J]. Mol Carcinog,2015,54(12):1722-1733.
[10] Liu G, Liu B, Zheng S, et al. AberrantRASSF5gene transcribed region hypermethylation in pediatric hepatoblastomas[J]. Int J Clin Exp Pathol,2018,11(7):3612-3617.
[11] Guo W,Wang C,Guo YL,et al. RASSF5A,a candidate tumor suppressor,is epigenetically inactivated in esophageal squamous cell carcinoma[J]. Clin Exp Metastasis,2015,32(1):83-98.
[12] Zhou BP,Deng J,Xia WY,et al. Dual regulation of Snail by GSK-3β-mediated phosphorylation in control of epithelial-mesenchymal transition[J]. Nat Cell Biol,2004,6(10):931-940.
[13] Sun J, Meng D, Yu T, et al. N-terminal truncated carboxypeptidase E represses E-cadherin expression in lung cancer by stabilizing the Snail-HDAC complex[J]. Am J Cancer Res,2020,10(3):925-938.
[14] An P, Chen F, Li Z, et al. HDAC8 promotes the dissemination of breast cancer cellsviaAKT/GSK-3β/Snail signals[J]. Oncogene, 2020, 39(26):4956-4969.
[15] Domoto T, Pyko IV, Furuta T, et al. Glycogen synthase kinase-3β is a pivotal mediator of cancer invasion and resistance to therapy[J]. Cancer Sci,2016,107(10):1363-1372.
[16] Jin F,Wu Z,Hu X,et al. The PI3K/Akt/GSK-3β/ROS/eIF2B pathway promotes breast cancer growth and metastasisviasuppression of NK cell cytotoxicity and tumor cell susceptibility[J]. Cancer Biol Med,2019,16(1):38-54.
[17] Liao TJ, Tsai CJ, Jang H, et al. RASSF5: an MST activator and tumor suppressorin vivobut oppositein vitro[J]. Curr Opin Struct Biol, 2016, 41:217-224.
[18] Donninger H, Calvisi DF, Barnoud T, et al. NORE1A is a Ras senescence effector that controls the apoptotic/senescent balance of p53viaHIPK2[J].J Cell Biol,2015,208(6):777-789.
[19] Li BT, Yu C, Xu Y, et al. TET1 inhibits cell proliferation by inducing RASSF5 expression[J]. Oncotarget,2017,8(49):86395-86409.
[20] Sun HY, Yang D, Mi J, et al. Histone demethylase Jmjd3 modulates osteoblast apoptosis induced by tumor necrosis factor-α through directly targeting RASSF5[J]. Connect Tissue Res,2020,61(6):517-525.

