支配初级视皮层的丘脑背外侧核神经元亚群的小鼠全脑输入图谱构建
王丽昭,马国芬,刘燕梅,王彦婕,王紫玥,陈兆南,张思宇#,徐天乐#
1.上海交通大学医学院附属上海儿童医学中心儿童脑科学中心,上海200127;2.上海交通大学基础医学院解剖学与生理学系,上海200025
丘脑是位于大脑中部的重要核团,接收来自视觉、听觉和触觉等感觉信号,并向相应的感觉皮层传递[1]。早期研究[2]认为丘脑是大脑信息传递的中继站,仅负责信号的传递,而信息处理则在皮层进行。近年来,越来越多的研究表明丘脑不仅有负责传递感觉信息的初级核团,还有能整合信息的高级核团[3]。这些高级核团接收来自皮层的投射并投回皮层,形成皮层-丘脑-皮层环路,调控感觉皮层信息处理,参与高级认知功能。比如,利用光遗传学技术研究小鼠后发现,丘脑后外侧核(lateral posterior nucleus,LP)为灵长类丘脑枕核在小鼠中的同源结构,可接收来自前额叶扣带回(anterior cingulate area,ACA)皮层神经元的投射并投向初级视皮层,调控初级视皮层神经元对视觉信号的处理,从而影响视觉相关行为[4]。
小鼠丘脑背外侧核(lateral dorsal nucleus,LD)也属于丘脑高级核团。与丘脑后外侧核相似,丘脑背外侧核也与初级视皮层(primary visual cortex,V1)、高级视皮层(higher-order visual cortices,HVC) 和前额叶皮层(prefrontal cortex,PFC)之间形成双向连接[5]。但是目前丘脑背外侧核的解剖学连接和功能都尚未细化,而对其解剖学连接的研究是其功能学研究的基础。利用传统的示踪技术,比如在神经核团注射霍乱毒素B 亚单位(cholera toxin B subunit,CTb)逆向标记,发现前额叶扣带回、顶叶压后皮层(retrosplenial area,RSP)和内嗅皮层(entorhinal cortex,EC)等皮层区域都有对丘脑背外侧核的神经投射[6-7]。但是CTb 介导的逆向标记不能特异地标记核团内某一亚群细胞的投射,先前的工作也没有对全脑范围内的投射进行精确的定量分析。近年来,经过基因编辑的病毒已经成为神经领域绘制和操控神经环路的强有力的工具[8]。比如,利用基因重组技术将具有强感染性的狂犬病毒糖蛋白(rabies glycoprotein,RG)基因替换成一种禽类肉瘤/白血病病毒的包膜蛋白(envelope glycoprotein,EnvA)基因后,由于哺乳动物神经元不表达EnvA的受体TVA蛋白,无法被其感染。经过这些改造后的狂犬病毒被称为假性狂犬病毒。哺乳动物的神经元需通过其他方式补充TVA 并在细胞膜上表达,才能被假性狂犬病毒感染。同时,被感染的神经元还需要通过其他方式补充RG,假性狂犬病毒被RG 包裹后,才能从被感染的神经元中跨越突触传递到直接支配被感染神经元的上级神经元。为了让假性狂犬病毒感染的神经元具有特异性,通常采用Cre 重组酶依赖的表达TVA和RG 蛋白的腺相关病毒(adeno-associated virus,AAV)作为辅助病毒,同时使用病毒或者转基因动物以在特定亚群神经元中表达Cre 重组酶,从而介导Cre 重组酶依赖的TVA和RG蛋白的表达。待这些辅助蛋白在神经元中充分表达后注射假性狂犬病毒,该病毒能够识别TVA 从而进入表达该受体的神经元。在同时存在RG 蛋白的情况下,可以形成具有感染性的病毒颗粒而跨突触感染直接支配初始神经元的上级神经元。由于被感染的上级神经元中没有RG 蛋白,进入该神经元的狂犬病毒失去了跨突触再次传播的能力,从而使得改造后的假性狂犬病毒具有逆向跨一级突触的特性,最终实现在全脑范围内标记特定神经元亚群的直接输入神经元[9]。
丘脑背外侧核整合位于初级、中级和高级皮层区域的大量信息,但其功能尚未明确。为了研究丘脑背外侧核在视觉信息处理及视觉相关行为中的功能,本研究联合使用表达小麦胚芽凝集素(wheat germ agglutinin,WGA)和Cre 重组酶融合蛋白(WGA-Cre)的腺相关病毒、假性狂犬病毒辅助腺相关病毒和假性狂犬病毒来标记支配初级视觉皮层的丘脑背外侧核神经元亚群的全脑范围输入神经元。在获取病毒标记的鼠脑后,我们进行全脑切片和数据采集,结合使用本实验室自主研发的高通量解剖数据分析软件,定量分析支配初级视皮层的丘脑背外侧核神经元亚群的全脑输入神经元,绘制更精细的解剖学连接图谱,为进一步研究丘脑背外侧核的功能奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 清洁级C57BL/6J 雄性小鼠,8~10 周龄,5 只,体质量20~25 g,购自上海灵畅生物科技有限公司,生产许可证号为SCXK(沪)2013-0018。实验小鼠饲养于上海交通大学医学院实验动物中心,使用许可证号为SYXK (沪) 2018-0027;环境温度25 ℃,湿度50%~60%,每12 h 明暗交替,小鼠自由饮水进食。实验动物相关操作均符合上海交通大学医学院动物伦理相关规定。
1.1.2 主要试剂 表达WGA-Cre 的腺相关病毒(AAVEF1a-mCherry-IRES-WGA-Cre)由山东维真生物科技有限公司制作,Cre 重组酶依赖的表达TVA 的腺相关病毒(AAV-EF1a-DIO-TVA-mCherry)、Cre 重组酶依赖的表达RG 蛋白的腺相关病毒(AAV-CAG-DIO-RG)、携带增强绿色荧光蛋白的假性狂犬病毒(PRV-EGFP)均购自武汉枢密脑科学技术有限公司,包埋剂购自美国Thermo 公司,封片剂购自美国Vectorlabs公司。
微量注射器 (Nanoject Ⅱ, 美国Drummond Scientific),冰冻切片机(HM525,美国Thermo),高通量普通荧光显微镜(VS120,日本Olympus)。
1.2 实验方法
1.2.1 病毒注射 为了逆向跨单突触标记支配初级视皮层的丘脑背外侧核神经元亚群的全脑输入,本研究设计了病毒联合使用策略(图1)。小鼠经异氟烷(5%诱导和1.5%维持)麻醉后,放置于立体定位仪上固定。使用加热垫使小鼠在手术过程中体温保持在37 ℃。小鼠头部剃毛,75%乙醇消毒后,切开头部皮肤暴露颅骨。先使用颅骨钻在注射位点上开直径约0.5 mm 的小窗,再使用微量注射器在注射位点以60 nL/min 的速度注射病毒。
向右侧初级视皮层(前囟-3.5 mm,旁开2.8 mm,深度0.5 mm)注射AAV-EF1a-mCherry-IRES-WGA-Cre 500 nL (2.4×1013μg/mL); 同时将AAV-EF1a-DIO-TVAmCherry (5.40×1012μg/mL) 和 AAV-CAG-DIO-RG(3.06×1012μg/mL)按照1∶2比例混合后向右侧丘脑背外侧核(前囟-1.2 mm,旁开1.0 mm,深度2.8 mm)注射100 nL。28 d 后,向初级视皮层注射RV-EGFP(2.40×108IFU/mL)100 nL。

图1 标记支配初级视皮层的丘脑背外侧核神经元全脑输入神经元的病毒联合使用策略Fig 1 Strategy for joint viral labeling of the whole-brain inputs to LD neurons innervating V1
1.2.2 组织取样及处理 假性狂犬病毒注射7 d 后,10%戊巴比妥钠深度麻醉小鼠,1×PBS 灌流3 min 后,换用4%多聚甲醛固定。取出小鼠大脑放置于4%多聚甲醛中后固定过夜,30%蔗糖溶液脱水2 d。充分脱水后,使用包埋剂包埋,冷冻,在冰冻切片机中切成厚度50 μm 的冠状切片,最后使用含DAPI的封片剂进行封片。
1.2.3 荧光显微镜成像 使用可完成自动聚焦和快速荧光扫描拍摄的VS120 高通量普通荧光显微镜对小鼠脑切片进行荧光成像。每个鼠脑取全脑切片55~60 片进行成像,存储量约为20 GB。
1.2.4 解剖数据分析方法 使用本实验室开发的高通量解剖数据分析软件对荧光脑片图像进行分析。此套软件包括3 个模块:胞体信号检测、脑片图谱配对和全脑定量分析。胞体信号检测模块能够标记胞体位置。脑片图谱配对模块能够将脑片与艾伦脑科学研究所(Allen Institute)发布的数字化图谱进行精准配对。全脑定量分析模块能够综合前2 个模块的数据计算出全脑范围内每个脑区内标记的细胞数量和占全脑标记细胞的比例。
1.3 统计学分析
采用Excel 2013软件进行统计分析,Origin 2019软件制作数据图表。定量资料用±s表示。
2 结果
2.1 丘脑背外侧核中的起始神经元
本研究共注射了5 只小鼠,选取其中3 只注射位点准确的小鼠进行后续数据分析。在初级视皮层,感染AAVEF1a-mCherry-IRES-WGA-Cre 的神经元表达红色荧光蛋白(图2A),并且合成和分泌WGA-Cre。这些红色荧光蛋白会留在细胞胞体所在的初级视皮层区域,而WGACre则会被分泌到细胞外。支配初级视皮层的丘脑背外侧核神经元的轴突可以从视皮层捕获被分泌到细胞外的WGA-Cre,并将其逆向转运回位于丘脑背外侧核的胞体。在胞体内,融合蛋白中的Cre 重组酶完成对Cre 重组酶依赖的表达TVA 蛋白和RG 蛋白的AAV 的DNA 剪切和重组,从而诱导TVA和RG蛋白的表达。
与此同时,表达TVA和RG蛋白的神经元也会表达红色荧光蛋白,从而标记丘脑背外侧核中支配初级视皮层的神经元亚群(图2B)。AAV 注射28 d后,TVA 和RG 蛋白在丘脑背外侧核支配初级视皮层的神经元亚群中已经充分表达。此时再向初级视皮层注射表达绿色荧光蛋白的假性狂犬病毒,假性狂犬病毒与存在于视皮层中的丘脑背外侧核神经元轴突上的TVA 结合,从而进入该亚群的神经元。当假性狂犬病毒被逆向运回位于丘脑的胞体后,病毒基因组进行复制,并加入RG 蛋白组装成为有跨突触感染能力的狂犬病毒颗粒。这些狂犬病毒颗粒逆向跨单突触感染直接支配丘脑背外侧核投向初级视皮层神经元亚群的上游神经元后,可大量表达绿色荧光蛋白,使得这些上游神经元在荧光显微镜成像中清晰可见(图2C)。
起始神经元是假性狂犬病毒介导的逆向跨单突触感染实验中既被表达假性狂犬病毒辅助蛋白的AVV(红色荧光)感染,又被假性狂犬病毒(绿色荧光)感染的神经元。在丘脑背外侧核中,观察到黄色(红色和绿色荧光叠加的结果)起始神经元(36±8)个(图2D)。全脑范围内的输入神经元与起始神经元的比值为64±11,即假性狂犬病毒从一个丘脑背外侧核的起始神经元出发,平均能感染到大约64个直接支配它的上游输入神经元。

图2 病毒注射位点及荧光蛋白在各级神经元的表达情况Fig 2 Viral vector injection sites and the expression of fluorescence proteins in the neurons
2.2 丘脑背外侧核支配初级视皮层的神经元亚群的上游输入神经元的全脑范围定量分析
本研究在多个脑区观察到有假性狂犬病毒携带的绿色荧光标记的上游输入神经元,包括皮层(cortical areas)、间脑(interbrain)和中脑(midbrain)(图3)。其中皮层的输入神经元占全脑输入神经元总数的(58.1±4.8)%,间脑占(23.2±0.9)%,中脑占(15.3±4.0)%(图4)。在皮层区域,输入神经元最多的区域是躯体运动皮层(somatomotor area,MO)、视皮层(visual area,VIS)和躯体感觉皮层(somatosensory area,SS)。此外,与高级认知功能相关的皮层区域如前额叶的眶额叶皮层(orbital area,ORB)和扣带回皮层,中间联合皮层区域的后顶叶皮层(posterior parietal association area,PTLp)和压后皮层中也有大量输入神经元的分布(图3A、图4A)。在视皮层、听皮层(auditory area,AUD)和躯体感觉皮层中输入神经元的胞体主要分布在第5 层和第6 层(图5),与皮层这2 层神经元的调节功能相符。在间脑,输入神经元主要分布于未定区(zona incerta,ZI)、下丘脑腹侧正中核(hypothalamic medial zone,MEZ)、丘脑网状核团(thalamus reticular nucleus,TRN)和外侧膝状体腹侧部(ventral part of the lateral geniculate complex,LGv)(图3B、图4B)。在中脑,输入神经元主要分布于顶盖前区(pretectal region,PRT)、黑质(substantia nigra,SN)、上丘(superior colliculus,SC)和中脑网状核(midbrain reticular nucleus,MRN)(图3C、图4C)。

图3 全脑范围内假性狂犬病毒逆向示踪标记的输入神经元Fig 3 Whole-brain distribution of pseudorabies virus-labeled input neurons
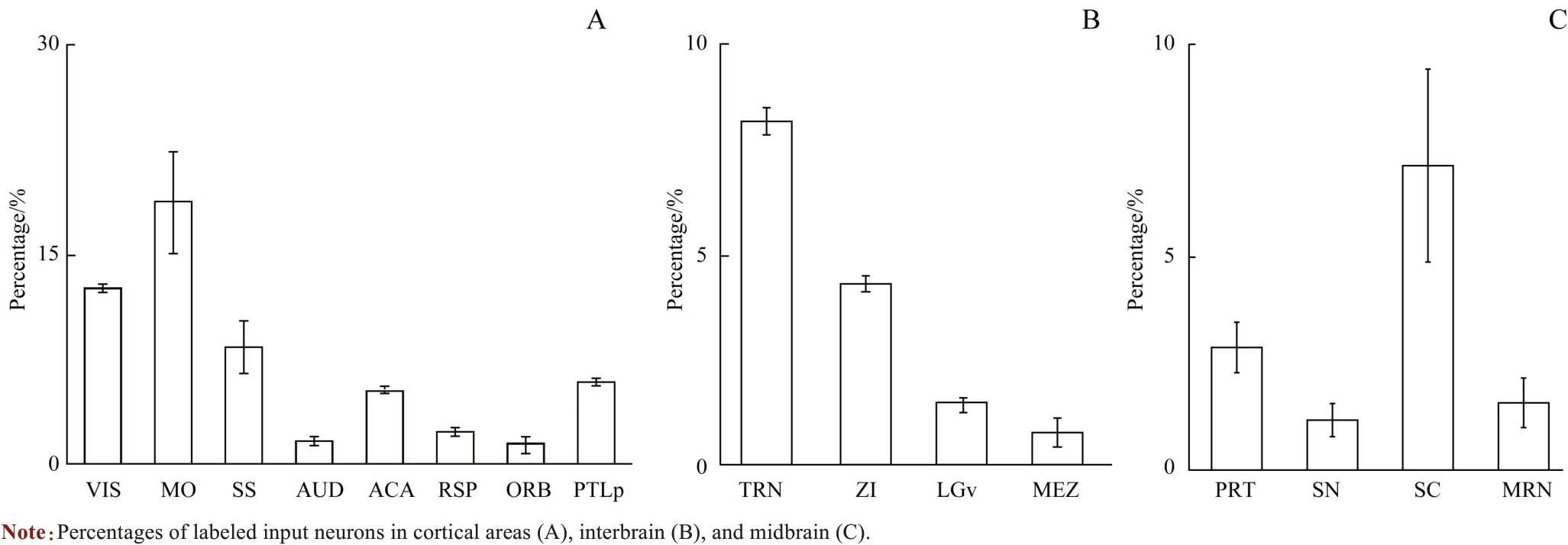
图4 全脑范围内各脑区假性狂犬病毒逆向示踪标记的输入神经元百分比Fig 4 Percentages of pseudorabies virus-labeled input neurons in the whole brain
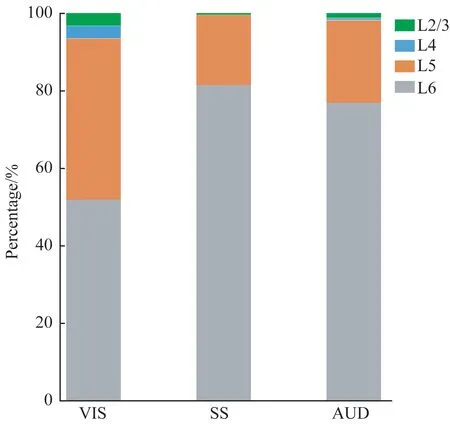
图5 假性狂犬病毒逆向标记的神经元在各感觉皮层中的分布Fig 5 Laminar distribution of pseudorabies virus-labeled input neurons in the sensory cortices
3 讨论
本研究利用自行设计的病毒注射策略和高通量数据分析软件进行定量分析,在全脑范围内标记出支配初级视皮层的丘脑背外侧核神经元亚群的直接输入神经元,绘制出了比传统示踪方法更加全面而精细的解剖学连接图谱,其中包括皮层-丘脑、中脑-丘脑和间脑-丘脑远距离连接。单个鼠脑的全脑范围解剖学数据的存储量可以达到20 GB 左右。若使用传统的图像分析软件(Image J)分析,耗时长、工作量大。本实验室自主研发的高通量解剖数据分析软件[10]能够获取神经元胞体在冠状切片的位置信息,还能利用脑片上的标记点,将脑片与Allen Institute 发布的数字化图谱进行一一对应,从而准确标记每个目标神经元在全脑范围内的位置,最后定量计算出各个脑区内标记到的上游输入神经元的分布比例。利用此高通量解剖数据分析软件分析一只小鼠脑片仅需5~6 h的时间,大大提高了分析效率。
丘脑作为皮层区域的主要输入来源,与皮层之间有大量的双向连接来进行信息交互处理[11]。本研究结果表明来自感觉皮层和前额叶皮层的输入占比最高。支配初级视皮层的丘脑背外侧核神经元亚群可以整合来自视皮层、听皮层和躯体感觉皮层等初级感觉皮层的信息和来自躯体运动皮层的运动控制信息,也可以同时接受来自更加高级的中间联合皮层和前额叶皮层的认知相关信息的调控。在整合了包括感觉、运动和认知的大量信息之后,该丘脑背外侧核的神经元亚群可以再将调控信息送回初级视皮层,从而调控视皮层神经元对视觉信息的处理,由此推测其可能参与了感觉信息自上而下的调控过程。
之前的研究中使用CTb 逆向示踪方法,显示次级运动皮层、前扣带回皮层[12]和压后皮层[6]的神经元投向丘脑背外侧核群。本研究结果也显示这些皮层区域直接支配丘脑背外侧核投向视皮层的神经元。前期研究报道内嗅皮层也直接支配丘脑背外侧核群,但我们的结果发现该区域被标记的神经元很少,推测内嗅皮层可能主要支配的是丘脑背侧核群中投向其他区域的神经元。除此之外,本研究还发现躯体感觉皮层、听皮层、后顶叶皮层以及眶额叶皮层都有神经元直接支配丘脑背外侧核投向视皮层的神经元。这些结果表明丘脑背侧核群中不同亚区或亚群的神经元可能受不同输入神经元的支配,要理清不同亚区或亚群的神经元解剖学连接图谱还需要进一步的研究。
丘脑神经元接收的兴奋性输入可以分为两大类:驱动型和调节型[1]。比如丘脑外侧膝状体接收的来自视网膜的信号就是驱动型信号;同时外侧膝状体神经元还接收来自初级视皮层第6层神经元的信号,该信号为调节型信号。丘脑枕核接收来自皮层第5 层神经元的驱动型信号,也接收来自第6 层神经元的调节型信号[13]。驱动型信号和调节型信号在丘脑神经元上的突触位置和电生理特性有所不同。比如驱动型信号主要发生在靠近胞体处的突触,激活离子通道型受体,产生紧张性放电(tonic firing),而调节型信号主要发生在远离胞体的树突突触,通过激活代谢型受体,产生爆发性放电(burst firing)[13]。本研究的结果显示丘脑背外侧核投向视皮层的神经元主要接收来自各感觉皮层区域第5 层和第6 层神经元的投射,而来自第5 层和第6 层神经元的兴奋性输入的电生理特性和功能如何则仍需进一步的研究。
间脑的丘脑网状核团是丘脑内的抑制性核团,主要由γ-氨基丁酸能神经元(GABAergic neuron)组成,它与几乎所有的丘脑核团形成双向的连接,在保持丘脑区域的兴奋/抑制平衡中起到非常重要的作用。最新研究[14-15]表明丘脑网状核团中心区的神经元支配丘脑初级核团,而外周区神经元支配丘脑高级核团,它们具有不同的输入强度和动力学特性。本研究结果显示,丘脑背外侧核中支配初级视皮层的神经元亚群接收的丘脑网状核的输入信号主要来自于其外周区,支持前述研究的结果。
中脑的上丘是感觉信息处理的中心之一,它直接接收来自视网膜神经节细胞和初级视皮层的输入,参与对视觉危险因素的躲避或对猎物发起捕食的本能反应[16]。在小鼠脑中,85%~90%的视网膜神经节细胞都可以直接支配上丘的神经元,从而传递视觉相关信号[17]。本研究结果显示,丘脑背外侧核神经元也接收上丘的投射,发起这些投射的上丘神经元是否直接接收视网膜神经元的输入,以及这些上丘投射传导何种信息还有待进一步研究。黑质是多巴胺能输入的主要来源之一,丘脑背外侧核神经元接收来自黑质的神经元投射,提示其功能可能受到多巴胺的调节,该过程在行为调节中的功能也值得进一步研究。
对环路的解剖学数据分析是对其功能学研究的基础。本研究通过多种病毒联合使用的策略以及高通量数据采集和软件定量分析,在全脑范围内标记出丘脑背外侧核中支配初级视皮层的神经元亚群的直接输入神经元,为进一步研究该神经元亚群及其接收的各远距离投射的功能奠定了基础。
参·考·文·献
[1] Sherman SM. Functioning of circuits connecting thalamus and cortex[J].Compr Physiol,2017,7(2):713-739.
[2] Halassa MM. Fronto-thalamic architectures for cognitive algorithms[J].Neuron,2018,98(2):237-239.
[3] Sherman SM, Guillery RW. Functional organization of thalamocortical relays[J]. J Neurophysiol,1996,76(3):1367-1395.
[4] Hu F, Kamigaki T, Zhang Z, et al. Prefrontal corticotectal neurons enhance visual processing through the superior colliculus and pulvinar thalamus[J].Neuron,2019,104(6):1141-1152.e4.
[5] Oh SW,Harris JA,Ng L,et al. A mesoscale connectome of the mouse brain[J].Nature,2014,508(7495):207-214.
[6] Shibata H. Organization of retrosplenial cortical projections to the laterodorsal thalamic nucleus in the rat[J]. Neurosci Res, 2000, 38(3):303-311.
[7] Shibata H. Direct projections from the entorhinal area to the anteroventral and laterodorsal thalamic nuclei in the rat[J]. Neurosci Res, 1996, 26(1):83-87.
[8] Haery L, Deverman BE, Matho KS, et al. Adeno-associated virus technologies and methods for targeted neuronal manipulation[J]. Front Neuroanat,2019,13:93.
[9] Viaene AN, Petrof I, Sherman SM. Properties of the thalamic projection from the posterior medial nucleus to primary and secondary somatosensory cortices in the mouse[J]. Proc Natl Acad Sci USA, 2011, 108(44): 18156-18161.
[10] Zhang SY, Xu M, Chang WC, et al. Organization of long-range inputs and outputs of frontal cortex for top-down control[J]. Nat Neurosci,2016,19(12):1733-1742.
[11] Hunnicutt BJ, Long BR, Kusefoglu D, et al. A comprehensive thalamocortical projection map at the mesoscopic level[J]. Nat Neurosci,2014,17(9):1276-1285.
[12] Shibata H, Naito J. Organization of anterior cingulate and frontal cortical projections to the anterior and laterodorsal thalamic nuclei in the rat[J].Brain Res,2005,1059(1):93-103.
[13] Sherman SM. Thalamus plays a central role in ongoing cortical functioning[J].Nat Neurosci,2016,19(4):533-541.
[14] Li Y, Lopez-Huerta VG, Adiconis X, et al. Distinct subnetworks of the thalamic reticular nucleus[J]. Nature,2020,583(7818):819-824.
[15] Martinez-Garcia RI, Voelcker B, Zaltsman JB, et al. Two dynamically distinct circuits drive inhibition in the sensory thalamus[J]. Nature, 2020,583(7818):813-818.
[16] Wang L, McAlonan K, Goldstein S, et al. A causal role for mouse superior colliculus in visual perceptual decision-making[J]. J Neurosci,2020,40(19):3768-3782.
[17] Ellis EM,Gauvain G,Sivyer B,et al. Shared and distinct retinal input to the mouse superior colliculus and dorsal lateral geniculate nucleus[J].J Neurophysiol,2016,116(2):602-610.

