3D 打印支架联合iPSCs-NSCs 对大鼠脊髓损伤后神经细胞凋亡及运动功能的影响
李长明 邓小梅 周化腾 全仁夫
脊髓损伤一直是困扰医学界的难题,常见于高处坠落、交通外伤,且呈现发病率高、致残率高的特点,常造成损伤平面以下的感觉、运动丧失,甚至瘫痪[1]。据不完全统计,中国有超过100 万的脊柱脊髓损伤患者,且以每年12 万的速度增长,不仅给患者带来严重的身心负担,同时也给家庭和社会形成了沉重的经济负担[2]。目前关于修复受损神经的研究越来越多,其中种子细胞+生物支架疗法被证实可以有效促进脊髓损伤的修复[3-4],但是其机制不明了,且细胞来源受到伦理学限制,难以扩大应用范围。因此,本实验采用人尿液来源重编程诱导性多能干细胞(induced pluripotent stem cells,iPSCs)并分化为神经干细胞(neural stem cells,NSCs)吸附于3D 打印支架上,移植于脊髓受损区域,观察其对大鼠运动神经元凋亡及运动功能的影响,并探讨其可能的机制。
1 实验材料
1.1动物 选用雄性SD 大鼠42 只,SPF 级,体质量200~250g,由湖南斯莱克景达实验动物有限公司提供[许可证号:SCXK(湘)2019-0004],给予足量的水和饲料,环境温度23~25℃,相对湿度40%~60%,明暗光照12h/12h,分笼饲养。本研究经伦理委员会审核,对动物处置方法符合相关伦理要求[伦理审查号:20170625182365]。
1.2主要试剂与仪器 聚乳酸-羟基乙酸共聚物(PLGA)(批号P133293)购于美国sigma 公司;山羊抗兔B 淋巴细胞瘤-2(Bcl-2)多克隆抗体(批号BS1511)、山羊抗兔Bcl 相关X 蛋白(Bax)多克隆抗体(批号BS1725)和半胱氨酸蛋白酶-3(Caspase-3)(批号BS7004)均购于美国Bioworld 公司;原位末端转移酶标记法(TUNEL)试剂盒(批号11684817910)购于中国罗氏生物公司。仪器包括荧光显微镜(型号CKX53)购于日本Olympus 公司;3D 打印机(型号Bio-Architect-Pro)购于中国杭州捷诺飞生物科技有限公司;可控性皮质损伤撞击仪(型号mode6.3)购于美国Custom Design 公司;手术器械购于中国江苏鱼跃医疗设备股份有限公司。
2 实验方法
2.1支架细胞预处理 将预先制备的3D 支架[5]截成2~3mm 的小段,置于干细胞培养基中浸泡48h后,在无菌操作台中风干,灭菌备用。按前期实验方法制备人来源iPSCs[6],并分离鉴定,并向NSCs 分化,将iPSCs-NSCs 细胞培养至第7 天时,消化计数,将1×106个细胞浓缩为0.2mL,滴于预处理过的支架上,置于培养箱中2h 后用于实验模型制备与术后处理。
2.2实验设计与分组 42 只SD 大鼠(SPF 级)按照随机数字表法分为三组,每组14 只。采用改良Allen's 法通过可控性皮质脊髓撞击仪构建脊髓损伤模型[7]。术后分笼饲养,37℃恒温下保温,每天以crede 手法按压排尿3 次,预防泌尿系统感染,术后3天以每天2 次的频率腹腔注射相同剂量庆大霉素(8mg/kg)预防感染。1 周后进行实验。麻醉后于T9-T10节段去除椎板,三组均切除损伤处脊髓2~3mm,给予不同干预措施。假手术组:只打开椎板;模型组:制作脊髓损伤模型,植入DMEM 培养液0.2mL;iPSCs-NSCs 组:植入载iPSCs-NSCs 的2~3mm 支架预处理。模型成功标准[8]:术后即刻大鼠出现痉挛性摆动,摆尾反射、双下肢迟缓性瘫痪,术后2h 进行Basso,Beattie and Bresnahan(BBB)评分评估小鼠后肢运动能力,BBB 评分为0 分时,则模型构建成功。
2.3后肢运动功能恢复的行为学评估 在术后1、3、7、14、28 天,将大鼠放入开口箱子,轻敲箱壁,使其爬行,观察动物运动距离,臀、膝、踝关节行走、躯干运动及其协调情况,每只大鼠观察15min,对各组大鼠的运动能力进行BBB 评分测试,评估采取双盲法,由熟悉BBB 评分量表的实验人员进行。
2.4苏木精-伊红(HE)染色检测脊髓损伤程度 各组动物均于干预8 周后处死,经40g/L 多聚甲醛心脏灌注固定取脊髓组织样本(T9-T10节段),PBS 清洗后置于40g/L 多聚甲醛中固定,再行脱水、包埋、切片等步骤,行HE 染色,镜下观察各组脊髓瘢痕和空洞面积,评价脊髓损伤程度。
2.5免疫组化检测Bax、Bcl-2 变化 每只大鼠取3张切片,按SP 试剂盒说明书测定Bcl-2、Bcl-2 相关性死亡蛋白(Bad)、Bax 的表达,常规脱蜡至水,3%过氧化氢处理、高温修复、血清封闭、滴加一抗过夜(浓度为1∶150),并同时用PBS 代替一抗作为阴性对照,4℃孵育过夜、隔日滴加二抗孵育20min、SABC 37℃孵育20min,继而DAB 显色,镜下观察显色背景。以上各步骤间均用0.01mol/L PBS 漂洗3 次,每次5min,梯度乙醇逐级脱水,二甲苯透明,中性树脂封片,光镜下观察脊髓组织变化。
2.6RT-PCR 检测Caspase-3 mRNA 表达 采用RNA 自旋试剂盒说明书方法抽提总RNA。反转录体系含4μL DNAse 处理过的RNA、Buffer 5μL、1μL dNTPs(10μM)、1μL Oligo (dT)、0.5μL 随机引物(100μM)、1μL MMLV 逆转录酶(200U/μL)、8.5μL DEPC H2O,共20μL。然后按以下条件进行反转录反应。30℃ 10min,42℃ 60min,99℃ 5min,4℃ 5min。取出后在0.2mL PCR 管内,依次加入1μL 反转录产物(RT 产物),各基因上游与下游引物各0.25μL,12.5μL PCR 反应mix(Taq 酶,Taq buffer,dNTPs),用ddH2O 补足体积至25μL。按以下条件进行反转录反应,94℃预变性2min,94℃变性30s,56℃/55℃/48℃退火30s,72℃延伸30s,72℃延伸10min,扩增35 个循环。用one-Dscan 图像分析软件分析目标条带的灰度值。
从GenBank 获得目的基因mRNA 的全长序列,利用引物和探针设计软件Primer 5.0 设计引物序列。经过Blast 分析,引物序列具有特异性。所用的引物及内参照β-actin 引物见表1。引物均委托南昌中洪博元生物有限公司合成。
2.7统计学方法 应用SPSS 16.0 进行统计分析,计量资料以均数±标准差(±s) 表示,多组间比较采用方差分析,两两比较采用t 检验,P<0.05 差异有统计学意义。
3 结果
3.13D 打印支架联合iPSCs-NSCs 促进脊髓损伤大鼠运动功能恢复 手术前所有大鼠BBB 评分均为21 分。假手术组因未损伤脊髓,术后BBB 评分均为21 分。术后1、3 天,模型组和iPSCs-NSCs 组比较,差异无统计学意义(P>0.05)。术后7、14、28 天,模型组和iPSCs-NSCs 组大鼠双下肢运动功能均得到一定程度的恢复(P<0.05),iPSCs-NSCs 组较模型组恢复更好(P<0.05),见表2。
表2 各组大鼠BBB 评分比较(分,±s)

表2 各组大鼠BBB 评分比较(分,±s)
注:假手术组不做处理;模型组植入DMEM 培养液0.2mL;iPSCs-NSCs 组植入载iPSCs-NSCs 的2~3mm 支架预处理;iPSCs 为诱导性多能干细胞;NSCs 为神经干细胞;BBB 评分为Basso,Beattie and Bresnahan 行为评分法;与同组术后1 天比较,aP<0.05;与同组术后3 天比较,bP<0.05;与模型组同期比较,cP<0.05
3.23D 打印支架联合iPSCs-NSCs 促进脊髓损伤大鼠脊髓神经元修复 干预28 天后,HE 染色显示假手术组脊神经生长良好;模型组脊神经受到损伤,组织水肿,细胞稀疏,细胞之间的间隙增大;iPSCs-NSCs 组细胞生长较模型组紧密,各组织生长间隙缩小,空泡减小,组织水肿消失。见图1。
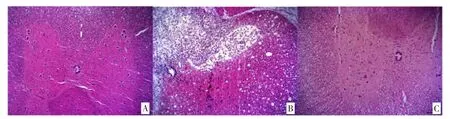
图1 各组大鼠脊髓组织HE 染色结果(HE 染色×100)
3.33D 打印支架联合iPSCs-NSCs 抑制脊髓损伤大鼠凋亡相关蛋白表达 免疫组化染色切片上,免疫阳性染色呈棕褐色。免疫组化结果显示,在脊髓损伤后28 天,iPSCs-NSCs 组Bcl-2 阳性细胞的表达较模型组多(P<0.05);iPSCs-NSCs 组Bax 阳性细胞的表达较模型组少(P<0.05)。见图2、表3。
表3 各组大鼠脊髓组织Bcl-2、Bax 阳性表达比较(个/mm2,±s)
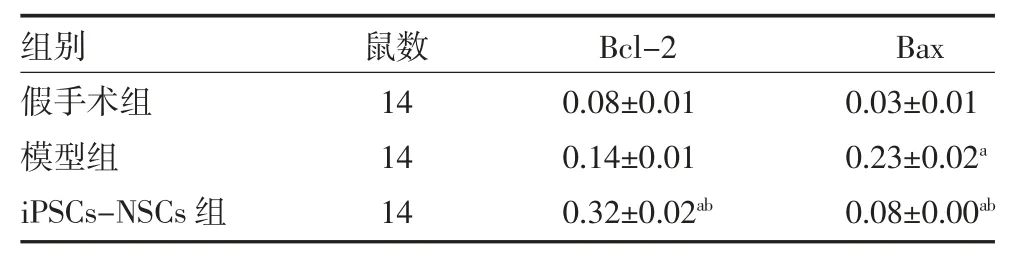
表3 各组大鼠脊髓组织Bcl-2、Bax 阳性表达比较(个/mm2,±s)
注:假手术组不做处理;模型组植入DMEM 培养液0.2mL;iPSCs-NSCs 组植入载iPSCs-NSCs 的2~3mm 支架预处理;iPSCs 为诱导性多能干细胞;NSCs 为神经干细胞;Bcl-2 为B 淋巴细胞瘤-2;Bax 为Bcl 相关X 蛋白质;与假手术组比较,aP<0.05;与模型组比较,bP<0.05
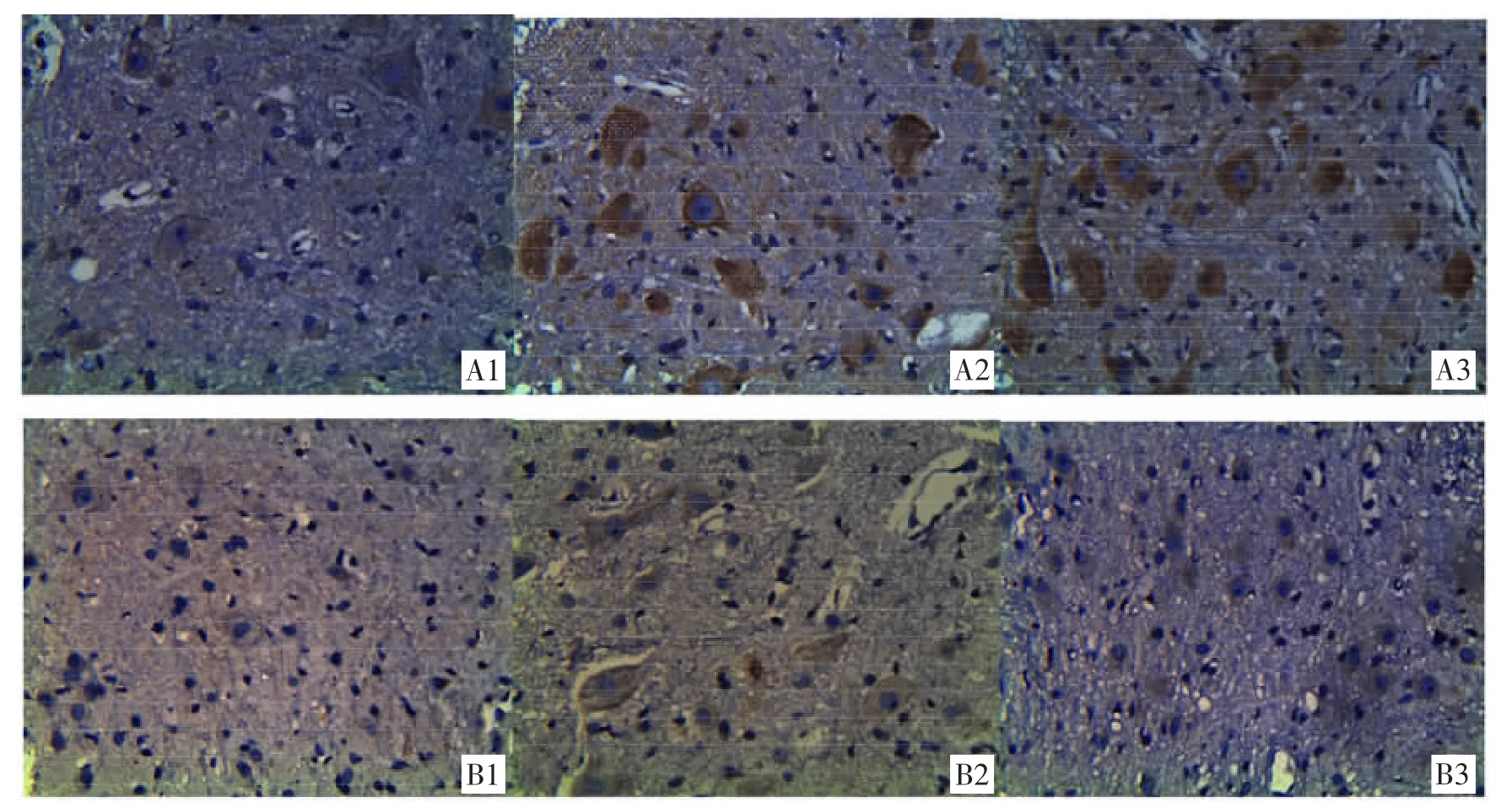
图2 各组大鼠脊髓神经组织Bcl-2 和Bax 阳性表达情况(免疫组化×100)
RT-PCR 结果显示,脊髓损伤术后28 天,iPSCs-NSCs 组Caspsase-3 mRNA 表达量较模型组少(P<0.05),较假手术组无明显改变(P>0.05)。见图3、表4。
表4 各组大鼠脊髓组织Caspase-3 mRNA 表达量比较(±s)
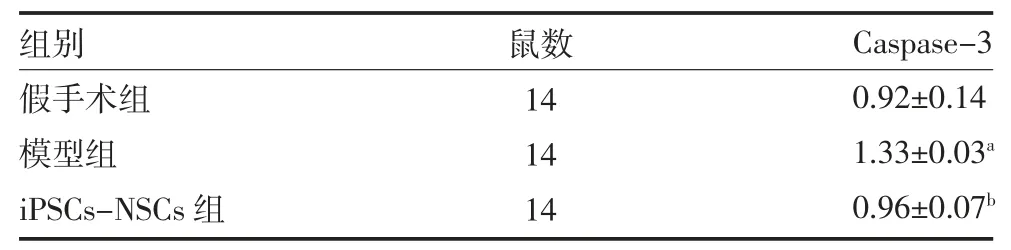
表4 各组大鼠脊髓组织Caspase-3 mRNA 表达量比较(±s)
注:假手术组不做处理;模型组植入DMEM 培养液0.2mL;iPSCs-NSCs 组植入载iPSCs-NSCs 的2~3mm 支架预处理;iPSCs 为诱导性多能干细胞;NSCs 为神经干细胞;Caspase-3 为半胱氨酸蛋白酶-3;与假手术组比较,aP<0.05;与模型组比较,bP<0.05
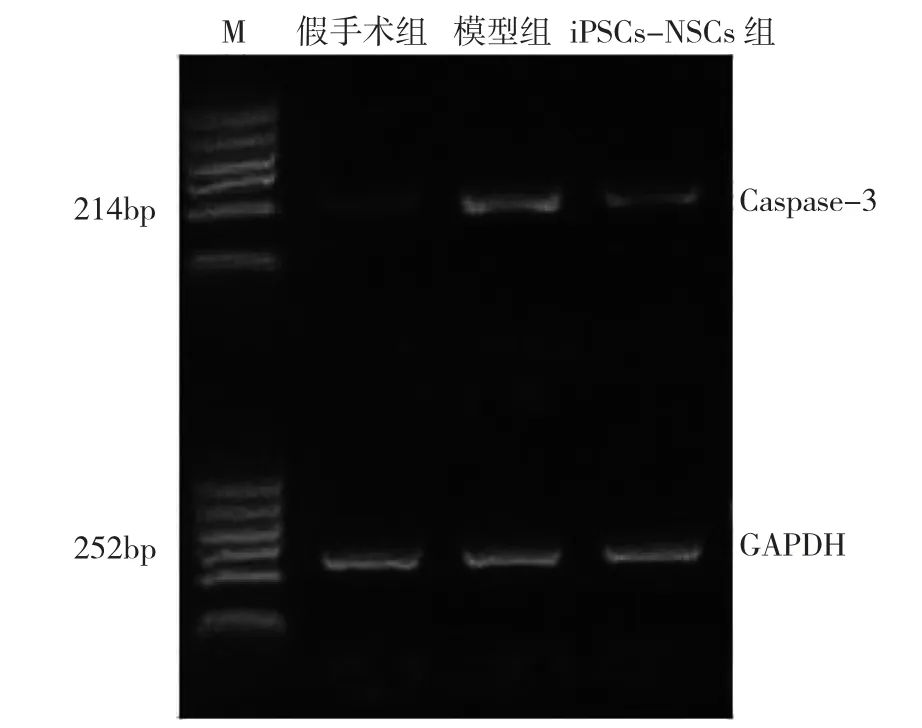
图3 各组大鼠受损节段脊髓组织Caspase-3 mRNA 表达情况
4 讨论
随着组织工程学的发展,种子细胞+生物支架疗法因其类似于体内正常组织中细胞-细胞外基质间的动态相互作用,被越来越多地用于脊髓损伤修复研究[9-10]。张仁坤等[3]研究证实,3D 打印支架载NeuroDl 修饰的NSCs 能够促进脊髓损伤大鼠神经环路的重建,对运动和感觉功能恢复有促进作用。曹宗锐等[4]利用胶原-硫酸肝素支架联合神经干细胞,促进大鼠脊髓损伤处神经纤维的再生,改善大鼠双侧后肢运动功能。本研究通过3D 打印支架联合iPSCs-NSCs 治疗脊髓损伤大鼠,发现28 天后,iPSCs-NSCs组BBB 评分高于模型组(P<0.05),且28 天后脊髓组织病理切片显示iPSCs-NSCs 组细胞生长较模型组紧密,各组织生长间隙缩小,空泡减小,组织水肿消失,说明该方法能促进脊髓损伤后大鼠感觉和运动功能的恢复,但是其机制还需要进一步探讨。
脊髓功能丧失主要是由继发改变引起的,在损伤急性期通过减轻或消除继发性病理变化、保护残存的轴突和神经元不再遭受二次损伤,是目前关于脊髓损伤治疗研究的重点[11]。脊髓损伤主要是由于损伤后水肿的发生,激活一系列分子和细胞机制,引发炎症反应等,最终导致细胞的凋亡和坏死。运动神经元细胞凋亡影响运动功能的恢复。有研究表明,Bcl-2、Bax 蛋白和Caspase-3 在脊髓损伤后神经细胞的凋亡中发挥关键性作用[12]。Bcl-2 是凋亡抑制因子,能够抑制或有效阻止脊髓损伤后各种途径引起的细胞凋亡,促进受损神经组织的修复。Bax 是凋亡促进因子,脊髓损伤后可刺激Bax 蛋白使线粒体膜的通透性发生变化,诱导神经细胞凋亡。Caspase-3 是凋亡执行因子,其表达水平可一定程度上反映细胞凋亡的情况。本研究结果表明,iPSCs-NSCs 组Bcl-2 阳性细胞表达明显增加,Bax 阳性细胞和Caspase-3 mRNA 表达明显减少,与模型组比较,差异具有统计学意义(P<0.05)。表明3D 打印支架联合iPSCs-NSCs干预可使脊髓损伤大鼠Bcl-2 表达上调,Bax 和Caspase-3 表达下调,因而有效抑制神经细胞凋亡。
脊髓损伤后局部胶质瘢痕形成,上下行神经传导束中断,微环境受损及神经元细胞凋亡、坏死造成脊髓不可逆性恢复,本研究中采用3D 打印支架替换受损脊髓,不仅为中断的神经环路提供了“桥梁”,而且3D 打印支架是中空多孔的结构,为上下行传导束重建和轴突生长提供通道并除去物理隔离,对改善其物理微环境有着积极的作用。NSCs 是一种多能干细胞,有永久的增殖能力及分化多向性,可改善受损神经元细胞,是理想的种子细胞。NSCs 移植能够抑制神经细胞凋亡,改善受损神经元神经功能缺失[13-14]。本文采用人尿液细胞提取、分化成NSCs,不仅无创,费用低,且有效避免了伦理学的限制。
综上所述,3D 打印支架联合iPSCs-NSCs 可明显恢复脊髓损伤大鼠运动功能,其原因可能为3D 打印支架为中断的神经环路提供了“桥梁”,NSCs 改善了受损脊髓微环境,其具体机制可能与上调Bcl-2表达及下调Bax、Caspase-3 表达,从而降低脊髓神经元细胞凋亡相关。

