胰岛素样生长因子1受体α亚单位基因重组真核表达质粒的构建
吴蕊辛,郑薇,李宁,芮忠颖,周雅倩,王萱
天津医科大学总医院,天津 300052
Graves病是自身免疫性甲状腺病最常见的类型[1]。Graves眼病(GO)是Graves病最常见的甲状腺外表现[2],通常累及眼球后脂肪、眼外肌等,从而造成眼部炎症、组织肿胀和纤维变性。目前研究认为,促甲状腺素受体抗体(TRAb)在Graves病及GO的发病过程中起重要作用。近年有研究报道,GO患者眼眶成纤维细胞中胰岛素样生长因子1受体(IGF-1R)高表达,IGF-1R是GO的致病抗原之一[3-4]。胰岛素样生长因子1(IGF-1)通过与IGF-1R结合刺激GO患者眼眶成纤维细胞分泌透明质酸,与增多的脂肪细胞共同参与GO的发生发展,IGF-1R是GO患者眼眶成纤维细胞增殖的重要始动因素[5-6]。本课题组前期通过转染促甲状腺激素受体(TSHR)α亚单位重组质粒成功诱导出Graves病小鼠模型[7-8],鉴于IGF-1R在GO发病过程中的重要作用,本研究拟构建IGF-1R重组真核表达质粒,为诱导Graves病伴GO动物模型奠定基础。
1 材料与方法
1.1 材料 TRIzol试剂购自美国Gibco公司,RTPCR试剂盒购自日本TaKaRa公司,限制性内切酶BamHⅠ、ScaⅠ、HindⅢ购自美国NEB公司,质粒提取试剂盒、DNA Marker、DNA纯化试剂盒购自北京天为时代科技有限公司,E.coli TOP10和pcDNA™3.1D/V5-His-TOPO购自美国Invitrogen公司,上下游引物合成及DNA测序由上海生工生物技术公司完成。
1.2 方法
1.2.1 引物设计 根据美国国立生物技术信息中心(NCBI)公布的人IGF-1R基因编码序列(NM_000875.5)和pcDNA™3.1D/V5-His-TOPO质粒载体信息,设计扩增IGF-1Rα亚单位引物,并在上游引物5'-端增加CACC拓扑克隆位点,保证克隆方向正确性和提高克隆效率。上游引物序列:5'-CACCATGAAGTCTGGCTCCG-3',下游引物序列:5'-TAGCTTGGCCCCTCCATACT-3',扩增产物长度2 679 bp。
1.2.2 甲状腺组织总RNA提取 收集来自天津医科大学总医院甲状腺外科Graves病患者手术切除的新鲜甲状腺组织,采用TRIzol一步法提取总RNA。取组织标本约50 mg,在放有液氮的研钵中研成粉末后移入加有1 mL试剂的冰浴的玻璃匀浆器中,冰浴下匀浆5 min。匀浆液移入1.5 mL离心管中,25℃水浴5 min,加入0.2 mL三氯甲烷剧烈振荡15 s,25℃水浴3 min,4℃12 000 g离心15 min。吸取上层水相加等量异丙醇,混匀,25℃水浴10 min,4℃12 000 g离心15 min。弃上清,RNA沉淀中加入由DEPC处理的水配制的75%乙醇1 mL,旋转混匀,4℃7 500 g离心5 min,弃去上清液。将RNA沉淀自然凉干,加入DEPC处理的水60μL,55℃温浴10 min溶解RNA。利用紫外—可见光分光光度计测定RNA纯度和浓度,1%甲醛变性琼脂糖凝胶电泳鉴定RNA完整性。
1.2.3 逆转录合成甲状腺cDNA 以500 ng总RNA为模板,用Oligo(dT)为引物,按照逆转录试剂盒说明制备cDNA。
1.2.4 IGF-1Rα亚单位基因PCR扩增 用Taq Platinum聚合酶扩增IGF-1Rα亚单位基因片段。PCR反应体系:上游引物(10μmol/L)1μL,下游引物(10μmol/L)1μL,cDNA 1.5μL,2×MasterMix 12.5μL,去离子水9.0μL,总反应体积25μL。PCR反应条件:94℃预变性3 min,94℃变性45 s,63℃退火1 min,72℃延伸45 s,共35个循环,最后72℃延伸7 min。PCR产物用1%琼脂糖凝胶电泳,溴化乙锭染色,凝胶成像仪上观察分析扩增结果,切取含目的片段(2 679 bp)的凝胶,以DNA纯化试剂盒回收纯化目的片段用于与载体连接。
1.2.5 IGF-1Rα-pcDNA™3.1D/V5-His-TOPO真核表达质粒的构建 用新鲜的IGF-1Rα亚单位基因PCR回收产物与pcDNA™3.1D/V5-His-TOPO载体(5 514 bp)进行拓扑克隆连接。将PCR回收产物1μL、TOPO vector 1μL、反应缓冲液1μL、超纯水3μL轻柔混合,室温(22~23℃)孵育30 min。取4μL混合物与E.coli One Shot®TOP10(50μL)感受态细胞混合,冰浴30 min。将混合物置于42℃的水浴中热休克30 s,使混合物立即冷却,加入250μL SOC培养基,放入空气浴振荡器,37℃200 r/min 30 min。取100μL反应物铺于含氨苄青霉素100μg/mL的LB培养板上,37℃培养过夜后观察菌落生长情况。
1.2.6 IGF-1Rα-pcDNA™3.1D/V5-His-TOPO真核表达质粒的鉴定 次日从培养板中随机挑取3个阳性单克隆菌落(命名为1号、6号、8号),分别接种于5 mL LB液体培养基中,加入5μL 1 mg/mL的氨苄青霉素,混匀,37℃200 r/min振荡培养过夜。按照质粒提取试剂盒说明书提取IGF-1Rα-pcDNA™3.1D/V5-His-TOPO重组质粒,以其为模板进行PCR扩增(反应条件同前)鉴定。用限制性内切酶HindⅢ或BamHⅠ分别消化重组质粒,IGF-1Rα-pcDNA™3.1D/V5-His-TOPO重组质粒0.5μL(1μg/μL),10×HindⅢ或BamHⅠ酶切缓冲液3μL,再加HindⅢ或BamHⅠ1μL(10 U/μL),以超纯水补充体积至30μL,37℃消化2 h,产物行1%琼脂糖凝胶电泳。先用限制性内切酶BamHⅠ消化IGF-1Rα-pcDNA™3.1D/V5-His-TOPO重组质粒,反应条件同前,行1%琼脂糖凝胶电泳并回收酶切产物。再用ScaⅠ消化上述酶切产物,酶切产物5μL,10×ScaⅠ酶切缓冲液3μL,ScaⅠ1μL(10 U/μL),以超纯水补充体积至30μL,37℃消化2 h,产物行1%琼脂糖凝胶电泳。经PCR验证和限制性内切酶酶切鉴定阳性的重组质粒分别以T7正向引物和BGH反向引物为测序引物进一步做测序分析,并与目的基因序列进行比对验证。
2 结果
2.1 Graves病患者甲状腺组织总RNA纯度、完整性测定结果 Graves病患者甲状腺组织中总RNA OD260/OD280为1.8~2.0,纯度较好。1%甲醛变性琼脂糖凝胶电泳显示RNA 28 s、18 s大小亚基结构完整,结果见图1。
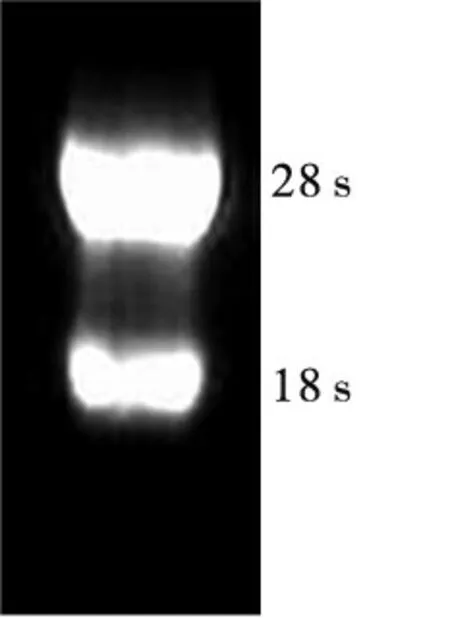
图1 Graves病患者甲状腺组织中总RNA 1%甲醛变性琼脂糖凝胶电泳图
2.2 IGF-1Rα亚单位基因PCR扩增结果 1%琼脂糖凝胶电泳显示,PCR产物在约2 600 bp处可见一条清晰、特异的条带,与目的基因片段长度2 679 bp基本吻合,见图2。
2.3 IGF-1Rα-pcDNA™3.1D/V5-His-TOPO重组质粒的鉴定结果 含有IGF-1Rα-pcDNA™3.1D/V5-His-TOPO重组质粒的单克隆菌落见图3。以该重组质粒为模板PCR扩增产物琼脂糖凝胶电泳显示,在约2 600 bp处可见清晰、特异的目的条带,初步证实重组质粒中含有IGF-1Rα亚单位目的基因(2 679 bp)片段,见图4。
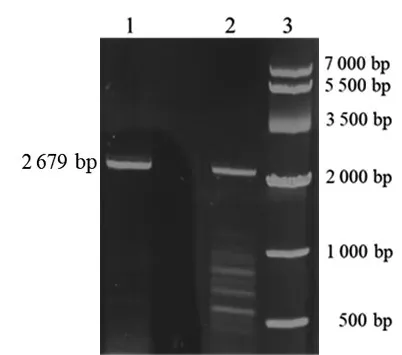
图2 IGF-1Rα亚单位基因PCR产物电泳图
图3 转化IGF-1Rα-pcDNA™3.1D/V5-His-TOPO重组质粒的大肠杆菌阳性菌落
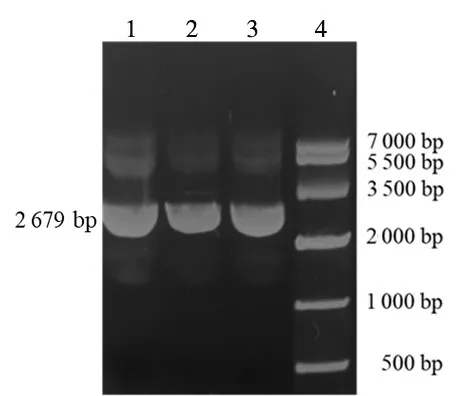
图4 IGF-1Rα-pcDNA™3.1D/V5-His-TOPO重组质粒PCR扩增产物电泳图
重组质粒经单酶切(HindⅢ或BamHⅠ),分别产生约8 100 bp单一特异产物,与IGF-1Rα-pcDNA™3.1D/V5-His-TOPO重组质粒(8 193 bp)大小一致,见图5。经双酶切(BamHⅠ和ScaⅠ),产生约250 bp和7 900 bp两条特异产物条带,与预期结果265 bp和7 928 bp相符,见图5。重组质粒酶切结果证明,筛选出的阳性菌落中含有IGF-1Rα-pcDNA™3.1D/V5-His-TOPO重组质粒。
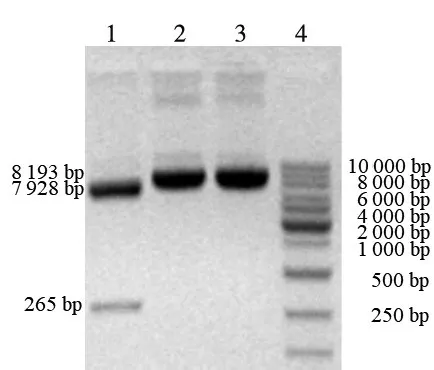
图5 IGF-1Rα-pcDNA™3.1D/V5-His-TOPO重组质粒酶切鉴定电泳图
经比对,插入的目的片段序列与NCBI公布的人IGF-1Rα亚单位基因编码序列(NM_000875.5)完全一致,接口序列与Invitrogen公司的pcDNA™3.1D/V5-His-TOPO载体一致,读码框架正确。证明IGF-1Rα亚单位目的基因片段已成功插入表达载体,IGF-1Rα-pcDNA™3.1D/V5-His-TOPO真核重组表达质粒构建成功。
3 讨论
GO是Graves病最常见的甲状腺外表现,25%~50%的Graves病患者会发展为GO,其表现为因眶内结缔组织和脂肪组织扩张而出现眼球突出等临床症状[9]。GO的发病机制目前尚不明确,1986年人们首次在大鼠甲状腺细胞中发现促甲状腺激素(TSH)和IGF-1信号通路间存在联系[10]。2008年TSUI等[11]通过比较GO患者和健康对照者眼眶成纤维细胞和甲状腺细胞表面IGF-1R、TSHR水平,发现TSHR、IGF-1R之间存在物理和功能上的共定位现象,TSHR、IGF-1R在甲状腺和眼眶组织中可能共同构成一个功能复合体。TSHR和IGF-1R是导致GO患者眼眶成纤维细胞增殖的重要因素[5-12]。
关于Graves病动物模型的研究已有30余年,但至今尚未制备出比较理想的Graves病伴GO的动物模型。2013年MOSHKELGOSHA等[13]用TSHRα亚单位基因重组腺病毒免疫小鼠产生TRAb而诱导出Graves病模型,部分模型小鼠出现眼眶肿胀充血、单侧或双侧眼球突出,大部分小鼠眼外肌增粗,有些小鼠出现球后脂肪组织増多,球后肌纤维黏多糖沉积及CD3+T细胞、巨噬细胞和肥大细胞眶内浸润,眼眶部位MRI成像显示眼眶肌增粗和周围脂肪增多等,但小鼠血清TRAb大部分为促甲状腺素受体阻断性抗体(TSBAb),甲状腺组织病理学表现为甲状腺功能减退。2017年XIA等[14]报道,在约30%Graves病小鼠中观察到眼裂增宽、眼部MRI显示眼外肌增大、眼外肌T淋巴细胞浸润(约50%)及透明质酸聚集(约30%),但未见明显眼球突出和球后脂肪增多。
随着对GO发病机制认识的不断深入,IGF-1R作为GO的重要致病抗原,逐渐成为GO发病机制的研究热点分子[12]。IGF-1R是一种酪氨酸激酶受体家族跨膜受体,由2个α亚基和2个β亚基组成,α亚基(残基1-707)完全位于胞外且与配体结合,是IGF-1R与IGF-1结合的主要部位,β亚基(残基712-1337)是包括细胞内酪氨酸激酶结构域的跨膜结构[15-16]。配体IGF-1与IGF-1Rα亚基的结合会诱导受体的构象变化,导致β亚基的激酶催化C结构域中的三个酪氨酸残基发生自磷酸化,活化下游信号传导通路[17],因此IGF-1Rα亚单位是IGF-1R发挥生物学功能的核心区域,在GO的发生发展中起关键作用。
本研究设计构建IGF-1Rα亚单位重组真核表达质粒用于诱导Graves病伴GO小鼠模型是基于以下两点考虑:第一,IGF-1Rα亚单位在GO的发生发展中起着独特作用,目前罕见应用IGF-1Rα亚单位基因诱导GO模型的成功报道;第二,相较于IGF-1R基因全长,α亚单位基因片段更小,有利于通过电穿孔将重组质粒转染动物,转染效率高,更易诱导出GO动物模型。根据人类蛋白质图谱公布的人体各类组织中IGF-1R水平分布情况可知,性腺、小脑、胰腺、甲状腺等组织中IGF-1R高表达,考虑组织获得的难易程度和体积大小,最终选择从甲状腺外科切除术中获得Graves病患者的新鲜甲状腺组织,采用TRIzol一步法提取总RNA。根据NCBI公布的人IGF-1R基因编码序列和pcDNA™3.1D/V5-His-TOPO质粒载体信息设计了多对引物作为候选。自身配对较多的引物会导致PCR产生非特异性扩增,引物GC含量过高会导致扩增困难,因此本研究选定自身互补配对数小于5且GC含量小于60%的引物作为特异性的扩增引物,运用RT-PCR技术扩增出IGF-1Rα亚单位mRNA编码序列,其长度为2 679 bp,编码893个氨基酸。此外,引物设计时还考虑到载体5'-末端悬挂四个碱基GTGG,在上游引物加5'-端CACC,这样既可以保证拓扑克隆方向正确,又可以提高连接效率(正确率大于90%),大大减少了后续重组质粒鉴定的工作量。
综上所述,本研究成功构建了IGF-1Rα-pcDNA™3.1D/V5-His-TOPO重组真核表达质粒,为诱导Graves病伴GO动物模型研究奠定了基础。

