血清CC16、Ang-2水平对重症肺炎患者预后的预测价值
王敏,郝明伟,陈晓明,张琳
合肥市第一人民医院,合肥 230601
肺炎主要由细菌和病毒感染肺部所致,是较为常见的呼吸道感染性疾病[1]。肺炎患者的预后视其病情严重程度而定,病情较轻患者可自行痊愈,而病情严重时则会危及患者的生命,是导致患者死亡的主要原因之一[2]。重症肺炎的发生发展十分迅速,准确且及时判断重症肺炎对于肺炎患者的诊治和预后评估尤为重要[3]。克拉拉细胞蛋白16(CC16)主要由支气管黏膜上的柱状上皮细胞产生,具有免疫调节和炎症抵抗等生物学功能[4]。在慢性阻塞性肺疾病和呼吸窘迫综合征等呼吸道炎症性疾病患者中表达下调,在慢性阻塞性肺疾病和呼吸窘迫综合征的诊断中具有一定临床价值[5-6]。血管生成素-2(Ang-2)主要由血管周皮细胞分泌产生,起促进血管生成和炎症反应的作用[7],在急性呼吸窘迫综合征和急性肺损伤患者中表达上调,与呼吸道炎症性疾病的发生密切相关[8-9]。目前仍然缺乏重症肺炎的有效血清学诊断指标,本研究检测血清CC16、Ang-2水平,旨在探讨其在重症肺炎患者中的水平变化及其对患者预后的预测价值。
1 资料与方法
1.1 临床资料 选择2018年2月—2020年5月我院诊治的132例重症肺炎患者作为重症肺炎组。纳入标准:均符合世界卫生组织制定的重症肺炎诊断标准[10];入院前6个月内无外科手术史;可完成各项检测并积极配合;胸部CT检查结果显示两肺有磨玻璃影,双肺可闻见爆裂音,无杵状指,出现呼吸困难症状且无心脏疾病及明显感染;临床资料完整。排除标准:肝肾功能异常;存在自身免疫性疾病;存在全身性感染性疾病;合并肿瘤;近期接受过糖皮质激素治疗。其中男76例、女56例,年龄48~77(62.26±13.74)岁,BMI为19~26(23.29±2.19)kg/m2,有吸烟史30例,有酗酒史22例,有高血压史29例,有糖尿病史25例。根据患者随访1个月后的预后情况将患者进一步划分为存活组(90例)和死亡组(42例)。选择同期在我院进行健康体检的100例健康者作为健康对照组,其中男58例、女42例,年龄49~76(62.69±12.58)岁,BMI为19~26(23.01±2.59)kg/m2,有吸烟史31例,有酗酒史21例。重症肺炎组与健康对照组年龄、性别比例、BMI和吸烟史等一般资料比较差异无统计学意义。本研究经医院伦理委员会审核,所有入选者签署知情同意书。
1.2 血清Ang-2和CC16以及生化指标检测 患者入院后(体检人员体检当日)抽取空腹静脉血5 mL,室温静置30 min后5 000 r/min(离心半径12.5 cm)离心20 min。将上清液转移至另一洁净离心管中,-80℃冻存用于后续检测。采用酶联免疫吸附法检测Ang-2和CC16,分别使用Ang-2检测试剂盒(美国Abcam科技有限公司)和CC16检测试剂盒(美国Abcam科技有限公司)进行检测,实验操作严格按照试剂盒说明书进行。采用全自动生化分析仪(美国哈尔德尔科技有限公司)检测总胆固醇、甘油三酯、低密度脂蛋白、高密度脂蛋白、载脂蛋白、白蛋白和总胆红素,采用血糖检测仪(美国罗氏诊断科技有限公司)检测患者血糖。采用血气分析仪(美国雅培科技有限公司)检测PaO2和PaO2/FiO2。
1.3 统计学方法 采用SPSS20.0统计软件。计量资料以±s表示,组间比较采用独立样本t检验∶计数资料比较采用χ2检验。采用多因素Logistic回归模型分析预后的影响因素,采用受试者工作特征(ROC)曲线分析各指标对患者预后的诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 重症肺炎组与健康对照组血清Ang-2、CC16水平比较 重症肺炎组血清Ang-2水平高于健康对照组,血清CC16水平低于健康对照组(P均<0.05),见表1。

表1 重症肺炎组与健康对照组血清Ang-2、CC16水平比较(μmol/L,xˉ±s)
2.2 存活组和死亡组临床资料比较 存活组男51例、女39例,有吸烟史18例,有酗酒史14例,有高血压史19例,有糖尿病史16例;死亡组男25例、女17例,有吸烟史12例,有酗酒史8例,有高血压史10例,有糖尿病史9例;两组比较差异无统计学意义。死亡组血清Ang-2水平高于存活组,而血清CC16水平、PaO2、PaO2/FiO2低于存活组(P均<0.05),两组临床计量资料比较见表2。
表2 存活组和死亡组临床计量资料比较(±s)

表2 存活组和死亡组临床计量资料比较(±s)
?
2.3 重症肺炎患者预后影响因素的多因素Logistic回归分析 以患者是否存活作为因变量,其中0=存活,1=死亡,表2中有统计学差异的变量为自变量进行多因素逐步Logistic回归分析(α入=0.05,α出=0.10),结果显示,血清Ang-2水平是重症肺炎患者预后的独立危险因素,血清CC16水平、PaO2、PaO2/Fi O2是重症肺炎患者预后的保护因素,见表3。
2.4 血清Ang-2、CC16水平对重症肺炎患者预后的诊断价值 ROC曲线结果显示,血清Ang-2联合CC16对重症肺炎患者预后的诊断价值高于各项指标单独检测(Z分别为2.588、3.152,P均<0.05),见表4、图1。

表3 重症肺炎患者预后影响因素的多因素Logistic回归分析

表4 血清Ang-2、CC16水平对重症肺炎患者预后的诊断价值
3 讨论
重症肺炎是临床上较为常见的呼吸系统危重症疾病,患者易发生感染性休克、全身炎症性反应,病情严重时会产生多器官功能障碍,导致患者出现脏器衰竭而死亡。重症肺炎会对患者造成严重的病理危害,首先是病原菌进入人体后会对肺间质细胞的结构和功能造成破坏,导致呼吸窘迫综合征的发生[11-12];其次,在重症肺炎发病过程中患者的免疫功能异常激活,机体产生过度免疫防御从而使呼吸窘迫综合征病情加剧,持续的状态容易引起机体免疫功能降低,进而引起血气指标(PaO2、PaO2/FiO2)降低,严重时引起多器官功能衰竭而导致患者死亡[13]。因此寻找与重症肺炎患者预后密切相关的标志物分子并将其应用于重症肺炎患者的预后预测具有重要的临床价值。
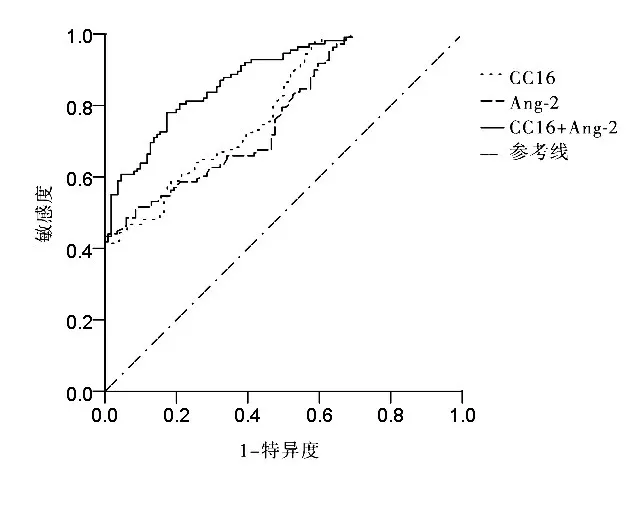
图1 血清Ang-2、CC16水平对重症肺炎患者预后诊断价值的ROC曲线
CC16是一种内源性抗炎症因子,主要分布于肺组织,具有免疫调节、抗炎症反应和抗组织纤维化等生物学功能[14]。PANG等[15]发现,CC16能够抑制趋化因子和炎症细胞因子的表达,同时抑制核因子-κB炎症信号通路的活化。RIVIÈRE等[16]发现,CC16能够抑制纤维蛋白的合成,进而抑制肺纤维化。本研究发现,重症肺炎患者血清CC16水平下降,并且与患者的不良预后密切相关。分析其原因可能是由于CC16能够抑制肺部炎症的产生。重症肺炎患者的免疫系统存在过度防御,免疫细胞如巨噬细胞和中性粒细胞的异常活化使得机体内的正常组织细胞被免疫细胞吞噬,造成组织器官衰竭[17]。趋化因子和炎症细胞因子作用于巨噬细胞和中性粒细胞使其发生转移和浸润,大量巨噬细胞和中性粒细胞浸润肺部组织,造成患者弥漫性肺泡损伤,进而导致患者肺功能损伤[18]。同时,CC16参与肺纤维化调节。重症肺炎患者的肺功能严重下降,其主要病因是肺部发生严重的纤维化,纤维化程度较高的肺组织氧运输功能急剧下降,患者易于发生呼吸衰竭而死亡[19]。重症肺炎患者CC16水平下降使得CC16对肺纤维化的抑制作用解除,肺纤维化会导致肺泡细胞的氧气输送功能和损伤修复功能下降,最终导致患者出现呼吸衰竭而死亡[20]。
Ang-2属于促血管生成素家族成员,是一种内分泌型细胞调节因子,主要作用于血管内皮细胞,在炎症所导致的血管增长、生成以及重构过程中起重要调节作用[21]。CAMPOS等[22]研究发现,Ang-2是氧化应激反应的标志物分子。LI等[23]研究显示,Ang-2抑制c-Jun氨基末端激酶信号通路,进而促进肺微血管细胞凋亡。本研究发现重症肺炎患者血清Ang-2水平升高,并且与患者的不良预后密切相关。分析其原因可能是由于Ang-2参与氧化应激过程。重症肺炎患者体内氧失衡,导致氧化应激反应形成;氧化应激过程中产生大量过氧离子和超氧离子等氧自由基;氧自由基具有较强的氧化性,其作用于患者肺部组织细胞会引起肺部组织细胞的呼吸电子传递链异常,导致细胞的有氧呼吸功能下降,并引起细胞代谢功能紊乱,导致肺部组织细胞死亡,最终导致患者的肺功能损伤[24]。同时重症肺炎患者肺部组织血管微环境紊乱。c-Jun氨基末端激酶信号通路能够促进肺组织细胞的增殖和损伤修复,Ang-2通过抑制c-Jun氨基末端激酶信号通路促进重症肺炎患者肺微血管细胞凋亡。肺微血管细胞凋亡会导致肺部微环境紊乱,因此重症肺炎患者Ang-2水平升高会促进肺部微环境紊乱并抑制肺微血管形成,使得肺部组织细胞的代谢和营养供应缺乏,并使得肺组织细胞的增殖和损伤修复功能紊乱,肺组织细胞大量死亡而导致患者出现肺功能下降,最终导致患者不良预后[25]。
本研究结果还显示,血清CC16联合Ang-2预测重症肺炎患者预后的价值较高,ROC曲线下面积为0.885,敏感度、特异度分别为79.23%、82.71%,明显优于血清CC16、Ang-2单独预测的价值。提示血清CC16、Ang-2水平联合检测可作为临床预测重症肺炎患者预后的重要生化标记物。目前对CC16、Ang-2在重症肺炎发病过程中的具体作用机制仍未阐明,并且本研究的临床样本量偏少,后续需要通过基础研究和大样本随机性研究对二者的分子机制以及在大样本中的情况进行深入探究。
综上可见,重症肺炎患者血清CC16水平下降,Ang-2水平升高,二者表达与重症肺炎患者的预后密切相关,在重症肺炎患者预后预测中具有一定临床价值。

