NRS-2002联合炎症反应标志物预测恶性梗阻性黄疸患者预后的Nomogram模型构建
张华安,周晓芳,蒋易君,张淏嘉
天门市中医医院,湖北天门 431700
恶性梗阻性黄疸(MOJ)是指由于恶性肿瘤的生长而导致肝内或肝外胆管阻塞的疾病。MOJ可由肝脏、胆管、胆囊、胰腺或壶腹周围的原发性和继发性恶性肿瘤引起。由于胆汁不能进入消化道,梗阻性黄疸可能导致肝损伤、心血管系统损伤、免疫功能下降、肠屏障功能障碍、内毒素血症、凝血功能障碍、营养不良等甚至死亡[1]。因而,大多数患者无法接受肿瘤根治术。相比之下,胆道支架植入术联合经皮肝穿刺胆管引流术是一种有效的姑息性治疗方法[2]。但是,MOJ患者生存期依然较短,2年总体生存率低至20%[3],中位生存期为178 d[4]。近年来,越来越多证据表明,恶性肿瘤患者生存率不仅取决于肿瘤本身,还取决于与宿主相关因素,如术前营养状态和炎症状况。营养不良可表现为慢性蛋白质—热量营养不良,近期由于急性疾病影响而进食减少,以及炎症和(或)感染并发症引起的急性体液平衡紊乱。但是,MOJ患者的营养状态评估尚未得到重视,主要因缺乏营养不良筛查的金标准或营养状态筛查工具的相关共识[5]。目前,营养状态筛查工具很多,如营养风险评估表(NRS-2002)、微型营养评定简法(MNA-SF)、主观整体营养状况评量表(PG-SGA)等。近期,两项研究建议采用NRS-2002筛查MOJ及原发性肝癌患者的术前营养状态[4,6]。循证医学结果表明,NRS-2002适用于腹部手术患者术前营养状态筛查[7]。恶性肿瘤发生、发展过程中的免疫系统研究阐明了炎症反应标志物在预测癌症预后意义。中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)已经被提议作为恶性肿瘤(如胆道肿瘤、胰腺癌)预后标志物[8-9]。Nomogram模型通过整合危险因素生成一个直观评分系统来达到精准预测目的。目前尚未构建MOJ患者预后的Nomogram模型。因此,本研究尝试整合NRS-2002、NLR及PLR构建预测MOJ患者生存率的Nomogram模型。
1 资料与方法
1.1 临床资料 选取我院在2017年1月—2019年1月就诊的129例MOJ患者,均接受胆道支架植入术联合经皮肝穿刺胆管引流术手术治疗。纳入标准:符合MOJ诊断标准;有胆道支架植入术联合经皮肝穿刺胆管引流术适应证;年龄≥18岁;无其他恶性肿瘤病史。排除标准:转移性MOJ或混合型恶性肿瘤;恶性肿瘤导致的胆管穿孔;意识状态较差,出现认知功能障碍;严重全身系统性疾病,如心血管疾病等;重度贫血;临床资料不完整。其中男85例、女44例,年龄58~78(66.78±12.47)岁。MOJ原因:胆管癌42例,胰头癌40例,肝脏肿瘤21例,胆囊癌11例,十二指肠癌8例,壶腹癌5例。本研究经本院伦理委员会批准通过且患者或家属签署知情同意书。
1.2 资料收集 ①患者一般临床资料,包括年龄、性别、体质量指数(BMI,kg/m2)。②血液指标,包括总胆红素(TBIL,μmol/L)、直接胆红素(DBIL,μmol/L)、总胆固醇(TC,mmol/L)、白蛋白(ALB,g/L)、血红蛋白(Hb,g/L)。③炎症反应标志物。计数中性粒细胞、淋巴细胞、血小板,计算NLR、PLR。④营养状态。入院24 h内对129例MOJ患者进行NRS-2002调查。NRS-2002评分量表评价参数包括近期体质量变化、饮食摄入变化、BMI、疾病严重程度、年龄(如年龄≥70岁,在总分基础上加1分),0~2分为营养正常、3~4分为营养不良风险、5~7分为营养不良。
1.3 随访 将129例MOJ患者的详细资料登记于随访管理系统。为防止随访丢失,同时记录患者近亲联系方式。术后每1个月电话随访1次;每3个月门诊随访1次,主要进行肿瘤标志物、腹部CT等相关检查。总生存时间从手术当日开始计算直到死亡时间或末次随访时间。本次研究随访截止时间为2020年4月30日。
1.4 统计学方法 采用SPSS22.0统计软件。计量资料以±s表示,多组间比较采用方差分析,两两比较采用SNK检验;计数资料比较采用χ2检验;采用Medcal统计软件绘制连续性变量受试者工作特征(ROC)曲线并获取最佳截断值,根据最佳截断值进行二分类变量转化;MOJ患者生存率的独立影响因素采用多元Cox风险回归模型分析;Nomogram模型根据多因素Cox比例风险模型结果和R版3.5.2中的RMS软件包绘制并进行外部验证,计算一致性(C-Index)。P<0.05为差异有统计学意义。
2 结果
129例MOJ患者均获得随访,生存时间32~351(184.71±26.74)d。随访末期,20例MOJ患者存活,109例MOJ患者死亡,病死率84.5%。
2.1 连续性临床资料诊断MOJ患者死亡的ROC曲线分析结果 根据MOJ患者是否死亡,将年龄、BMI、TBIL、DBIL、TC、ALB、Hb、NLR、PLR进 行ROC曲线分析,其曲线下面积(AUC)分别为0.652、0.637、0.549、0.531、0.596、0.727、0.586、0.744、0.735,最佳截断值分别为65岁、19.4 kg/m2、172.7μmol/L、138.2μmol/L、4.13 mmol/L、38.6 g/L、85 g/L、2.52、0.52,见表1。
2.2 不同临床病理参数与MOJ患者预后的关系 根据NRS-2002评分,129例MOJ患者中,营养正常14例(10.9%)、营养不良风险86例(66.7%)、营养不良29例(22.5%)。死亡患者的ALB、NLR、PLR及营养不良比例高于存活患者(P均<0.05),而营养正常比例低于存活患者(P<0.05),见表2。
ALB(≤38.6 g/L)、NLR(>2.52)、PLR(>0.52)患者的总体生存率低于ALB(>38.6 g/L)、NLR(≤2.52)、PLR(≤0.52)者(P均<0.05);此外,营养不良风险及营养不良患者的总体生存率低于营养正常患者(P均<0.05),见图1。
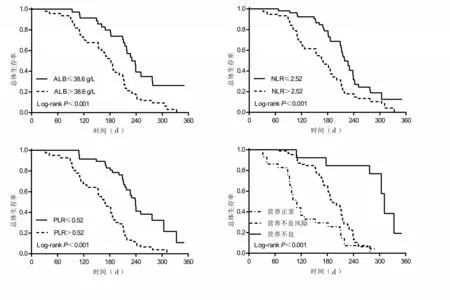
图1 不同ALB、NLR、PLR及营养状态者生存曲线
2.3 MOJ患者死亡的多因素Cox风险比例模型分析结果 将单因素有差异的临床指标纳入多因素Cox风险比例模型中,采用逐步回归法进行分析。结果显示:NLR(H R:1.718,95%C I:1.119~2.637)、PLR(H R:1.699,95%CI:1.042~2.711)、NRS-2002[营养不良风险(HR:3.204,95%C I:1.339~6.368),营养不良(H R:7.416,95%CI:1.231~9.525)]是MOJ患者死亡的独立危险因素(P均<0.05),见表3。
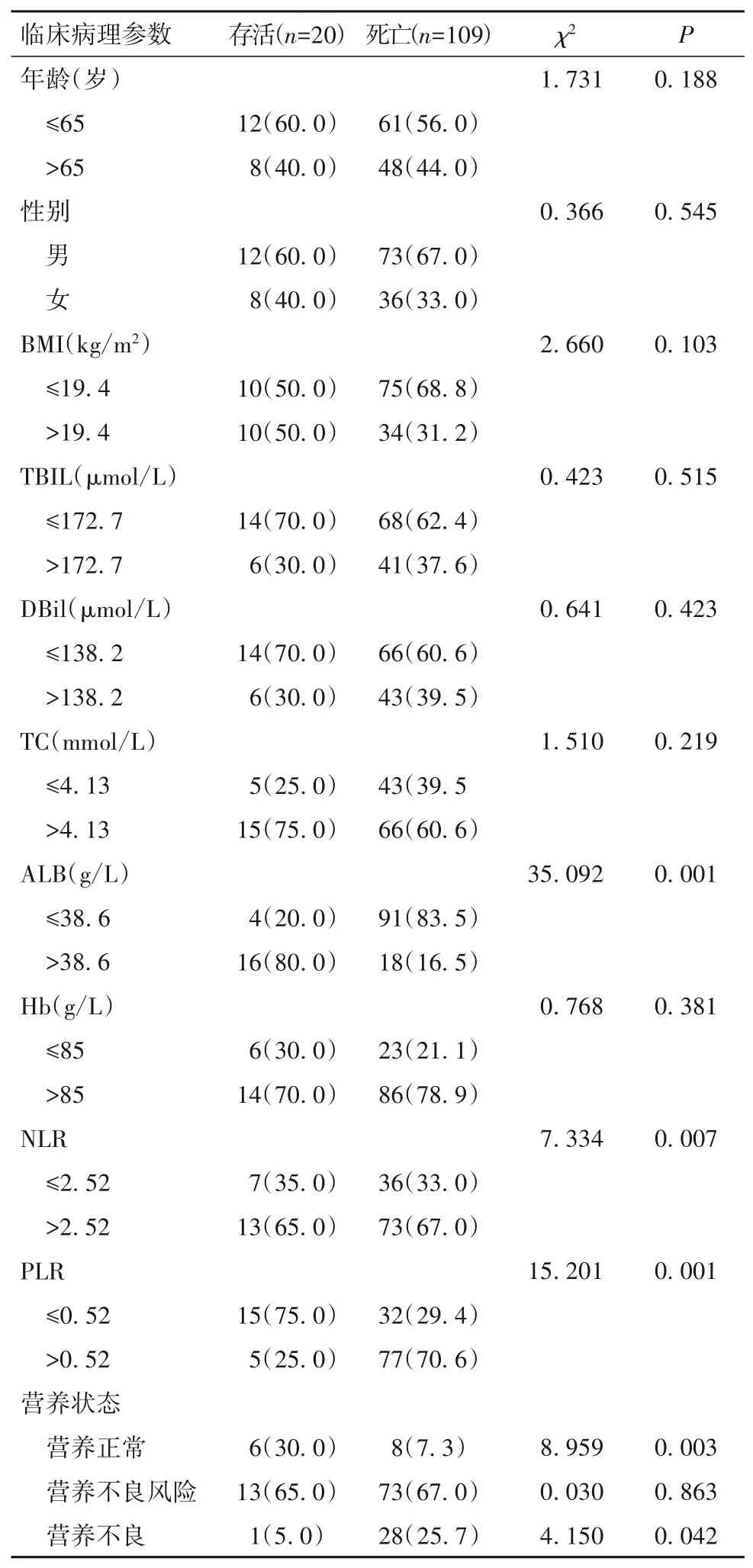
表2 不同临床病理参数与MOJ患者预后的关系[例(%)]

表3 MOJ患者死亡的多因素Cox风险比例模型分析结果
2.4 预测MOJ患者预后的Nomogram模型及外部验证结果 根据NLR、PLR、营养状态构建预测MOJ患者90、180、270天生存率的Nomogram模型,见图2。外部验证结果显示:90、180、270天生存率C-index分别为0.756(95%C I:0.695~0.862)、0.701(95%C I:0.647~0.781)、0.698(95%CI:0.611~0.778),见图3。
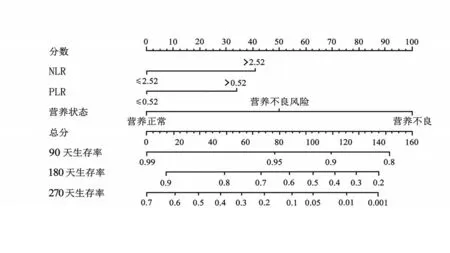
图2 预测MOJ患者生存率的Nomogram模型
3 讨论
胆道支架植入术联合经皮肝穿刺胆管引流术只能解除胆道梗阻,缓解临床症状,对肿瘤无治疗作用[10]。近年来,随着MOJ患者基因和免疫检测点的识别、新药的不断出现、多学科综合诊疗的合理实施,MOJ患者预后得到改善,但MOJ患者整体生存率非常低。在本研究中,129例MOJ患者生存时间32~351(184.71±26.74)d,病死率84.5%。这与ZHANG等[11]报道的中位生存时间185 d及韩山山等[4]报道的中位生存时间为178 d较为一致。学者们一直在探寻和MOJ患者预后相关因素,拟通过积极干预提高MOJ患者生存率。营养不良和全身炎症反应在各种恶性肿瘤中普遍存在,并与不良预后相关[12]。为此,本研究从MOJ患者入院时营养状态及机体炎症反应入手,整合NRS-2002、NLR及PLR并成功构建预测MOJ患者生存率的Nomogram模型。该结果可较为准确赋予MOJ患者术后生存率的危险评分,以便于识别、指导、完善MOJ患者治疗方案,延长生存时间。
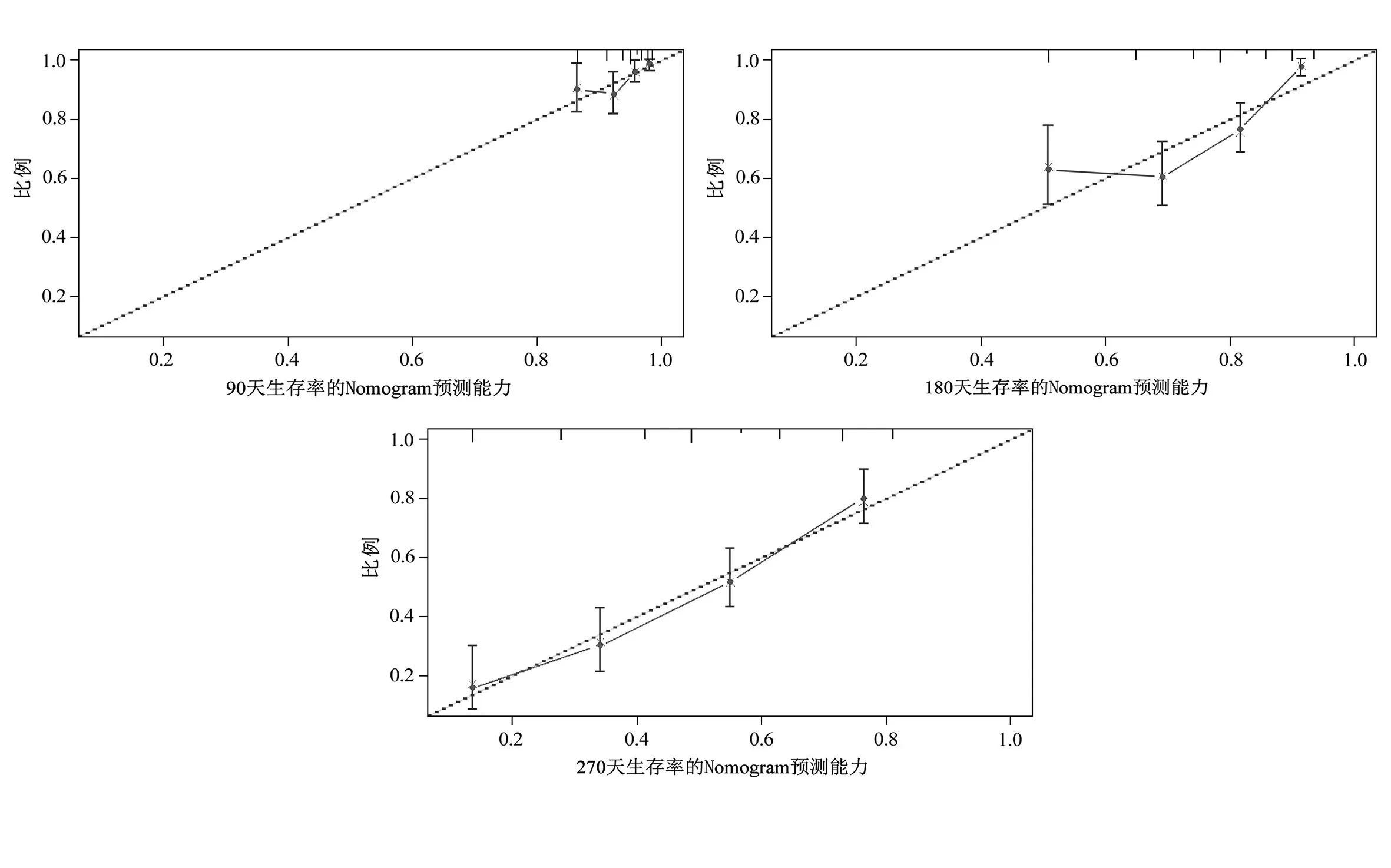
图3 预测MOJ患者生存率的Nomogram模型校正曲线
肠内与肠外营养学会、欧洲临床营养与代谢学会、日本肠道营养学会及中国肠道营养学会推荐住院患者进行营养筛查并根据筛查结果给予营养支持[13-15]。但是,住院患者营养状态评估目前没有金标准。NRS-2002是第一个基于循证医学建立的营养状态筛查工具。在既往研究[4,6-7]基础上,欧洲临床营养与代谢学会也推荐将NRS-2002用于恶性肿瘤患者的营养筛查[16]。为此,本研究采用NRS-2002筛查129例MOJ患者入院时的营养状态。筛查结果显示营养正常患者14例,营养不良风险患者86例,营养不良患者29例。进一步研究证实,NRS-2002是MOJ患者死亡的独立危险因素。提示MOJ患者的营养状态不容乐观且与预后显著相关。NRS-2002筛查项目包括近期体质量变化、饮食摄入变化、BMI、疾病严重程度、年龄。TAKADA等[17]学者研究证实,较低的BMI与恶性肿瘤患者较低的无病生存率和总生存率之间存在显著联系。许多晚期恶性肿瘤患者饮食摄入量急剧下降,不足以维持正常体质量或营养需求[18]。这进一步导致恶病质,降低恶性肿瘤患者生存率,减少生存时间[19]。MEISTER等[20]证实年龄与MOJ患者预后显著相关。结合上述文献,NRS-2002作为MOJ患者营养状态筛查工具的价值值得肯定。因此,营养状态筛查在在恶性肿瘤治疗过程中起重要作用。与其他明确的预后危险因素联合,可更好地进行术前评估,完善围手术期治疗方案。
在过去几十年里,学者们揭示了肿瘤微环境中的炎性反应意义[21-22]。恶性肿瘤通过抑制细胞凋亡、促进血管生成和损伤DNA等途径增加MOJ患者炎症过程;而炎症反应参与了肿瘤组织损伤的修复,是肿瘤细胞微环境中不可缺少的因素。NLR、PLR可以反映恶性肿瘤微环境中炎症变化程度[23]。中性粒细胞和血小板在体内可以促进肿瘤血管形成、恶性肿瘤细胞增殖和转移,从而促进恶性肿瘤进展[24]。而淋巴细胞在恶性肿瘤免疫监视中发挥着重要作用,可抑制恶性肿瘤的进展。因此,NLR和PLR的失衡对肿瘤如何进展及如何影响患者预后提供了新的研究视角。本研究证实NLR、PLR是MOJ患者死亡的独立危险因素。
本研究首次整合营养状态或者炎症反应标志物构建预测MOJ患者预后的Nomogram模型。通过外部验证,得出90、180、270天生存率C-index分别为0.756、0.701、0.698。Nomogram模型中C-Index被定义为个体预测精度的性能。在恶性肿瘤预后的Nomogram模型研究中,CHEN等[25]经内部验证得出C-Index为0.641,外部验证得出C-Index为0.709。WANG等[26]经内部验证得出无病生存率及总体生存率的C-Index分别为0.723和0.800。可见,本研究经内部验证得出的C-Index较为满意,本研究构建的Nomogram模型个体预测精度的性能较好。但是本研究存在一定局限性。首先,NLR和PLR的最佳截断值在目前研究中尚未统一,因此,本研究构建的Nomogram模型的临床推广可能缺乏更多证据。其次,本研究的样本量较少,且未采用外部验证来进一步证实该Nomogram模型的性能。最后,NRS-2002都包含了患者的体质量及饮食情况,而在收集数据过程中发现部分患者依靠家属回忆获得上述信息。
综上所述,本研究基于NRS-2002、NLR及PLR构建的Nomogram模型有望成为预测MOJ患者预后的重要方法。然而,考虑到本研究局限性,有必要进一步开展多中心、大样本的前瞻性试验来证实该Nomogram模型的性能。

