海洋弧菌HN897 β-琼脂糖酶基因vas1-1339 异源表达及活性分析
喻飞, 金兴坤, 雷天影, 曹海航, 陈锵辉, 阳耀帆, 李佳航, 赵哲
河海大学海洋学院, 海洋生物技术与资源利用研究所, 江苏 南京 210098
琼脂是由海洋藻类中提取的一类胶状多糖, 琼脂糖(Agarose)是其主要组成成分之一(Park et al,2020)。琼脂糖是由α-L-半乳糖和β-D-半乳糖重复单元构成的琼脂多糖; 部分微生物可通过琼脂糖酶(Agarase)生化酶解作用将琼脂糖水解为更小分子量的琼脂寡糖, 从而可被生物体进一步分解利用, 这也是海洋微生物碳源利用的方式之一(Wang et al,2020; Park et al, 2020)。依据水解糖苷键的不同, 琼脂糖酶分为α-琼脂糖酶和β-琼脂糖酶, 其中β-琼脂糖酶可水解多糖的β(1,4)糖苷键从而产生具有β-D-半乳糖还原性残基末端的新琼寡糖(Neoagaro oligosaccharides)等(Hsu et al, 2015)。新琼寡糖具有多重生物活性, 在食品医药等领域具有重要的开发利用价值(Fu et al, 2010)。
目前已在不同种属的海洋细菌基因组中发现β-琼脂糖酶编码基因, 例如Agarivorans(琼胶菌属)、Microbultifer、Pseudomonas(假单胞菌属)、Zobellia、Vibrio(弧菌属)等菌属。基于序列同源性,β-琼脂糖酶分子被分为4 个不同糖苷水解酶家族(Glycoside hydrolase, GH family), 即GH-118 家族、GH-86 家族、GH-50 家族和GH-16 家族; 尤以GH-16 家族酶类较多, 且具有不同的底物特异性(Lu et al, 2009;Liang et al, 2014; Teh et al, 2020)。上述4 类GH 家族蛋白具有底物催化功能的糖苷水解酶结构域(GH),大部分具有糖类结合结构(Carbohydrate binding modules, CBM)。CBM 结构域普遍存在于多肽链的羧基端(Alkotaini et al, 2016), 如弧菌来源的琼脂糖酶AgaA、AgaV 等(Boraston et al, 2004; Zhang et al,2007; Dong et al, 2007)。近年来, 国内外针对产β-琼脂糖酶菌株分离及基因鉴定已较为完善, 研究重点已逐步向阐述其降解琼脂糖机制及应用工具开发方向转变。
2018 年本课题组分离获得一株高产琼脂糖酶弧菌HN897 株(张静雅 等, 2018), 2020 年对该菌基因组编码的8 个琼脂糖酶基因进行了分子鉴定和功能研究(Liu et al, 2020); 其中β-琼脂糖酶基因vas1-1339是弧菌HN897 基因组中一个GH-16 家族基因, 功能结构域比对分析发现该基因编码蛋白含3 个保守的结构域: N 端疏水信号肽、β-琼脂糖酶同源结构域(Beta_agarase, InterPro 数据库登录号:IPR016287)和Ricin_B_lectin 结构域(InterPro 数据库登录号: PF00652)。该基因编码蛋白与弧菌V134 株的琼脂糖酶AgaV (GeneBank 登录号: ABL06969.1)高度同源, 暗示两者具有相似功能(Zhang et al, 2007;Liu et al, 2020)。在弧菌HN897 中, 基因敲除试验表明β-琼脂糖酶基因vas1-1339的缺失显著降低弧菌HN897 对琼脂的水解作用, 说明Vas1-1339 琼脂糖酶是弧菌HN897 高效降解琼脂糖的必要基因。为进一步探查弧菌HN897 株Vas1-1339 琼脂糖酶是否可以独立发挥降解功能, 本研究在大肠杆菌(非产琼脂糖酶菌)中重组表达了Vas1-1339 琼脂糖酶, 分析其表达特性及功能活性。
1 材料方法
1.1 材料
海洋弧菌HN897 菌株由本课题组筛选分离自海水水样, 保存于河海大学海洋科学实验中心; 大肠杆菌DH5α和BL21 菌株购自天根生化科技有限公司。弧菌TCBS 培养基、大肠杆菌LB 培养基、卢戈氏碘液、蛋白酶抑制剂PMSF 等试剂购自上海生工生物科技有限公司。PrimeStar HS PreMix 和In-fusion cloning kit 购自Takara 公司; 细菌DNA 提取试剂盒、Gel & PCR Clean Up Kit 及Plasmid Mini Kit 购自Omega 公司; Protein loading buffer、考马斯亮蓝染色液、Chemiluminescence Kit 等蛋白电泳试剂购自上海天能生物科技有限公司; 鼠源His6 标签抗体和偶联HRP 的兔源抗鼠IgG 抗体购自ABclonal Technology 公司。
1.2 pET28a-1339 载体克隆构建
将弧菌HN897 菌株复苏涂布于TCBS 培养平板,30℃培养24~28h, 挑取单菌落扩大培养, 利用提取试剂盒提取细菌DNA。依据HN897 菌株基因组信息(Vas1, GeneBank 登录号: CP047475)设计β-琼脂糖酶基因vas1-1339(GeneBank 登录号:WP_164648163.1)的阅读框扩增引物, 引物为1339-F1: 5′-ATGGGTCGCGGATCCGAATTCATGA AATCCATAATTAAAACTCTGACATT-3′; 1339-R1:5′-TTGTCGACGGAGCTCGAATTCTTATTGTATAA ATTTCAATCGCTGGTT-3′。以200ng 弧菌HN897 DNA 作为模板, 进行PCR 扩增, 扩增条件: 98℃10s, 58℃ 30s, 72℃ 1min, 35 个循环。PCR 产物纯化回收, 利用In-fusion cloning kit 插入pET28a (+)空质粒(EcoRⅠ酶切位点); 热激转化大肠杆菌DH5α, 37℃培养12~16h, 挑取单克隆测序验证, 获得pET28a-1339 载体质粒。
1.3 诱导表达
将100ng pET28a-1339 质粒, 热激转化大肠杆菌BL21 菌株, 37℃培养12~16h; 挑取单克隆于5mL LB液体培养基(含有100μg·mL-1氨苄青霉素)中过夜活化。活化菌液进一步1∶100 稀释扩大培养至OD600达到0.4 左右, 加入不同浓度的异丙基-β-D-硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside, IPTG)诱导His6-1339 表达, 4000g 离心5min, 收集菌体备用, 加入蛋白酶抑制剂苯甲基磺酰氟(Phenylmethylsulfonyl fluoride, PMSF)用于抑制蛋白降解。重组His6 标签蛋白纯化方法参照产品说明书。
1.4 聚丙烯酰胺凝胶电泳和免疫印迹
聚丙烯酰胺凝胶电泳(SDS-page): 菌体蛋白加入2×Protein loading buffer, 混匀, 95℃处理10min 后进行聚丙烯酰胺凝胶电泳(10%~12% SDS-page胶)。电泳条件: 80V 电压电泳30min, 120V 电压电泳60min, 然后进行考马斯亮蓝染色或转膜。
免疫印迹: 将蛋白胶转印至PVDF 膜上。转膜条件: 100V 电压转印60min; 膜用5%脱脂牛奶封闭2h; His6 一抗1∶3000 稀释孵育4h; 用磷酸缓冲液(Phosphate buffered saline and 1% Tween-20, PBST)清洗4 次每次5min; 辣根过氧化物酶(Horseradish peroxidase, HRP)偶联二抗 1∶4000 稀释孵育 2h;PBST 清洗4 次每次5min; 利用化学发光法显色试剂盒Chemiluminescence Kit 显色。
1.5 卢戈氏碘液染色分析
重组His6-1339 菌株活体水解琼脂活性分析:活化培养菌株(His6-1339)至OD600 达到0.4, 1∶100稀释后取1μL 点加至LB 培养平板(含有100μg·mL-1氨苄青霉素及不同浓度的IPTG), 37℃培养12h; 利用1.5%卢戈氏碘液进行平板染色0.5~1min; 根据平板上菌落周围透明圈的大小对菌株降解琼脂糖的能力进行定性分析; 转化pET28a 空载体的大肠杆菌BL21 菌株作为对照组。
重组表达的琼脂糖酶水解琼脂活性分析: 500ng纯化的融合蛋白His6-1339 溶液点加至1.5%琼脂平板, 37℃孵育2h, 进行卢戈氏碘液染色; 500ng 牛血清蛋白(Bovine serum albumin, BSA)溶液作为阴性对照。蛋白浓度利用二辛可宁酸法(bicinchoninic acid method, BCA)试剂盒进行测定。
1.6 基因及氨基酸序列数据及分析
HN897 菌株基因组数据信息已由本课题组上传至 NCBI GenBank 数据库, 登录号为 CP047475(Vas1)和CP047476 (Vas2); 重组His6-1339 蛋白理论分子量计算利用 Compute pI/Mw tool (https://web.expasy. org/ compute_pi/); 利用Peptide cutter 进行 蛋 白 多 肽 切 割 位 点 预 测 (https://web.expasy.org/peptide_ cutter/)。
2 结果
2.1 β-琼脂糖酶基因vas1-1339 克隆及分析
为研究海洋弧菌 HN897 株β-琼脂糖酶基因vas1-1339在大肠杆菌中的表达, 从海洋弧菌HN897 株中提取细菌基因组 DNA, 以此为模板PCR 扩增获得Vas1-1339 的基因编码阅读框(open reading frame, ORF), 全长1359bp (图1a); 利用同源重组方法插入 pET28a 空质粒中, 构建新表达ORF: His6-1339, 全长1467bp; 从而获得pET28a-1339 载体用于表达N 端带有His6 标签的融合蛋白His6-1339, 且C 端未引入外源多肽。融合蛋白肽链全长488 个氨基酸, 其中His6 标签和1339 蛋白理论分子量分别为3.8kDa 和51.7kDa (图1b)。
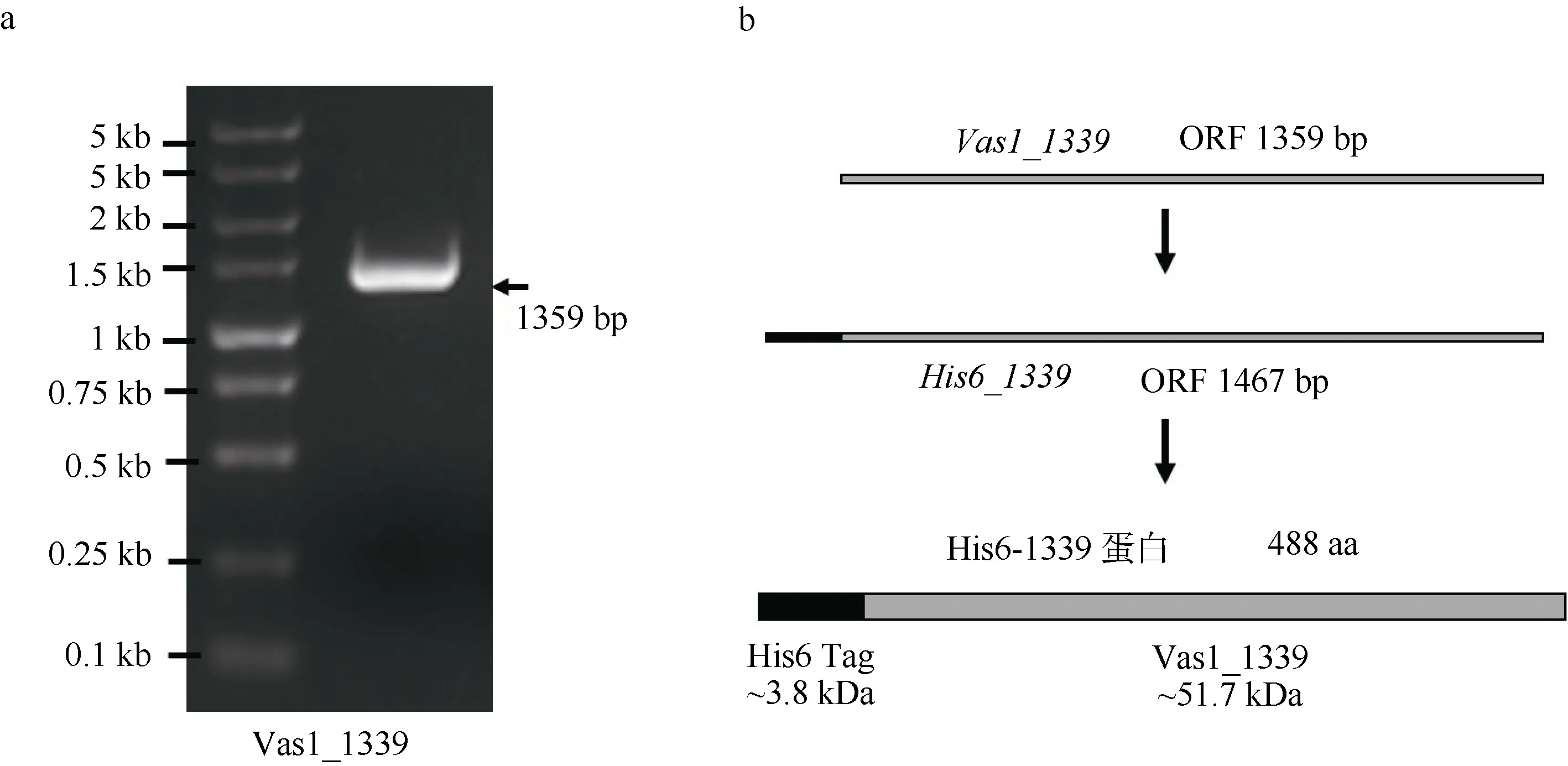
图 β-琼脂糖酶Vas1-1339 基因PCR 扩增电泳图(a)及其pET28a-1339 载体的重组表达模式图(b)Fig. 1 Agarose electrophoresis of Vas1-1339 product (a), and schematic diagram of the gene expression (b)
2.2 β-琼脂糖酶重组表达
在大肠杆菌中诱导表达N 端带有His6 标签的融合蛋白His6-1339。首先利用100μmol·L-1诱导物IPTG 初步诱导3h, 收集菌液。聚丙烯胶变性电泳(SDS-Page)分析发现约55kDa 蛋白大小附近有明显条带(图2a), 初步表明融合蛋白His6-1339 成功表达;利用免疫印迹试验验证这一结果(图2b)。为进一步优化融合蛋白His6-1339 重组表达条件, 利用不同IPTG 浓度(0、0.1、1、10、100 μmol·L-1)诱导表达融合蛋白His6-1339; 100μmol·L-1IPTG 能够显著抑制His6-1339 菌株的生长, 说明表达的融合蛋白的His6-1339 菌株对高浓度IPTG 敏感; 同时卢戈氏碘液染色分析发现10μmol·L-1IPTG 为诱导表达的最优浓度(图3)。免疫印迹分析发现在10μmol·L-1IPTG诱导1~4h 条件下, His6-1339 蛋白均有效表达; 2~4h表达量高于1h 的表达量(图4)。
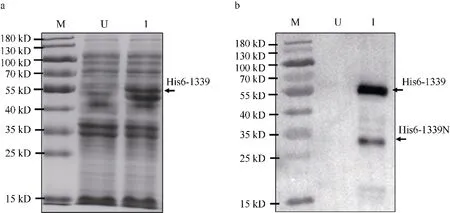
图2 重组β-琼脂糖酶His6-1339 诱导表达a. β-琼脂糖酶His6-1339 诱导表达样品的SDS-PAGE 分析, U 未诱导, I 诱导; b. 图a 中样品进行免疫印迹分析, 鼠抗His-tag 单克隆抗体用于识别His6 标签蛋白Fig. 2 β-Agarase His6-1339 induced to express in Escherichia coli. (a) His6-tagged protein was induced from E. coli.Representative images from an SDS-PAGE analysis of His6-1339 is shown. Lanes: (U) non-induced; and (I) induced. (b) A western blot analysis of the His6-tag protein (in a) probed with a monoclonal antibody against His6-tag

图3 卢戈氏碘液染色分析His6-1339 菌株水解琼脂能力不同菌株(His6-1339 和His6)培养12h 后进行卢戈氏碘液染色分析, 诱导表达中IPTG 使用浓度分别为0.1、1、10 和100 μmol·L-1, 未加IPTG 作为对照组(0μmol·L-1)Fig. 3 Lugol’s iodine staining analysis indicating activity of β-Agarase in Escherichia coli. Agar plate with E. coli strains(His6-1339 and His6) was stained by Lugol’s iodine. IPTG (0.1, 1, 10 and 100 μmol·L-1) were used to induce protein expression, and 0 μmol·L-1 IPTG served as a negative control
2.3 β-琼脂糖酶羧基端存在胞内切割的现象
作为GH16 家族蛋白之一, 基因vas1-1339编码的β-琼脂糖酶具有两个主要保守结构域, 分别是氨基 端 Beta_agarase (IPR016287) 和 羧 基 端Ricin_B_lectin (PF00652)结构域。免疫印迹分析发现His6-1339 菌株中检测到两条带有His6 标签的蛋白条带(图2b、图4); 一条为His6-1339 融合蛋白全长,大小约为55kDa; 另一条为His6-1339 融合蛋白的氨基端蛋白, 大小约为30kDa, 该小蛋白的存在暗示His6-1339 融合蛋白在成熟过程中羧基端的多肽序列可能被切除。
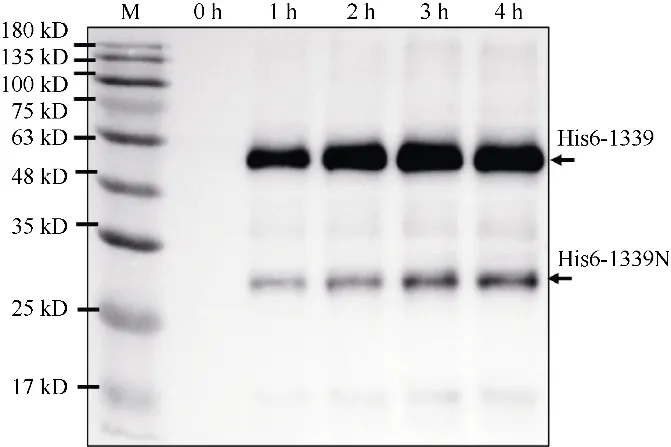
图4 重组β-琼脂糖酶His6-1339 诱导表达时间优化不同时间点(0、1、2、3、4 h)收集诱导菌株(His6-1339)样品进行免疫印迹分析, 鼠抗His-tag 单克隆抗体用于识别His6 标签蛋白,样品IPTG 使用浓度为10μmol·L-1Fig. 4 Optimization of β-Agarase His6-1339 expression induced by IPTG. A western blot analysis of the His6-1339 protein probed with a monoclonal antibody against His-tag.The samples were collected at the indicated times, and the 10 μmol·L-1 IPTG was used to induce protein expression
2.4 异源细菌中表达弧菌β-琼脂糖酶的活性初步分析
为分析Vas1-1339基因在大肠杆菌中的表达产物是否具有降解琼脂糖酶活性, 利用卢戈氏碘液染色分析法初步评估His6-1339 融合蛋白水解琼脂能力。结果表明, 活体His6-1339 菌株在LB 平板上能够有效水解培养基中的琼脂, 形成明显的透明水解圈(图3), 其中10μmol·L-1IPTG 诱导条件下形成的透明水解圈更明显。该结果初步说明弧菌来源的琼脂糖酶Vas1-1339 在大肠杆菌中能够发挥降解琼脂糖的功能。利用亲和结合纯化获得His6-1339 融合蛋白(图 5), 卢戈氏碘液染色分析表明纯化的His6-1339 融合蛋白2h 内即能够有效水解培养基中的琼脂糖, 形成透明水解圈(图5c), 说明纯化的琼脂糖酶在体外能够有效降解琼脂糖。
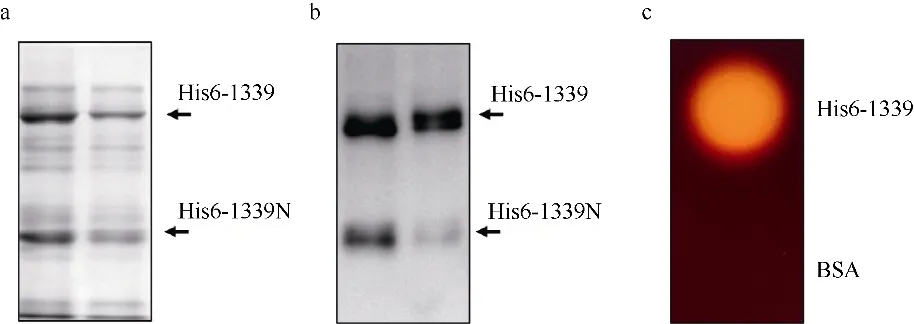
图5 纯化β-琼脂糖酶His6-1339 降解琼脂糖分析a. 纯化His6-1339 蛋白进行SDS-PAGE 分析, 两泳道代表不同批次纯化的蛋白样品; b. 纯化的His6-1339 蛋白样品进行免疫印迹分析,鼠抗His-tag 单克隆抗体用于识别His6 标签蛋白, 两泳道表示不同批次纯化的蛋白样品; c. 卢戈氏碘液染色分析纯化的His6-1339 蛋白水解琼脂能力, His6-1339 蛋白使用量为500ng, 等量牛血清蛋白(BSA)作为对照Fig. 5 Agarose hydrolysis of purified His6-1339 protein. (a) Purified His6-1339 protein analyzed by SDS-PAGE assay; (b) A western blot analysis of purified His6-1339 protein probed with a monoclonal antibody against His6-tag; (c) Agar plates with purified His6-1339 protein (500 ng) were stained by Lugol’s iodine. The 500 ng BSA protein serves as a control
3 讨论
通过全基因组筛查发现弧菌HN897 株编码了8个琼脂糖酶编码基因, 分别属于GH50 和GH16 家族,其中Vas1-1339是弧菌降解琼脂糖的关键基因(Liu et al, 2020), 本研究在异源细菌(大肠菌杆菌)中成功表达了该琼脂糖酶基因, 证明该基因表达产物能够独立发挥琼脂糖酶水解活性, 说明单一的琼脂糖酶Vas1-1339 即能够降解琼脂糖生成还原性低聚糖产物, 并不完全依赖于其他GH 家族基因(例如GH50)的初步降解。在弧菌HN897 中其他的7 个GH 家族蛋白可能与琼脂糖酶Vas1-1339 具有不同的底物特异性, 即降解的多糖类型不同; 也有可能部分GH家族蛋白参与了Vas1-1339 酶解产物(低聚糖)的进一步水解(Yu et al, 2020)。琼脂糖酶Vas1-1339 降解琼脂糖的产物类型本文并未涉及, 有待进一步深入研究。
除了GH-118 家族以外, 大多数β-琼脂糖酶结构中包含CBM 域, 其能够识别多糖中的二糖重复单元, 从而使糖苷水解酶结构域能够靶向多糖, 发生酶促反应并水解底物(Chi et al, 2012; Han et al,2013)。在Vas1-1339 琼脂糖酶中并未发现保守CBM结构域, 其C 端是一个未知功能的Ricin_B_lectin结构域(Liu et al, 2020)。在Zobellia galactanivorans菌GH-16 家族β-琼脂糖酶AgaA 羧基端有两个未知功能结构域; AgaA 全长理论大小为60kDa, 在降解琼脂糖过程中发现其未知功能的结构域被切除(C 端245 个氨基酸), 成熟的AgaA 仅有31kDa (Jam et al,2005); 同样在κ型卡拉胶酶(κ-carrageenase)中也发现类似切割现象(Potin et al, 1995; Barbeyron et al,1998)。在异源细菌中重组表达Vas1-1339 琼脂糖酶,免疫印迹分析发现表达的His6-1339 融合蛋白C 端的Ricin_B_lectin 结构域可能被切除, 产生一个仅有30kDa 左右的N 端蛋白; 可能原因是琼脂糖酶在多肽合成后经过多步反应最终产生成熟蛋白; 该结论仍需要利用质谱试验进一步确认变性或非变性条件下蛋白的准确分子量以及蛋白切割的效率(Jam et al,2005)。目前免疫印迹分析结果仅能初步说明Vas1-1339 琼脂糖酶在表达中可能经过复杂的切割成熟过程, 这为进一步研究弧菌Vas1-1339 琼脂糖酶的琼脂降解机制指明初步方向。
琼脂经水解作用可获得二糖、四糖、六糖、八糖等(新)琼脂寡糖。琼脂寡糖具有抗氧化、抗炎抗辐射、降血糖等多种生物学活性(Hsu et al, 2015;Jiang et al, 2020)。目前可基于化学方法和酶解方法水解琼脂获得该类低聚糖产物, 广泛应用于食品、医药、化工等领域(Martin et al, 2014)。化学方法主要通过强酸或氧化还原法破坏琼脂糖苷键获得新低聚产物, 该类方法具有专一性(稳定性)差, 反应条件苛刻等劣势, 同时还可能带来严重的环境污染问题(林福娣, 2020)。与此类方法相比, 酶解法利用琼脂糖酶特异性识别底物水解琼脂糖, 有利于特定寡糖的大量制备, 酶促反应具有一定的稳定性及环保性(Jiang et al, 2020; 林福娣, 2020)。然而,目前酶解法大规模应用还处于概念和研发阶段。本文初步利用生物工程技术在大肠杆菌中表达弧菌琼脂糖酶基因, 优化其表达条件; 为进一步针对海洋弧菌来源的琼脂糖酶应用技术开发奠定了初步的基础。

