三份南海岛礁珊瑚砂样品中可培养细菌多样性
李存, 崔林青, 杨红强, 龙丽娟, 田新朋
1. 中国科学院热带海洋生物资源与生态重点实验室(中国科学院南海海洋研究所), 广东 广州 510301;
2. 中国科学院边缘海与大洋地质重点实验室(中国科学院南海海洋研究所), 广东 广州 510301;
3. 南方海洋科学与工程广东省实验室(广州), 广东 广州 511458;
4. 中国科学院大学, 北京 100049
珊瑚礁是典型的生物礁, 珊瑚礁生态系统是全球物种多样性最高、资源最丰富的生态系统之一, 被誉为“海洋中的热带雨林”(龙丽娟 等,2019)。岛礁生态系统中的微生物至关重要, 它不仅参与珊瑚礁生态系统的化学循环和物质转化,还与珊瑚礁生态系统中各种生物的健康息息相关(周进 等, 2014), 但目前对岛礁环境微生物的研究相对较少, 因此岛礁环境中微生物资源有待深入的研究。
微生物在地球能量流动和物质循环中扮演了重要角色, 也是珊瑚礁生态系统中重要成员, 开展微生物多样性研究将有助于了解微生物在珊瑚礁生态系统中的功能, 对珊瑚礁生态系统微生物资源的开发和利用有促进作用。近年来为了对纯培养微生物多样性进行研究, 许多学者通过改进培养基配方以及优化培养条件, 显著提高了分离得到的可培养微生物的多样性, 并获得了更多新的微生物类群。孙创等(2021)采用改良的 2216E固体培养基、R2A 固体培养基、MBM 固体培养基、TCBS 固体培养基和改良的2216E 液体培养基对西太平洋海水中的微生物进行分离纯化, 而且获得了多株新分类单元。Xian 等(2020)通过微生物网络分析, 发现温单胞菌在群落中可以将复杂底物转化为绿弯菌等难培养微生物生长必需的小分子底物, 于是利用菌株TepidimonasSYSU G00190W 的上清液改良培养基, 实现了热泉生境中未培养绿弯菌的定向分离培养, 进一步代谢组学研究表明, 培养基上清液中含有很多小分子有机基质, 可作为未培养细菌生长的潜在营养物质。何媛秋等(2020)通过采用不同培养温度、盐度、pH、样品稀释倍数和营养浓度条件对南海沉积物样品进行可培养细菌的多样性研究, 发现寡营养、20 倍的样品稀释倍数、pH 6 和0.05%以下的有机营养物浓度更有利于稀有细菌类群的分离培养。熊盈盈等(2021)总结前人对微生物分离培养的经验, 提出针对未培养的环境微生物培养基和培养条件改良方法, 比如添加抑制剂、样品抽提液或菌液、信号分子、电子供受体以及维生素、生物酶或蛋白因子等物质, 或用其他凝固剂代替琼脂,延长培养时间以及极限稀释培养法等。
珊瑚礁样品采集难度较大, 非常珍贵, 为获得更多种类的可培养微生物, 本研究采用5 种不同营养成分的培养基, 并添加不同的微量元素, 对3 个岛礁陆域珊瑚砂样品进行可培养微生物的分离; 同时分析了不同培养基条件下岛礁可培养细菌的多样性, 岛礁可培养细菌的群落组成, 以及使用PICRUSt2 软件对不同岛礁微生物群落功能进行了合理预测, 以展示其生态功能状况。
1 材料与方法
1.1 材料
1.1.1 珊瑚砂样品
本次试验的南海岛礁珊瑚砂样品从有人岛礁永暑礁(Y11-S)以及无人岛礁扁参礁(BS2-S)和贝壳礁(BK-S)采集获得, 使用无菌采样勺取珊瑚砂表层0~3cm 的新鲜沉积砂样, 装入无菌塑料保藏袋, 放于-20℃保藏备用。
1.1.2 分离培养基
试验采用5 种寡营养培养基, 即5% 2216E固体培养基、 5% AIA (DifocMactinomycete isolation agar)固体培养基、5% R2A 固体培养基、SN 固体培养基和10% 菌液琼脂培养基(表1)。同时单独添加不同的微量元素(终浓度为0.05%),分别为醋酸钠、二甲基巯基丙酸(DMSP)、半胱氨酸、甲硫氨酸、牛磺酸。每种培养基中琼脂终浓度为15. 0g·L–1。
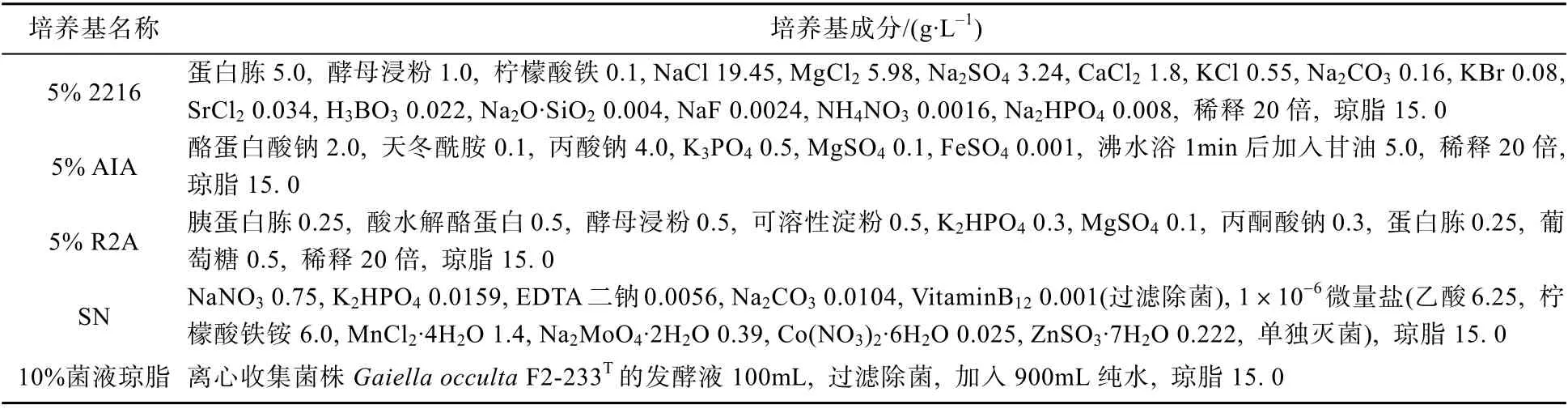
表1 不同培养基的类型及其成分Tab 1 Components of selective isolation media used in this study
1.1.3 试验试剂与仪器
细菌 16S rRNA 基因扩增的通用引物 27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R (5′-TACGGCTACCTTGTTACGACTT-3′)由生工生物工程(上海)股份有限公司合成。5% Chelex 100 试剂(5g Chelex 100 Resin (Bio-rad, USA)溶解于100mL 灭菌超纯水); Taq DNA 聚合酶(北京全式金); PCR 仪(Eppendorf, German); 凝胶成像系统(Bio-rad, USA);小型台式高速离心机和恒温箱(ESCO, Singapore)。
1.2 菌株的分离、纯化与保藏
称取0.5g 珊瑚砂样品, 使用灭菌的无菌海水稀释20 倍, 手动用力震荡摇动3min 后取150μL 稀释后的样品悬浊液涂布于固体培养基表面, 每份样品每种培养基涂布两个平板。将涂布好的分离培养基倒置培养于28℃恒温培养箱中, 连续培养一个月后挑取培养基中所有细菌形态的单菌落, 利用平板划线法在2216E 固体培养基(MA)上进行分离纯化, 将纯化后的菌种转入体积质量30%甘油管中, 放置于-80℃冰箱中保藏。
1.3 16S rRNA 基因扩增测序分析
细菌总 DNA 通过 5% Chelex-100 试剂提取(Walsh et al, 1991), 采用细菌通用引物27F 和1492R进行16S rRNA 基因PCR 扩增。获得的PCR 产物经琼脂糖凝胶电泳检测后, 送广州天一辉远测序公司进行基因测序。测序结果采用 SeqMan 5.0(Swindell et al, 1997)软件进行拼接, 去除质量不佳的测序碱基后, 将获得的有效序列(近1500bp)提交至EzBioCloud (Yoon et al, 2017)和NCBI (https://www.ncbi.nlm.nih.gov/)进行在线BLAST 比对, 比对结果按照 98%作为区分物种的标准(Yarza et al,2014), 若与已知菌种相似度小于等于98%, 则认为该菌株为潜在新种。
1.4 系统进化分析
根据序列比对结果, 选取同源性较高的模式菌株的 16S rRNA 基因序列作为参比序列, 使用CLUSTAL_W 软件进行多序列比对, 使用MEGA-X(Kumar et al, 2018)软件, 结合Kimura2-parameter 模型估算系统进化矩阵, 采用邻近法(neighbor-joining,N-J)(Saitou et al, 1987)进行聚类分析, 设置1000 次重采样构建系统发育树, 使用iTOL (Letunic et al,2019)在线网站对系统发育树进行可视化。
1.5 多样性分析与群落功能预测
统计3 份样品中获得的细菌种类和丰度, 制作样品-细菌物种丰度矩阵表, 使用R 语言vegan 包计算样品的α多样性, 包括Shannon 多样性指数、Simpson 指数、invsimpson 多样性指数和Chao1 指数。使用PICRUSt2 软件(Douglas et al, 2020)基于16S rRNA 基因数据对群落功能进行预测, 参考京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes, KEGG)数据库, 得到直系同源(KEGG orthology)功能的丰度预测表及KEGG 代谢途径丰度表。
2 结果与分析
2.1 细菌多样性
通过菌株分离纯化, 本研究共从126 个未污染的分离平板获得349 株细菌, 经16S rRNA 基因序列相似性比对分析, 显示这些新分离的菌株分别与目前134 个已知种亲缘关系相近, 这些菌株分别属于4 门、6 纲、26 目、43 科、73 属。4 个分离到的细菌门中放线菌门(Actinobacteria)的菌株占所有分离菌株的60%, 为优势菌门, 其他依次为变形菌门(Proteobacteria, 28%)、厚壁菌门(Firmicutes, 11%)和拟杆菌门(Bacteroidetes, 2%)。分离到较多的属级类群为链霉菌属(Streptomyces, 46 株)、糖多孢菌属(Saccharopolyspora, 40 株) 和产微球茎菌属(Microbulbifer, 37 株)。图1 展示了纯培养菌株在不同分类等级中细菌类群所占的比例。图2 展示了134 个物种(选取同种菌株中相似度最高的作为代表菌株)与其最相似已知物种菌株的16S rRNA 基因组列构建的系统发育关系。对获得的4 个门级类群纯培养菌株的多样性分别进行描述。
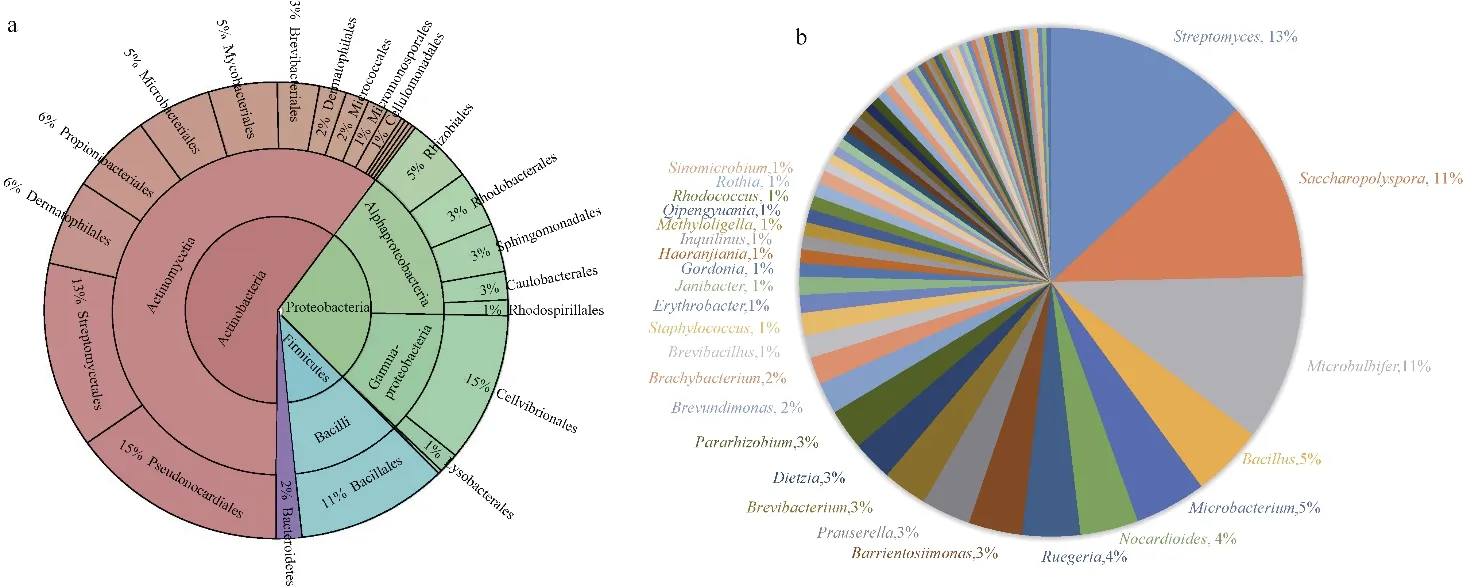
图1 分离获得的纯培养细菌在各分类等级中的分布情况a. 在不同门级、纲级、目级水平下细菌类群比例; b. 在不同属水平下细菌类群比例(标注了菌株中丰度前25 的属)Fig. 1 Distribution of isolated pure culture strains in each classification grade. (a) Proportion of pure culture strains at different phylum, class and order levels, and (b) proportion of pure culture strains in the top 25 genera
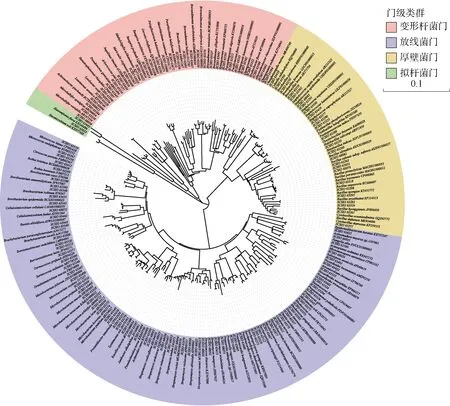
图2 采用邻接法基于16S rRNA 基因序列构建的134 个代表菌株系统发育树Fig. 2 Neighbor-joining phylogenetic tree of 134 representative strains reconstructed based on the 16S rRNA gene sequences
2.1.1 放线菌门
分离得到的放线菌门细菌共计210 株, 属于放线菌纲(Actinomycetia)的15 目22 科37 属74 个菌种, 分离菌株数量最多的为链霉菌和糖多孢菌属, 其中包含链霉菌属下的11 个菌种、糖多孢菌属下的3 个菌种, 其中Saccharopolyspora spongiae(27 株)、Streptomycesdiacarni(20 株)、Saccharopolyspora tripterygii(12 株)、Streptomyces albiaxialis(11 株) 、Nocardioides iriomotensis(11 株)为分离到的主要优势菌株, 其他优势属还包括微杆菌属(Microbacterium)、类诺卡氏属(Nocardioides) 、Barrientosiimonas、 布劳氏菌属(Prauserella)、短杆菌属(Brevibacterium)、迪茨氏菌属(Dietzia)、两面神菌属(Janibacter)、罗斯氏菌属(Rothia)、红球菌属(Rhodococcus)、戈登氏菌属(Gordonia)等。
2.1.2 变形菌门
本研究分离得到的变形菌门菌株共计 96 株,涵盖了3 纲(α-变形菌纲、β-变形菌纲、γ-变形菌纲)、8 目(Burkholderiales、Caulobacterales、Cellvibrionales、Lysobacterales 、 Rhizobiales 、 Rhodobacterales 、Rhodospirillales、Sphingomonadales)、15 科、23 属、33 种。在纲水平上优势类群为α-变形菌纲(53 株)和γ- 变形菌纲(42 株) 。 前者中以红细菌目(Caulobacterales)、根瘤菌目(Rhizobiales)和柄杆菌目(Caulobacterales)为主, 后者则以Cellvibrionales 为主。获得菌株中最多的物种为Microbulbifer variabilis(34 株)、Ruegeria arenilitoris(11 株)、Pararhizobium haloflavum(9 株)。
2.1.3 厚壁菌门和拟杆菌门
本研究中获取的37 株厚壁菌门菌株分别属于芽孢杆菌目的4 科11 属, 以芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus) 、 短芽孢杆菌属(Brevibacillus)为主, 优势菌株为Bacillus altitudinis(5 株)。另外, 拟杆菌门仅分离得到6 株, 分别属于土壤中华微杆菌(Sinomicrobium soli, 3 株)和黄色简浩然菌(Haoranjiania flava, 3 株)。
2.2 3 份珊瑚砂样品中可培养细菌多样性的比较
本研究所采集的3 份样品中可培养细菌的主要优势类群不同, 选择Shannon、Simpson、Invsimpson、Chao1 和ACE 指数对3 份样品的细菌群落多样性进行评估。由表2 和图3 可知, 样品BK-S 和BS2-S的多样性较高, 而Y11-S 样品的多样性较为单一。BK-S 样品中获得的80 个菌种分别属于4 门、5 纲、21 目、32 科、48 属, 优势类群为放线菌纲、α-变形菌纲和γ-变形菌纲。BS2-S 样品中获得的64 个物种分别属于4 门、7 纲、20 目、32 科、43 属, 优势类群为放线菌纲、α-变形菌纲和芽孢杆菌纲。Y11-S样品中获得的20 个物种分别属于2 门、2 纲、6 目、7 科、10 属, 其优势类群为放线菌纲的链霉菌属。虽然采集3 个样品的水深均为10m 左右, 采集样品的水温、透光性等环境参数也相似, 但样品可培养细菌多样性存在明显差异, 样品间细菌多样性差异是否与人类活动有关, 仍需进一步验证。

表2 3 份珊瑚砂样品中细菌群落多样性指数Tab. 2 Diversity index of pure cultured strains isolated from three coral reef samples
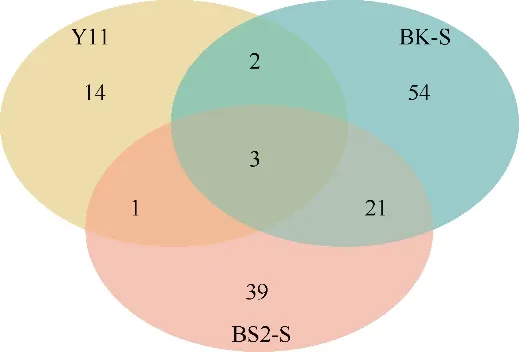
图3 3 份样品(Y11、BK-S、BS2-S)中共有菌种数量Fig. 3 Numbers of same species discovered in three samples of Y11-S, BK-S and BS2-S
2.3 不同培养基分离到的可培养细菌多样性比较
本研究使用5 种培养基获得的最优势门级类群都为放线菌门, 最优势纲为放线菌纲。在5 种培养基中, 5% 2216、SN、10%菌液琼脂培养基分离得到的细菌多样性较高, 除放线菌纲外, 3 种培养基中都分离到了芽孢杆菌纲、α-变形菌纲和γ-变形菌纲。在SN 培养基中还获得了3 株黄杆菌纲菌种, 在10%菌液琼脂培养基中还获得了3 株Chitinophagia 纲和1 株β-变形菌纲菌种。在这种水平上, 5 种培养基分离得到细菌的多样性由高到低依次为5% 2216 培养基(61 种)、10%菌液琼脂培养基(59 种)、SN 培养基(53 种)、5% AIA 培养基(9 种)、5% R2A 培养基(8种)(图4)。5% 2216 培养基和10%菌液琼脂培养基中含有丰富多样的营养物质, 其营养成分配比更接近于海洋环境, 如碳氮硫浓度、盐度, 可以为多种类型的菌株提供生长所需的营养环境。分析添加的微量元素的分离效果, 含有醋酸钠的培养基获得了更多的菌株数量; 同时发现与已知物种Pseudactinotalea terrae、Actinoplanes sediminis、Tessaracoccus flavescens、Achromobacter piechaudii等相近的潜在新分类单元仅在含有醋酸钠的分离培养基中获得, 与Micromonospora aurantiaca相近的潜在新分类单元仅在含有甲硫氨酸的分离培养基中获得, 与Actinomadura meyerae相近的潜在新分类单元仅在含有DMSP 的培养基中获得。
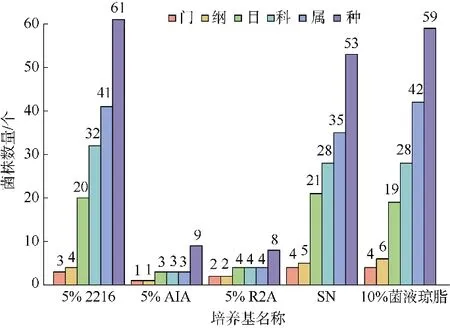
图4 不同培养基获得的可培养细菌在不同分类水平上的多样性Fig. 4 Bacterial diversity in different classification grades isolated from different selective isolation media
2.4 潜在新物种信息
以16S rRNA 基因相似度大于98% 时作为同一物种, 本试验中共分离得到56 株潜在新种, 与目前有效发表的最相近菌种的16S rRNA 基因相似度范围在89.9%~98.0%, 其中89.9%~95.0% 的有7 株,95.0%~97.0%的有21 株, 97.0%~98.0%的有28 株;去重复后为18 个潜在新种, 见表3。图5 为56 株潜在新种与已知物种的系统进化发育树, 其中31 株潜在新分类单元属于放线菌纲, 19 株属于α-变形菌纲, 3 株属于芽孢杆菌纲, 3 株属于Chitinophagia 纲。获得的31 株潜在放线菌纲新种分别属于短杆菌属(Brevibacterium)、短状杆菌属(Brachybacterium)、Barrientosiimonas属 、 赖 氨 酸 单 胞 菌 属(Lysinimonas)、微杆菌属(Microbacterium)、花金龟菌属(Protaetiibacter)、迪茨氏菌属(Dietzia)、戈登氏菌属(Gordonia)、类诺卡氏菌属(Nocardioides)、普劳氏菌属(Prauserella)、阮氏菌属(Ruania)和链霉菌属(Streptomyces)。对潜在新种的来源培养基进行分析,发现在5% 2216 培养基(19 株)和SN 培养基(19 株)中获得了最多的潜在新种。图6 展示了部分潜在新物种的平板菌落形态情况。
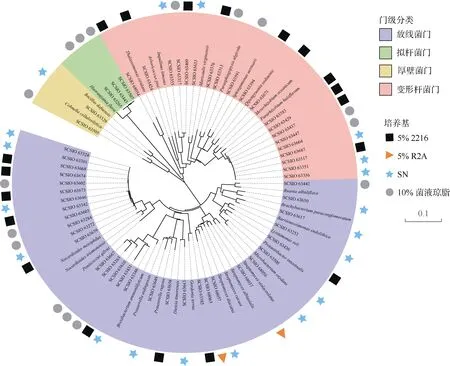
图5 不同培养基分离得到的潜在新种的系统发育树Fig. 5 Phylogenetic tree of potential new taxa obtained from different media
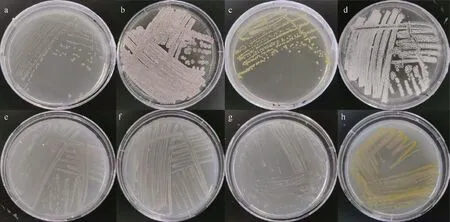
图6 不同潜在新种在2216E 培养基上培养14 天后的菌落平板a. SCSIO 63409 (Inquilinus limosus); b. SCSIO 63263 (Brevibacterium casei); c. SCSIO 63671 (Mesorhizobium oceanicum); d. SCSIO 63659 (Nocardioides iriomotensis); e. SCSIO 63385 (Gordonia terrae); f. SCSIO 63505 (Cohnella cellulosilytica); g. SCSIO 63658(Prauserella rugose); h. SCSIO 68054 (Oceanobacillus iheyensis)Fig. 6 Pure culture morphology of potential new taxa on 2216E medium after incubation for 14 days. (a) SCSIO 63409(Inquilinus limosus); (b) SCSIO 63263 (Brevibacterium casei); (c) SCSIO 63671 (Mesorhizobium oceanicum); (d) SCSIO 63659 (Nocardioides iriomotensis); (e) SCSIO 63385 (Gordonia terrae); (f) SCSIO 63505 (Cohnella cellulosilytica); (g)SCSIO 63658 (Prauserella rugose); (h) SCSIO 68054 (Oceanobacillus iheyensis)
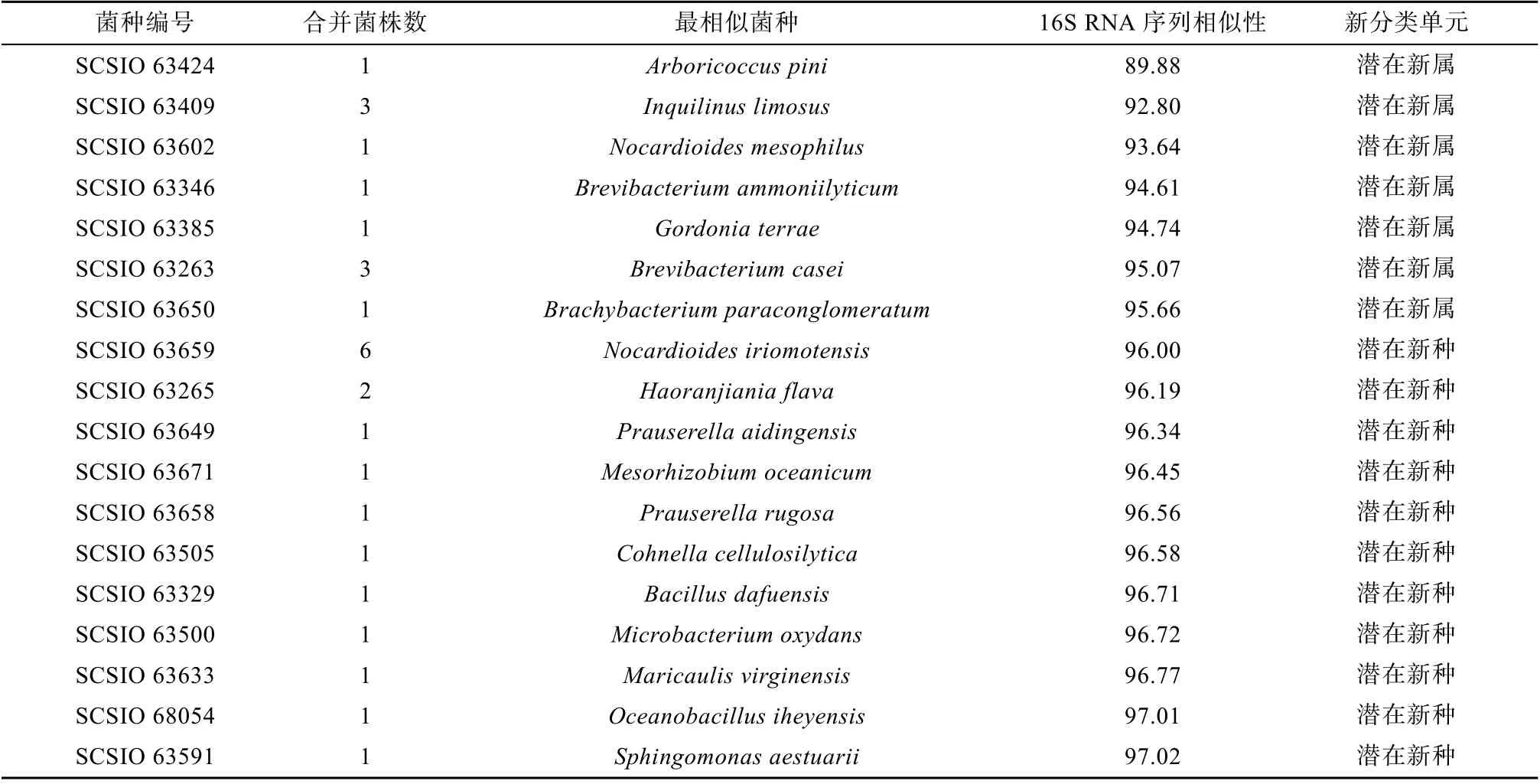
表3 潜在新菌种去重复信息表Tab. 3 Potential new taxa information after removing the duplication
2.5 PICRUSt2 功能预测分析
基于PICRUSt2 软件, 进行菌群功能分析, 得到不同样品细菌的功能预测信息。利用KEGG 数据库对测序数据进行比对, 所有样品分析的功能涉及8 类生物代谢通路: 代谢(metabolism)、功能蛋白(protein families)、遗传信息处理(genetic information processing)、环境信息处理(environmental information processing)、细胞转化(cellular processes)、生物体系统(organismal systems)、人类疾病(human diseases)和未分类(Unclassified)(图7), 这8 个代谢通路主要体现了细菌菌群的生长繁殖、物质代谢与转运、能量代谢与传递、环境互作等方面的功能信息。分析结果显示, 代谢和编码功能蛋白是主要通路, 丰度分别为40.64%~43.0%和23.18%~23.83%。进一步对预测基因二级功能层级进行分析, 共发现碳水化合物代谢(carbohydrate metabolism)、氨基酸代谢(amino acid metabolism)、转录(transcription)、膜转运 (membrane transport) 、 信 号 传 导 (signal transduction)、细胞生长和死亡(cell growth and death)和能量代谢(energy metabolism)等38 个子功能。分析发现3 个样品的群落功能组成大体一致, 在碳水化合物代谢、氨基酸代谢、编码遗传信息处理蛋白、编码信号转导和细胞过程蛋白等通路具有更高的丰度。PICRUSt2 功能预测分析显示出有人岛礁和无人岛礁细菌群体在其生态功能方面并无差异, 这说明岛礁周边水下环境细菌生态功能并未因为岛礁陆域上人为活动而受到影响。
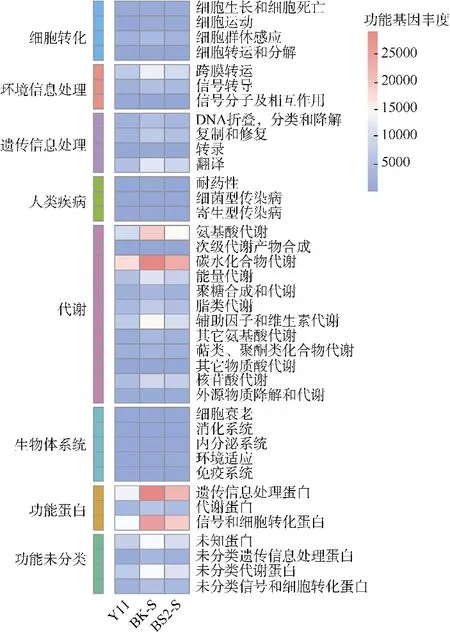
图7 不同来源样品的PICRUSt2 功能预测热图Fig. 7 Function prediction heatmap of PICRUSt2 for three different samples
3 讨论
珊瑚砂是以珊瑚碎屑为主并有石灰藻、有孔虫、棘皮动物碎片、贝壳碎片等组成的砂质沉积物, 颗粒大小不等, 规格多种多样, 其最大的特点是表面微孔丰富, 适宜细菌生存。本研究采用纯培养方式对南海岛礁珊瑚砂环境可培养细菌多样性进行研究,共获得349 株纯培养菌株。鉴定结果显示这些菌株分别属于4 门、6 纲、26 目、43 科、73 属、134 种,包括18 个潜在新种, 其中放线菌门是最优势的细菌类群, 占所有分离菌株的60%, 原因可能与3 个样品营养贫瘠有关; 其他优势类群依次为变形菌门(28%)、厚壁菌门(11%)和拟杆菌门(2%)。分离得到较多的属级类群为链霉菌属(46 株)、糖多孢菌属(40株)和产微球茎菌属(37 株)。分析发现样品BK-S 和BS2-S 中的细菌多样性较高, 而Y11 样品的细菌多样性较为单一。样品BK-S 和BS2-S 来源于无人岛礁, Y11 样品来源的岛礁上有人类活动, 对细菌群落功能的预测分析结果显示有人岛礁和无人岛礁细菌群体在其生态功能方面并无差异, 这说明岛礁周边水下环境细菌生态功能并未因为岛礁陆域上人为活动而受到影响, 因此Y11 样品来源岛礁周围环境中的细菌多样性低的原因仍然未知。Schöttner 等(2011)对红海亚喀巴湾东北部浅岸礁的碳酸盐砂和硅酸盐砂样品进行免培养细菌多样性的研究, 发现珊瑚砂样品中细菌的群落组成主要为γ-变形菌纲、放线菌纲、α-变形菌纲、δ-变形菌纲、厚壁菌门、拟杆菌门等。韩敏敏等(2020)使用6 种普适性培养基对Khai岛和Pathiu 岛采集的2 份珊瑚礁沉积物样品进行分离培养, 获得的可培养细菌类群为变形菌门(54.55%)、厚壁菌门(31.82%)、放线菌门(9.09%)和拟杆菌门(4.54%)。对比已有的对珊瑚砂细菌多样性的研究, 本研究获得的可培养类群与珊瑚砂中主要细菌类群一致, 并且通过优化改良培养基, 从样品中获取了更多种类的菌株, 有助于更好的反映珊瑚砂样品中可培养细菌的多样性。
本研究将常用的2216E、R2A、AIA 等基础培养基稀释到5%, 以及使用SN、10%菌液琼脂等寡营养培养基对样品进行分离, 从得到的纯培养菌株多样性来看, 寡营养培养基珊瑚砂样品具有更好的分离效果。根据文献报道, 在营养丰富的培养基中获得的微生物的数量并非最多, 相反培养基中高浓度的营养物会影响寡营养微生物细胞生长, 而用于培养寡营养环境中微生物的培养基中有机碳水平不应高于50mg·L-1(Jannasch et al, 1959; Kadota, 1981;Kjelleberg et al, 1985)。Cho 等(2004)在分析太平洋及远洋样品时, 发现有44 株γ-变形菌无法在经典培养基上形成菌落, 而其中7 株菌却可以在10% R2A 琼脂培养基上形成菌落。K o c h(2 0 0 1)认为当寡营养微生物从营养贫乏的生态环境中突然转移到富营养环境中时, 微生物无法快速适应环境变化, 可能会在生长过程中产生有毒物质, 例如有氧代谢形成的有毒产物累积或细胞内自由基过快积累, 导致细胞损伤, 影响生长。同时, 大量非代谢物质的转运摄取会导致细胞壁、细胞质生长不均衡, 膜蛋白比例过高阻碍细胞质膜生长, 细胞内代谢失调, 影响细胞增殖机制。
环境中有些微生物具有乙酰辅酶 A 连接酶(Acetate-CoA ligase, EC 6.2.1.1), 能利用乙酸盐作为唯一碳源, 使乙酸盐生成乙酰辅酶A, 而乙酰辅酶A 是细胞生化代谢过程中重要的中间产物, 可以转化成多种细胞所需要的营养物质。硫元素是生物体必需的营养元素, 在海洋生态系统中硫酸盐、硫化物储存量巨大, 不同价态硫化合物之间的转化主要由代谢功能多样的微生物等来完成, 环境中的硫元素对某些微生物的生长至关重要。因此, 本研究在寡营养培养基的基础上, 添加乙酸钠、含硫氨基酸、DMSP 等小分子物质来增加从环境中获取微生物的几率, 从结果来看, 与以往使用经典培养基进行环境样品分离相比, 本研究获得的菌株在多样性和潜在新种数量等方面都有显著的提高。

