盐度对广盐型聚球藻K1 生长及转录组的影响*
廖莹, 夏晓敏
1. 热带海洋生物资源与生态重点实验室(中国科学院南海海洋研究所), 广东 广州 510301;
2. 中国科学院大学, 北京 100049
海洋聚球藻(cluster 5Synechococcus)是一类光合自养的微微型原核生物, 直径介于0.6~1.7μm 之间, 广泛分布于河口和海洋区域(Moore et al, 2002;马英 等, 2004)。聚球藻光合膜外排列着许多大分子聚集体——藻胆体(phycobilisomes, PBSs), 其功能是捕获并将已捕获的光能传递给类囊体上的叶绿体a进行光合作用(Yamanaka t al, 1981; 路荣昭 等,1991)。根据藻胆体组成结构的不同, 聚球藻可分为3 种色素类型(Callieri et al, 2002; Six et al, 2007)。Ⅰ类(type1)聚球藻只含藻蓝蛋白(phycocyanobilin,PCB), 吸收红光呈现绿色, 主要分布于河口区域;Ⅱ类(type2) 聚球藻同时含有藻红蛋白(phycoerythrobilin, PEB)和PCB, 分布在相对干净的近岸水域; Ⅲ类(type3)聚球藻同时含有藻尿胆素(phycourobilin, PUB)、PEB 和PCB, 对蓝光吸收较强, 广泛分布于外海(Xia et al, 2017, 2018)。按照PUB/PEB 的比例, Ⅲ类聚球藻又可分为3a 型(低PUB)、3b 型(中PUB)、3c 型(高PUB)、3d 型(可变PUB)和3f 型(超高PUB)(Everroad et al, 2012; Xia et al, 2017)。另一方面, 根据标记基因的序列差异, 如rpoC1 (Fuller et al, 2003; Mühling et al, 2005)和内源转录间隔区(internally transcribed spacer, ITS)(Rocap et al, 2002; Ahlgren et al, 2006), 海洋聚球藻被分为3 个主要进化亚簇(subcluster): subcluster 5.1、subcluster 5.2 和subcluster 5.3。其中, subcluster 5.1和subcluster 5.3 主要为严格海洋型聚球藻, 广泛分布于外海, 而subcluster 5.2 为广盐型聚球藻, 是河口的重要组成部分。近期研究中subcluster 5.1 被进一步分为20 个遗传型, 主要由Ⅱ类和Ⅲ类聚球藻组成(Xia et al, 2019)。
聚球藻具有丰富的物种多样性, 其分布受多种环境因素影响。前期研究中发现聚球藻的色素类型分布与盐度梯度紧密相关, PEB 型聚球藻丰度在高盐区域较高, 而在低盐区域则显著降低(Wang et al,2011)。此外, Xia 等(2017)在香港水域的调查中发现,随着盐度增加, 聚球藻的优势种逐渐由PCB 型聚球藻(Ⅰ型)向PEB 型聚球藻(Ⅱ和Ⅲ型)转变(Xia et al,2017)。而遗传类群中, subcluster 5.2 主要分布在低盐海域, 而subcluster 5.1-clade Ⅱ和subcluster 5.1-clade Ⅲ广泛分布于高盐海域。随着生物技术的发展, 聚球藻基因组分析技术已比较成熟, Palenik 等(2003)已破译聚球藻WH8102 的全基因组。目前,NCBI 数据库中已经有30 多个相对完整的聚球藻基因组数据, 但聚球藻中部分基因功能还未知, 而转录组测序技术即RNA-seq (RNA Sequencing), 可反映物种的表达信息, 得到大量功能基因表达数据,对揭示基因表达与生物学过程的关系具有重要意义。因此, 通过转录组的比较分析, 有助于揭示河口区域聚球藻的盐度适应机制。
本文选取广盐型聚球藻K1 和严格海洋型聚球藻YX02-1, 对两者在不同盐度下的生长进行对比,并进一步通过转录组分析广盐型聚球藻K1 的耐低盐机制, 旨在加深人们对聚球藻盐度适应机理的认识, 为厘清聚球藻分布和变化趋势提供新的科学依据和预测方向。
1 材料与方法
1.1 聚球藻的分离纯化
将采集的1mL 海水样品转至3mL 无硅f/2 培养基(表1)(Guillard et al, 1962), 用灭菌海水稀释5 倍,同时加入放线菌酮(20mg·L-1)以抑制真核藻类生长,并置于25℃、光照∶黑暗=12∶12、35μmoL·m-2·s-1光照强度下培养数天。当培养基出现淡红色或者淡绿色时, 采取稀释法和平板划线法分离纯化聚球藻K1。稀释法: 取5 个12mL 细胞培养管, 高温高压灭菌后做标记, 每个培养管中加入9mL 用灭菌人工海水配置的无硅f/2 培养基, 并加入1mL 藻液于1号培养管, 轻摇混匀后, 汲取1mL 混合液至2 号培养管, 按顺序依次稀释至5 号培养管, 最后放置于光照培养箱(Kenton, China)中培养。平板划线法: 在500mL 液体无硅培养基中加入5g 琼脂, 高温高压灭菌后制成固体培养平板备用, 利用接菌环或涂布棒将藻液轻轻涂抹于平板上, 置于光照培养箱下培养数天并观察生长状况, 以ropC1 标记基因利用PCR和流式细胞仪分析为依据验证聚球藻是否纯化成功。

表1 无硅f/2 培养基配方Tab. 1 The medium formula of f/2 without silicon
聚球藻YX02-1 分离自南海, 由厦门大学郑强博士提供。
1.2 试验设计及生理测定
试验选用聚球藻YX02-1 和K1, 通过调节人工海水中NaCl 和MgCl2浓度设置5 个盐度: 10‰、13‰、18‰、25‰和33‰, 并设3 个重复组, 于40mL细胞培养瓶中连续培养, 培养条件: 25℃、光照∶黑暗=12∶12、35μmoL·m-2·s-1。培养过程中每24h 取1mL藻液, 利用可见分光光度计(A360, China)进行OD440测量, 并绘制生长曲线。
1.3 全吸收光谱和流式细胞分析
采用可见分光光度计测量聚球藻YX02-1 和K1的全吸收光谱(400~700nm), 并通过流式细胞仪(Becton-Dickinson FACSCalibur cytometer, Becton,Dickinson and Company, USA) 488nm 和635nm 的双激光束测定两种藻株的色素类型。
1.4 DNA 提取、PCR 及测序
采用 DNA 提取试剂盒(Invitrogen, Thermo Fisher Scientific, Carlsbad, CA, USA)提取聚球藻DNA。将滤膜用无菌剪刀剪成2mm×2mm 碎片, 按照试剂盒说明书操作。DNA 提取后储存于 TE(Tris-EDTA)缓冲液中进行洗脱, 并于-20℃冰箱中保存, 待进一步作特定功能基因rpoC1 扩增实验。第一轮PCR 反应采用25μL 反应体积: 模板1μL、引物(rpoC1-N5 和rpoC1-C) 1μL、超纯水9.5μL 和taqDNA 聚合酶12.5μL。首先将反应体系处于95℃下进行10min 高温变性, 然后进行30 个循环: 95℃45s, 51℃ 45s, 72℃ 45s, 最后, 在Taq酶(72℃)作用下, 以dNTP 为原料, 合成与模板互补的DNA 链。第二轮采用 50μL 反应体积: 模板 3μL、超纯水18μL、taqDNA 聚合酶 25μL 和引物[rpoC1-39F(5′-GGNATTNGTNTGYGAGCGYTG-3′) 和rpoC1-462R (5′-CGYAGRCFCTGRTCAGCTT-3′)] 各 2μL(Xia et al, 2015, 2018)。扩增子通过Beckman AWPure Beads 纯化后, 采用Agilent 2100 Bioannlyzer 定量并于Illumina Hiseq 2500 进行高通量测序。
1.5 进化树构建
从NCBI 数据库下载除K1 外的45 株聚球藻的rpoC1 基因序列。利用MEGA7.0 软件进行同源性分析(Kumar et al, 2016), 通过 ClustalW 对核苷酸序列进行一致性比对, 并以最大似然数(maximum likelihood)构建系统发育进化树, 以cluster 3 (聚球藻进化簇3)序列为外群, 测试方法Bootstrap, 重复数100。
1.6 样品收集和转录组分析
将培养在33‰和10‰并处于对数生长期的聚球藻K1, 通过0.2μm PC 膜(polycarbonate membrane,聚碳酸酯膜)过滤收集后放于1.5mL 离心管中, 加入200μL RNA Later 液氮速冻, 于-80℃超低温冰箱中储存等待送样测序。提取工作由广州美格公司承接,提取后对样品质量进行检测并选取合格样品进行文库构建和初步定量, 并于Illumina Hiseq 2500 平台进行文库测序, 获得带接头的原始测序序列, 使用megahit 和Prodigal 进行基因组装和预测处理原始测序数据(raw reads)后, 利用bowtie 计算每个基因丰度, 最后得到高质量数据(clean reads)进行基因表达水平分析, 转录基因丰度升高表明基因表达水平也在提高, 通过序列数即可估计相应基因的表达水平。另外, 将获得的高质量数据进行基因注释并上传至京都基因与基因组数据库(Kyoto encyclopedia of genes and genomes, KEGG)和蛋白相邻类的聚簇数据库(cluster of orthologous groups of proteins,COG)进行序列比对和富集分析。
1.7 差异基因分析
通过R 语言DESeq2 进行基因差异性分析, 得到高盐和低盐样本中的差异表达基因(differential expression genes, DEGs), 并取p-value<0.05 且|log2Foldchange|>1 的基因作为差异基因集, 基因上升或下降2 倍以上的进一步使用R (version 3.4.0)聚类软件包 pheatmap 作热图分析, 且所有 TPM(Transcript per million, 每千个碱基的转录每百万映射读取的转录本)值进行平方根处理(square root transformed, sqrt), 基因名称、功能等通过KEGG 注释。
1.8 数据分析
生长速度通过R (version 3.6.3)和Excel 2016 进行统计学分析, 以平均值及标准差形式展示(mean±sd); 通过以下公式计算生长率(μ, 单位: d-1):
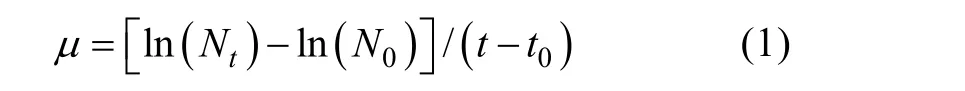
式中:Nt和N0分别表示t和t0时聚球藻在440 nm 波长下的吸光值。本研究所获得的序列数据已上传NCBI 数据库, 登录号为: PRJNA723138 和MW971921, 其他聚球藻序列下载自NCBI 数据库。
2 结果
2.1 聚球藻的生理特征
聚球藻K1 和YX02-1 在不同盐度下的生长曲线如图1 所示。K1 在10‰、13‰、18‰、25‰和33‰盐度下均生长良好, 13‰时具有最高生长率(对数期), 为0.189, 33‰时生长率最低, 为0.145 (图1b)。而YX02-1 在盐度33‰时生长率最高, 为0.2, 10‰和13‰盐度中无法生存, 18‰盐度下的聚球藻生长状态较差, 生长率为0.1 (图1a、图2)。结果表明K1盐度适应性强, 但更偏好中低盐环境, 而YX02-1 则在≤13‰盐度下无法生存。
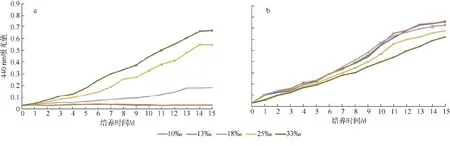
图1 聚球藻YX02-1 (a)和K1 (b)在不同盐度(10‰、13‰、18‰、25‰、33‰)下的生长曲线Fig. 1 The growth curve of Synechococcus sp. of YX02-1 (a) and K1 (b) at different salinity (10‰, 13‰, 18‰, 25‰, 33‰)

图2 聚球藻YX02-1 在不同盐度(10‰、13‰、18‰、25‰、33‰)下培养至第8 天时的生长状况Fig. 2 The growth of Synechococcus sp. YX02-1 cultivated for eight days under different salinity (10‰, 13‰, 18‰, 25‰,33‰)
2.2 聚球藻鉴定和进化树构建
聚球藻YX02-1 (图3a)和K1 (图3b)的全吸收光谱显示, YX02-1 在490nm 和550nm 处存在两个吸收峰, 分别是PUB 和PEB, 而K1 在630nm 处存在一个吸收峰, 为PCB (Six et al, 2007)。同时,流式细胞分析显示YX02-1 具有很强的藻红蛋白(PEB)荧光信号(图3c), 而K1 具有较强的藻蓝蛋白(PCB)荧光信号(图 3d)。该结果表明, YX02-1为PEB 型聚球藻, K1 为PCB 型聚球藻。
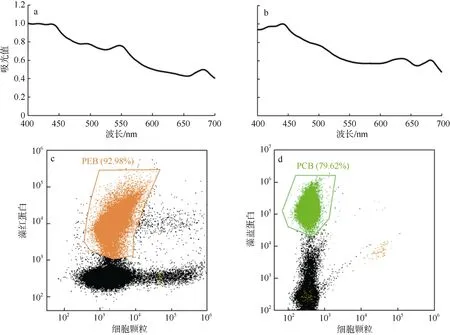
图3 聚球藻YX02-1 (a)、K1 (b)的全吸收光谱图和YX02-1 (c)、K1 (d)的流式细胞荧光信号图PEB: 藻红蛋白; PCB: 藻蓝蛋白Fig. 3 The total absorption spectra of Synechococcus sp. YX02-1 (a) and K1 (b) and the flow cytometric fluorescence signals of Synechococcus sp. YX02-1 (c) and K1 (d)
基于极大似然估计(maximum likelihood)方法对rpoC1 功能基因进行比对和分析, 构建包括YX02-1、K1 在内的46 株聚球藻的系统发育进化树,进一步分析明确聚球藻的分类地位(图4)。结果显示,聚球藻被分为3 大类: subcluster 5.1、subcluster 5.2和subcluster 5.3, 其中, YX02-1 与WH8103 亲缘性为100%, 被共同划分为subcluster 5.1-clade Ⅲ, K1与LTW-RED、WH8007 共同组成subcluster 5.2-B。结合图3 聚球藻色素类型分析, 可鉴定YX02-1 为PEB 严格海洋型聚球藻, K1 为PCB 广盐型聚球藻。
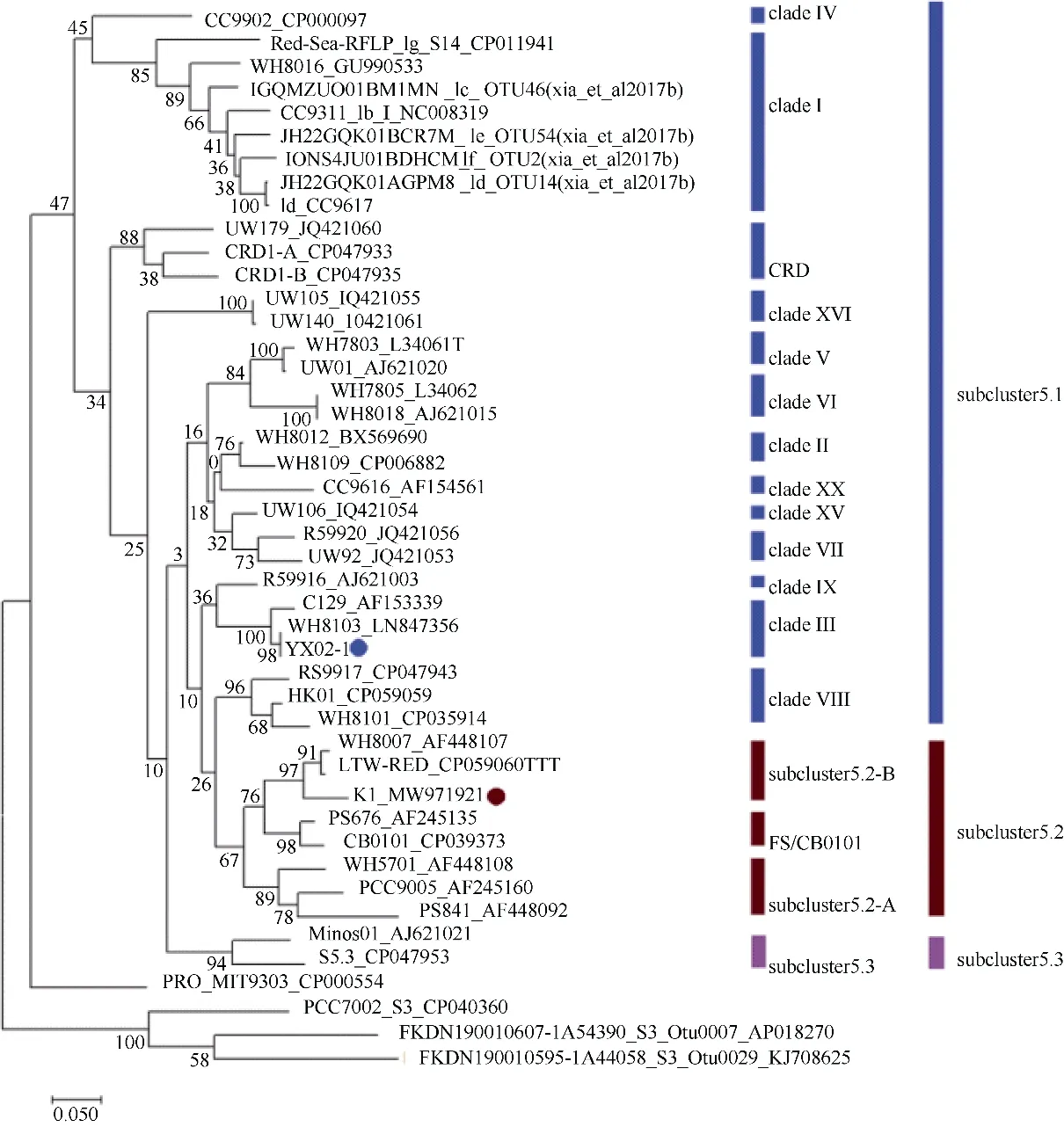
图4 聚球藻系统发育进化树主要分为3 个分支: subcluster 5.1、subcluster 5.2 和subcluster 5.3。聚球藻K1 由红色圆圈标记, 聚球藻YX02-1 由蓝色圆圈标记Fig. 4 The phylogenetic tree of Synechococcus being mainly divided into three groups: subcluster 5.1, subcluster 5.2 and subcluster 5.3. K1 is marked by red dot, while YX02-1 is marked by blue dot
2.3 低盐条件下聚球藻K1 在转录组水平的基因表达
聚球藻K1 在低盐或高盐培养条件下的差异表达基因分析显示: 以高盐条件为对照组, 低盐条件下显著上调基因共227 个, 下调基因70 个, 并且差异性基因主要参与碳水化合物转运和代谢、能量产生和转化、信号转导等。在低盐条件下, 与渗透压有关的基因, 包括ggpS (葡萄糖基甘油磷酸合成酶)、SPS(蔗糖磷酸合成酶)、stpA (葡萄糖基甘油3-磷酸酶)等基因丰度发生显著下降(图5b、图6a)。并且聚球藻K1 的色素蛋白cpcA 和cpcB 基因, 以及光合作用中ATPF0B、ATPF0A、ATPF1D和ATPF1A等相关产能基因丰度, 均在低盐条件下显著下降,说明盐度会影响聚球藻的光合作用(图5b、图6b)。此外, 代谢通路包括碳循环、硫代谢、氮代谢等也均受到盐度影响。其中,cynT 基因作为氮代谢的重要参与者, 在低盐培养条件下表达量增加。基因coxA、coxB 和coxC 是细胞色素亚基单位, 参与氧化磷酸化, 具有将氢离子从基质泵入细胞间隙的能力, 并产生ATP 供转运者泵出渗透性成分或铁, 以维持低盐度条件下的渗透压平衡, 这些基因均在低盐条件下明显上调。而热休克蛋白HSP20 基因表达量上升, 这类蛋白是非生物胁迫下细胞耐受机制的重要组成部分(图5a)。此外,FTRC基因明显下调, 该基因为铁氧还蛋白硫氧还蛋白还原酶, 其催化生成的还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)可用于卡尔文循环中的固碳以及硫同化、碳同化等(图5b)。上述基因表达量的丰度变化是聚球藻K1 适应低盐环境的重要内在机制。
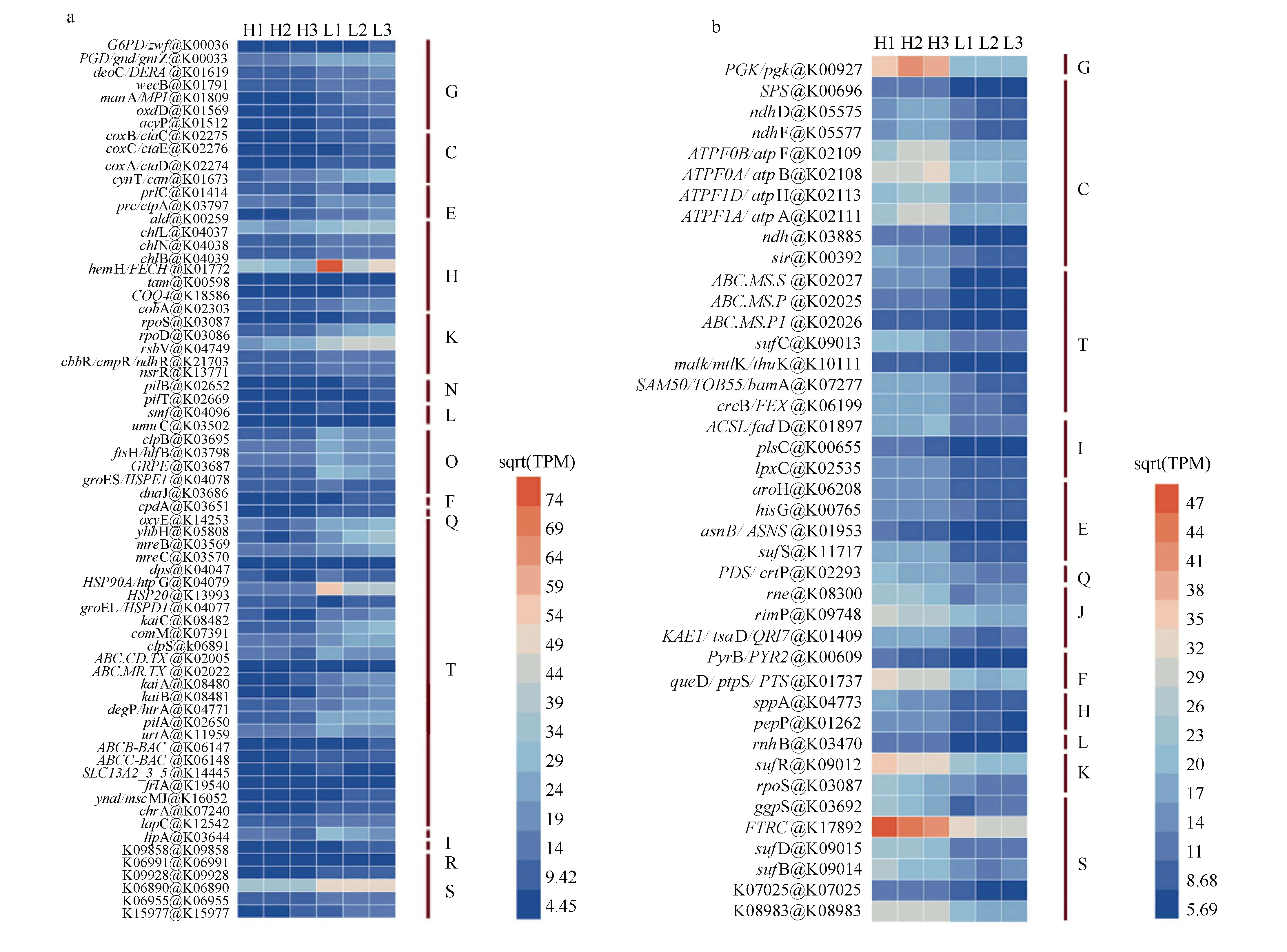
图5 热图显示低盐条件下聚球藻K1 显著上调(a)或显著下调(b)的基因及丰度图中H1、H2、H3 表示高盐组; L1、L2、L3 表示低盐组。Sqrt(TPM)表示经过开平方转换的TPM 值。图中左侧为基因名称@该基因在KEGG 通路中的K 号; 右侧字母为基因功能代码, J: 翻译、核糖体结构和生物发生; K: 转录; L: 复制, 重组和修复; D: 细胞周期, 细胞分裂, 染色体分配; V: 防御机制; T: 信号转导机制; M: 细胞壁/膜/包膜生物发生; N: 细胞运动; U: 细胞内运输, 分泌和囊泡转运; O: 翻译后修饰, 蛋白质周转, 分子伴侣; C: 能量产生和转化; G: 碳水化合物转运和代谢; E: 氨基酸转运和代谢; F:核苷酸转运和代谢; H: 辅酶转运和代谢; I: 脂质转运和代谢; P: 无机离子转运和代谢; Q: 次级代谢产物生物合成, 转运和分解代谢; S: 未知功能Fig. 5 The heatmap showing that the gene abundance (TPM) of Synechococcus sp. K1 was significantly up-regulated (a) or down-regulated (b) at low salinity
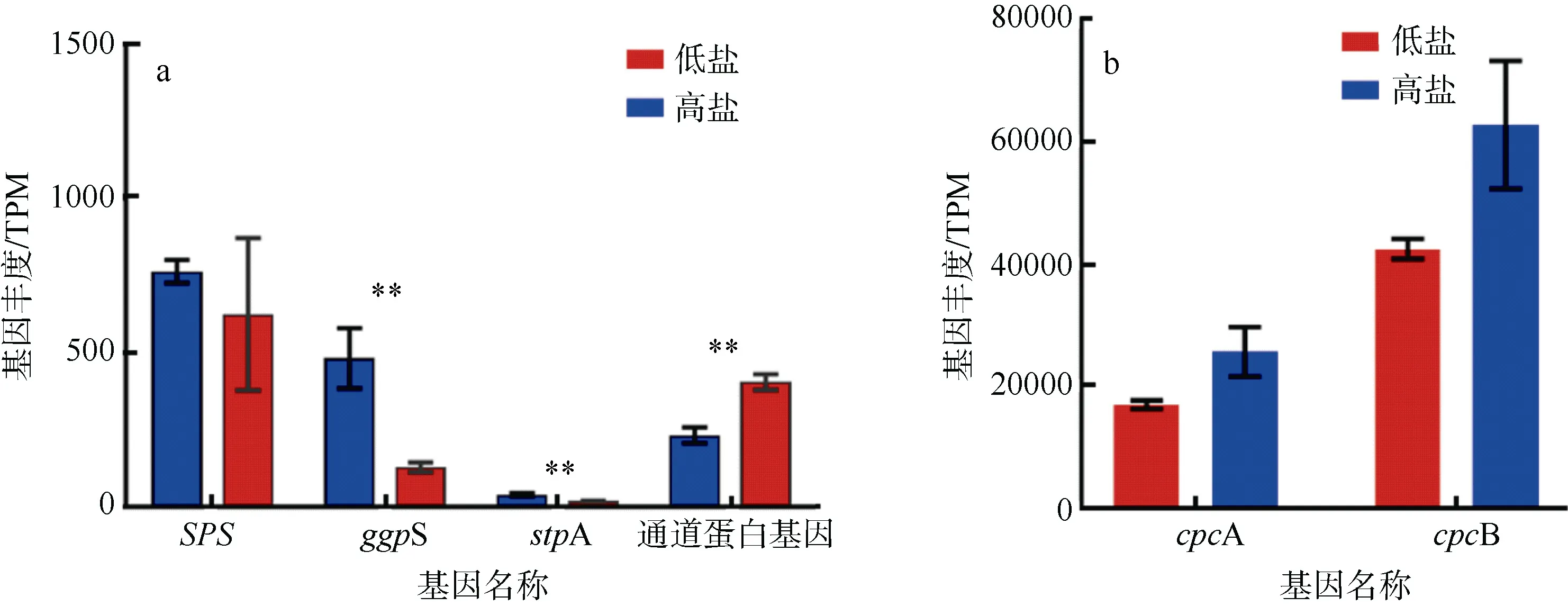
图6 聚球藻K1 在高盐或低盐培养条件下渗透压有关的基因SPS、ggpS、stpA、通道蛋白基因(a)和色素蛋白基因cpcA、cpcB (b)的基因丰度(TPM)比较**表示差异极显著(p<0.01)Fig. 6 Comparison of the abundance (TPM) of genes SPS, ggpS, stpA, channel protein (a) and pigment proteins genes cpcA,cpcB (b) under high and low salinity
2.4 盐度对聚球藻K1 主要代谢过程的影响
聚球藻K1 在低盐和高盐培养条件下均保持着完整的代谢通路过程, 主要包括碳代谢、硫代谢和氮代谢。在碳代谢过程中, 参与葡萄糖降解的有关基因在低盐条件下显著上调。其中,g lk基因(glucokinase, 葡萄糖激酶)上调了约1.4 倍;G6PD(glucose-6-phosphate-1-dehydrogenase, 6-磷酸葡萄糖1-脱氢酶)上调了约2 倍, 该基因是糖酵解和其他葡萄糖分解的重要参与者;PGLS(6-phosphogluconolactonase, 6-磷酸葡萄糖酸内酯酶)和PGD(6-phosphogluconolactonase dehydrogenase, 6-磷酸葡萄糖酸脱氢酶)分别上调了1.7 和1.9 倍(图7a)。在碳代谢的其他过程中, 参与合成乙酰辅酶A 的PDHA(pyruvate dehydrogenase, 丙酮酸脱氢酶)、PK(pyruvate kinase, 丙酮酸激酶)、PGK(phosphoglycerate kinase, 磷酸甘油酸激酶)等基因表达量基本降低了1~4 倍, 其中,PGK下调最多, 约3.5 倍(图7b)。硫代谢中, 参与异化硫酸盐还原过程中的基因表达量均下降(该过程为图7b 中的硫酸盐还原为硫化物)。而在氮代谢过程中, 硝酸盐还原为铵盐的过程增强, 包括NRT(nitrate/nitrite transporter, 硝酸盐/亚硝酸盐转运子)、narB (nitrate reductase B, 硝酸盐同化还原酶基因B)、narA (nitrate reductase A, 硝酸盐同化还原酶基因A)在内的基因丰度均上调了1倍左右(图7c)。同时, CO2转化为氨基甲酸盐的能力加强, 基因cynT 上调了约2.8 倍,cynS 上调了约1.9倍, 但谷氨酸盐代谢能力减弱。该结果说明盐度对硫代谢过程的消极影响最大, 其碳代谢部分通路在低盐下减弱, 并且还原硫酸盐的基因也受到限制,但硝酸盐还原为铵的能力增强, 说明K1 在河口下的生长过程需要大量的铵盐, 这也进一步解释了分布于河口的聚球藻对氮源的需求。
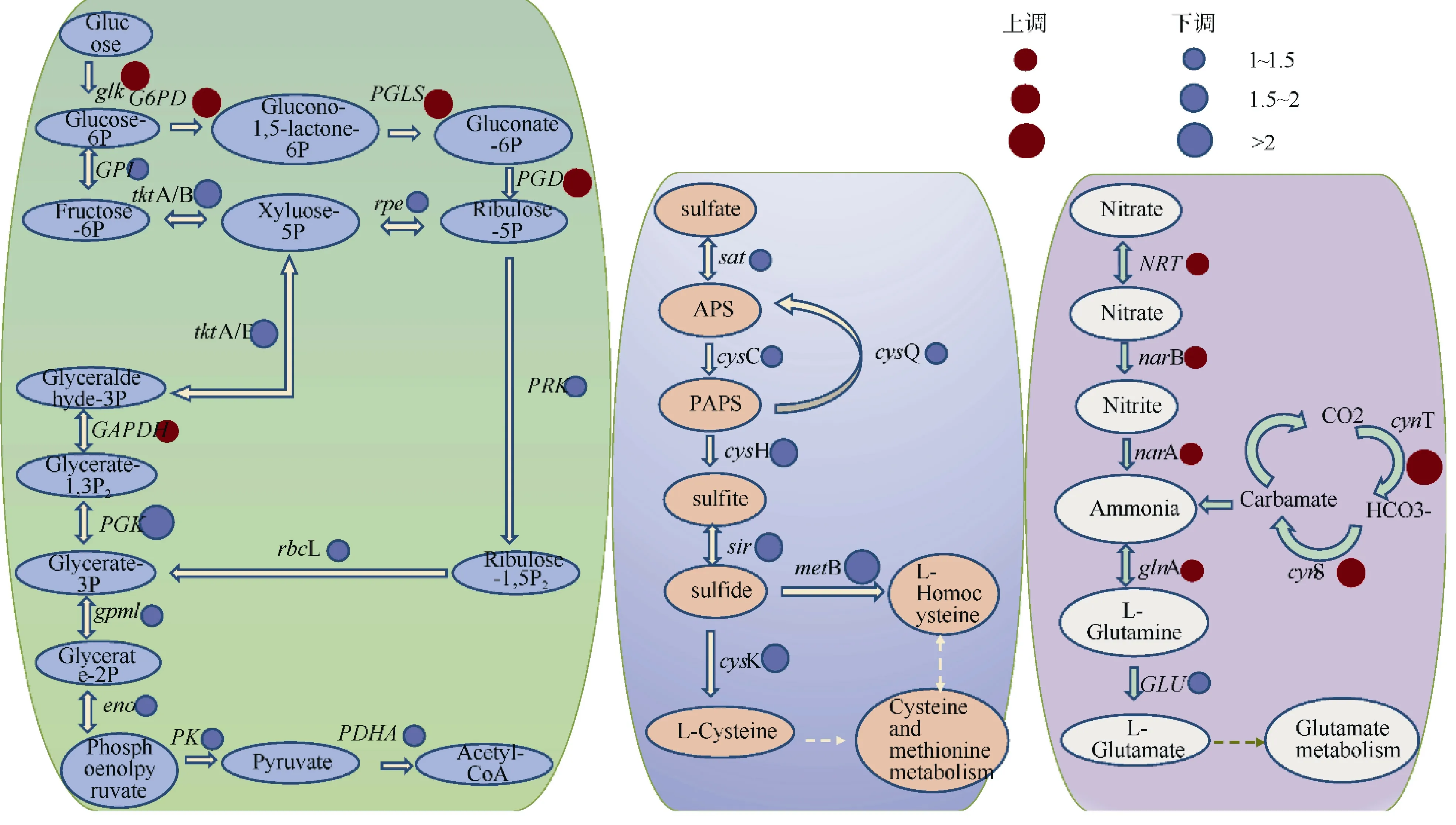
图7 聚球藻K1 碳代谢(a)、硫代谢(b)、氮代谢(c)途径对盐度变化的响应红色圆圈代表基因上调, 蓝色圆圈代表基因下调。圆圈大小表示调整幅度Fig. 7 The responses of carbon metabolism (a), sulfur metabolism (b) and nitrogen metabolism (c) of Synechococcus sp. K1 to salinity changes. The red dot represents the genes of up-regulation, and the blue dot represents the genes of down-regulation
2.5 聚球藻K1 的其他调控机制
通过对比低盐和高盐培养条件下聚球藻毒素-抗毒素系统(toxin-antitoxin system,TA-system)的相关基因(doc、mvpA、ftsZ、EARS)丰度, 发现两个试验条件下的基因表达量几乎没有变化(图8)。该结果说明TA-system 作为一种重要的防御机制, 能够降低生长、抑制生长或者杀死细胞亚群来抵抗环境压力, 是广盐型聚球藻生活在河口的重要组成, 但并不是其适应盐度的调控机制。
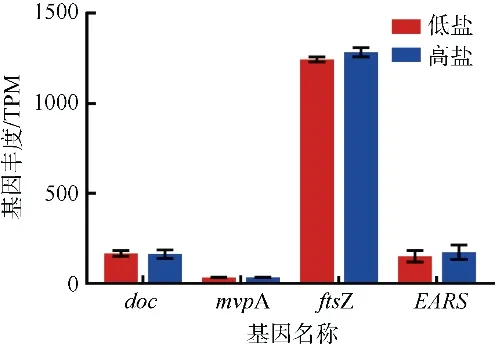
图8 聚球藻K1 在低盐或高盐培养条件下TA-system 相关基因(doc、mvpA、ftsZ、EARS)丰度(TPM)的比较Fig. 8 Comparison of genes (doc, mvpA, ftsZ, EARS)abundance (TPM) about TA-system under low and high salinity
3 讨论
前期针对河口区域聚球藻分布的研究显示, 聚球藻的色素类型组成及群落结构组成在河口区域具有明显的空间差异(Xia et al, 2015, 2017, 2018)。例如在珠江口, 随着盐度增加, 聚球藻的主要类群从淡水类群向subcluster 5.2, 再向subcluster 5.1-cladeⅢ过渡。研究指出, 河口聚球藻群落组成的空间变化往往是由盐度、营养盐、温度、浊度等环境要素决定(Celepli et al, 2017; Xia et al, 2017)。本研究通过对低盐区域和高盐区域分离得到的聚球藻进行不同盐度条件下的生长对比, 发现 K1 在盐度10‰~33‰范围内均生长良好, 而YX02-1 在盐度≤13‰下无法生长。这一结果进一步验证了盐度是影响聚球藻在河口分布格局的重要因素。此外, 我们发现虽然K1 在所有盐度(10‰、13‰、18‰、25‰、33‰)下都能生长, 但是33‰盐度下聚球藻K1 的生长率显著低于13‰盐度下的生长率。该结果表明K1 更偏好低盐度, 解释了为何广盐型聚球藻的丰度往往在河口中低盐度区域较高(Xia et al, 2017)。进化分析显示, 遗传分类上K1 属于subcluster 5.2, 而YX02-1 属于subcluster 5.1 (图4), 与Herdman 等(2001)的研究结果一致。Herdman 等发现subcluster 5.1 类群的聚球藻除了clade Ⅷ, 大部分都是严格海洋种, 而subcluster 5.2 类群的聚球藻都是能耐受低盐的广盐类群(Herdman et al, 2001)。
通过转录组研究, 我们发现广盐型聚球藻耐受低盐主要是通过减少细胞内渗透压相关小分子合成, 同时增加膜通道蛋白提高小分子物质外排来达到细胞内外渗透压平衡, 这一结果与 Xia 等(2020)人的研究结论一致, 他们针对PEB 型广盐型聚球藻的耐低盐机理开展研究, 发现该类型的聚球藻也是通过减少渗透压调节分子合成、减少小分子向胞内转运, 同时提高小分子外排来实现内外渗透平衡。研究表明, 蓝藻主要利用蔗糖、葡萄糖基甘油和甜菜碱作为渗透压调节分子(Celepli et al,2017)。我们对生长于低盐和高盐下的聚球藻K1 进行转录组比较分析, 发现在低盐条件下, 与糖酵解合成相关的基因ggpS 和stpA 基因表达量显著下降。ggpS 和stpA 作为糖酵解催化酶, 能催化ADP-葡萄糖转化为葡萄糖基甘油(GG), 表明葡萄糖基甘油是PCB 型广盐型聚球藻适应渗透压变化的关键物质。这与严格海洋型聚球藻及PEB 型广盐型聚球藻不同, 这两类聚球藻主要是利用甜菜碱作为渗透压调节分子(Xia et al, 2020)。在波罗的海的研究也发现, 聚球藻甜菜碱合成基因bsmB 主要在高盐度站位发现, 而蔗糖合成和葡萄糖基甘油合成的基因SPS和ggpS 在所有盐度都占有较高比例(Celepli et al, 2017)。这些结果表明使用不同的渗透压调节分子有可能是不同聚球藻类群耐受低盐能力差异的一个重要因素(Celepli et al, 2017)。另一方面, 转录组分析结果中还发现一种具有甘氨酸拉链(>fig|1129.219. peg.877, Glycine zipper, GXXXGX XXG)的通道蛋白(channel protein)基因, 其丰度在低盐条件下显著上升(图6a)。通过TMpred 网站对该蛋白序列进行预测, 结果显示该蛋白具有跨膜双螺旋结构(图9)。根据最近的研究报道, 该蛋白是一类双向跨膜蛋白, 被命名为glzT, 是渗透压调节机制Env/OmpR 系统的重要组成部分(Xia et al,2020)。该类跨膜蛋白基因glzT, 在PEB 型广盐型聚球藻(Xia et al, 2020)和PCB 型广盐型聚球藻(本研究)都有发现, 并且在低盐条件下表达量显著上调, 表明该蛋白普遍存在于广盐型聚球藻中, 与低盐耐受密切相关, 是广盐型聚球藻在河口低盐环境中重要的生存机制。
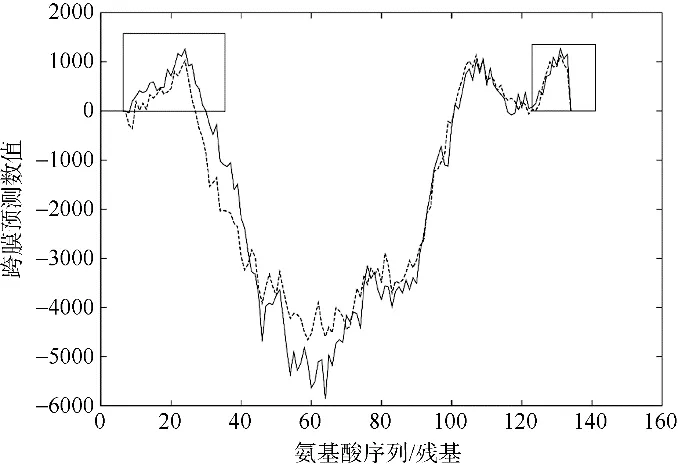
图9 TMpred 预测的基因glzT 跨膜结构图图中实线表示膜内向膜外预测; 虚线表示膜外向膜内预测。左和右侧小方框表示膜外区域Fig. 9 The transmembrane structure diagram of glzT predicted by TMpred
最后, 本研究表明降低盐度可对聚球藻多个代谢通路产生影响。在低盐条件下, 广盐型聚球藻的光合作用可能受到盐度影响, 其编码色素蛋白的基因cpcA、cpcB 以及相关产能基因ATPF0B、ATPF0A、ATPF1D和ATPF1A丰度均下调, 这与Deshnium 等(1995)报道一致, 该研究将聚球藻从无NaCl 培养基转移到含0.4mol·L–1NaCl (23.4‰)的培养基后, 两天内光合作用减弱、细胞生长缓慢,说明盐度变化会影响聚球藻的光合作用(Deshnium et al, 1995)。Ludwig 等(2012)报道发现ATPF0/F1在高盐下基因丰度上升, 该结果同样说明盐度会影响聚球藻光合作用(Ludwig et al,2012)。盐度降低对聚球藻的碳代谢、硫代谢、氮代谢也可发生不同程度影响。其中, 硫代谢所受影响最大, 相关基因丰度下调了 1~2 倍左右, 但氮代谢的相关基因普遍上调, 尤其是硝酸盐还原为铵的能力增强, 说明聚球藻K1 在低盐条件下需要较多无机氮, 与低盐下较高的生长率相一致。
Marsan 等(2017)研究发现, 在硝酸盐和磷酸盐限制下, 聚球藻CB0101 的TA-system 相关基因表达量在转录组水平发生明显上升, 这说明TA-system 是营养盐限制条件下的重要保护机制,目前已经在广盐型聚球藻包括CB0101、WH5701、CB0205 中均发现了该系统(Marsan et al, 2017)。但通过对比低盐和高盐下聚球藻K1 的TA-system 相关基因丰度, 发现盐度变化对其丰度影响较小, 该结果说明TA-system 是河口多变环境下的重要调节机制, 但可能并不是耐低盐机制的关键调节系统。
4 结论
本研究旨在阐明广盐型聚球藻K1 适应低盐的内在分子机制, 通过转录组分析发现, 广盐型聚球藻渗透压调节机制更完善, 其在低盐条件下能通过降低渗透剂(葡萄糖基甘油)的生物合成、蛋白通道转运离子、Env/OmpR 系统调节机制等, 改变细胞内渗透压以维持细胞正常生长。同时, 盐度还会影响聚球藻的光合系统及代谢水平。本文深入阐释了广盐型聚球藻的耐低盐机制, 但缺少与严格海洋型聚球藻的比较基因组分析, 后续研究需进一步结合多种研究方法, 从多方面更深入的探讨聚球藻对盐度的适应机制。

