刺参“参优1 号”新品种在不同盐度下的代谢特征和适应性研究*
王治平 李 彬 秦 蕾 王印庚,3 廖梅杰①荣小军 张 正 范瑞用 郑 炯
(1. 江苏海洋大学 连云港 222005;2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛 266071;3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室青岛 266071;4. 青岛瑞滋集团有限公司 青岛 266408;5. 青岛市渔业技术推广站 青岛 266000)
刺参(Apostichopus j aponicus)具有重要的营养和药用价值,在20 世纪80 年代,其苗种规模化繁育技术得到突破。进入21 世纪,养殖产业迅猛发展,成为引领我国第5 次海水养殖浪潮的主要品种。然而,近年来随着产业规模的急剧扩大,养殖业出现种质退化现象,表现出生长速度慢、病害频发、存活率低等问题,导致每年数10 亿的经济损失(王印庚等, 2014)。中国水产科学研究院黄海水产研究所针对刺参病害问题,采用群体选育方法,培育出具有生长速度快、抗病力强、成活率高的刺参“参优 1 号”新品种(GS-01-016-2017)(全国水产技术推广总站, 2018),为刺参养殖良种化提供了种质基础。刺参是狭盐性海洋动物,盐度作为重要的环境因子之一,对刺参的生长存活、呼吸排泄、能量和碳氮收支等生理生态影响显著(龚海滨等, 2009; 袁秀堂等, 2006; Yuan et al, 2010;孟雷明等, 2013)。随着刺参养殖产业的发展,尤其是“东参西养”和“北参南养”模式的快速发展,海参养殖区从最初的刺参自然分布区逐步拓展到黄河三角洲地区和闽、浙沿海。受海域自然盐度及降水、结冰、化冰、蒸发等因素的影响,各养殖区池塘盐度变化差异显著。本研究对不同盐度下刺参“参优1 号”的生长存活、呼吸代谢以及免疫酶活性进行了测定,旨在探明刺参“参优1 号”对盐度的适应性,分析不同盐度下,“参优1 号”苗种的免疫调节、耗氧率、排氨率、生长等代谢特征,进而确定其最适盐度条件及其耐盐机制,为该良种在不同地域推广、健康养殖提供理论依据和参考。
1 材料与方法
1.1 实验材料
本研究所用刺参“参优1 号”苗种由山东青岛瑞滋集团有限公司培育,苗种规格为(5.00±0.75) g。选取活力良好、健康无异的个体,在清洁海水中暂养7 d后用于后续实验。
1.2 实验方法
根据刺参对盐度的耐受特点,本研究设定16 个盐度梯度,分别为14、15、16、17、18、20、23、26、29、32、35、36、37、38、39 和40,实验用水以砂滤洁净海水为基础,采用粗盐或淡水调节至相应盐度并分别储备在体积为1 m3的单独的PP 水槽中。盐度实验所用养殖水槽为容积30 L 白色塑料水槽,按照每天降低或升高1 个盐度对海参进行梯度降盐或升盐。每个盐度实验设置4 个平行,其中,3 个平行实验组用于生长和存活测试,另外,1 个平行水槽用于酶指标的测定,每个平行放置30 头刺参。实验期间,每天投喂配合饲料1 次,投喂量为刺参体重的2%,每天按时投喂并吸底清污,并更换相同盐度的海水,换水量为50%。观测并记录刺参摄食、体征、生长、死亡等情况,计算各组存活率(Survival Rate, SR, %)和特定生长率(Specific Growth Rate, SGR, %/d),测定各组刺参的呼吸代谢及非特异性免疫酶活性的差异。
1.2.1 不同盐度条件下刺参“参优1 号”苗种特定生长率和存活率的变化 实验开始时,称取苗种的初始体重;实验结束时,记录苗种的存活数量和终末平均体重,苗种的SR 和SGR 采用以下公式计算:
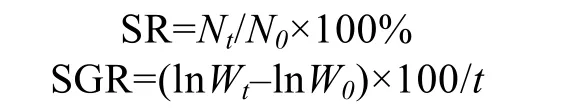
式中,N0和Nt分别为刺参初始数量和终末存活数量,W0和Wt分别为刺参初始平均体重和终末平均体重(g),t 为养殖天数。
1.2.2 不同盐度条件下刺参“参优1 号”苗种的呼吸代谢变化 各组到达设定盐度7 d 后,开始测定相应盐度下刺参的呼吸代谢。实验在2 L 呼吸瓶中进行,每个测试瓶中加入相应盐度的海水和刺参,每个盐度设3 个平行组,每组10 头刺参,同时,设立3 个空白对照组(未放置刺参组)。所有呼吸瓶放入同一个水槽中,以保持相同的温度条件(16.0℃)。每个呼吸瓶加满相应盐度海水和刺参后,立即用橡皮塞封口,封口后4 h,采用虹吸法自各实验组取水样,分别用碘量法(GB 17378.4-2007)和靛酚蓝分光光度法(GB 17378.4-2007)测定水样中溶解氧(DO)和氨氮(-H)含量,计算刺参的耗氧率(RO)和排氨率(RN)以及氧氮比(O : N)。计算公式如下:
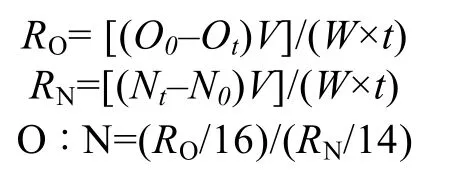
式中,O0和Ot分别为实验结束时对照组和实验组水体的DO 质量浓度(mg/L),N0和Nt分别为实验结束时对照组和实验组水体中总氨氮(TN)质量浓度(mg/L),t 为实验持续时间(h);W 为刺参的体重(g),V 为实验水体体积(L)。
1.2.3 不同盐度条件下刺参“参优1 号”苗种的非特异性免疫酶活性变化 30 d 的实验周期内,分别在0、10、20、30 d 从各盐度组随机取3 头刺参,活体解剖取体腔液,4℃条件下,5000 r/min 离心10 min,取上清液。使用南京建成生物公司的试剂盒并参照试剂盒说明书测定刺参苗种体腔液的酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LZM)、超氧化物歧化酶(SOD)的活性。
1.3 数据处理
使用GraphPad Prism 8.0 软件绘图,采用SPSS 18.0 对数据进行单因素方差(One-way ANOVA)分析,采用Tukey 检验对数据进行多重分析,P<0.05 为不同盐度组的相应指标差异显著。
2 结果与分析
2.1 盐度对刺参“参优1 号”苗种存活率的影响
实验周期内刺参“参优1 号”苗种在不同盐度条件下的SR 曲线见图1。从图1 可以看出,低盐对苗种存活影响很大,盐度为14 和15 实验组的苗种在14和24 d 累计死亡率达到100%;在30 d 的养殖期内,盐度为16~20 时,“参优1 号”苗种的SR 随盐度的升高而增加,苗种的 SR 由(13.33±4.71)%逐渐增加到(86.67±4.71)%;盐度为23~40 的各实验组SR 均为100%。
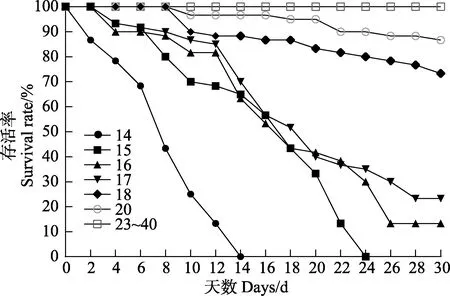
图1 不同盐度条件对刺参“参优1 号”苗种存活率的影响Fig.1 Effect of salinity on survival rate of sea cucumber “Shenyou No.1”
2.2 盐度对刺参“参优1 号”苗种生长的影响
盐度为14~16 的各实验组,由于苗种的SR 过低,无法计算30 d 实验周期内的SGR;盐度为17~40 时,各实验组“参优1 号”苗种的SGR 见图2。从图2 可以看出,盐度在17~40 之间,苗种的SGR 随盐度的增加呈先升高后降低的趋势。盐度为17~20 时,苗种的SGR 为负值;盐度为23~40 时,SGR 为正值;盐度大于26 时,SGR 显著增高(P<0.05);盐度为29~37 时,SGR 保持较高的水平,各组之间的差异不显著(P>0.05),并在盐度为32 时达到最高,为0.9932%/d;盐度在37~40 范围内,SGR 随盐度的上升而降低。依据获得的生长参数并通过数学函数推导,盐度在17~40 范围内,盐度和刺参SGR 的关系可以用以下公式:
SGR= -0.0062S2+0.4046S-5.7849 (R2=0.9602)
根据公式推算,刺参“参优1 号”在盐度为32.6时,SGR 最高。
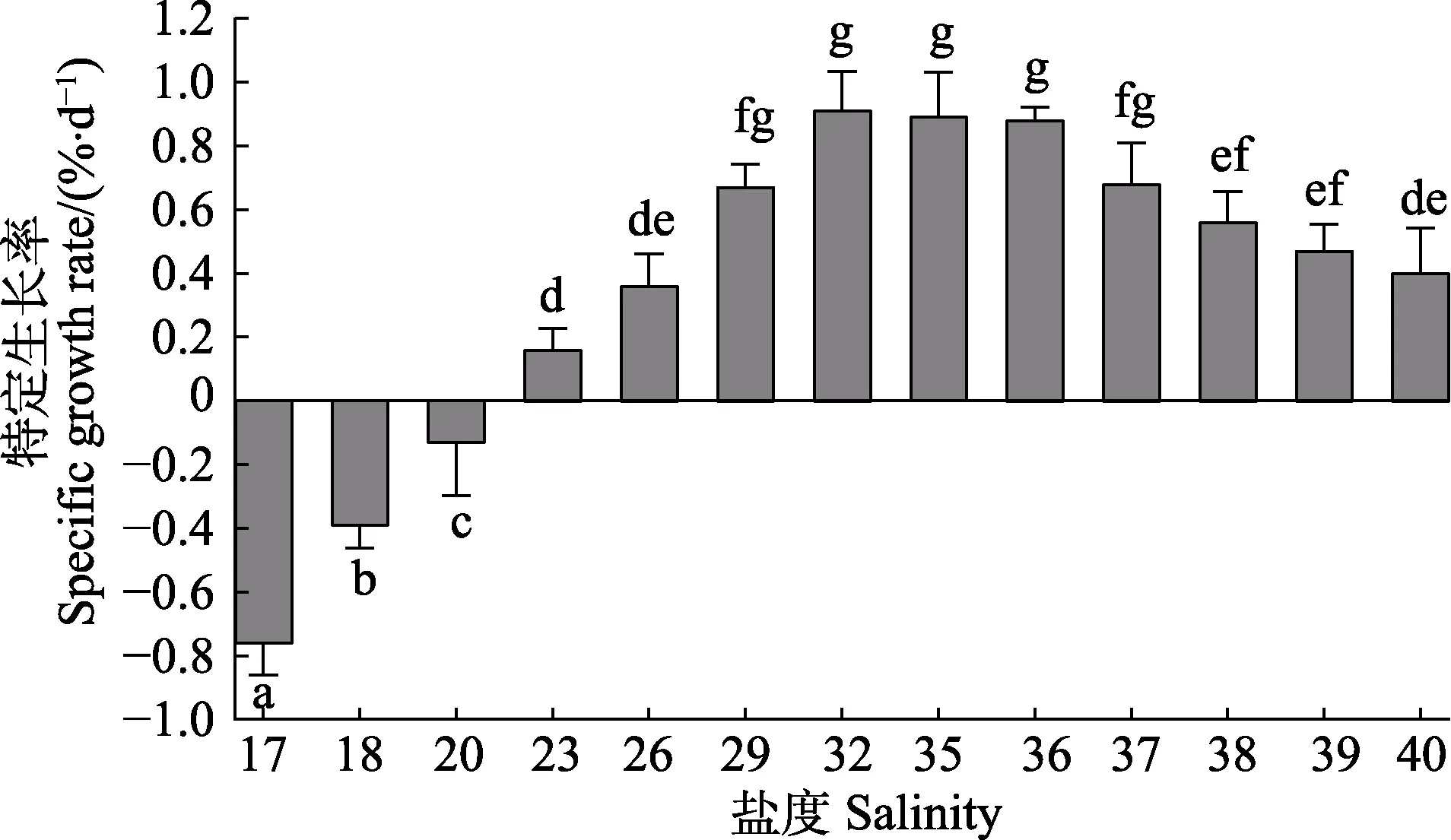
图2 不同盐度条件下刺参“参优1 号”苗种的特定生长率Fig.2 Specific growth rate of sea cucumber“Shenyou No.1” under different salinity
2.3 盐度对刺参“参优1 号”苗种呼吸代谢的影响
不同盐度条件下,刺参“参优1 号”苗种的RO计算结果见图3。从图3 可以看出,在盐度为14~40时,苗种随盐度的升高RO呈“M”型波动。盐度在14~17 范围内RO较低,各组间无显著差异(P>0.05);盐度高于18 时,实验苗种的RO显著增高(P<0.05);盐度为23~29 时,RO处于较高水平,各组之间的差异不显著(P>0.05);盐度为26 时,RO达到第1 个高峰值,为0.0173 mg/(g·h)。盐度为32 时,实验苗种的RO显著降低(P<0.05);当盐度高于35 时,RO逐渐升高,并在盐度为37 时达到第2 个高峰值,为0.0196 mg/(g·h);盐度为38~40 时,“参优1 号”苗种的RO随盐度的升高呈下降趋势。
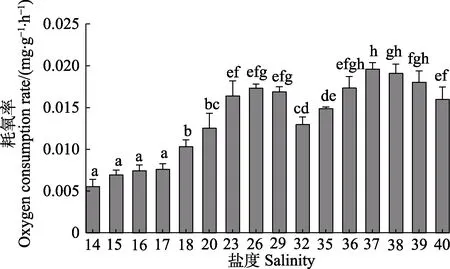
图3 不同盐度条件下刺参“参优1 号”苗种的耗氧率Fig.3 Oxygen consumption rate of sea cucumber“Shenyou No.1” under different salinity
不同盐度条件下,刺参“参优1 号”苗种的RN变化见图4。从图4 可以看出,其变化趋势和RO变化趋势相似,盐度在14~29 范围内,随着盐度的升高,实验苗种的RN逐渐增高;盐度为23~29 时,RN达到较高的水平。其中,盐度为26 时RN较高,为0.00185 mg/(g·h);盐度为32 时,RN显著降低(P<0.05);在盐度为32~37 范围内,RN逐渐升高,并在盐度为37 时达到峰值,为0.00196 mg/(g·h);盐度高于37 时,“参优1 号”的RN随盐度的升高呈下降趋势。

图4 不同盐度条件下刺参“参优1 号”苗种的排氨率Fig.4 Ammonia excretion rate of sea cucumber “Shenyou No.1” under different salinity
不同盐度条件下,刺参苗种O : N 值的计算结果见表1。从表1 可以看出,不同的盐度组O : N 值均在8 左右,随盐度的变化无显著差异(P>0.05)。

表1 盐度对刺参“参优1 号”O : N 的影响Tab.1 Effect of salinity on O : N of sea cucumber “Shenyou No.1”
2.4 盐度对刺参“参优1 号”苗种非特异性免疫酶活性的影响
在盐度为14~16 时,实验结束后,苗种全部死亡,无法进行体腔液的获取。盐度为17 时,实验结束后,剩余苗种数量获得的体腔液不足以进行非特异性免疫酶活性的检测。本研究对盐度为18~40 各实验组苗种的非特异性免疫酶活性进行测定,结果见图5~图8。
由酸性磷酸酶(ACP)的测定结果(图5)可以看出,盐度为18、32、35、36 的实验组,在实验周期内不同时间点刺参“参优1 号”苗种的ACP 活性无显著变化(P>0.05),其余实验组ACP 均呈先升高后降低的趋势,并在第10 天时,ACP 活性达到最高,显著高于其他时间的ACP 活性,其中,盐度为26 的实验组第10 天ACP 活性达到最高。

图5 盐度对刺参“参优1 号”体腔液酸性磷酸酶活性的影响Fig.5 Effect of salinity on ACP activity of coelomic fluid in sea cucumber “Shenyou No.1”
在30 d 实验周期内,各盐度组碱性磷酸酶(AKP)活性的测定结果(图 6)可以看出,在实验盐度范围内,随着盐度的增高,不同盐度组同一时间实验苗种的AKP 活性呈波浪形波动;盐度高于18 时,AKP的活性逐渐增高,并在盐度为23 时达到峰值,然后逐渐降低;在盐度为32 时达到最低值;盐度高于32时,AKP 活性逐渐上升。同一盐度组不同时间点苗种的AKP 活性变化也存在差异,其中,盐度为32和35 时,不同时间点AKP 活性差异不显著,其余盐度组随时间的延长基本呈先升高后降低的趋势,并在第10 天达到较高值。
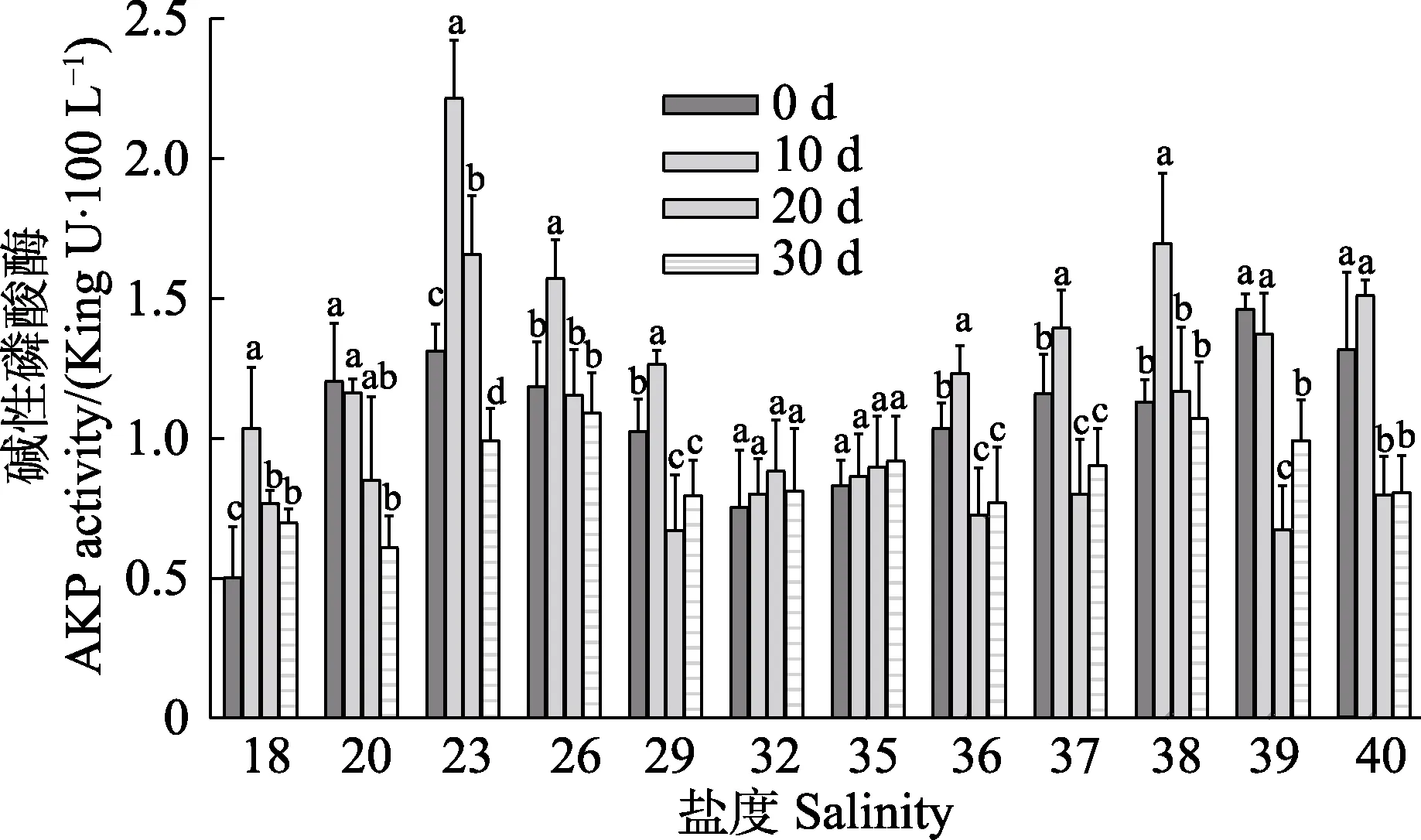
图6 盐度对刺参“参优1 号”体腔液碱性磷酸酶活性的影响Fig.6 Effect of salinity on AKP activity of coelomic fluid in sea cucumber “Shenyou No.1”
不同盐度条件下,刺参“参优1 号”苗种体腔液溶菌酶(LZM)活性变化见图7。从图7 可以看出,在实验盐度范围内,随着盐度的增高,实验苗种不同盐度组在同一时间点的LZM 活性呈先升高后降低再升高的“M”型趋势。其中,在盐度为29、39 时,LZM 活性达到较高值;盐度为32、35 时,LZM 的活性较低。同一盐度组中,盐度为18 时,LZM 活性随着实验时间的延长出现下降趋势,其余各组的LZM 活性呈先升高后降低的趋势,并在第10 天时达到较高值。

图7 盐度对刺参“参优1 号”体腔液溶菌酶活性的影响Fig.7 Effect of salinity on LZM activity of coelomic fluid in sea cucumber “Shenyou No.1”
各盐度条件下,刺参苗种超氧化物歧化酶(SOD)活性变化见图8。从图8 可以看出,在盐度为18~29 时,0 d 各组SOD 活性均处于最高水平,随盐度的增加呈先升高后降低的趋势,并在盐度为18~23 时,各实验组SOD 的活性随时间变化呈逐渐降低的趋势;而盐度为26 和29 的实验组,SOD 的活性呈先降低后升高的趋势;盐度为32 的实验组,SOD 活性随时间变化无显著差异(P>0.05);盐度为36~38 时,SOD 的活性随时间变化呈先降低后升高的趋势,均在第20 天时达到最低,并在第30 天时又显著上升(P<0.05)。
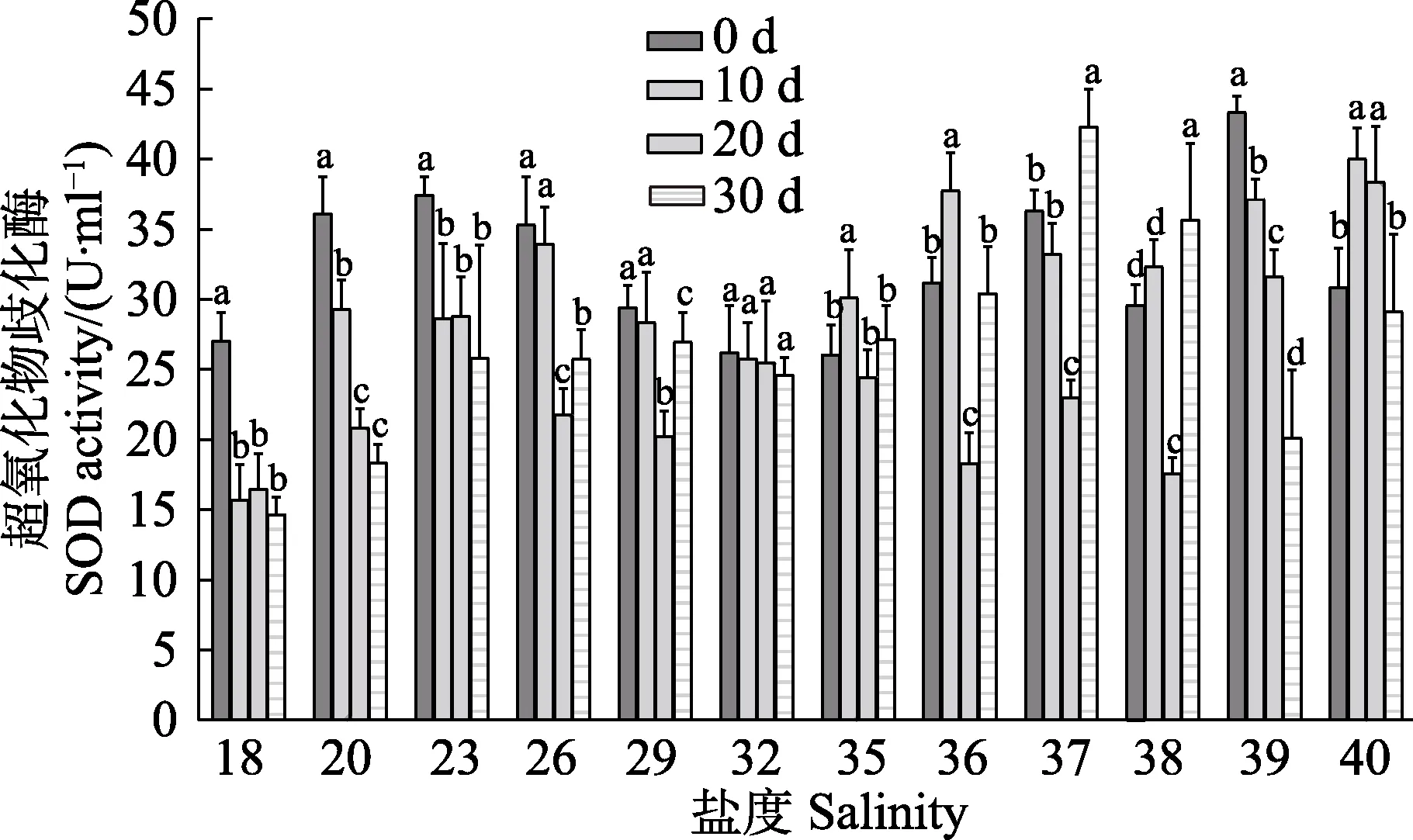
图8 盐度对刺参“参优1 号”体腔液超氧化物歧化酶活性的影响Fig.8 Effect of salinity on SOD activity of coelomic fluid in sea cucumber “Shenyou No.1”
3 讨论
3.1 刺参“参优1 号”苗种在不同盐度条件下的适应性
盐度作为影响海洋生物生理生态学最重要的环境因子之一,与养殖动物的渗透压调节、生长、发育关系密切(Dong et al, 2008; Zhang et al, 2018)。棘皮动物缺乏专门的排泄器官,机体不能进行细胞外渗透压调节,当水体盐度变化时,刺参体内的渗透压也会迅速变化,机体细胞通过调节氨基酸和部分离子的浓度来维持与体腔液渗透压平衡(Talbot et al, 2002)。刺参属于典型的狭盐性海洋生物,盐度的变化对刺参的生长和存活有明显影响(陈勇等, 2007; 郑慧等, 2014; Li et al, 2010; Hu et al, 2010)。对于选育的新品种而言,选育目标性状决定了其在养殖业中的应用潜力,而新品种生态适应性则决定了其推广范围和区域。刺参“参优1 号”是以抗灿烂弧菌(Vibrio sp lendidus)能力和生长速度为选育目标培育出的刺参新品种,为获得最大的良种贡献率,需要对该品种的生态适应范围进行重新评估。
刺参机体对盐度的调节有一个安全阈值,超过这个阈值会影响其生存。本研究结果显示,盐度为18 以下,刺参“参优1 号”的SR 会大幅度降低,这可能就是由于盐度超过了其自身调节范围导致。龚海滨等(2009)和张少华等(2004)通过SR 测算和生理状态观察的方法,确定了急性盐度骤变条件下,刺参的适宜盐度分别为20~35 和18~39,最适生长盐度为25~30。当水体盐度在等渗点附近时,机体用于渗透压调节的能量较少,更有利于刺参的生长和幼体的发育(Asha et al, 2005)。本研究发现,刺参“参优1 号”在盐度约为32 时SGR 最高,这可能是由于盐度为32 是刺参等渗点的附近,用于渗透压调节的能量较少,故生长速度最快。本研究通过盐度缓降后30 d 的养殖结果表明,刺参“参优1 号”的存活盐度为23~40,最适生长盐度为29~37。王吉桥等(2009)研究了60 d 实验周期内,盐度骤变对刺参幼参存活和生长的影响,提出采用存活盐度和抑制生长盐度2 个概念表示刺参的耐盐性,得出盐度为26 是明显的抑制生长的拐点,刺参幼参的存活盐度为26~33,生长适宜盐度为30~33。胡炜等(2012)通过测定逐步降盐(盐度缓降)和盐度突变(盐度骤降)2 种实验模式下,盐度对刺参生存、摄食和生长的影响时发现,影响刺参摄食和生长的关键是低盐胁迫的最终盐度而不是改变盐度方式。本研究所测得的刺参“参优1 号”的盐度耐受和适宜盐度范围与王吉桥等(2009)研究结果基本一致,说明刺参“参优1 号”在选育过程中的盐度耐受适应性未发生显著变化,而本研究所得到的结果范围明显小于龚海滨等(2009)和张少华等(2004)的研究结果。一方面是由于本研究测定周期长(30 d),远高于前2 项研究(分别为168 和48 h)的监测时间,另一方面也是由于本研究除了考虑存活率,同时,将生长率作为判定其最适盐度的指标,导致的结果范围显著偏小。
3.2 刺参“参优1 号”在不同盐度条件下的呼吸代谢特征
盐度的变化会对刺参造成胁迫反应,进而影响刺参的能量代谢,表现为呼吸和排泄的不同。水生动物处于等渗点时RO最低,可能是动物处于等渗点用于渗透压调节的耗能最少。汪洋(2013)对南移刺参在盐度为20~35 条件下的呼吸代谢测定结果表明,随着盐度的升高,刺参的RO和RN均呈先降低再升高的趋势,且均在盐度为30 时达到最低。包杰(2008)研究了在盐度为23~38 条件下,不同规格青刺参和红刺参呼吸代谢的变化发现,在所测试的盐度范围内,刺参的RO和RN变化呈“M”型趋势,并依据这一趋势得出盐度为29~32 是青刺参和红刺参的最适盐度范围;袁秀堂等(2006)对不同规格刺参的盐度呼吸代谢测定表明,盐度为31.5 时,不同规格刺参的RO和RN均最低。本研究结果表明,刺参“参优1 号”的RO和RN也以盐度为32 呈波谷的“M”型趋势,在低于和高于等渗点苗种的RN均升高,这可能是由于盐度胁迫带来的渗透压调节需要较多游离氨基酸分解导致,同时,也说明盐度为32 可能最接近刺参“参优1 号”的体液等渗点。这与前几项的研究结果相一致,具体等渗点数值的差异应该是因为各研究在具体实验方法中设置的盐度差异不同引起的。将RO和氮排泄结合起来计算代谢的O : N 值,可以评估无脊椎动物的能量需求和对营养物质的利用特性并被用作其对环境胁迫指标(Bayne et al, 1978)。本研究结果表明,盐度对刺参“参优1 号”的O : N 值的影响不显著,与袁秀堂等(2006)和薛素燕等(2009)研究结果相一致,而与包杰(2008)对青刺参和红刺参的研究结果表明,不同品系刺参O : N 值随盐度的变化趋势不同,这可能是跟刺参品系差异有关。
3.3 刺参“参优1 号”苗种在不同盐度条件下的非特异性免疫酶活性特征
刺参体腔液细胞是其非特异性免疫系统的承担者,体腔液细胞可产生多种免疫因子及免疫酶(Coteur et al, 2002; Kudriavtsev et al, 2004; 叶海斌等, 2018),因此,可以通过检测体腔液细胞中非特异性免疫酶活性的变化来反应其应对各种胁迫状态下的免疫应答(田青等, 2014; 徐松涛等, 2017; 韩莎等, 2018)。本研究结果表明,盐度变化显著影响了刺参“参优1 号”的非特异性免疫酶指标。对相同盐度30 d 实验期内酶指标的测定结果可以看出,在盐度胁迫下,SOD 活性的峰值一般在0 d 出现,而ACP、AKP 活性的峰值在第10 天出现,LZM 活性的峰值在10~20 d 出现,表明体腔细胞在应对盐度变化的过程中,不同酶指标变化响应时间存在一定差异。相应酶指标对盐度变化在时间上的响应规律与郑慧等(2014)的研究结果一致。但与田青等(2014)检测饥饿胁迫、徐松涛等(2017)检测氨氮胁迫和韩莎等(2018)检测pH 胁迫条件下的响应变化规律存在显著差异,这说明刺参在应对不同胁迫条件下,非特异性免疫酶活性的变化存在很大差异。对不同盐度条件下所检测酶指标活性对比结果可以看出,在盐度为18 条件下,各酶指标的活性都显著低于其他盐度组,表明在苗种受到致死盐度胁迫时,机体已无法正常维持其免疫酶活性的调节能力,这与侯西坦等(2016)的研究结果相一致。而在刺参能存活的23~40 盐度范围内,相应酶指标的变化均表现为在适宜盐度内活性较低,而应对低盐或高盐胁迫时活性显著升高,表明在受到盐度胁迫后刺参会产生一种应激和保护反应,通过提高非特异性免疫酶活性以增强免疫力。
综上所述,在刺参“参优1 号”苗种养殖生产过程中,应保持水体盐度在29~37 范围内,苗种生长速度较快,盐度过高或过低均会引起刺参的应激反应,生理表现为RO和RN升高并引发机体免疫酶活性的变化,对苗种的生长产生不利影响。因此,在良种推广过程中,应根据海域自然盐度条件选择适宜的推广区域,该新品种在刺参池塘养殖过程中要避免暴雨、结冰等天气造成的盐度波动。本研究结果可为良种在不同模式、不同海域的推广提供科学依据。

