水处理周期中微生物群落结构的变化
章 霞,徐志进,李伟业,殷小龙,马雪彬,陈 爽
(浙江省舟山市水产研究所,浙江舟山 316000)
水产养殖总产量和集约化程度日益增加,我国养殖产量已占世界养殖产量的 60% 以上[1-2],随之而来的尾水处理问题已经成为研究的焦点。在目前的工厂化循环水养殖中,生物滤池是重要的水处理环节。而微生物群落结构是影响生物滤池的水处理效果的重要因素[3],这使得研究水处理周期中的微生物群落结构变化具有重要意义。
水处理系统中微生物群落结构与养殖环境因子息息相关。陈琛等[4]研究发现养殖密度会显著影响凡纳滨对虾养殖水体中微生物群落特征。程璐璐等[5]研究发现缓释碳源生态基质的添加可使系统优势菌属生物占比发生变化,假单胞菌(Pseudomonas) 占比增加,脱氮效果得到提高;包鹏等[6]研究发现低溶解氧可以引起较高的生物多样性,而高溶解氧则更利于硝化功能菌(Proteobacteria菌门的Nitrosomonas菌属、Nitrospirae菌门的Nitrospira菌属)的富集。以上研究表明,养殖环境因子不仅会影响养殖对象的生理状态,也会改变养殖环境中微生物群落结构。
碳源的添加方式是反应器运行效果的影响因素之一。Ciggin等[7]研究表明分次添加碳源的方式比连续添加更加能促进微生物的生长。张万友等[8]研究表明分次添加碳源的处理方式在处理序批式反应器(sequencing batch reactor,SBR)中更加有利于提高反硝化效率。张兰河等[9]对碳源投加方式对SBR工艺脱氮速率的影响的研究结果也表明分次添加碳源能够提高有机物质的反应速率和总氮去除率。而碳源添加后在水处理周期对微生物群落多样性结构的影响鲜见报道。该研究拟通过对配置黑石斑循环水人工废水的水处理效果和微生物群落的动态变化进行研究,为今后深入开展微生物菌落调控水处理效果提供科学依据。
1 材料与方法
1.1 试验材料选取聚苯乙烯泡沫滤珠(EPS)作为生物滤料,放置在自行设计的简易的循环水系统,进行生物挂膜水处理。装置上部为40 L的滤料桶(直径25 cm,高81.6 cm),其中装有20 L滤料,下部为直径120 cm、高70 cm的蓄水桶,盛放水体约400 L,通过水泵(流量2 600 L/h)实现下进水、上出水循环,滤料∶水体体积比为1∶20。滤料图和水处理装置图见图1~2。

图1 滤料聚苯乙烯泡沫滤珠数码摄像
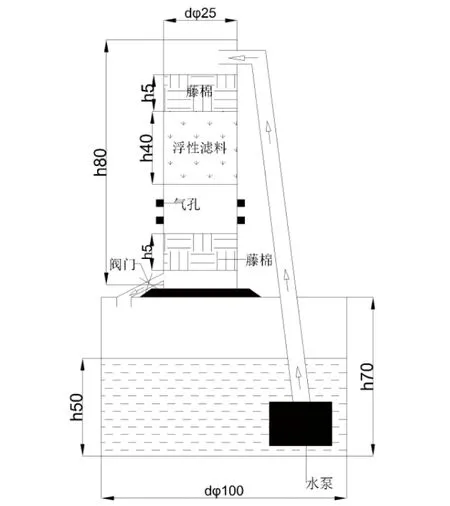
图2 水处理装置(单位:cm)
1.2 试验方法
1.2.1水处理试验。根据前期水处理挂膜试验条件配置黑石斑循环水人工废水400 L[10],使得水体指标初始值氨氮(NH4+-N)约为2.5 mg/L,亚硝酸盐(NO2--N)约为5 mg/L,磷酸盐(PO43--P)约为0.5 mg/L,硝酸盐(NO3--N)约为0.5 mg/L。添加葡萄糖71 g使得水体中总有机碳(TOC)约为80 mg/L(TOC-葡萄糖配制标准曲线y=460.32x-1.922 1,R2=0.999 3),初始碳氮比设置为TOC∶无机氮≈10∶1,设置3个重复开展水处理试验,试验过程中不换水,试验周期为11 d。
1.2.2水质测定。前6 d每天统一时间取样测定水体中氨氮和亚硝酸盐,后4 d,每隔1 d测定水中氨氮和亚硝酸盐。氨氮测定采用GB 17378.4—2007次溴酸盐氧化法,亚硝酸盐测定采用GB 17378.4—2007萘乙二胺分光光度法,采用总有机碳分析仪 TOC-LCPH CN200测定水体中TOC浓度。
1.2.3水体中微生物多样性检测。每隔1 d取滤膜测定微生物多样性。水体微生物取样:每个桶各取水样2 L,经0.22 μm 滤膜过滤,每组混合为1个样本。样本记录为D1、D3、D5、D7、D9、D11。
DNA提取并扩增测序分析:采用DNeasy PowerSoil Kit(50)(MoBio)试剂盒提取DNA,并采用引物进行16S rDNA V4高可变区的PCR扩增,具体扩增方法参照文献[10],扩增产物送至上海欧易生物医学科技有限公司进行测序。
1.3 数据分析水质试验数据采用Excel 2007和SPSS 19.0软件进行数据分析和差异显著性检验(α=0.05)。测序数据由 Illumina miseq 测序获得原始双端测序数据,先需要进行去杂、拼接、嵌合体序列处理,获得较为优质的序列 valid tags,再进行分类 OTU、系统发育树、Alpha和Beta 多样性等分析。
2 结果与分析
2.1 水体中氨氮、亚硝酸盐、TOC的变化由图3可知,在水处理过程中,氨氮出现2个波峰,分别在第1天和第3天,在第2天氨氮的去除率可达63.0%,在第4天后氨氮趋于稳定,最终去除率可达98.0%以上;亚硝酸盐和TOC浓度呈下降趋势,在第1天时下降速率最快,到第4天有轻微的增长,后续下降后趋于稳定,在第2天亚硝酸盐去除率可达81.2%,TOC去除率为73.4%,最终去除率分别可达99.0%和95.0%以上。

图3 水体中氨氮、亚硝酸盐、TOC浓度变化
2.2 不同时间水体中细菌丰度及多样性的变化从表1可以看出,在循环水处理周期中,微生物原始序列呈增长再平缓最后下降的趋势,有效序列在第3天(D3)显著高于其他各组;操作分类单元数量在第3天最少,为128,第5天(D5)之后为730以上,显著高于第3天;通过比较3个样品细菌丰富度情况,从Chao指数可以看出微生物丰富度在第9天(D9)最高,从Shannon指数、Simpson指数发现群落多样性在第5天最高,最低的为第3天。

表1 不同时间水处理系统中细菌丰度情况
2.3 不同时间水体微生物Alpha多样性指数分析和物种间相似性的变化从Rank Abundance曲线可以看出样品所含物种的丰富程度和均匀程度。曲线在横轴上的长度越宽表示物种组成越丰富,而在纵轴上跨度越小、曲线越平坦表示物种组成均匀程度越高。图4表明,D3的微生物物种组成相较于其他各组最为丰富,最为均匀,其次是D1、D9。根据OTU注释结果,绘制6个样本的微生物物种间相似性的聚类图包括样本间聚类关系树(图5),可以看出自第5天之后,水体中物种相似性越来越高。

图4 不同时间运行系统中细菌的丰富程度比较

图5 不同时间循环水中微生物DNA样本的相似性聚类
2.4 不同时间水体微生物在门、属分类层面的变化
2.4.1在门分类层面的变化。从表2可以看出,整个周期中,随着水处理时间的延长,各个时间段的优势细菌在门分类上变化不大,变形菌门在水体中占主要优势,拟杆菌门、厚壁菌门、放线菌门不同时间点有所差异。第1天(D1)细菌丰富度排列前5的门类为变形菌门、放线菌门、拟杆菌门、酸杆菌门、芽单胞菌门;第3天(D3)细菌丰富度排列前5的门类为变形菌门、拟杆菌门、厚壁菌门、放线菌门、TM6;第5天(D5)细菌丰富度排列前5的门类为变形菌门、拟杆菌门、放线菌门、TM6、蓝藻菌门;第7天(D7)细菌丰富度排列前5的门类为变形菌门、拟杆菌门、放线菌门、TM6、Gracilibacteria;第9天(D9)细菌丰富度排列前5的门类为变形菌门、厚壁菌门、拟杆菌门、放线菌门、TM6;第11天(D11)细菌丰富度排列前5的门类为变形菌门、厚壁菌门、拟杆菌门、放线菌门、Gracilibacteria。在水处理周期内,微生物群落组成占比呈现一定的变化趋势。水体中的变形菌门在前3 d占比达95.00%以上,第5天之后从77.79%逐渐下降至63.67%;拟杆菌门在第5天时急剧增长,并在后续时间段波动维持;厚壁菌门在第7天后呈现增长态势,第9天约为第7天的32倍。放线菌门先下降后上升再下降,在第3天占比最低,第7天最高;TM6呈先升高后降低的趋势,在第5天最高。
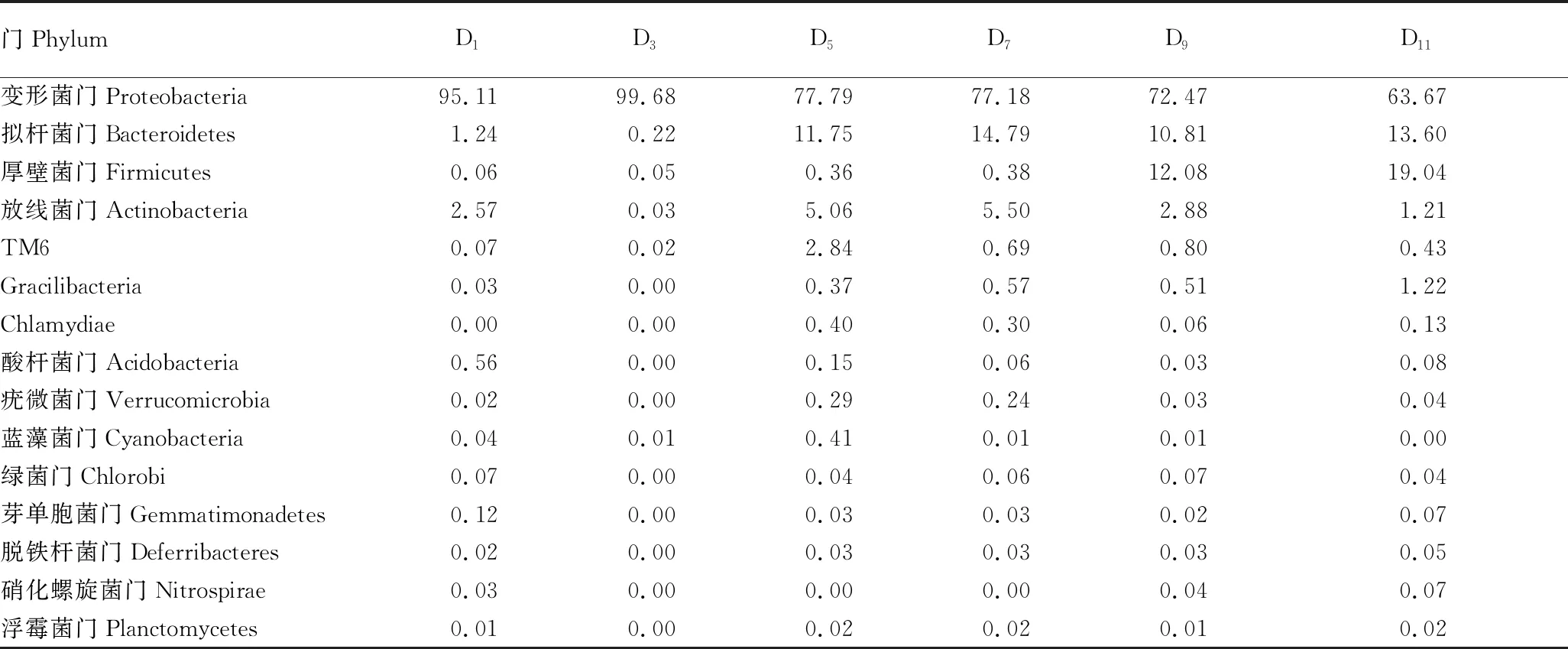
表2 不同时间水处理中细菌(门)的群落组成相对百分比
2.4.2在属分类层面的变化。从表3可以看出,水体中细菌丰富度属类差异较大。第1天(D1),细菌丰富度排列前5的属类依次为远洋杆菌属、发光杆菌属、弧菌属、Candidatus_Aquiluna、Owenweeksia;第3天(D3),细菌丰富度排列前5的属类依次为弧菌属、远洋杆菌属、蛭弧菌属、Fabibacter、发光杆菌属;第5天(D5),细菌丰富度排列前5的属类依次为远洋杆菌属、蛭弧菌属、弧菌属、Fabibacter、Candidatus_Aquiluna;第7天(D7),细菌丰富度排列前5的属类依次为远洋杆菌属、弗朗西斯氏菌属、弧菌属、Candidatus_Aquiluna、蛭弧菌属;第9天(D9),细菌丰富度排列前5的属类依次为远洋杆菌属、弗朗西斯氏菌属、拟杆菌属、粪杆菌属、Owenweeksia;第11天(D11),细菌丰富度排列前5的属类依次为远洋杆菌属、拟杆菌属、粪杆菌属、Owenweeksia、弗朗西斯氏菌属。在水处理周期内,微生物群落组成占比呈现一定的变化趋势。远洋杆菌素在第1天时占比最高,为69.76%,第3天迅速下降,第5天后逐渐升高,到第11天占比为40.83%,低于第1天;弧菌属在第1天占比为2.97%,第3天迅速增至98.07%,第5天下降至8.38%,到第11天占比仅为0.47%;蛭弧菌属在前3 d 呈现低占比,为0.08%~0.16%,第5天呈现一个峰值,占比为18.53%,第7天后逐渐下降;弗朗西斯氏菌属前9 d呈现增长态势,第11天下降;拟杆菌属在第9天有所增长,第11天占比达6.87%。

表3 不同时间水处理中细菌(属)的群落组成相对百分比
3 讨论与结论
变形菌门(Proteobacteria) 通常是水环境中主要的原核生物,包含了光营养型、化能自养型和化能异养型细菌,这类细菌在水环境中普遍存在,相关报道指出在湿地、养殖废水和深海沉积物等环境中以第一优势门存在[11-12]。从该试验结果来看,在整个水处理过程中,变形菌门都保持第一优势菌门的存在(占比63.67%~99.68%);而在11 d的水处理中,水体中的拟杆菌门和厚壁菌门呈快速增长,变形菌门占比逐渐下降,由变形菌门、厚壁菌门和拟杆菌门构成了水体中的优势菌,有研究表明厚壁菌门和拟杆菌门存在一种相互促进的共生关系,且能降解水体中的蛋白质、糖类等物质[13-14]。推测是水体中的糖类促进了厚壁菌门和拟杆菌门的生长,而氮元素比例的减少,是变形菌门相对丰度下降的主要原因[15]。此外水体中蓝藻菌门在第5天占比达到峰值,之后则占比逐渐下降,推测蓝藻菌门与水体中的氮元素有密切关系,前期可能是因为水体中丰富的氮磷营养盐为蓝细菌的生长繁殖提供了便利[16],后期是因为水体中碳源、氮源的消耗而造成其相对丰度下降。
众所周知,弧菌病是海水养殖中最常见、流行广、危害大的一类疾病[17]。例如,哈维氏弧菌(Vibrioharveyi)可以感染海洋脊椎动物和无脊椎动物,引发鱼虾感染发病,造成大量死亡[18]。而在此次试验中,在水处理的第3天,水体中弧菌属暴发性的增长,细菌(属)的群落组成相对百分比为98.07%,此时水体中氨氮也达到了第二次峰值,推测水体中弧菌属细菌的生长与氨氮浓度之间具有密切相关关系;在第5天和第7天,所占百分比分别为8.38%和2.35%,第9天和第11天分别为0.63%和0.47%。蛭弧菌属在第5天群落占比最高,在7 d后逐渐下降。蛭弧菌是一种短时间内侵染和裂解弧菌、气单胞菌等革兰氏阴性致病菌的小型寄生性细菌,同时可有效控制水体中氨氮、亚硝酸盐、硫化物等有害物质的含量,达到改良水质的目的[19-20]。
综上所述,由EPS泡沫滤珠作为生物滤料构建的水处理系统具有较好的废水处理能力,氨氮、亚硝酸盐、TOC的最终去除率分别可达98.0%、99.0%和95.0%以上。系统处理第5天后,水质情况趋于稳定。而在该试验条件运行中,发现水体中的微生物丰富度在第9天最高,群落多样性在第5天最高,整个周期中优势细菌在门分类上变化不大,变形菌门在水体中占主要优势,推测其在水处理过程中发挥重要作用。

