饥饿与重摄食对河蟹肠道菌群结构的影响
王晨赫 周彦锋 方弟安 张希昭 张 丽 刘剑羽 郑 泽 尤 洋,
(1. 南京农业大学无锡渔业学院, 无锡 214081; 2. 中国水产科学研究院淡水渔业研究中心, 农业部淡水渔业和种质资源利用重点实验室, 无锡 214081; 3. 青海省海西州可鲁克湖养殖场, 青海 817000)
肠道微生物作为宿主的“重要器官”, 具有庞大的数量特征, 在长期进化的过程中, 宿主和肠道微生物相互影响, 肠道微生物在肠道内形成了复杂的微生态系统[1], 同时在维持宿主的生理活动、帮助宿主营养吸收以及协助宿主的免疫调节具有重要作用[2]。在水产动物中, 影响肠道菌群结构的组成有4个方面, 包括宿主因素、环境因素、微生物相互作用因素以及个体之间的差异[3], 已有的研究在针对水生生物的不同遗传背景[4,5]、不同食性[6,7]、不同生理状态[6,8]、不同生存环境[9—11]及不同的饲料都做了深入的研究, 并且确定了部分水生动物肠道微生物的确切组成, 为后续开展研究不同生理状态肠道菌群结构异同提供了基础数据支撑。
河蟹, 又称中华绒螯蟹(Eriocheir sinensis), 作为中国特种经济水产动物, 在水产养殖业占据着重要地位。随着20世纪90年代人工育苗难关的突破,极大地推动了河蟹养殖业的发展。随着人工集约化程度的不断提高, 养殖密度不断加大, 在养殖池塘中存在着极大的种内竞争, 不仅影响了河蟹的自身健康发展, 同时也严重制约了养殖效益的提高。而肠道微生物对于宿主是极其重要的, 处于正常生理状态下的宿主拥有复杂且相对稳定的微生态系统[12]。在河蟹养殖过程中, 由于投喂饲料的方式以及数量与河蟹的生长情况不相符, 造成河蟹出现上岸寻食以及自相残食的状况, 严重制约了河蟹的生长发育, 同时河蟹对于重摄食后肠道菌群的变化也缺乏对应的研究。而现有对于河蟹饥饿的研究还较为匮乏。因此研究河蟹在饥饿条件下以及重摄食后肠道菌群结构的变化对于帮助后续探索不同微生物在河蟹生理代谢的作用具有重要的参考价值。
关于河蟹肠道微生物还都集中在基础研究的探索。Li等[13]通过qPCR方法得出河蟹肠道菌群数量在每克肠道108个左右, 狄盼盼等[13]和Chen等[14]分别通过分离培养和高通量测序分析得到河蟹肠道优势菌门分别为软壁菌门(Tenericutes)、拟杆菌门(Bacteroidtes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)。后续较为深入的研究包含了针对白班病毒(WSSV)与正常河蟹肠道微生物的异同[15,16]、河蟹肠道微生物、鳃微生物与水体微生物共有菌群探究[17]以及“蟹稻共生”两种模式下河蟹肠道微生物的异同[18]。但针对正常、饥饿以及重摄食这3种状态下肠道菌群结构的异同比较却未见研究。
本文通过研究3种状态下河蟹肠道微生物, 对比3种状态下肠道微生物群落多样性、群落结构以及3种状态下的差异菌群, 旨在了解饥饿以及重摄食对于河蟹肠道菌群结构的影响, 为后续进一步确定肠道微生物功能以及在河蟹生理功能中的作用提供数据支撑。
1 材料与方法
1.1 实验设计和材料采集
实验所用河蟹于2017年7月采集于阳澄湖池塘(N120°79′, E 31°51′), 雄蟹初始体重为(72.19±5.68) g,雌蟹的初始体重为(61.92±6.46) g, 采样回来的螃蟹随机分成3组, 饲养于中国水产科学研究院淡水渔业研究中心的南区的3个水族箱1周, 并配合天邦人工饲料(蛋白质水平32%, 粗脂肪水平4%)进行投喂,随后设计饥饿实验天数分别为7d和14d, 重摄食实验天数分别为7d和14d[19—21]。对照组、饥饿7d、饥饿14d与重摄食7d每组3个重复, 重摄食14d设置2个重复。待每组实验结束24h后, 从水族箱中随机抽取规格无显著差异的个体, 先用无菌水彻底清洗表面, 随后使用75%无水乙醇擦拭表面身体, 随后在无菌台中取出肠道, 封存于无菌1.5 mL Ep管中,-80℃保存以备后续实验使用。具体分组编号与信息见表 1。
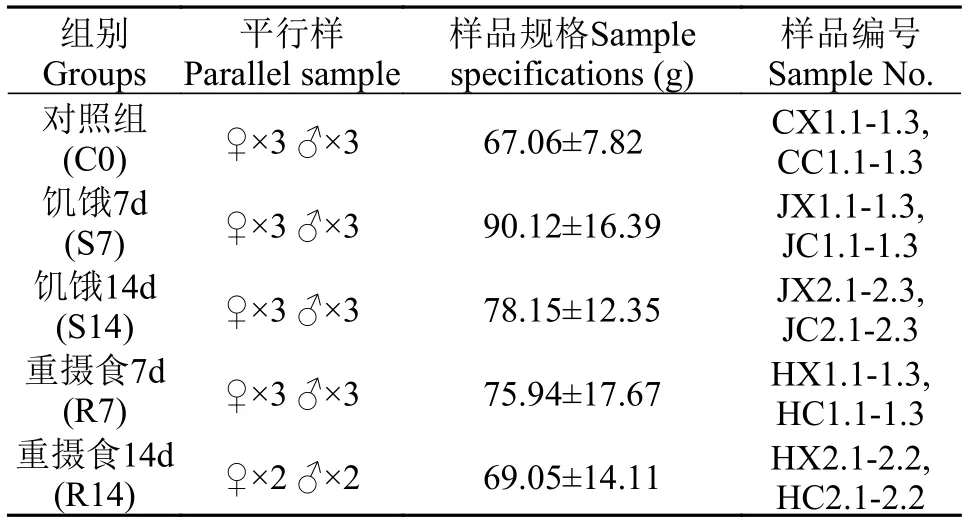
表 1 样品分组信息表Tab. 1 Sample grouping information
1.2 肠道总DNA提取、PCR扩增以及16s rRNA测序
所有肠道样品采用动物组织DNA快速提取试剂盒提取(OMEGA Bio-Tek, Norcross, GA, USA),采用Qubit 4 Fluorometer荧光定量仪进行DNA浓度检测, 选取未降解, 浓度较高的样品进行后续琼脂糖检测完整度, 采用1.5%琼脂糖胶凝胶电泳检测DNA的完整度, 电压为150 V, 时间为25min, 选取呈扫帚状、合格的样品用于PCR扩增。采用细菌16S rRNA基因V4区通用引物515F(5′-GTGCCAGC MGCCGCGGTAA-3′)和 806R (5′-GGACTACHV GGGTWTCTAAT-3′)[22—25], 反应条件为94℃预变性5min, 然后为30个循环, 每个循环为94℃变性30s,54℃退火30s, 72℃延伸30s, 循环结束后进行72℃持续10min结束反应。产物从1.5%琼脂糖凝胶中切下并通过AxyPrep DNA凝胶提取试剂盒(AXYGEN Inc., Union City, CA USA)纯化。将纯化的产物进行Illumina Hiseq2500的高通量测序(BGI,Shenzhen, China)。
1.3 高通量数据生物学信息分析
测序采用双端测序法, 原始数据下机后, 经内部程序删除其含有超过2个与引物错配reads; 去除某一碱基连续超过10 bp的reads; 去除含N的reads;如果窗口平均质量值小于20, 则读取序列的末端从窗口截断, 并且移除具有最终读取长度小于原始读取长度的75%的reads[26], 从而获得clean data。使用序列拼接软件FLASH[27], 将双端测序的reads利用重叠关系拼接成一个Tags, 设置最小匹配长度为15 bp,同时允许重叠区域的错配率为0.1。利用软件USEARCH将OTU在相似度97%水平下进行聚类[28],获得OTU代表序列, 通过RDP classifer(v2.2)软件将OTU代表序列与数据库(Sliva V119)进行比对与物种注释, 置信度阈值设置为0.6[29]。使用Mothur(v1.31.2)计算每个样本的Alpha多样性指数[30]。使用mothur中metastats分析不同组别差异菌群, 并通过Originlab2017进行箱型图的绘制。
2 结果
2.1 不同状态下肠道微生物多样性分析
实验从28个样品中一共获得了2416616条高质量reads, 拼接获得2783个OUT。16S rRNA的原始序列上传至GeneBank, 登录号为PRJNA477595。稀释曲线显示了样品的中所测得的OTU数量随着样品序列的增多而变化的情况, 从图 1可以看出, 随着序列的增加, OTU数量已趋于一个稳定值。而从样品测序覆盖程度上看, 28个样品中覆盖值均大于99%, 表明样品中细菌基本上被确定(图 2)。
Alpha多样性(Alpha diversity)指数包含了Observed species指数、Ace指数、Chao指数、Shannon指数以及Simpson指数等。前面4个指数越大,最后一个指数越小, 说明样品中的物种越丰富。各分组的Alpha多样性指数见图 3。其中雄蟹饥饿7d与对照组、饥饿14d、重摄食7d以及14d在Ob-served species指数与Chao指数具有显著差异(P<0.05), 而在饥饿7d与重摄食14d在Ace指数具有显著差异(P<0.05), 与其他组别无显著差异(P>0.05)。总体看来, 雌雄个体在饥饿7d肠道微生物群落显示多样性指数最高, 而后随着饥饿时间的增加以及重摄食后, 肠道微生物多样性指数呈现下降趋势; 值得注意的是, 雌雄蟹在重摄食7d时, 雄蟹肠道微生物多样性显示短暂的上升, 但雌蟹肠道微生物多样性依然呈现下降趋势。且在肠道微生物群落均匀度指数上, 雌蟹在重摄食7d时肠道微生物均匀度指数依然呈现增加趋势, 菌群群落更加单一, 而在雄蟹中, 重摄食7d, 均匀度指数呈现短暂的下降趋势, 菌群群落更加多样。结果表明, 短暂的饥饿会致使河蟹肠道微生物多样性的增加, 但在持续的饥饿下,肠道微生物多样性呈现下降趋势, 但在重摄食后,雌雄蟹出现差异, 雄蟹较雌蟹表现出更强的适应能力。
2.2 不同状态下肠道微生物菌群组成分析
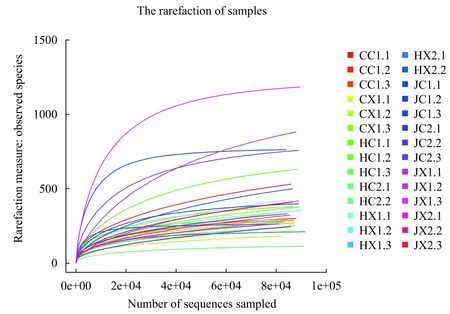
图 1 样品稀释曲线Fig. 1 Rarefaction analysis of the sample

图 2 测序深度覆盖曲线图Fig. 2 Sequencing depth coverage curve
从28个样品测得的序列利用软件USEARCH将OTU在相似度97%水平下进行聚类, 获得OTU代表序列, 通过与数据库(Sliva V119)进行比对与物种注释, 共将所有菌群分为25个菌门(图 4)。其中在5个组别中, 有4个优势菌门, 分别为变形菌门(Proteobacteria)、软壁菌门(Tenericutes)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes), 这4个菌门的相对丰度在总菌门的总占比为97.21%—98.85%。分析比较饥饿以及重摄食对菌门所占比例, 发现在雌蟹个体中, 变形菌门在对照组、饥饿7d、饥饿14d、重摄食7d以及重摄食14d所占据的比例分别为42.09%、43.25%、57.74%、14.58%和30.33%,而软壁菌门在5个组别中所占据的比例分别为36.9%、33.2%、12.55%、66.88%和54.01%。在雄蟹的个体中, 变形菌门在5个组别中所占的比例分别为43.55%、13.56%、25.79%、33.49%和47.94%,软壁菌门所占据的比例为26.01%、53.49%、51.22%、20.95%和36.7%。总体来看, 饥饿会致使雌蟹肠道微生物中的变形菌门所占比例升高, 而软壁菌门占比会呈现下降趋势, 重摄食后, 变形菌门会恢复至对照组水平, 软壁菌门却会出现大幅度上升并在肠道微生物中保持较高的占比。但是饥饿会致使雄蟹肠道微生物的变形菌门所占比例下降, 而软壁菌门占比出现上升趋势, 在重摄食后, 变形菌门恢复至对照组水平, 但软壁菌门同样会出现较大幅度上升趋势。值得一提的是, 不管是雌蟹还是雄蟹, 拟杆菌门在饥饿发生后较对照组占比会有所上升, 但在重摄食后, 会恢复至对照组水平。蟹肠道微生物的变形菌门所占比例下降, 而软壁菌门占比出现上升趋势, 在重摄食后, 变形菌门恢复至对照组水平, 但软壁菌门同样会出现较大幅度上升趋势。值得一提的是, 不管是雌蟹还是雄蟹, 拟杆菌门在饥饿发生后较对照组占比会有所上升, 但在重摄食后, 会恢复至对照组水平。

图 3 基于Alpha指数分析比较样品中细菌群落多样性Fig. 3 Comparison and analysis of bacterial communities in samples based on Alpha index

图 4 样品中在门水平中菌群丰度组成与变化趋势Fig. 4 Composition and trends of bacteria in the sample of Phylum-level
2.3 不同状态下肠道微生物差异菌群比较
将28个样品分为5组, 应用Metastats差异分析进行组间比较, 共得到了8个具有在丰度上显著差异菌群, 其中科水平有差异的菌群有2个, 属水平有差异的菌群为6个。其中8个菌群有5个属于变形菌门, 2个属于拟杆菌门, 1个属于软壁菌门, 且在对比这8个菌群在不同状态下我们发现(表 2和图 5), 变形菌门中希瓦氏菌属(Shewanella)、Defluviicoccus菌属以及气单细胞菌属(Aeromonas)随着饥饿时间的增加, 丰度呈现增加趋势, 但在重摄食后, 丰度均有所下降, 拟杆菌门中的子单胞菌科(Porphyromonadaceae)趋势也与之相似; 但在拟杆菌门中,拟杆菌属(Bacteroides)却是随着饥饿时间的增加,丰度有所上升, 在重摄食7d后, 菌群丰度达到最大值, 在重摄食14d后, 菌群丰度恢复至正常水平; 软壁菌门虽然只有一个Candidatus Bacilloplasma菌属在组别中具有显著差异(P<0.05), 但在肠道菌群所占据的比例中, 却是在这8个菌群中占据比例最高的, 在肠道菌群中占据着重要的地位。其丰度随着饥饿时间的增加, 丰度有所下降, 在重摄食7d后, 会有所上升, 在重摄食14d后, 丰度下降且低于对照组丰度。红环菌科(Rhodobacteraceae)在饥饿肠道中丰度呈现缓慢上升的趋势, 但在重摄食14d后, 菌群丰度下降至对照组水平; 而不动菌属(Acinetobacter)饥饿组以及重摄食组丰度均低于对照组丰度,且对照组与除饥饿14d的其他三组均具有显著差异(P<0.05)。
3 讨论
3.1 不同状态下河蟹肠道菌群多样性分析
饥饿, 作为一种非正常生理状态, 不仅是动物本身, 肠道其作为营养吸收与维持生理的重要场所,也面临着巨大的挑战[31]。在本研究中, 河蟹在饥饿胁迫7d和14d后, 雌雄蟹肠道菌群多样性均呈现下降趋势。有研究表明, 在面对饥饿时, 机体与肠道微生物同时面对能源危机, 机体会倾向于缩小肠道“尺寸”[32—34]。而与此同时, 肠道微生物面对“空间危机”会相应的发生菌群多样性和相对丰度的改变。例如斑马鱼[35]等在饥饿胁迫下, 肠道微生物多样性呈现下降趋势, 这与本研究中河蟹在饥饿胁迫下肠道微生物多样性呈现下降趋势结果一致。
肠道微生物的群落多样性与宿主的健康有着密切的关系[36—38]。有研究表明, 人类肠道梭菌属引起的相关腹泻、肥胖均与肠道微生物群落多样性有关, 且在增加肠道微生物多样性会提高人体的健康程度[39,40]。而在水生动物中, 鱼类的红鳃病会致使肠道微生物多样性低于健康的个体[41]。Hou等[42]在研究患白便综合征的虾相较于健康虾来说肠道微生物多样性较低。在本研究中, 饥饿作为一种非正常、不健康的生理状态, 通过饥饿以及重摄食对于河蟹肠道微生物多样性的影响。结果表明, 在饥饿第7天, 雌雄个体肠道微生物多样性会出现短暂的上升, 但在饥饿14d、重摄食7d与14d后, 雌雄个体肠道微生物均呈现下降趋势。这与tran等[43]在对草鱼(Ctenopharyngodon idellus)进行饥饿实验中肠道微生物多样性变化趋势相似。
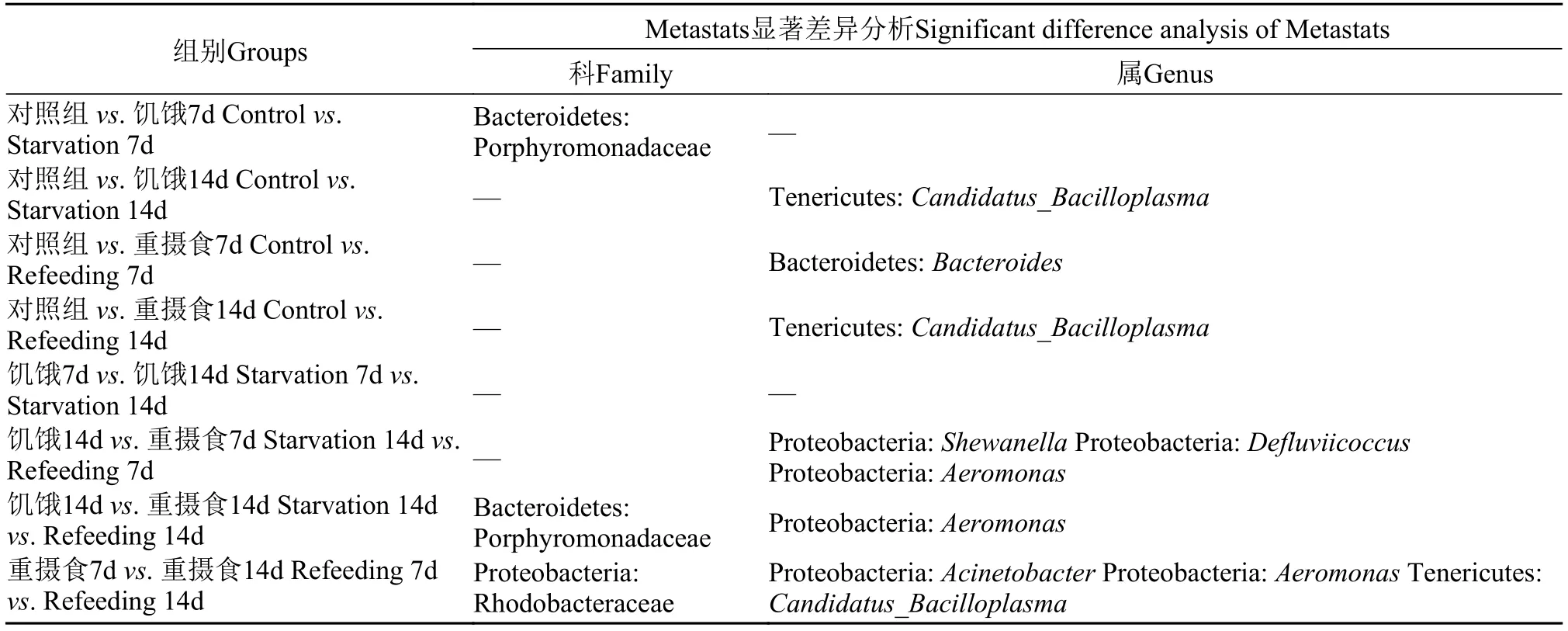
表 2 不同状态具有显著差异菌群汇总Tab. 2 Significant different bacteria groups under different states
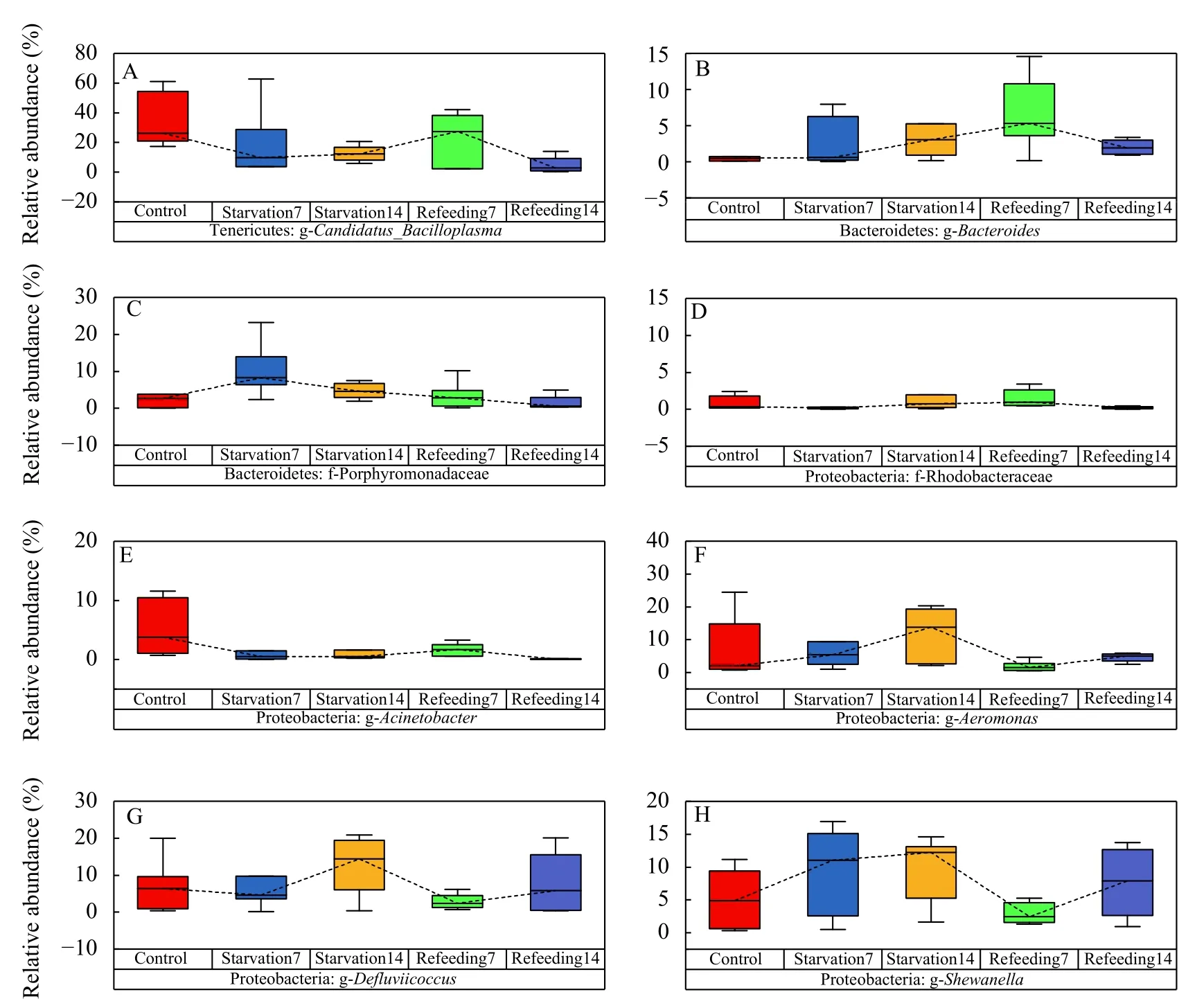
图 5 不同状态下具有显著差异菌群(P<0.05)相对丰度比较Fig. 5 The of relative abundances of significantly different flora in different states (P<0.05)
3.2 不同状态下菌群组成差异分析
肠道微生物作为肠道的“内稳态”, 在维持宿主生理免疫、营养吸收等方面具有重要作用[2]。每个宿主体内都有一些稳定且长期存在的群落结构, 我们通常称之为“优势菌群”, 在Chen等[14]和Zhang等[17]研究中, 河蟹肠道微生物的优势菌门为软壁菌门、变形菌门、拟杆菌门以及厚壁菌门, 而其中软壁菌门占比最好, 变形菌门次之。而在本研究中, 对照组中河蟹肠道微生物占比最高为软壁菌门, 变形菌门次之, 而随着饥饿时间的增加, 河蟹肠道微生物中软壁菌门占比逐渐降低, 而变形菌门占比逐渐升高, 并在优势菌门中占比最高; 这一结果与草鱼[43]、尼罗罗非鱼[44]以及斑马鱼[35]等水生动物在饥饿状态下肠道菌门变化趋势一致。但在重摄食后, 河蟹肠道微生物中软壁菌门占比迅速增加, 在优势菌门中占比最高, 变形菌门占比迅速降低, 恢复至正常水平。有研究表明, 变形菌门在能力不平衡以及不稳定肠道菌群中占比较高[45—47], 这与本研究结果一致。但在另外2个优势菌门, 拟杆菌门与厚壁菌门随着饥饿的胁迫, 菌门占比不断上升, 在重摄食后,菌门占比呈现下降趋势, 这与Tran等[43]在草鱼的饥饿研究以及Zhang等[48]在人类的研究结果不符, 但在菌门占比上, 需要结合绝对定量进行确认和探索。在菌群功能上, Zhang等[48]发现拟杆菌门以及厚壁菌门是未消化食物残余物代谢的主要细菌, 但在本研究中, 在饥饿的胁迫下, 厚壁菌门和拟杆菌门, 特别是拟杆菌门的占比不断升高, 且在重摄食后, 菌门占比恢复至对照组水平, 这一结果表明在河蟹肠道微生物菌群中, 厚壁菌门以及拟杆菌门的生理功能有待进一步探索。
在对比不同状态的菌群进行差异分析, 我们统计了8个具有显著差异的菌群, 隶属于3个菌门。而在这8个菌群中, 只有1个Candidatus bacilloplasma菌属隶属于软壁菌门, 且具有较大丰度, 而Candidatus bacilloplasma菌属广泛存在于海洋动物中,如虾[49,50]、河蟹[14]、龙虾[51]以及比目鱼[52]等动物中。且前人的研究表明[53], 该菌属附着于甲壳类胃肠道并与之共生的, 这一结论同样在Chen等[14]对于河蟹“土著”菌群研究中得到证实。因此Candidatus bacilloplasma菌属在河蟹肠道微生物菌群中占据着重要地位[14,53], 但该菌属的功能还未清楚。进一步探索其功能, 为揭示其丰度变化对于河蟹肠道微生物以及宿主生理功能影响机制具有重要意义。
本研究结果表明, 河蟹肠道微生物在饥饿胁迫以及在重摄食后, 菌群的多样性以及群落结构等方面会产生相应的变化, 同时, 筛选了8个在组别中具有显著差异的菌群(P<0.05)。本研究首次研究了饥饿以及重摄食对于河蟹肠道菌群结构的影响, 为河蟹饥饿以及重摄食的研究提供了较为全面的基础数据, 同时为进一步探究菌群的特定功能奠定了基础。

