母代环境升温对菹草石芽形态、碳氮元素含量及子代萌发过程的影响
王 韬 张雨婷 李 超 胡博文 徐 军 张 敏
(1. 华中农业大学水产学院, 淡水水产健康养殖湖北省协同创新中心, 池塘健康养殖湖北省工程实验室, 武汉 430070;2. 中国科学院水生生物研究所, 武汉 430072)
联合国政府间气候变化专门委员会(IPCC)第五次评估报告指出: 全球气温仍呈上升趋势, 在RCP8.5高排放情景下, 到21世纪末全球平均气温相对于工业化前可能升高4℃[1]。在全球继续变暖的趋势下, 热浪等极端天气事件被预测会以更高的强度出现[1]。气候变暖将会引起某些环境因子变化,进而影响生态系统的结构和功能。与陆地生态系统相比, 水域生态系统对气候变暖的响应更加敏感[2]。
植物亲本所经历的环境条件的影响可以传递给子代。这种母代环境的影响可以帮助植物子代在面临相同的环境变化时能够更好的适应[3], 从而为进化争取到足够的缓冲时间。温度、水分、光照及营养等母代环境因子的变化都有可能影响到植物的后代[3—7]。已有研究发现, 植物亲本所处的环境条件的变化可能会对其繁殖体的数量、质量、特定元素含量及萌发情况产生影响[5,7—9]。黑肉叶刺茎藜(Sarcobatus vermiculatus)亲本在营养充足(施肥处理)的条件下, 其产生的种子数量、质量、氮元素含量及萌发率均有显著增加[7]; 飞廉(Carduus nutans)亲本在升温环境下产生的种子萌发所用的时间缩短, 但种子质量及最终萌发率不变[4]。母代环境不仅影响植物繁殖体的形成及萌发, 还会对子代幼苗的生长发育状况产生影响。Lundgren等[6]在对水蓼(Polygonum hydropiper)的模拟遮光实验中, 发现遮光亲本产生的子代在早期有着更能适应低光环境的性状, 其产生叶片的时间要显著早于对照组, 且生长的速度更快。目前, 关于母代环境对植物后代影响的相关研究主要集中在陆生植物方面, 关于水生植物的研究较少。在水生植物方面,有研究发现, 种子质量及母代环境因子能够影响篦齿眼子菜(Potamogeton pectinatus)种子的萌发时间及总萌发率[10]。
菹草(Potamogeton crispus)作为一种世界广布种, 对维持冬春季湖泊生态平衡具有重要意义。温度在菹草石芽的形成及萌发过程中起到十分重要的作用[11,12]。因此, 探讨不同母代环境菹草产生石芽的早期萌发特征, 有助于揭示在全球变暖及极端温度波动增多的趋势下菹草群落结构变化的响应机制。本实验通过模拟不同的升温模式, 探讨升温对菹草石芽形态和化学计量学特征的影响, 并进一步探讨了母代环境温度对菹草石芽早期萌发策略的影响, 为研究气候变暖趋势下菹草石芽的变化特征及预测菹草群落的动态变化提供参考依据。
1 材料与方法
1.1 实验地点
实验模拟系统位于湖北省武汉市华中农业大学(30°29′N, 114°22′E), 该地处于亚热带季风气候区, 月平均温度变化范围为3—29.3℃。1906—2015年, 武汉市年平均气温为17.3℃, 最低年均温为15.8℃(1969年), 最高年均温为19.11℃(2007年), 呈现微弱增暖趋势[13]。
1.2 实验材料
实验选取菹草作为研究对象, 探究母代环境升温对其石芽繁殖方式的影响。菹草是一种地理分布范围极广的水生沉水植物, 在中国各地的淡水湖泊、池塘及河流中均有分布, 是淡水生态系统的重要初级生产者[14]。与大多数沉水植物不同, 菹草于秋季萌发、冬春生长、夏季逐渐凋亡衰退, 其独特的生活史策略可使其避免生境中其他物种的竞争[14]。菹草对富营养化水体的适应能力强, 能有效吸收水体中的无机盐, 控制藻类、提高水质, 在湖泊生态系统维护方面具有重要价值[15]。菹草虽兼具有性繁殖和无性繁殖两种繁殖方式, 但其种子在自然条件下萌发率极低[11], 其繁殖和扩散主要依靠无性繁殖器官—石芽, 所以菹草石芽的正常萌发和幼苗生长是其种群建立和扩增的关键所在[16]。
本文实验分为2个阶段, 第一阶段实验: 菹草石芽购买自兴化市龙马水生植物培育有限公司, 萌发后取单株幼苗作为菹草亲本在不同温度模式下培养, 并收集其产生的石芽; 第二阶段实验: 探究母代温度环境升温对菹草石芽的影响。
1.3 实验系统
实验通过中型室外模拟控制系统(Mesocosm)完成, 该系统由圆柱形塑料缸(材料为聚乙烯塑料,直径1.5 m, 高1.4 m)和控制平台两大部分组成, 塑料缸内配有加热装置和测温探头, 可由控制平台在电脑上实时控制和监测水温。升温处理组用600 w的水族缸加热器加热。所有处理组的水温用电脑控制, 通过精准的温度传感器每10s记录1次水温。控温系统会根据对照组每次测量的平均温度来调控升温组的水温。实验系统为室外模拟控制系统,实验期间的光照环境为自然光照。
1.4 实验方法
第一阶段实验(1)温度控制模式: 自然水温(C), 全期升温3℃(T), 升温3℃基础上3℃的变温(H),自然水温基础上3℃的变温(R)。其中, 在2017年2月15日—3月20日, 处理H固定升温3℃, 处理R维持自然水温; 从 2017年3月21日开始, 处理H较自然水温升温6℃与升温3℃按周交替, 处理R较自然水温升温3℃与自然水温按周交替。
(2)实验设计及取样: 选取湿重在(0.35±0.05) g的菹草石芽在常温下萌发, 萌发3周后取长度10 cm左右的菹草幼苗种植到种植杯(直径12 cm, 其内含有10 cm厚的陆地土壤)中。每种温度模式设置6个平行, 塑料缸加水至1 m, 每个塑料缸放入40盆菹草。在菹草繁殖期间, 每隔2周收集一次石芽(使用Pre+温度方案字母的方式作为第一阶段不同处理实验获得的石芽编号, 即PreC、PreT、PreH和PreR四个处理)。
(3)相关指标测定: 将收集到的石芽清洗干净并吸干表面水分, 使用万分之一电子天平称量湿重,参考王锦旗等[17]对石芽长宽的测量方法测量长宽,之后置于4℃避光保存。待全部石芽收集完成后,每个处理随机挑选30颗石芽于60℃烘干至恒重, 研磨后取2—3 mg(使用MiniBeadbeater-16研磨至粉末状), 使用碳氮元素分析仪(Flash EA 1112, CE Instruments, Italy)测定石芽中碳氮元素含量[18]。
第二阶段实验(1)温度控制模式: 第二阶段实验于2017年11月10日开始, 仍然设置上述4个温度模式。其中, 处理H、R升温模式仍按周交替, 处理H第1周水温升高3℃, 第2周升高6℃, 之后降回升温3℃; 处理R第1周保持自然水温, 第2周升高3℃,之后降回自然水温。
(2)实验设计及取样: 将第一阶段实验收集到的石芽取出, 分别选择每种母代温度环境下产生的规格相似的石芽160颗均分到4个覆网塑料盒中(每个塑料盒40颗), 再交叉到实验所设的4种温度模式下进行萌发(即PreC、PreT、PreH及PreR组的石芽分别在4种温度下进行萌发)。萌发时将塑料盒下沉到1 m的水深, 塑料盒内无基质, 实验为期18d, 每天统计石芽萌发情况, 并于萌发结束后测量萌发出的幼苗长度。
(3)相关指标测定: 统计石芽萌发情况时, 萌发出白尖的石芽被认定为萌发。使用直尺测定幼苗地上部分的长度作为幼苗长度。

图 1 菹草生长期间日均水温变化趋势Fig. 1 The mean daily water temperature during the growth of P. crispus
1.5 数据分析
所有数据用SPSS 19 (IBM SPSS Statistics 19)进行分析, 用Excel 2007及OriginPro 2017绘制图表。在分析前检验数据是否满足正态分布和方差齐性, 对不满足正态分布和方差齐性的数据, 视具体情况进行Log(x)、Log(x+1)或转换。对于满足方差分析条件的数据进行单因素方差分析(Oneway ANOVA), 若差异显著, 再采用Tukey’s HSD方法进行多重比较。对于转换后仍不满足方差分析条件的数据, 则采用非参数检验Kruskal-Wallist test进行相关数据分析。
2 结果
2.1 石芽的重量及形态特征变化
第一阶段实验期间, 各组水温变化如图 1所示。处理C的日平均水温在9.80—31.15℃, 处理T的日平均水温在12.25—34.23℃, 处理H的日平均水温在12.31—36.57℃, 处理R日平均水温在9.66—33.79℃。
在菹草繁殖期间, 共收集到石芽1496颗, 其中处理C 405颗(PreC组)、处理T 267颗(PreT组)、处理H 494颗(PreH组)、处理R 330颗(PreR组)。在实验过程中, 由于未收集到全部石芽, 所以此数目并不代表不同处理菹草产生石芽的总数。如图 2所示, 在不同温度模式条件下, 菹草亲本产生的石芽湿重无显著性差异, 仅PreH组的石芽湿重略高于其他组(P=0.051)。
对石芽长度的分析结果表明: 处理组间存在显著性差异(P<0.001), PreH组的石芽长度显著高于PreC组(P<0.01)和PreT组(P<0.01), PreR组的石芽长度显著高于PreC组(P<0.05, 图 3A); 同时, 不同处理亦显著影响石芽宽度(P<0.001), PreH组的石芽宽度显著高于PreC组(P<0.01)、PreT组(P<0.01)及PreR组(P<0.05, 图 3B)。同样, 石芽长宽比在各处理组间也存在明显差异(P=0.002), PreC组石芽的长宽比值显著低于PreH组(P<0.05)和PreR组(P<0.01,图 3C)。
2.2 石芽碳氮元素化学计量学特征
不同温度模式处理下的菹草亲本产生的石芽总碳、总氮含量及碳氮元素比值如图 4所示。PreC、PreT、PreH和PreR组石芽总碳含量的平均值分别为403.5、403.1、406.2和406.3 mg/g, 总氮含量的平均值分别为5.9、6.7、7.9和6.2 mg/g。统计分析结果表明各处理组石芽的总碳含量无显著性差异(P=0.055, 图 4A), 而PreH处理中石芽总氮含量显著高于对照(P<0.01, 图 4B)。由于PreH处理中石芽总碳含量不变且总氮含量升高, 相应导致石芽碳氮比下降, 石芽碳氮比存在显著性差异(P=0.004,图 4C)。PreH组的石芽碳氮比显著低于PreC组(P<0.01)和PreR组(P<0.05)。
2.3 石芽的早期萌发特征
在第二阶段实验期间, 处理C的水温变化约为12—16℃, 处理T的水温变化为15—19℃, 处理H的水温变化为15—21℃, 处理R的水温变化为14—17℃。所有处理产生的石芽在4种温度模式下均从第5天开始萌发, 升温处理产生的石芽往往表现出更快的萌发速率(图 5)。在处理C条件下,PreT、PreH升温处理产生的石芽具有更快萌发速率和更高的最终萌发率(PreT、PreH组分别为80%、87.5%, PreC组和PreR组均为65%); 在处理T条件下, 由于环境温度的升高减弱了母代环境温度对石芽萌发造成的影响, 各处理组产生的后代萌发速率较为一致, 且最终萌发率的差距缩小(PreC、PreH组为75%, PreT、PreR组为82.5%); 在处理H条件下, PreT、PreH组升温产生的后代萌发速率更快, 但最终萌发速率的差距缩小(PreC组为70%, PreT和PreR组为77.5%, PreH组为85%); 在处理R条件下, 母代升温幅度较大的PreT和PreH组在萌发速率上仍然占据优势, 但最终萌发速率的差距缩小(PreC组为67.5%, PreT组为77.5%, PreH组为70%, PreR组为65%)。
在萌发结束后, 测量了各处理组产生的石芽在不同的温度模式下萌发出的幼苗长度(图 6)。统计分析结果表明: 在处理C与处理T的萌发条件下,PreH和PreT组的平均长度虽略高于PreC组和PreR组, 但未产生显著性差异(处理C,P=0.62; 处理T,P=0.161); 在处理H的萌发条件下, 各组间产生显著性差异(P=0.011), PreC组的幼苗平均长度显著低于PreT组(P<0.05)和PreH组(P<0.05); 在处理R的萌发条件下, 各组间产生显著性差异(P=0.001), PreR组的幼苗平均长度显著低于PreT组(P<0.01)和PreH组(P<0.01)。
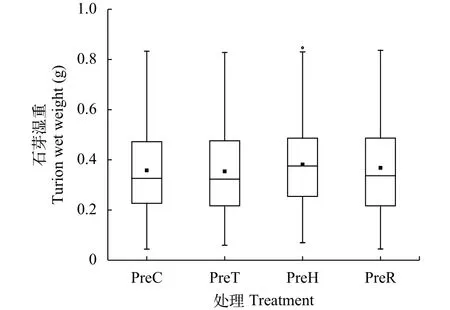
图 2 不同温度处理条件下获得的菹草石芽湿重Fig. 2 Wet weight of P. cripus turion under different temperatures

图 3 不同温度处理条件下菹草石芽长度(A)、宽度(B)及长宽比(C)的变化(数值以均值±标准差表示)Fig. 3 The length (A), width (B) and length: width ratio (C) of P. cripus turion under different temperatures (Data are given as Means±SD)标注不同小写字母表示处理间差异显著(P<0.05); 下同Different letters are significant difference at P<0.05 level among different treatments; the same applies below
3 讨论
3.1 菹草的温度环境条件对石芽重量和形态特征的影响
目前关于母代环境对繁殖体重量影响的研究大多集中在陆生植物。相关研究表明, 陆生植物种子质量是影响种子萌发、幼苗形成、早期生长甚至成株有性繁殖的重要因素[19,20]。同时陆生植物所处环境特征(如干旱或暴雨[5]、升温[8])未引起陆生植物的种子质量发生改变。与陆生植物不同, 水生植物的繁殖系统更加多样, 在探究水生植物繁殖策略时, 应充分考虑无性繁殖在水生植物繁殖中发挥的作用[21,22]。菹草的种子通常对其种群动态和群落组成影响较小, 而其无性繁殖体石芽的繁殖更为普遍。在本实验中, 不同升温模式处理下菹草产生的石芽湿重未呈现出显著性差异。此外, 在菹草对长期升温适应的研究中发现, 菹草产生的石芽个体生物量减小、数量增多[23]。对比本研究的短期适应, 我们发现升温在短期内未引起菹草石芽重量的改变。

图 4 不同温度处理下菹草石芽总碳(A)、总氮(B)含量及碳氮比(C)变化(数值以均值±标准差表示)Fig. 4 The TC (A), TN (B) and C∶N (C) of P. cripus turion under different temperatures (Data are given as Means±SD)
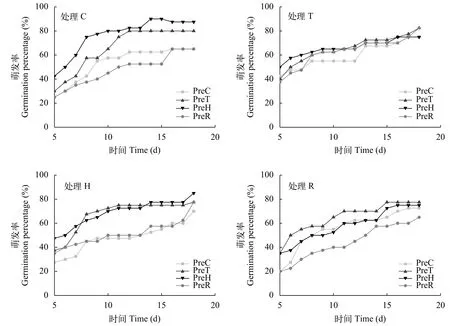
图 5 不同母代温度环境产生的菹草石芽在4种温度模式下的萌发情况Fig. 5 The germination of turions produced in different maternal temperature environment in four temperature modes
不同升温模式虽未引起石芽重量的显著变化,但却导致了石芽形态的变异, 尤其是PreH组, 长宽均有显著的增加。因此, 不同的环境温度条件可能会导致菹草产生石芽的长宽形态特征发生变异, 尤其是当存在温度波动时, 且较大幅度的波动升温(PreH)对石芽形态变异的影响更为显著。在对某些水生植物的研究中发现, 水温升高会影响水生植物的叶面积[24], 进而造成叶片形态的变化, 而菹草石芽是由茎叶变态形成, 这或许是引起石芽长宽形态变异的原因之一[17]。
3.2 菹草的温度环境条件对石芽化学计量学特征的影响
在本实验中, 不同温度环境并未对菹草石芽的总碳含量产生显著性影响, 却导致了石芽总氮含量的显著升高, 即PreH组(升温幅度最高)显著高于PreC组(常温组), 同时石芽碳氮比随温度的升高而减小。本系统的前期研究发现, 升温会导致菹草叶片的总碳及总氮含量下降、碳氮比升高[18]。在本研究中, 菹草的无性繁殖体石芽化学计量学特征与叶片的分析结果正好相反, 这一研究结果表明菹草在环境温度升高的条件下不同器官的营养分配模式可能存在差异。与叶片相比, 氮营养元素可能更倾向于分配至繁殖器官中。在陆生植物中, 也有研究发现升温会导致植物不同器官氮元素含量的变化不同, 灌木地团花(Globularia alypumL)在经过6年的1℃升温生长后, 其叶片的氮元素含量下降,根茎的氮元素含量升高[25]。此外, 对陆生植物澳扁芒草(Austrodanthonia caespitosa)的研究中发现, 其种子的碳氮元素含量均不因升温(约1℃)而发生改变[8]。在本研究中的PreT组与PreR组石芽碳氮元素含量均未与对照组产生差异, 菹草在对无性繁殖体石芽的碳氮元素分配上或许会采取与陆生植物种子相似的策略以应对中小幅度的变暖, 但在相对更高的升温情景下(PreH), 菹草会将更多的营养物质分配至石芽中, 以保证其获取种群的繁殖优势。
3.3 菹草母代环境温度对石芽早期萌发的影响
在陆生植物中, 已有相当数量的研究表明, 环境因子的改变不仅会造成母代表观性状的变化, 也会对后代的性状产生影响[26—29]。这种现象也被称之为植物的跨世代可塑性。温度、营养、光照及水分等各种环境因子的变化均会使植物子代的某些性状发生特定变化, 或影响其种子的萌发时长,或影响其幼苗的生长速度, 或影响其后代的开花时间, 而通过这些特定变化可以帮助后代在面临相同的环境变化时更好的生长, 尤其是当环境因子向不利方向转变时[3,4,8,27,30]。与陆生植物相比, 水生植物在此方面的研究相对匮乏。母代环境温度升高,菹草的无性繁殖体石芽也能产生适应性的转变, 这表明菹草的无性繁殖也能受到跨世代可塑性的影响。此外, 菹草石芽由于是由母代茎、叶形成, 相对于陆生植物的种子, 其可能更易受到母代环境因子的影响。
在本研究中, 菹草母代环境的升温对于石芽的萌发速率具有促进作用。其中石芽在常温萌发条件下, 母代环境升温对石芽萌发的促进作用表现的尤为显著, 其原因可能是在低温萌发条件下母代环境变暖对石芽萌发产生的影响更大。当石芽萌发期间也处于升温环境中后, 母代环境特征对石芽萌发率影响的差异就会减弱, 其中石芽均处于固定升温3℃的萌发条件下, 各组的萌发情况趋于一致, 说明萌发环境的升温能够在一定程度上减弱母代环境差异的影响。在处理H条件下, 不同处理的石芽萌发速率差异可能是由于较大的升温幅度影响, 减缓了PreC、PreR组石芽的萌发速率, PreT、PreH组由于母代环境升温幅度较高, 因此石芽在萌发过程中对水温的较高幅度的增加有一定的适应性。在幼苗长度方面, 母代环境升温(PreT与PreH)产生的后代萌发出的幼苗在早期生长更快。PreR组菹草母代虽也经过升温, 但石芽并未表现出更快的萌发速率及幼苗长度的增加, 这可能是由于PreR组升温幅度较小导致的。在处理R条件下, 其幼苗长度低于对照组, 这或许是因为石芽个体之间仍存在活力差异所致。不同升温处理产生的石芽在湿重方面并无显著性差异, 但萌发速率却有所提高, 这或许与石芽总氮含量的升高有关, 但由于相关研究较少,石芽化学计量学特征的变化与其萌发速率的关系仍需进一步的深入研究。

图 6 不同母代环境产生的石芽在4种温度模式下萌发的幼苗长度(数值以均值±标准差表示)Fig. 6 The average seedling length of P. crispus turions produced in different maternal temperature environment in four temperature modes(Data are given as Means±SD)
此外, 变暖能够在一定程度上加快菹草石芽的萌发速率及幼苗生长速度, 使其在早期萌发过程中占据优势。在处理H条件下, 母代升温处理后代仍能表现出较好的适应能力, 且在早期萌发的幼苗长度有所增加, 这可能与菹草秋冬季萌发生长的独特生活史特征有关。由于秋冬季气温较低, 即使有大幅度的升温, 仍不会超过其适宜的生长温度, 有利于母代升温后代的生长, 但对于母代常温后代, 大幅度的升温造成了更大的环境温度变化, 可能需要更久的时间适应。但升温对石芽早期萌发与生长的促进作用并不意味着变暖有利于菹草群落的扩张。有研究表明变暖对水生植物的影响可能与季节因素有关[24], 菹草在高温时会停止生长甚至衰退[31]。变暖可能加快菹草冬春季的生长, 更快生长到水面以获得光照优势, 进而可能对早春季节的藻类生长有一定的抑制作用, 但在夏季, 变暖造成的高温可能导致菹草群落的提前衰退, 从而导致湖泊稳态的提前转变。

