白藜芦醇抑制嗜水气单胞菌毒力作用研究
谭宏亮 陈 凯 习丙文 秦 婷 潘良坤 谢 骏
(1. 南京农业大学无锡渔业学院, 无锡 214081; 2. 中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室, 无锡 214081)
嗜水气单胞菌(Aeromonas hydrophila)是一种在淡水生态环境中广布的革兰氏阴性菌, 普遍存在于自然界水体、土壤和水生动物体表及消化道内[1],在特定条件下可引起水生动物局部或全身感染, 尤其在渔业生产中每年都会造成养殖鲤(Cyprinus carpio)、鲫(Carassius auratus)、团头鲂(Megalobrama amblycephala)、斑点叉尾鮰(Ietalurus punetaus)和罗非鱼(Oreochromisspp.)等养殖品种暴发出血性败血病, 是淡水养殖中影响较大的条件性致病菌[2,3]。基于大量病原生物学研究发现嗜水气单胞菌的菌毛(Pilus)、外膜蛋白(Outer membrane protein, OMP)、溶血素(Hemolysin)、气溶素(Aerolysin)、生物膜(Biofilm)等在病原菌株的黏附、入侵、定植、毒素分泌、宿主营养夺取和增殖等致病过程中发挥重要作用[4—7]。同时, 病原菌能通过群体感应(Quorum sensing, QS)调控系统协同细胞群体生长、毒力和抗逆性等[8,9]。当前, 在水产养殖中抗生素、化学药物、疫苗和微生物制剂等被广泛应用于防控嗜水气单胞菌引起的细菌出血病; 然而,抗生素仍然是最主要的防控手段。随着病原菌耐药性、水环境污染和食品安全等问题日益受到国家和公众的广泛关注, 水产细菌病防控迫切需要探索研发新的防治策略和药物。
中草药应用于临床防控人、畜和水生动物疾病已有几千年的历史。近年, 中草药药理学研究快速推动中草药资源的开发和利用。药用植物提取物中的多糖、生物碱、酸、萜类、皂苷和黄酮类等具有重要的杀虫、抑菌、抗炎和抗氧化等作用。白藜芦醇(Resveratrol, Res)是一种天然单体化合物, 存在于药用植物大黄(Rheum palmatum)、虎杖(Reynoutria japonica)和藜芦(Veratrum nigrum)等,具有抗菌、抗炎和抗氧化等功效[10—12], 能够抑制细菌病原泳动、群体感应、生物膜形成、鞭毛基因表达和溶血活性[12—17]等。
本研究通过体外试验分析白藜芦醇对嗜水气单胞菌生长和毒力相关基因表达的影响, 并通过人工感染试验检测白藜芦醇对感染嗜水气单胞菌异育银鲫(Carassius auratus gibelio)的保护作用和对鱼体炎症相关因子表达的影响。
1 材料与方法
1.1 试验菌株和培养条件
本实验所使用的嗜水气单胞菌株NJ-35由南京农业大学刘永杰教授实验室馈赠。菌株保存在-80℃甘油管中, 使用前在NB平板划线, 28℃过夜培养, 挑取单克隆。
1.2 药品和试剂
白藜芦醇(99%)购自aladdin、二甲基亚砜(DMSO)购自碧云天公司、NB培养基购自青岛海博生物技术有限公司、无菌脱纤维绵羊血购自南京森贝伽生物科技有限公司。基因转录表达分析试剂: RNAiso Plus, One Step SYBR®PrimeScriptTMPLUS RT-PCR Kit (TaKaRa)等均购自大连宝生物有限公司。
1.3 白藜芦醇对嗜水气单胞菌生长的影响
将白藜芦醇溶解于DMSO配置成母液, 稀释备用。取嗜水气单胞菌NJ-35单菌落于NB液体培养基(蛋白胨10 g/L、牛肉浸粉3 g/L、氯化钠5 g/L)中过夜培养(28℃, 180 r/min), 离心(3000 r/min, 5min)后弃上清, 用无菌生理盐水调整细菌A600=0.3。菌液按(1%v/v)接种量转接至含白藜芦醇(浓度分别为1024、512、256、128、64、32和16 μg/mL)的NB培养基中; 设置培养基内不添加白藜芦醇的空白对照组和添加等量DMSO的溶剂对照组; 控温摇床中(28℃、180 r/min)培养26h, 每2h取样检测A600值。试验设置3个重复, 根据取平均值绘制生长曲线。
1.4 白藜芦醇对嗜水气单胞菌生物膜形成的影响
根据Vasudevan等[18]的结晶紫染色法检测菌株生物膜。菌液按(1%v/v)接种量转接至含有白藜芦醇(浓度分别为128、64、32 和16 μg/mL)的NB培养基中, 设置空白对照组和DMSO溶剂对照组。在充分混匀后, 转入至96孔细胞培养板中, 28℃静置培养48h后, 吸出菌液并测定细胞浓度, 同时用无菌PBS清洗培养孔后, 先后用100 μL 40%甲醛固定15min, 1%结晶紫溶液染色5min; 干燥后加入100 μL 33%冰醋酸, 37℃ 孵育30min溶解结晶紫。用全波长酶标仪(Multiskan G, Thermo Scientific)测定培养孔中溶液的A590值, 试验重复3次, 各试验组设置3个重复。由于不同试验组细菌生长存在差异, 每个样品孔测得的A590值需要消除由细菌浓度造成的差异;生物膜A590(相对值)=A590(测量值)/A600(细菌浓度值)。
1.5 白藜芦醇对嗜水气单胞菌溶血活性的影响
根据Mao等[19]的试验方法检测嗜水气单胞菌NJ-35溶血活性。菌液按(1%v/v)接种量转接至含有白藜芦醇(浓度分别为128、64、32和16 μg/mL)的NB培养基中, 设置培养基内不接种嗜水气单胞菌的空白对照组和不添加白藜芦醇的阳性对照组。摇床培养(28℃、180 r/min)8—16h, 调整各组A600值到1.0, 用过滤膜(0.22 μm)过滤除细菌细胞。将绵羊红细胞用PBS稀释成5%悬浮液, 37℃水浴30min。取50 μL细菌过滤液加入5 mL红细胞悬液中, 37℃静止孵育30min, 室温下5000 r/min离心10min。取上清液测定A405值, 试验重复3次, 各试验组设置3个重复。用此公式计算溶血百分比: H%=(AS-A0)/(A100-A0)(AS: 添加药物组A405值,A0: 空白对照组A405值,A100: 阳性对照组A405值)。
1.6 白藜芦醇对嗜水气单胞菌毒力相关基因表达的影响
用无菌生理盐水调整细菌A600=0.3, 菌液按(1%v/v)接种量转接至含白藜芦醇(浓度为64 μg/mL)的NB培养基中过夜培养, 对照组接入不含白藜芦醇的NB培养基中; 5000 r/min离心1min, 弃上清, 根据RNAiso Plus试剂盒的操作说明, 提取细菌总RNA; 使用NanoDrop 2000 (Thermo Scientific,Wilmington, DE, USA)测定样品RNA浓度并调整浓度至40 ng/μL, 冻存于-80℃备用。以嗜水气单胞菌rpob作为内参基因, 检测细菌溶血素基因hly, 外膜蛋白基因omp, 群感系统相关基因luxR、luxS、qseb表达量的变化。样品RNA反转录和荧光定量分析溶液配制参照One Step SYBR®PrimeScriptTMPLUS RT-PCR Kit (Takara)试剂盒的方法和步骤。荧光定量分析检测采用ABI PRISM 7500 Real-time PCR Systeam仪器, 基因相对表达量分析用2-ΔΔCt方法; 试验所用引物见表 1。
1.7 白藜芦醇对异育银鲫的保护作用
异育银鲫[(50±10) g; (10±1.5) cm]由中国水产科学研究院淡水渔业研究中心南泉实验基地提供,在室内循环水养殖系统中驯化2周, 水温26℃。将试验鱼随机分为4组, 每组设3个重复, 每个重复30尾。在用病原菌嗜水气单胞菌攻毒前1h, 每组分别注射白藜芦醇(药物∶鱼体重: 0、25、50和100 mg/kg)。病原菌接种于无菌NB培养基中, 28℃、180 r/min培养18h, 离心收集细胞, 用无菌PBS调整浓度接近半致死量1×106CFU/mL, 每尾鱼腹腔注射100 μL菌液, 攻毒后连续观察7d, 记录死亡量。7d后每组随机采取21尾鱼的肝脏和血清(3500 r/min, 15min)保存于-80℃备用。根据RNAiso Plus试剂盒的操作方法, 对肝脏样品的总RNA进行提取, 使用Nano-Drop 2000测定RNA的浓度后用Nuclear-free water调整浓度至40 ng/μL, 且A260/A280值在1.8—2.0,冻存于-80℃冰箱备用。β-actin作为内参基因, 根据实时荧光定量RT-PCR试剂盒使用说明在ABI PRISM 7500 Real-time PCR Systeam仪器中检测免疫相关基因TNF-αmRNA、IFN-γmRNA、IL-10 mRNA表达量变化, 数据分析用2-ΔΔCt方法, 试验所用引物见表 2。

表 1 荧光定量PCR所用引物Tab. 1 Primers used for quantitative PCR
1.8 数据统计分析
试验数据结果以平均值±标准误(Mean±SEM)表示, 其中毒力因子mRNA表达量数据使用SPSS 19.0统计软件中的独立样本T检验法比较分析; 其他数据使用软件中的单因素方差分析(One-way ANOVA)进行检验, 使用Duncan氏法进行组间多重比较,P<0.05为差异显著。
2 结果
2.1 白藜芦醇抑制嗜水气单胞菌生长
如图 1所示, 空白对照组和溶剂DMSO试验组生长曲线基本重合, 溶剂DMSO不影响嗜水气单胞菌NJ-35的生长。白藜芦醇浓度≤32 μg/mL时对NJ-35的生长没有明显的影响(P>0.5), 在白藜芦醇浓度≥64 μg/mL时, 明显抑制了嗜水气单胞菌的生长, 菌株进入对数生长期的时间出现了延迟, 且生长平台期菌液浓度明显低于对照组(P<0.5)。随着白藜芦醇浓度增加, 嗜水气单胞菌进入对数生长期的时间也随之延迟, 且稳定期的最大值也随之降低。白藜芦醇对嗜水气单胞菌的最小抑菌浓度(MIC)明显高于1024 μg/mL。
2.2 白藜芦醇对嗜水气单胞菌生物膜形成的影响
如图 2所示, 溶剂DMSO对嗜水气单胞菌NJ-35生物膜形成无显著影响(P>0.5), 白藜芦醇浓度为16 μg/mL时, 对NJ-35生物膜形成抑制率为2.5%, 与对照组相比无显著差异(P>0.5), 在白藜芦醇浓度为32 μg/mL时, 生物膜形成抑制率为12.4%, 与对照组相比有显著差异(P<0.5)。在白藜芦醇浓度为64和128 μg/mL时, NJ-35生物膜抑制率分别为40.5%和44.6%, 差异显著(P<0.5)。
2.3 白藜芦醇对嗜水气单胞菌溶血活性的影响
如表 3所示, 溶剂DMSO试验组溶血率为98%,对嗜水气单胞菌NJ-35溶血无明显影响(P>0.5); 白藜芦醇浓度为16 μg/mL时, 溶血率为94.8%, 抑制溶血效果不显著(P>0.5); 当白藜芦醇浓度为32 μg/mL时, 溶血率为78.8%, 能显著抑制NJ-35溶血活性(P<0.5)。白藜芦醇对嗜水气单胞菌NJ-35溶血活性的抑制作用呈现剂量依赖, 白藜芦醇浓度越高抑制效果越强。

表 2 荧光定量PCR所用引物Tab. 2 Primers used for quantitative PCR
2.4 白藜芦醇对嗜水气单胞菌毒力相关基因表达的影响
如图 3所示, 菌株接种到含64 μg/mL白藜芦醇的培养基后, 嗜水气单胞菌NJ-35毒力相关基因表达呈现不同的变化趋势。Ⅰ型群感系统相关基因luxR表达量显著上调(P<0.5), Ⅱ型群感系统相关基因luxS、外膜蛋白omp表达量显著下调(P<0.5), 其中溶血素hly、Ⅲ型群感系统相关基因qseb下调不显著(P>0.5)。
2.5 白藜芦醇对感染嗜水气单胞菌的异育银鲫死亡率的影响
如图 4所示, 异育银鲫攻毒后7d累计死亡率, 试验中对照组7d累计死亡率超过50%, 腹腔注射白藜芦醇的处理组死亡率低于对照组, 其中注射浓度为25 mg/kg组的7d累计死亡率为29.1%, 50 mg/kg组7d累计死亡率为20.8%, 100 mg/kg组累计死亡率最低为12.5%。试验表明腹腔注射白藜芦醇可降低异育银鲫的死亡率。
2.6 白藜芦醇对感染嗜水气单胞菌的异育银鲫肝脏基因表达量的影响
如图 5所示, 异育银鲫注射病原菌后肝脏组织中炎症因子TNF-α、IFN-γ mRNA表达量显著上调(P<0.5), 白藜芦醇处理组TNF-α mRNA和IFN-γ mRNA的表达量显著下调(P<0.5); 其中TNF-α mRNA表达量在注射浓度为50 mg/kg白藜芦醇时达到最低; IFN-γ mRNA表达量在注射浓度为100 mg/kg白藜芦醇时达到最低。而抑制炎症因子IL-10 mRNA表达量在注射嗜水气单胞菌NJ-35后显著降低, IL-10 mRNA表达量在注射浓度为50 mg/kg白藜芦醇时达到最低。
3 讨论
3.1 白藜芦醇对病原菌的最小抑菌浓度
白藜芦醇是一种天然多酚, 存在于多种植物中,具有广谱抗菌作用(Anti-bacterial activity); 能显著抑制多种致病菌的生长、泳动、毒力和生物膜形成等[20]。本研究首次报道了白藜芦醇对水生动物重要细菌病原嗜水气单胞菌的抗菌作用。在此前的研究中, 白藜芦醇对不同来源细菌菌株的最小抑菌浓度存在较大差异。如He等[21]发现白藜芦醇对具核梭杆菌(Fusobacterium nucleatum)的MIC值为100 μg/mL。Jung等[22]在对43株人畜来源细菌的药敏试验分析发现, 白藜芦醇对其中40株菌的MIC≥1000 μg/mL。本研究发现白藜芦醇对嗜水气单胞菌的MIC值与后者研究结果相似(≥1000 μg/mL)。由于1000 μg/mL接近白藜芦醇在溶剂中的最大溶解浓度, 因此, 后续研究主要关注白藜芦醇在低浓度条件下对嗜水气单胞菌的抗菌作用。

表 3 白藜芦醇对嗜水气单胞菌溶血活性的影响Tab. 3 The effect of resveratrol on the hemolytic activity Aeromonas hydrophila

图 1 嗜水气单胞菌NJ-35在不同浓度的白藜芦醇培养基中生长曲线Fig. 1 The effect of resveratrol on the growth of Aeromonas hydrophila NJ-35

图 2 白藜芦醇对嗜水气单胞菌NJ-35生物膜形成的影响Fig. 2 The effect of resveratrol on the biofil formation of Aeromonas hydrophila NJ-351. 对照组control; 2. DMSO; 3. 16 μg/mL; 4. 32 μg/mL; 5. 64 μg/mL;6. 128 μg/mL

图 3 白藜芦醇对嗜水气单胞菌NJ-35毒力相关基因转录表达的影响Fig. 3 Effect of resveratrol on the virulence gene expression in Aeromonas hydrophila NJ-351. luxR; 2. luxS; 3. Hly; 4. Qseb; 5. Omp; 柱形图的上标“*”表示差异显著mean significant difference, P<0.05
3.2 白藜芦醇影响病原菌群感调控系统基因表达
嗜水气单胞菌具有复杂的群感调控系统(如Ⅰ型LuxR/I, Ⅱ型LuxS/AI-2和QseBC), 能根据菌体周围环境中信号分子, 协同调控细胞群体的生长、运动性、毒力表达和生物膜生成等, 在病原菌致病过程中发挥重要作用[23—28]。研究表明嗜水气单胞菌ahyⅠ基因缺失, 显著降低影响Ⅰ型群感调控系统信号分子AHL表达, 菌株致病性显著下降[29]。王娜[25]研究发现嗜水气单胞菌luxS基因缺失株在生物膜形成能力、黏附能力与溶血活性都出现减弱, 相关基因的表达量下调。同时, 张小军等[30]研究发现嗜水气单胞菌luxS缺失株不产生Ⅱ型群感系统的信号分子AI-2, 并影响AHLs合成; 说明群感调控系统间具有一定交互调控作用。Ⅲ型群感系统(Qse-BC双组分调控系统)广泛存在于革兰氏阴性杆菌中, 参与细菌的毒力、鞭毛和生物膜的形成。本研究发现64 μg/mL白藜芦醇处理嗜水气单胞菌后, 其群感调控系统中luxR基因显著上调表达,luxS基因显著下调表达, 但QseB基因无显著变化。这说明白藜芦醇可以影响嗜水气单胞菌Ⅰ型和Ⅱ型群感调控系统基因表达。
3.3 白藜芦醇影响病原菌生物膜生成和毒力因子活性
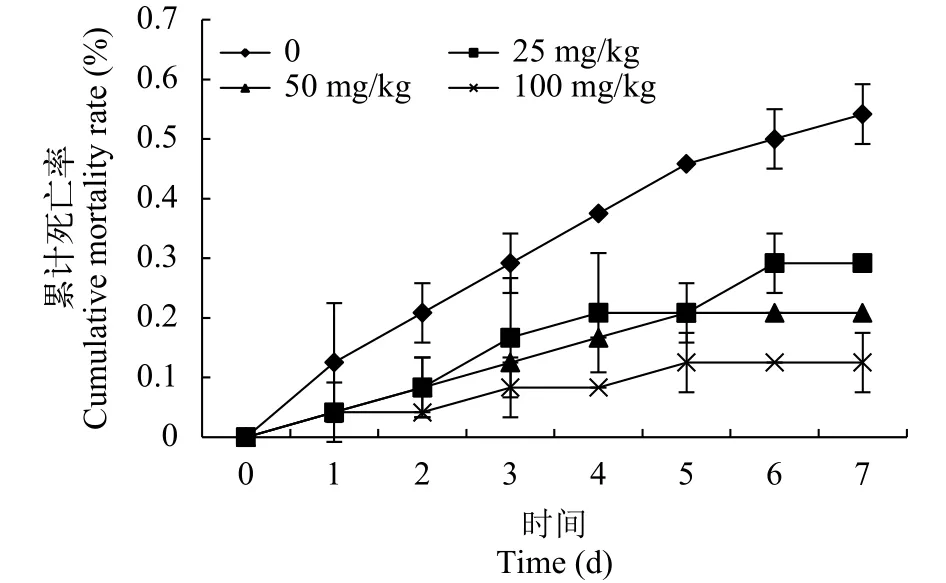
图 4 嗜水气单胞菌攻毒后异育银鲫累计死亡率Fig. 4 Cumulative mortality rate (%) of crucian carp after Aeromonas hydrophila challenge in 7 days

图 5 肝脏组织炎症因子转录表达变化Fig. 5 The effect of resveratrol on the expression of Liver tissue inflammatory factors柱形图上不同字母表示有显著差异, P<0.05Different letters indicate significant differences, P<0.05
生物膜作为细菌一种十分重要的胞外结构, 参与细菌黏附、物质运输以及自我保护等功能。本研究发现白藜芦醇(32—128 μg/mL)能显著抑制嗜水气单胞菌生物膜形成。白藜芦醇对霍乱弧菌(Vibrio cholera)抑菌作用研究表明其可以通过与病原菌转录调控因子AphB相结合, 从而在不抑菌的情况下减弱细菌形成生物膜的能力[15]。白藜芦醇浓度≥32 μg/mL时, 嗜水气单胞菌的溶血活性显著降低, 但溶血素基因hly的表达量并没有明显的变化。嗜水气单胞菌能够分泌多种与溶血活性相关的毒力因子, 其中属于溶血性毒素[25]的气溶素和溶血素是最重要的致病因子[32]。它们主要通过作用于细胞膜磷脂结构与活性从而破坏细胞膜[25,33]或作为细胞膜孔蛋白导致大量离子涌入引起渗透失衡使细胞死亡[34]。有研究认为气溶素基因aer和丝氨酸蛋白酶基因ahpA是嗜水气单胞菌具有致病力的关键基因, 而溶血素hly与嗜水气单胞菌的致病力并不相关[5], 但也有研究者提出致病性嗜水气单胞菌必定存在aer或hly基因[35], 同时存在aer和hly两个基因时为强毒株[36]。嗜水气单胞菌的溶血活性可能通过多个基因共同发挥作用。菌体外膜蛋白是嗜水气单胞菌黏附宿主细胞主要作用因子和重要的免疫抗原[37,38]。白藜芦醇(64 μg/mL)处理嗜水气单胞菌后omp基因表达量下调, 说明嗜水气单胞菌受白藜芦醇的影响黏附能力减弱。在实验过程中, 作者发现白藜芦醇与嗜水气单胞菌胞外产物直接共同孵育, 并不能直接改变胞外产物的溶血活性(数据未发表)。因此, 白藜芦醇对嗜水气单胞菌溶血活性和生物膜形成的影响可能通过调控群感因子表达进而影响下游毒力相关因子。
3.4 白藜芦醇促进鱼体抗病原菌感染力
研究表明白藜芦醇腹腔注射大鼠(20 mg/kg)1h后, 在心、肝、肾、肠等组织中都能检测到白藜芦醇, 且肝脏浓度最高, 达到6.72 μg/mL[39], 因此, 本研究采用白藜芦醇腹腔注射浓度为20—100 mg/kg。攻毒试验结果表明白藜芦醇对感染嗜水气单胞菌的异育银鲫有显著保护作用, 药物处理组死亡率都低于对照组。白藜芦醇对异育银鲫的保护作用可能从两方面发挥作用, 一方面鱼体组织分布的白藜芦醇能减弱病原菌的毒力, 另一方面白藜芦醇能降低鱼体自身炎症反应。白藜芦醇在人和其他动物体内被发现具有很好的抗炎症作用。适度的机体炎症反应对抑制病原具有重要作用, 但长期过高的炎症因子表达, 会损伤鱼体甚至导致死亡[31]。Yu等[40]研究显示, 大黄鱼(Larimichthys crocea)高死亡率组脾脏组织中往往具有更高的促炎症因子表达量, 这或许意味着炎症因子表达量和死亡率也存在一定关系。TNF-α和IFN-γ都是促炎症因子, 参与动物体内的免疫调节, TNF-α被认为是炎症因子中的核心因子, 当发生病原体感染时, 炎症细胞被激活后会释放大量如TNF-α等的炎症介质, 而且较严重的组织中往往会有更高的TNF-α蛋白表达量和TNF-αmRNA表达量[41]。杨智景等[42]在对鳗弧菌(Vibrio anguillarum)感染香鱼(Plecoglossus altivelis)的研究中发现血清和巨噬细胞中TNF-αmRNA表达量和TNF-α蛋白表达量同步上升。本研究中白藜芦醇处理组促炎症因子TNF-αmRNA和IFN-γmRNA表达量显著下调, 表明白藜芦醇可以减弱因病原菌感染而导致的炎症反应, 从而减轻因炎症而导致的鱼体损伤。Zhang等[43]研究证明白藜芦醇可以通过抑制NF-κB信号通路中p65和IκB的磷酸化以及MAPK信号通路中p38和ERK的磷酸化, 降低LPS诱导引起的促炎性细胞因子的表达。Zheng等[44]研究发现饲料添加白藜芦醇(0.1 g/kg)能上调吉富罗非鱼肝脏组织中IL-10 mRNA等抗炎因子的表达量, 降低促炎症因子TNF-α和IFN-γmRNA的表达。
综上所述, 白藜芦醇≥32 μg/mL时, 对嗜水气单胞菌致病力具有显著抑制作用, 对受嗜水气单胞菌感染的异育银鲫有明显保护作用。白藜芦醇在预防和治疗水生动物由嗜水气单胞菌引起的细菌败血症具有重要的应用价值。

