盐酸氯苯胍在斑点叉尾体内的药代动力学及残留消除规律
余琳雪 刘永涛 丁 浩 苏志俊 艾晓辉
(1. 中国水产科学研究院长江水产研究所, 武汉 430223; 2. 上海海洋大学水产科学国家级实验教学示范中心, 上海 201306;3. 农业部水产品质量安全控制重点实验室, 北京 100125)
盐酸氯苯胍(Robenidine hydrochloride, ROBH)是一种人工合成的抗球虫药[1], 相对分子量为370.66, 分子式为C15H13Cl2N5·HCl, 属胍基衍生物[2]。在水产养殖中, 盐酸氯苯胍是我国允许使用的国标渔药, 主要用于治疗鱼类孢子虫病[3]。近年来, 由于药物残留问题带来的经济损失越来越多, 水产药物在使用过程中也不可避免会带来药物残留问题, 目前水产品渔药残留问题已经成为制约我国水产品出口的主要问题。药物使用不当或使用过量都会引起水产品药物残留问题, 水产品中的药物残留会危害水产品的质量安全, 人们长期食用这些带渔药残留的水产品会严重危害身体健康, 同时也会对自然环境造成污染, 污染水域环境, 影响水生动物的正常生长。目前, 水产品中药物残留的检测技术主要有高效液相色谱[4—6]、高效液相色谱-质谱联用技术[7,8]和免疫分析法[9,10]。通过对药物残留的检测, 可以制定药物的最高残留限量以及休药期等参数, 确保水产品的质量安全。目前, 关于盐酸氯苯胍在斑点叉尾鮰(Ictalurus punctatus)体内的药代动力学及残留消除规律的研究尚未见报道。
本试验以斑点叉尾鮰作为研究对象, 研究盐酸氯苯胍在斑点叉尾鮰体内的药代动力学及残留消除规律, 制定试验条件下药物的休药期, 保证用药安全, 旨在为水产品的质量安全问题提供理论依据,确保水产动物的食用安全性, 保障人们的生命健康。
1 材料与方法
1.1 试验鱼
斑点叉尾鮰, 平均体重(200±50) g, 购自中国水产科学研究院长江水产研究所基地, 在运至实验室后, 放置于已清洗并用高锰酸钾消毒的水族箱(122 cm×80 cm×80 cm)中暂养1周, 试验用水为充分曝气的自来水。在暂养结束后, 选择无病无伤, 规格均匀的个体, 控制水温为(28±1)℃, 自然光照, 连续24h充气; 每2天换1次水, 每次换水量1/3; 及时清除水体残饵和排泄物。
1.2 仪器与试剂
Mettler-TOLE-DOAE-240型精密电子天平(梅特勒-托利多公司)、20PR-520型高速冷冻离心机(日本日立)、调速混匀器(上海康华)、氮吹仪(AOSHENG, 杭州奥盛仪器有限公司)、高效液相色谱—串联质谱(Suryeyor MS Pump Plus, Suryeyor Autosampler Plus, Thermo TSQ Quantum Acess MAX)及Thermo LCquan 2.6 数据采集处理软件。
盐酸氯苯胍(纯度≥98%, 质量比, 德国Dr.Ehrenstorfer GmbH公司)、盐酸氯苯胍-D8标准品(纯度≥98%, 质量比, 德国Dr. Ehrenstorfer GmbH公司)、盐酸氯苯胍原料药(CAS 25875-50-7, 纯度98%, 寿光市华弛化工有限公司)。乙腈、乙酸、乙酸乙酯、正己烷、甲酸(色谱纯, 美国J.T. Baker公司)。无水乙醇(分析纯, 西陇化工股份有限公司)、蒸馏水, 可溶性淀粉(分析纯, 湘中化学试剂供应站)、无水硫酸镁(分析纯, 国药集团化学试剂有限公司)、肝素钠(生物级, 上海生化试剂有限公司)。
1.3 给药及样品采集
药代动力学试验: 盐酸氯苯按胍20 mg/kg剂量口灌斑点叉尾鮰, 分别于给药后0.5h、1h、2h、4h、6h、8h、10h、12h、24h、48h、72h、96h、120h、144h、168h自尾静脉采血样, 每个时间点采样5尾, 从尾静脉采集血液样品, 装于用肝素钠溶液润洗的离心管中, 4000 r/min离心5min, 取上清液-20℃冰箱保存备用。
残留消除规律试验: 按20 mg/kg剂量连续5d口灌给药, 分别在最后一次给药后1d、2d、3d、5d、7d、9d、12d、15d、20d、25d和30d采样, 采样方法同药代组。
1.4 样品处理
将样品在室温下解冻后, 取1 mL血浆或适量组织(肌肉2 g, 其他组织各1 g)于15 mL离心管中, 加入50 µL, 1 µg/mL内标溶液氘代盐酸氯苯胍, 加入7 mL1%甲酸乙酸乙酯溶液, 置调速混匀器上涡旋振荡30s, 超声5min, 再加入0.5 g无水硫酸镁, 涡旋振荡30s, 8000 r/min离心5min, 转移上清液至新的离心管中, 再重复上述操作提取一次, 合并2次上清液于离心管中, 置45℃氮吹仪上氮吹至干, 用1 mL定容溶液(0.1%甲酸水溶液∶甲醇=30∶70)溶解残渣,涡旋振荡30s, 12000 r/min离心5min, 0.22 µm微孔滤膜过滤后上机检测。
1.5 仪器条件
色谱柱: Symmetry®C18(100 mm×2.1 mm×3.5 μm)色谱柱; 流速为250 μL/min; 进样量20.0 μL;柱温: 30℃。
质谱条件: 采用加热电喷雾离子源(HESI), 负离子模式; 检测方式采用选择反应监测(SRM)模式;喷雾电压: -3000 V; 鞘气压力40 kPa; 辅助气压力5 kPa; 蒸发气温度: 350℃; 碰撞气及压力: 氩气,1.5 MPa; 离子传输毛细管温度: 350℃。母离子, 定性离子对, 定量离子对和碰撞能量(表 1)。

表 1 盐酸氯苯胍和氘代盐酸氯苯胍质谱条件Tab. 1 Mass spectrometry parameters of ROBH and ROBH-D8
1.6 标准曲线的制备及回收率与精密度测定
标准储备液的制备: 分别准确称取10 mg的盐酸氯苯胍标准品和氘代盐酸氯苯胍标准品, 置于100 mL的容量瓶中, 分别加少量甲醇溶解并定容至100 mL, 配制成质量浓度均为100 mg/L的盐酸氯苯胍和氘代盐酸氯苯胍标准储备液, -20℃保存备用。
标准曲线的制备: 以标准储备液为基础, 配制含氘代盐酸氯苯胍内标50 ng/mL, 盐酸氯苯胍浓度为0.01、0.05、0.2、0.5、2、5、10和20 µg/mL的标准曲线, 作HPLC-MS分析; 以测得的盐酸氯苯胍和氘代盐酸氯苯胍的峰面积比值为纵坐标, 盐酸氯苯胍的浓度为横坐标, 计算回归方程和相关系数。
回收率与精密度测定: 在空白组织中分别添加3个浓度水平的标准溶液, 使组织中盐酸氯苯胍质量浓度分别为1、10和100 ng/mL, 氘代盐酸氯苯胍的质量浓度为50 ng/mL。每个浓度的样品5个平行,计算回收率及精密度。
1.7 数据处理
标准曲线, 消除曲线方程采用Microsoft Excel 2013软件绘制, 药物动力学模型拟合及参数计算采用中国药理学会数学专业委员会编制的3p97药代动力学程序软件处理。
2 结果
2.1 标准曲线及回收率
在1—20 µg/mL浓度内盐酸氯苯胍线性关系良好, 线性方程为y=0.0107x+0.0191, 相关指数R2=0.9991。
在本试验建立的色谱条件下, 基线走动平稳,盐酸氯苯胍峰形良好, 无明显杂质峰影响。盐酸氯苯胍的出峰时间为约5.22min, 氘代盐酸氯苯胍的出峰时间约为5.21min, 样品的分析时间为9min。并通过内标法来对各时间点的组织药物含量进行测定。
2.2 盐酸氯苯胍在斑点叉尾体内各组织中的药时曲线
由图 1可见, 在各组织中的药物浓度均出现了双峰现象, 且2次的达峰时间均为8h和24h, 盐酸氯苯胍在血浆中的峰浓度值较其他组织高。
表 2 盐酸氯苯胍在斑点叉尾各组织中的平均加标回收率和精密度Tab. 2 The average recoveries and precisions for ROBH in the Ictalurus punctatus tissues (n=5)

表 2 盐酸氯苯胍在斑点叉尾各组织中的平均加标回收率和精密度Tab. 2 The average recoveries and precisions for ROBH in the Ictalurus punctatus tissues (n=5)
10 (ng/mL或μg/kg)组织Tissue 1 (ng/mL或μg/kg)100 (ng/mL或μg/kg)血浆Plasma 89.43±2.88 88.07±2.57 95.22±1.51肌肉Muscle 96.50±3.00 107.71±4.26 78.47±2.82皮肤Skin 82.71±3.31 95.89±3.38 98.69±1.92肝Liver 64.02±3.53 81.08±3.05 76.50±1.95肾Kidney 114.17±4.19 91.19±2.66 95.92±3.94鳃Gill 73.92±2.34 81.43±4.52 96.31±4.33脑Brain 81.48±0.05 82.05±1.58 79.72±0.25肠Intestines 77.75±5.35 98.26±2.64 90.27±2.62

图 1 盐酸氯苯胍在斑点叉尾组织中的药时曲线Fig. 1 The concentration-time curve of ROBH in tissues of Ictalurus punctatush (n=5)
2.3 盐酸氯苯胍在斑点叉尾组织中的药动学参数
2.4 盐酸氯苯胍在斑点叉尾体内的残留消除规律
由表 4可见, 盐酸氯苯胍在肠道中的残留量最大, 在血浆中的残留量最低。消除半衰期在各组织中的大小依次为: 肠>皮肤>肾脏>肝脏>肌肉>脑>鳃>血浆, 说明盐酸氯苯胍在肠道中消除最慢, 在血浆中消除最快。
2.5 休药期(WDT)的确定
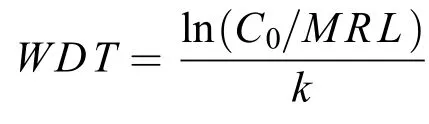
3 讨论
3.1 药时曲线的双峰现象
斑点叉尾鮰按20 mg/kg单剂量口灌盐酸氯苯胍后, 由图 1可以看出盐酸氯苯胍在斑点叉尾组织中的药-时曲线均出现了明显的双峰现象。目前, 关于口服药物药-时曲线的双峰现象报道较多[11—14],主要有以下几种解释: 肝肠循环, 指药物经胆汁排入十二指肠后, 部分药物可再经小肠上皮细胞被重新吸收返回肝脏, 从而引起双峰现象的出现; 双部位吸收, 指口服药物在胃肠两个不同部位吸收时, 有快有慢, 因而出现双峰; 胃排空, 由于胃在一定的时间会进行排空, 因而导致药物进入小肠的时间不同, 造成药物2次入血, 出现双峰。而脂溶性药物在口服吸收后, 迅速分布到组织中, 在血液中药物代谢到一定程度后, 也会出现二次释放入血, 出现双峰。此外, 双峰现象还可能与药物的分布、重吸收有关, 即当其他组织的药物浓度高于血浆药物浓度时, 药物可能会转移到血中, 引起血药浓度的再次升高[15]。
表 3 盐酸氯苯胍在斑点叉尾组织中的主要药代动力学参数Tab. 3 The pharmacokinetic parameters of ROBH in tissues of Ictalurus punctatush
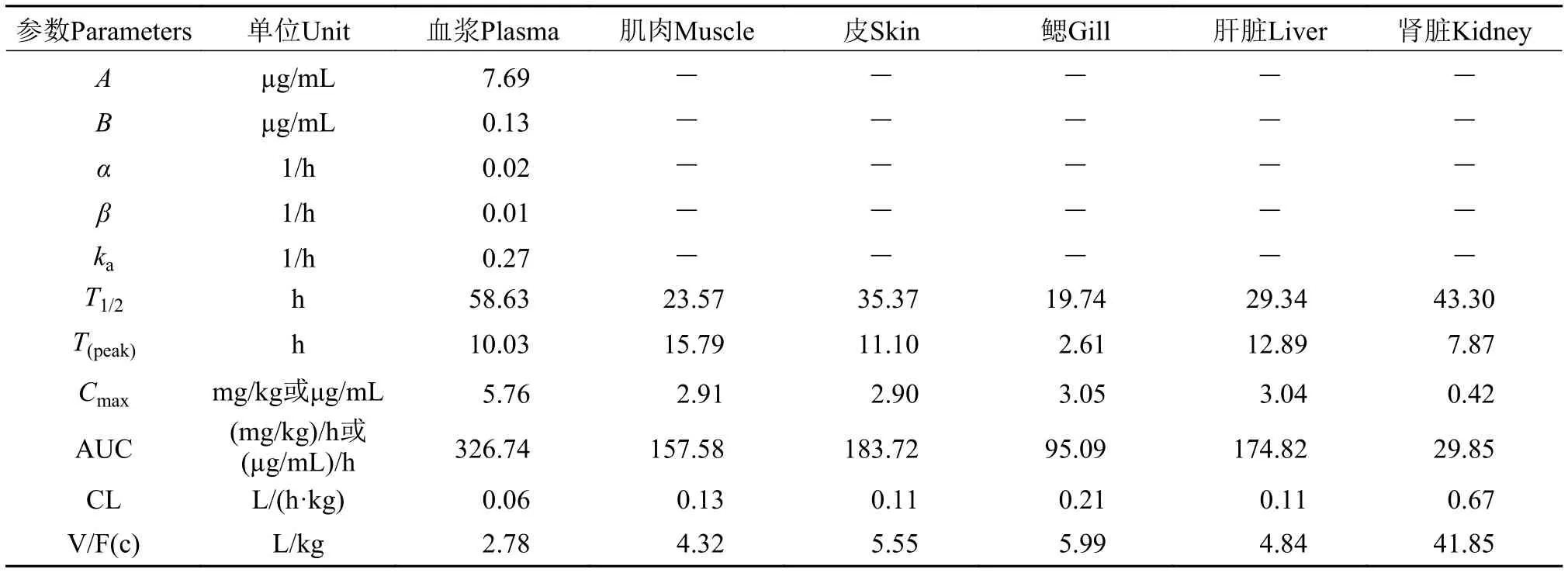
表 3 盐酸氯苯胍在斑点叉尾组织中的主要药代动力学参数Tab. 3 The pharmacokinetic parameters of ROBH in tissues of Ictalurus punctatush
注: A为分布相的零时截距; α为分布速率常数; B为消除相的零时截距; β为消除速率常数; Ka为吸收速率常数; T1/2为消除半衰期;Tpeak为达峰时间; Cmax为峰浓度; AUC为药时曲线下面积; CL为总清除率; V/F为相对表观容积Note: A. Zero intercept of distribution phase; α. Distribution rate constant; B. Zero intercept of phase elimination; β. Elimination rate constant; Ka. Absorption rate constant; T1/2. Elimination half-life; Tpeak. The time at highest peak of concentration; Cmax. The biggest concentration of the drug in plasma; AUC. Area under concentration-time curve; CL. The overall clearance rate; V/F. Apparent volume of distribution
参数Parameters 单位Unit 血浆Plasma 肌肉Muscle 皮Skin 鳃Gill 肝脏Liver 肾脏Kidney Aµg/mL 7.69 - - - - -Bµg/mL 0.13 - - - - -α 1/h 0.02 - - - - -β 1/h 0.01 - - - - -ka 1/h 0.27 - - - - -T1/2 h 58.63 23.57 35.37 19.74 29.34 43.30 T(peak) h 10.03 15.79 11.10 2.61 12.89 7.87 Cmax mg/kg或μg/mL 5.76 2.91 2.90 3.05 3.04 0.42 AUC (mg/kg)/h或(µg/mL)/h 326.74 157.58 183.72 95.09 174.82 29.85 CL L/(h·kg) 0.06 0.13 0.11 0.21 0.11 0.67 V/F(c) L/kg 2.78 4.32 5.55 5.99 4.84 41.85
表 4 斑点叉尾口灌盐酸氯苯胍后组织中的消除曲线方程及参数Tab. 4 The equation of elimination curve and parameters in tissues of Ictalurus punctatus after oral administration of ROBH

表 4 斑点叉尾口灌盐酸氯苯胍后组织中的消除曲线方程及参数Tab. 4 The equation of elimination curve and parameters in tissues of Ictalurus punctatus after oral administration of ROBH
组织Tissue消除方程Equation相关系数Correlation coefficient (R2)消除半衰期(T1/2)Elimination half-life (d)血浆Plasma C血=612.53e-0.416t 0.9387 1.66肌肉Muscle C肌肉=504.46e-0.268t 0.9233 2.58 Liver C肝=1127.6e-0.19t 0.9552 3.65肝 肾Kidney C肾=1086.1e-0.168t 0.9664 4.12皮Skin C皮=2099.6e-0.235t 0.9628 2.95鳃Gill C鳃=4149.2e-0.31t 0.9585 2.24肠Intestines C肠=15060e-0.13t 0.9562 5.33脑Brain C脑=3257.1e-0.273t 0.9537 2.54
3.2 盐酸氯苯胍在斑点叉尾体内药动学特征
将盐酸氯苯胍以20 mg/kg剂量单次口灌斑点叉尾鮰后, 通过3p97软件分析, 可知盐酸氯苯胍主要分布于斑点叉尾鮰的皮、肌肉和肝脏组织中, 药物在肾脏中驻留时间最长。汤菊芬等[16]在红笛鲷口灌盐酸氯苯胍后, 发现药物主要分布于肾脏和肝脏,在肌肉中平均驻留时间最长, 消除半衰期明显高于肾脏和肝脏; 在眼斑拟石首鱼[17]中, 盐酸氯苯胍主要分布在肾脏中, 药物在肝脏中的平均驻留时间最长, 其消除半衰期也高于肾脏和肌肉。可见药物在体内的分布情况和代谢速率与作用对象密切相关。
3.3 盐酸氯苯胍在斑点叉尾体内的残留消除规律
将盐酸氯苯胍以20 mg/kg的剂量连续口灌斑点叉尾鮰5d后, 第1天药物在肠道内的残留量远高于其他组织, 浓度高达16.44 mg/kg, 而在其他组织中的药物残留浓度依次为: C鳃>C脑>C皮肤>C肝>C肾>C血浆>C肌肉, 说明盐酸氯苯胍进入体内后, 优先分布在肠、鳃、脑、皮肤等组织。而鱼类孢子虫病主要就是寄生在这些部位中, 这就促进了药物疗效的发挥, 但由于消除速率相对较快, 不会在脑中长时间残留, 既能充分发挥药物作用, 又可降低对脑神经的损伤。其在肌肉中的残留量最低且消除速率较快, 在肠道中的消除最慢。班付国等[18]研究了鸡组织中的氯苯胍的残留消除规律, 结果显示, 氯苯胍在肌肉中的残留量最低且消除速度最快。李强[19]在对兔体内氯苯胍残留消除规律进行了研究, 结果表明, 氯苯胍在兔的肝脏中药物残留量最高, 在肌肉和肾脏中残留极少, 消除迅速, 在停喂3d后就检测不到了。这与本文的研究结果基本一致, 但盐酸氯苯胍在鮰体内的消除速率比在鸡、兔体内较为缓慢, 这可能是因为不同研究对象对药物的代谢速率不同。
3.4 盐酸氯苯胍在斑点叉尾体内的休药期
目前, 关于盐酸氯苯胍在可食动物产品中的最高残留限量在国内外都有相关的规定。我国农业部于2002年发布第235号公告, 规定氯苯胍在鸡脂肪、皮、可食组织中的最高残留限量分别为200、200和100 μg/kg[20]。2012年, 美国《联邦规章典集》中的关于盐酸氯苯胍在鸡脂肪、皮及其他可食用组织中的最高残留限量规定与我国相同[21]。加拿大规定盐酸氯苯胍在鸡、兔子、火鸡肌肉中的最大残留限量均为100 μg/kg[22]。而关于水产品中盐酸氯苯胍的最大残留限量尚无明确规定[23]。根据日本2006年实施的食品中农业化学品残留“肯定列表制度”, 要求对于未制定最大残留限量标准的农业化学品在食品中含量不得超过10 µg/kg[24]。本研究将10 µg/kg作为盐酸氯苯胍的最高残留限量, 在肌肉组织中在第12天后含量为8 µg/kg, 低于最高残留限量, 而本试验对鱼皮中药物残留量也进行了测定, 在第20天后鱼皮的浓度为9 μg/kg, 低于最高残留限量。而通过休药期公式计算可知, 理论上盐酸氯苯胍在斑点叉尾鮰肌肉中的休药期为15d, 皮肤中的休药期为23d, 肝脏中的休药期为25d,肾脏中的休药期为28d。考虑到在实际中内脏往往都会被去除, 故以可食性组织肌肉和皮肤为标准来制定休药期, 在本试验条件下, 建议盐酸氯苯胍在斑点叉尾鮰体内的休药期至少应为23d。

