氨氮降解菌的筛选、鉴定与复合菌水质调控效果研究
陈红菊 王 慧 孔维祎 许高朋 王晓云 赵 燕 季相山
(1. 山东农业大学山东省动物生物工程与疾病防治重点实验室, 泰安 271018; 2. 中国农业大学(烟台)海洋学院, 烟台 264000)
在水产养殖中, 投入水体中的饲料只有约25%的蛋白被水产动物吸收利用, 多数饲料蛋白通过粪便、残饵、分泌物等形式重新流失到水体中[1,2],造成含氮有机物在水体中累积, 当这些有机物过多,难以被天然的微生物完全分解时, 便造成了水质恶化, 从而引发水体缺氧、水生动物发病甚至死亡等一系列后果。因此, 人为地施加能高效分解残饵、粪便等有机物的微生物菌种是非常有必要的[3]。为了将大的有机物分解掉, 施加的菌株最好是复合菌,从功能上分主要包含2大类, 第一类是能将大的有机物分解为氨氮等小分子有机物的菌株; 第二类是将氨氮等进一步转化为氮气等气体的菌株。枯草芽孢杆菌(Bacillus subtilis)具有强大的产酶系统, 在其生长繁殖期间, 特别是在稳定期能够分泌大量的中性蛋白酶、碱性蛋白酶、淀粉酶、纤维素酶、植酸酶等数十种酶[4], 可将残饵、粪便等有机物分解为氨氮等小分子物质, 主要行使第一类菌的功能。为了提高枯草芽孢杆菌等分解大分子有机物的能力, 人们多从提高其酶活性方面开展相关研究,如通过紫外诱变等手段筛选和培育高产酶活性的枯草芽孢杆菌等[5,6]。蔡婉玲等[7]利用紫外诱变使菌株产蛋白酶活性提高了15.6%。本实验室前期通过紫外诱变的方法获得了能稳定遗传的高产蛋白酶活性的突变菌株B38, 其降解饲料中可溶性蛋白的能力提高了2.57倍[8]。
氨氮等进一步转化为氮气等气体的过程较为复杂, 需要经过氨氧化、硝化、反硝化等众多途径,中间会形成硝酸盐、亚硝酸盐、一氧化二氮等中间产物[9], 一般需要一个或多个菌株的共同参与才能完成。前期人们已筛选了大量的降解氨氮的菌株[9—12], 但从养殖水体和底泥中直接筛选降解氨氮菌株的报道并不多。
本研究在前期试验的基础上, 为了进一步提高水体中含氮有机物分解效果, 拟从多种水产动物的养殖池塘中筛选出高效的氨氮降解菌, 优化其培养条件, 并通过灌服试验检测其对养殖生物的安全性。再将筛选菌株与B38[8](能分解饲料蛋白的枯草芽孢杆菌)复配后制成复合菌, 通过养殖试验与4种商品微生态制剂(光合细菌、酵母菌、强效EM和芽孢杆菌)进行比较, 评价复合菌液在水质调控方面的效果, 为复合型微生态制剂的开发提供技术支撑。
1 材料与方法
1.1 试验材料
菌株: 用于筛选菌株的样品取自泰安、济宁和南宁的多处养殖池塘或自然水体(表 1), 共计82份。试验用鱼: 黄河鲤(10—12 cm)、鲢、鳙(8—10 cm)取自泰安市水产研究所。
光合细菌、酵母菌和强效EM由山东宝来利来生物工程股份有限公司惠赠; 芽孢杆菌购自广州利洋水产科技股份有限公司。
1.2 菌株的分离鉴定
菌株的筛选与评价 采集的水样不做处理,可直接作为样品液使用。对采集的泥样做以下处理: 分别称取1 g泥样加入到装有9 mL无菌生理盐水的离心管中, 30℃振荡活化30min, 静置15min后取上清液, 由此制得泥样悬浮液。采用定向富集分离法对采集的样品进行菌株富集分离[13]。将样品以1%的接种量接种到初始氨氮浓度为50 mg/L的高浓度氨氮培养基中, 进行连续6次的富集驯化培养,每次的驯化周期为3天。在驯化结束后采用平板划线法分离筛选菌株, 共筛选出9株, 划线纯化3代后置于-80 ℃冰箱保存备用。
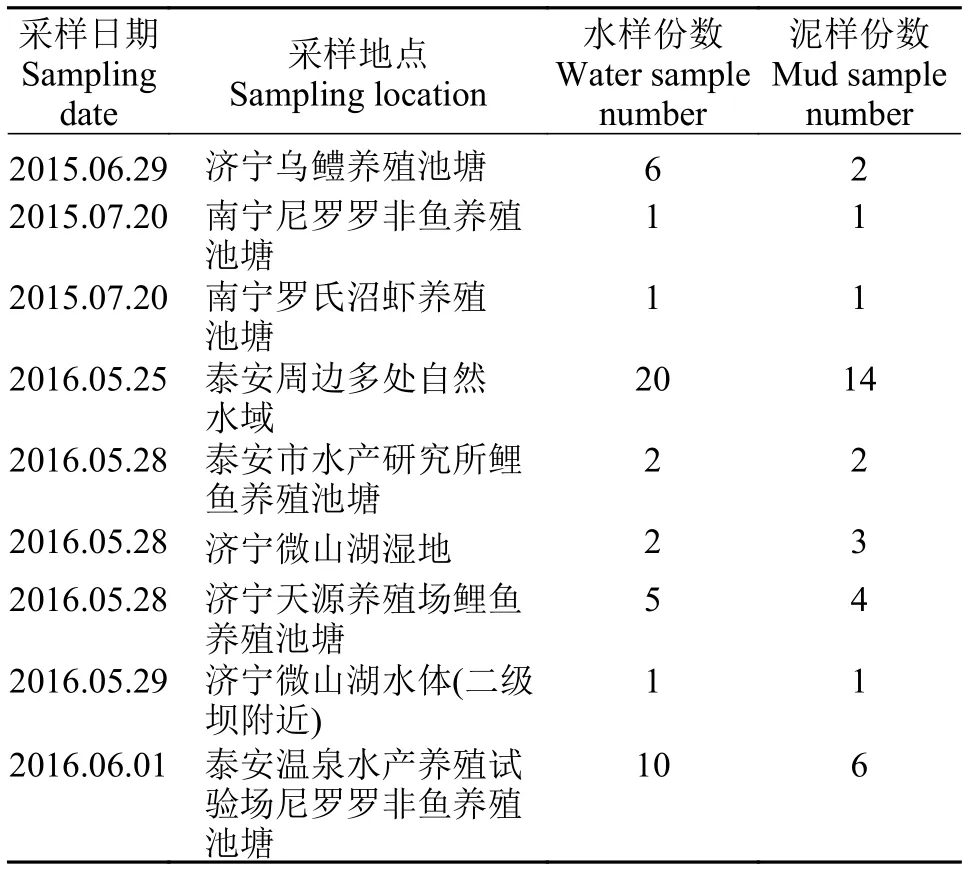
表 1 采集样品相关信息Tab. 1 Sample information
将分离得到的9株耐受基础菌株摇菌后制成A600为1的菌液, 分别接种到装有20 L水的容器中,接种量终浓度为107个/mL, 氨氮初始浓度为50 mg/L。试验用水进行曝气、充氧, 每隔24h测定水体的氨氮浓度, 测定3次。
菌株的鉴定形态学观察: 将xh1和xh7用革兰氏染色法染色后, 依照《常见细菌系统鉴定手册》[14]对细菌种类进行初步鉴定。
生理生化鉴定: API 50CHE 试验条和apiweb-API 50CHBV3.0 分析鉴定数据库(BioMérieux公司)、BioNumerics生物分析软件(Applied Maths公司)对xh1和xh7进行生理生化鉴定[15]。
以菌液为模板进行16S rDNA 部分序列的PCR扩增, 引物为: 5′-AGAGTTTGATCMTGGC TGAG-3′, 5′-TACGGYTACCTTGTTACGAGTT-3′。PCR扩增程序: 94℃预变性4min, 94℃变性30s,56℃复性45s, 72℃延伸90s, 35个循环后72℃延伸7min, 4 ℃保存。选取阳性克隆测序, 所得序列进行Blast比对, 利用MEGA5.05软件构建进化树, 对菌株进行分子鉴定。
1.3 菌株培养条件的优化
筛选得到的xh1和xh7菌株菌悬液分别接种于优化培养基, 进行单因素的条件优化, 即在优化一个条件时, 其他条件保持不变(温度30℃, C/N 15,pH7.0, 盐度0)。200 r/min振荡培养, 24h后测定菌液A600值。
温度梯度设置: 20℃、25℃、30℃、35℃、40℃。
pH设置: 6.0、6.5、7.0、7.5、8.0、8.5。
盐度梯度设置: 0、3‰、5‰、10‰、20‰、30‰。
C/N梯度设置: 2、5、10、15、20[16]。
1.4 菌株的安全性检测
选取相同养殖环境、相同日龄、体重(50±2.48) g的黄河鲤660尾, 平均分为11组, 每组3个重复。暂养一周后进行试验。第1组灌服无菌生理盐水作为对照组。第2至第6组灌服不同浓度的xh1菌液, 第7至第11组灌服不同浓度的xh7菌液, 菌液浓度分别为105、106、107、108和109cfu/mL。每尾试验鱼灌服剂量为0.5 mL, 连续灌服3d, 观察时间为14d, 相同条件饲养, 观察摄食能力及行动状态, 统计14d内的累计死亡率。
1.5 复合菌与四种商品微生态制剂对水质调控效果的评价
复合菌的配制: xh1、xh7是本研究筛选出的2个高效氨氮降解菌, B38是本实验室通过诱变筛选得到的高产蛋白酶的菌株[8]。将xh1、xh7和B38培养至109个/mL时, 离心浓缩后以1∶1∶1的比例复配成复合菌。
试验设计: 共设置5个试验组(分别泼洒复合菌、光合细菌、酵母菌、强效EM菌、芽孢杆菌)和2个对照组(不泼洒益生菌), 其中1个对照组正常投喂饲料, 另1个不投喂饲料, 所有试验组都投喂饲料。试验用益生菌在泼洒前均用梯度稀释法进行菌种计数, 菌液泼洒终浓度为107个/L。每组3个池塘重复。各组池塘中饲养鲤、鲢和鳙, 鲤放养密度为(207±7.58) g/m3, 鲢和鳙放养比例为3∶1, 放养密度为(57±3.24)g/m3, 日投饵量为鱼体重的4%—5%, 试验期间每个池塘投饵量都一致, 日投饵量120 g。试验所用池塘初始水体积为8 m3, 调节各池塘的水体初始pH为7.5, 试验水温控制在25—30 ℃。向各水体内添加NH4Cl溶液, 调节水中初始总氨氮(TAN)浓度至6 mg/L。在试验过程中, 选取不同时间点取样, 测定各项水质指标。氨氮、亚硝态氮测定的取样时间为:0(加入微生态制剂后的6h)、1d、5d、9d、11d和18d, 藻类测定的取样时间为: 0 (加入微生态制剂后的6h)、5d、9d和14d。
总氨氮的测定: 采用纳氏试剂法[17]测定。计算公式:ρ=A水样/b×25.0/V水样
亚硝态氮的测定: 采用重氮偶合分光光度法测定。
藻类数量的测定: 采用浓缩沉淀法[18]测定。
1.6 数据分析
数据均用平均值±标准差的形式表示, 用软件Excel 2016和SPSS 21.0对数据进行统计分析和显著性检验(P<0.05)。
2 结果
2.1 氨氮降解菌的筛选、培养条件优化与安全性检测
氨氮降解菌的筛选本试验共采集82份样品(表 1), 采用定向富集分离法筛选高效降解氨氮的菌株, 共筛选出9株菌株, 命名为xh1-xh9。这9株菌降氨氮效果评价试验显示, 24h时xh1和xh7两株菌对氨氮的降解率均达到90%以上。72h时xh1与xh7菌株的降解率分别达97.8%和98.5%。二者在各个时间点对氨氮的降解率均显著高于其他菌株(表 2)。
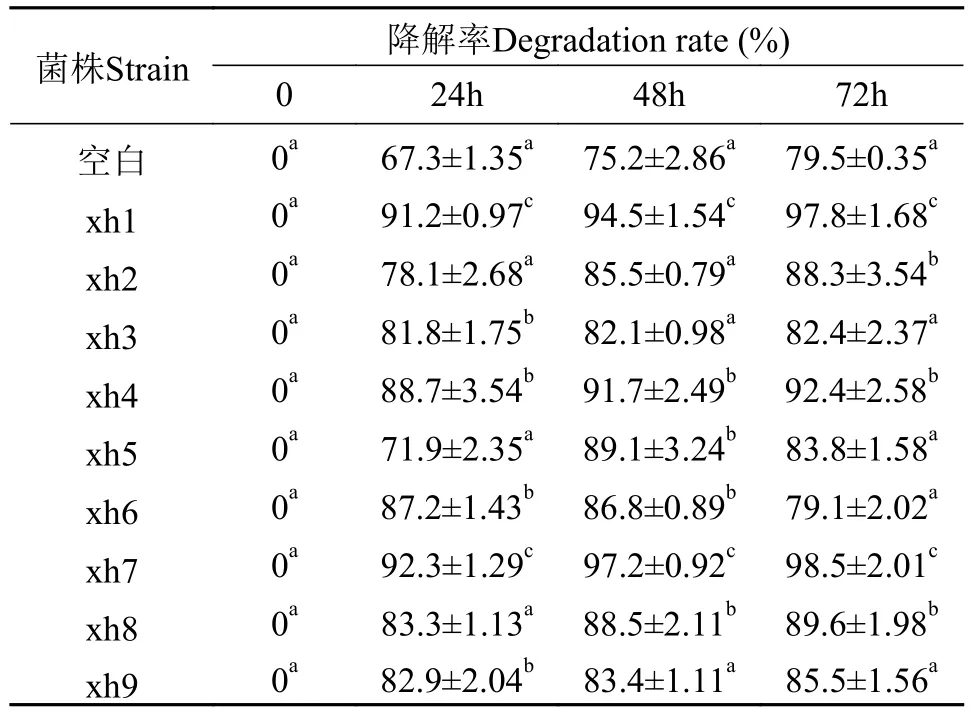
表 2 筛选菌株氨氮降解率结果Tab. 2 Results of ammonia nitrogen degradation rate
菌株的鉴定结果显微镜观察发现, 2个菌株胞体均呈杆状, 能形成芽孢, 无鞭毛, 两端钝圆,单个或少数呈短链状。经革兰氏染色均呈阳性。依据《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》将其初步鉴定为芽胞杆菌属。
将培养好的菌液接种于API50 CH 芽孢杆菌鉴定试剂条, 得出该菌株的生理生化反应谱。经计算机软件鉴定, xh1、xh7与凝结芽孢杆菌(Bacillus coagulans)的相似度分别为99.6%与96.9%。
从筛选菌株基因组扩增到长度约1500 bp的16S rDNA序列, 在NCBI中BLAST比对结果显示,xh1与xh7序列与凝结芽孢杆菌的相似性在99%以上。选取芽孢杆菌属中的9株菌株序列信息, 与筛选菌株进行序列分析, 以非典型弧菌(Vibrio atypicus, 登录号: JX867739)作为外类群构建系统发育树。结果显示, xh1、xh7与凝结芽孢杆菌(登录号:NR_041523.1)聚为一类, 说明筛选菌株与凝结芽孢杆菌的亲缘关系最近(图 1)。
菌株培养条件的优化菌株培养条件优化试验显示, xh1和xh7两株菌受pH的影响不大, 在微酸性、中性和微碱性环境下均能生长良好。其中,xh1菌株的最适pH为7.5, xh7菌株的最适pH为7.0(图 2A)。
在温度低于35℃时, 测得2株菌的A600随温度的升高而增大, 最适温度应该在35—40℃左右; 而温度达到45℃时, xh7菌株生长稍受影响, xh1菌株的生长状况良好, 说明xh1菌株耐高温能力较xh7强(图 2B)。
在低盐度环境下, xh1菌株的生长情况良好, 盐度为10‰时生长情况最佳; 盐度高至30‰时, 2株菌的生长均受到一定程度的影响,A600值降至2以下。xh7菌株受盐度变化的影响不大, 始终保持在A600值为2左右(图 2C)。总体看来, 在一定范围内, 盐度对复合菌的生长情况影响不大。
随着C/N的升高, xh1与xh7两株菌A600值均升高, C/N为15时两株菌生长状况最好, C/N为20时xh7菌株生长稍受影响, 而xh1菌株依旧生长良好(图 2D)。
菌株安全性检测在各个菌液灌服浓度下,黄河鲤的摄食能力和行动状态均正常, 均未出现死亡现象, 与灌服生理盐水的对照组无差异(表 3)。结果表明菌液是安全的, 可以用于生产实践。
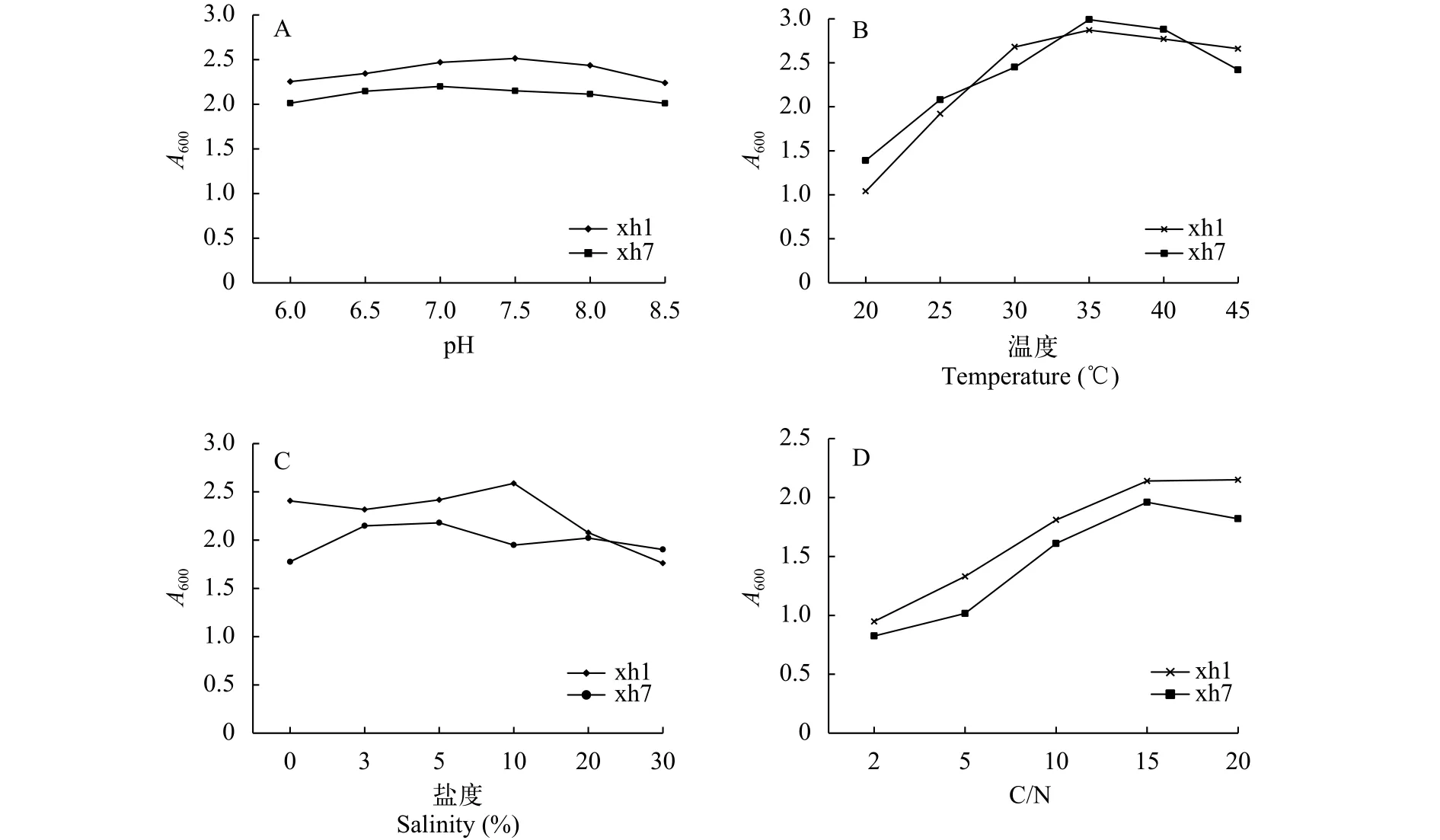
图 2 菌株培养条件的优化Fig. 2 Optimization of strain culture conditionsA. 不同pH对两株菌生长情况的影响; B. 不同温度对两株菌生长情况的影响; C. 不同盐度对两株菌生长情况的影响; D. 不同C/N对两株菌生长情况的影响A. Effects of different pH values on the growth of two strains of bacteria; B. Effects of different temperatures on the growth of two strains of bacteria; C. Effects of different salinities on the growth of two strains of bacteria; D. Effects of different C/N on the growth of two strains bacteria
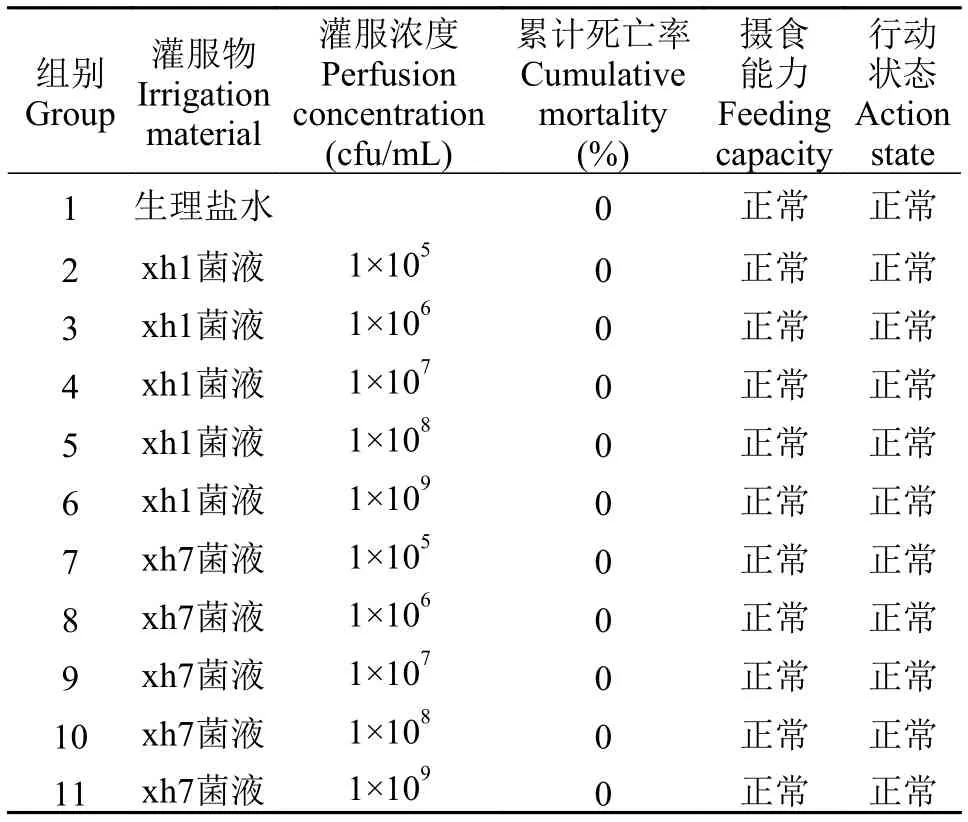
表 3 筛选菌株的安全性检测Tab. 3 Safety test of screening bacteria
2.2 复合菌对水质调控效果的评价
复合菌与四种商品微生态制剂对养殖水体氨氮含量的影响添加复合菌的池塘在第1天和第5天, 氨氮含量显著低于其他4种微生态制剂组和对照组, 说明复合菌能快速有效地降解养殖水体中的氨氮; 随着时间的延长, 在第9天, 复合菌组和强效EM菌组、芽孢杆菌组氨氮含量差异不显著, 明显低于2个对照组和光合细菌组、酵母菌组; 第11天和第18天, 复合菌组和光合细菌组氨氮含量差异不显著, 明显低于其他5组。总体来说, 从试验第1天开始, 复合菌组的氨氮含量逐渐降低, 第11天以后,含量低于1 mg/L; 并且相较于其他各组, 复合菌组的氨氮含量一直处于最低水平。结果说明, 添加复合菌的试验组降解氨氮效果快速并且持续性较好(图 3)。
复合菌与四种商品微生态制剂对养殖水体亚硝酸盐含量的影响试验5d后各组的亚硝酸盐含量均有所升高; 复合菌组与酵母菌组亚硝酸盐含量呈现一种先升后降的趋势, 并且在各个时间点,与对照组差异不显著; 添加强效EM菌和芽孢杆菌的两组在各个时间点亚硝酸盐含量相对较高, 9d和11d时含量均高达5 mg/L (图 4)。
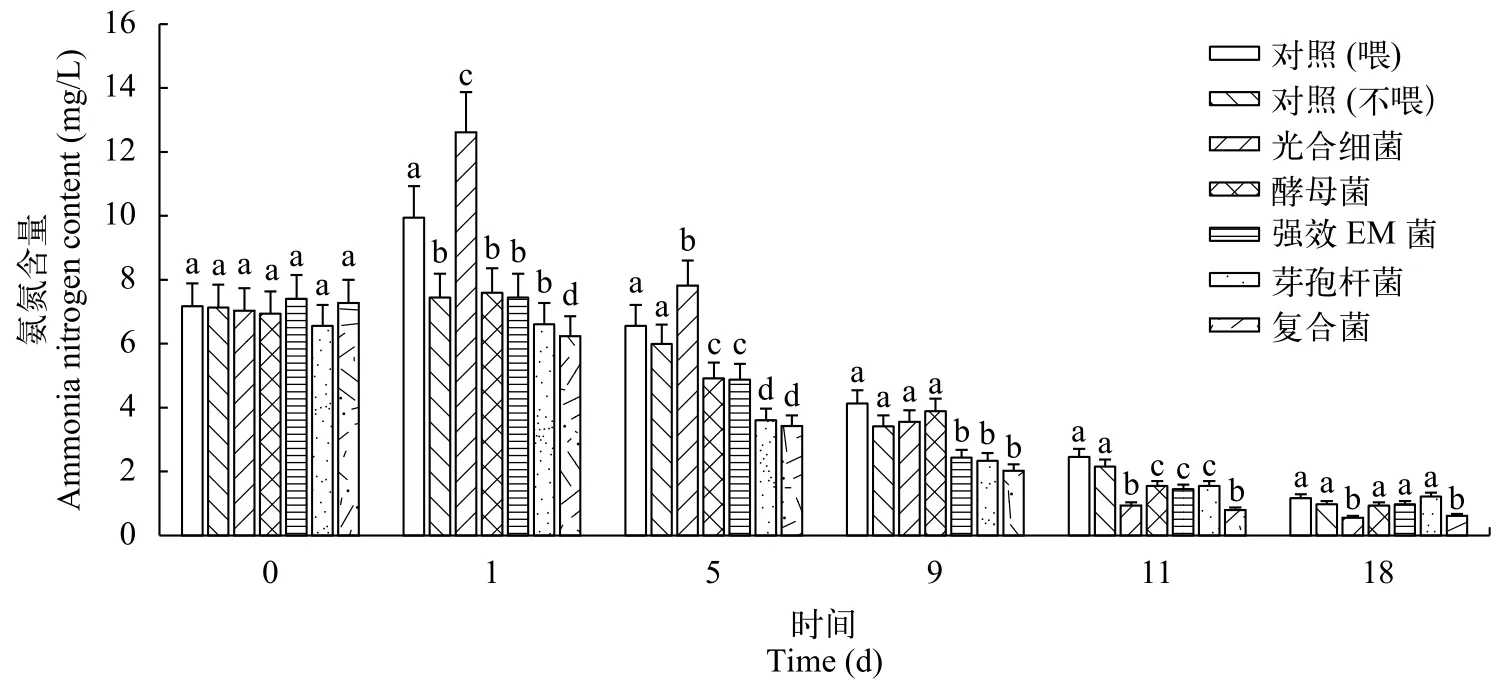
图 3 五种微生态制剂对养殖水体氨氮的影响Fig. 3 Effects of five probiotics on ammonia nitrogen in aquaculture water同列数据肩标不同小写字母差异显著(P<0.05); 下同Mean values in the same column with different superscripts were significant different (P<0.05); the same applies below
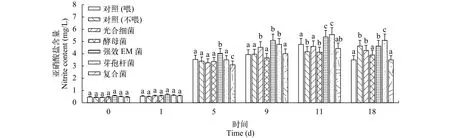
图 4 五种微生态制剂对养殖水体亚硝酸盐的影响Fig. 4 Effects of five probiotics on nitrite in aquaculture water
复合菌与四种商品微生态制剂对养殖水体藻类数量的影响从第9天开始, 添加复合菌与芽孢杆菌组藻类数量高于其他各组, 达到7万个/mL左右; 在第14天, 复合菌与芽孢杆菌组藻类数量显著高于其他各组, 分别达到8万个/mL和9万个/mL左右, 大约为其他组的两倍, 说明二者能促进藻类的增殖(图 5)。从第5天开始, 光合细菌组藻类数量明显低于其他试验组及对照组, 差异显著; 第14天, 光和细菌组藻类数量与复合菌、芽孢杆菌组差异极显著。
3 讨论
3.1 氨氮降解菌的筛选与培养条件的优化
本试验用富集分离法筛选得到两株高效降氨氮的菌株均为芽孢杆菌属(Bacillus)的凝结芽孢杆菌(Bacillus coagulans), 对氨氮降解率分别达到97.8%和98.5%。这与前人研究结果一致, 郭静等[19]从养殖水体中筛选出的凝结芽孢杆菌, 对氨氮和亚硝酸盐氮的去除率分别达80.1%和91.2%, 具有较好的水质净化作用[19]。宋增福等[10]从对虾养殖池塘中筛选出的凝结芽孢杆菌, 能够在14h内将亚硝酸盐氮由10 mg/L降至0[10]。周文喆等[9]从河边污泥中富集分离得到了一株降解氨氮的优势菌株, 鉴定为芽胞杆菌属, 在24h内可达到79.70%的降解率[9]。此外, 肠杆菌(Enterobactersp.)[11]、戈登氏菌(Gordonia)、红球菌(Rhodococcus)[12]、溶杆菌(Lysobacter)、假单胞菌(Pseudomonas)[20,21]、产碱杆菌(Alcaligenes)[22]、反硝化细菌(Denitrificans)[23]等菌株被筛选出来, 均可不同程度地降解氨氮。
氨氮是养殖水体富营养化和水生动物疾病的重要原因[24,25], 筛选水样或泥样中能高效降解氨氮的细菌, 并加以优化培养再用于调控水质是现在的主要研究方向。目前, 常用的筛选方法主要有3种:传统培养法、指示剂法和改变培养条件法。胡君利等[26]比较了氨氮降解菌的筛选方法, 结果证明通过传统培养法筛选往往无法得到目的菌株。也有研究通过在培养基中添加指示剂, 来推测目的菌株的存在[27]。改变培养条件法是现在常用的一种方法, 即根据所要筛选的菌株生长特性, 设计、优化一种或多种因素, 使目的菌株成为培养基中的优势菌株, 从而迅速筛选出来。对于氨氮降解菌来说,温度、溶氧、pH、氨氮浓度等条件的优化都有可能使氨氮降解菌成为混合培养物中的优势菌株, 从而更易被分离。本研究即是在培养基中添加NH4Cl作为唯一氮源进行筛选得到了高效降解氨氮的菌株。
对筛选出的2株凝结芽孢杆菌培养条件优化结果表明, 2菌株受pH变化影响不大, pH6.0—8.5时,A600值始终保持在2左右; 最适温度应该在35—40℃左右; 在一定范围内(盐度低于30‰), 盐度对复合菌的生长情况影响不大; C/N为15时两株菌生长状况最好, C/N为20时xh1菌株依旧生长良好。结果说明, 筛选到的两株凝结芽孢杆菌pH、C/N适应范围广, 并且耐高温、高盐。王彦波等[28]也认为筛选自南美白对虾养殖池塘的凝结芽孢杆菌对温度、pH和盐度具有广泛的适应性[28]。这些优点都有利于凝结芽孢杆菌在生产上推广应用。
3.2 复合菌对水质的调控
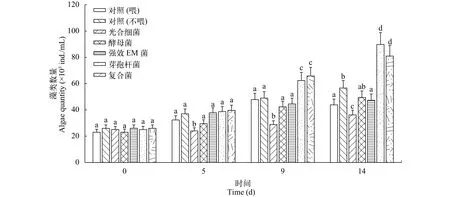
图 5 五种微生态制剂对养殖水体藻类的影响Fig. 5 Effects of five kinds of probiotics on algae in aquaculture water
将筛选出的菌株泼洒于水体中对水质进行调控, 是益生菌的应用之一, 也是本研究筛选菌株的目的之一。在泼洒到水体之前, 通过灌服试验检测了所筛选出的2株凝结芽孢杆菌对养殖动物的安全性。灌服菌液浓度1×105—1×109的凝结芽孢杆菌,14d内黄河鲤摄食能力和行动状态均正常, 均未出现死亡现象, 与灌服生理盐水的对照组无差异, 表明菌液是安全的。
以前的研究已证明, 单一菌种微生物在控制、净化水质方面都有一定的局限性[29—31], 因此在实际生产中, 往往使用2种或2种以上的有益菌共同发挥作用。本研究将前期筛选的枯草芽孢杆菌与本文筛选的凝结芽孢杆菌配制成复合菌, 用来调控养殖水体的水质。将这2种芽孢杆菌联合使用, 枯草芽孢杆菌首先将残饵、粪便等分解为氨氮等小分子物质, 凝结芽孢杆菌再进一步将氨氮等分解为硝酸盐等无机物, 以此来调控养殖水体的水质。本试验结果显示复合菌具有良好的降氨氮特性, 从试验第1天开始, 复合菌组的氨氮含量逐渐降低, 第11天以后, 含量低于1 mg/L; 并且相较于其他各组, 复合菌组的氨氮含量一直处于最低水平, 说明复合菌降解氨氮效果快速并且持续性较好。在氨氮含量下降的同时, 亚硝酸盐含量有上升的趋势, 试验5d后各组的亚硝酸盐含量均有所升高, 可能是氨氮氧化成亚硝酸盐所造成的。并且复合菌组与酵母菌组亚硝酸盐含量呈现一种先升后降的趋势, 在试验的第18天含量明显降低, 说明添加的复合菌有一定的降亚硝酸盐效果, 但比较缓慢。在后续复合菌研制试验中, 应添加硝化或反硝化细菌, 以尽快降低亚硝酸盐含量。
3.3 复合菌对藻类数量的影响
本文发现, 从第9天开始添加复合菌与芽孢杆菌组藻类数量高于其他各组, 达到7万个/mL左右;在第14天, 复合菌与芽孢杆菌组藻类数量显著高于其他各组, 分别达到8和9万个/mL左右, 大约为其他组的2倍, 说明添加复合菌与芽孢杆菌对藻类数量的增加效果显著(图 5)。其原因是由于藻类与细菌之间的互利共生关系, 藻类是生活在水体中的的光合自养型生物, 通过光合作用将二氧化碳转换为有机物, 为异养生物(如细菌)提供营养物质, 并产生氧气提供给需氧细菌, 然后细菌分解有机物使之转化成藻类生长的养分无机盐类, 如: 硝酸盐、磷酸盐、硫酸盐等, 并释放二氧化碳, 以供藻类光合作用[32,33]。富丽静等[34]将以芽孢杆菌为主体的复合微生态制剂泼洒到养殖水体中, 发现可促进单细胞藻类硅藻、裸藻生长使其成为优势菌群。林东年等[35]认为在罗非鱼池中投放芽孢杆菌复合制剂可使绿藻保持优势地位。石洪玥等[36]证明向池塘中泼洒高效微生态制剂, 对养鱼池塘中优势藻类蓝藻的繁殖有明显的抑制作用, 对绿藻和硅藻的繁殖有明显的促进作用。张庆等[37]研究发现在养殖环境中添加芽孢杆菌制剂可增加硅藻数量。以上研究表明芽孢杆菌可促进硅藻等单细胞藻类的生长, 单细胞藻类通过光合作用可为养殖水环境提供氧气,供水生动植物等使用, 如此反复形成一个良性循环。
光合细菌具有抑藻作用已是大家的共识, 本研究也发现从第5天开始, 泼洒光合细菌组藻类数量明显低于其他试验组及对照组, 差异显著; 第14天,光和细菌组藻类数量与复合菌、芽孢杆菌组差异极显著。这与陈小晨等[38]研究结果一致。

