高级别宫颈鳞状上皮内病变患者宫颈锥切术后高危型人乳头瘤病毒持续感染的相关因素分析*
周佳怡,张跃明,何静,吴蕾,姜飞洲,侯文杰
215006江苏 苏州,苏州大学附属第一医院 妇产科(周佳怡、何静);215000江苏 苏州,苏州大学医学中心(苏州大学附属第一医院独墅湖院区) 妇产科(张跃明、姜飞洲、侯文杰);215000江苏 苏州,苏州工业园区疾病防治中心(吴蕾)
WHO将宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)分为低级别宫颈鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)和高级别宫颈鳞状上皮内病变(high-grade squamous intraepithelial lession,HSIL)[1-2],其中LSIL相当于原三级分类中的CIN I,而HSIL相当于原三级分类中的CIN II和CIN III。其中CIN I和CIN II又称为轻度及中度不典型增生,而CIN III包括重度不典型增生和原位癌。研究表明1%~20%的不典型增生和65%的重度不典型增生发展为原位癌[3]。美国阴道镜及宫颈病理学会(American Society for Colposcopy and Cervical Pathology,ASCCP)推荐HSIL患者应接受进一步治疗[4]。宫颈锥切术是一种被广泛采纳用来治疗HSIL的手术方式,主要方式有子宫颈冷刀锥切术(cold knife conization,CKC)、子宫颈环形电切术(loop electrosurgical excision procedure,LEEP)和激光锥切术,目前国内普遍应用的是CKC和LEEP两种手术方式[5]。
现已明确高危型人乳头瘤病毒持续感染是引起CIN及宫颈癌的主要因素[6]。目前按致病力大小,将HPV分为高危型和低危型。高危型主要与宫颈癌、外生殖器癌相关,包含16、18、31、33等亚型;而低危型主要导致外生殖器和皮肤疣状改变,以6、11型为代表。已有报道称:宫颈病变患者在行宫颈锥切术后HSIL复发的风险为5%~25%,术后患者行HPV检测对于预后判断存在价值[7]。目前国内外关于HPV病毒清除对术后患者影响的研究较少,本研究拟通过对行宫颈锥切术的HSIL患者临床资料进行回顾性分析,研究以高危型HPV(high-risk human papillomavirus,HR-HPV)持续感染为代表的多因素与疾病的相关性,从而更有效地指导临床治疗。
1 材料和方法
1.1 一般资料
选取我院宫颈门诊的2017年1月至2019年1月两年间就诊的278例高级别HSIL的女性患者为研究对象,年龄为25~58岁,平均(42.85±12.47)岁,所有研究对象均于我院门诊手术室行宫颈LEEP手术或住院行CKC,患者术前行宫颈液基薄层细胞学检测(Thinprep Cytology Test,TCT)及HPV分型定量检测(荧光定量PCR法),以电子阴道镜检查并以活检病理学结果为诊断依据。术后病理证实为CINⅡ~Ⅲ级且切缘组织均为阴性者进行定期随访,观察其术后3个月、6个月、12个月和24个月HPV检测结果,并记录患者年龄、产次、病变程度、病变累及象限、HPV分型以及锥切方式等相关信息,分析影响HSIL患者宫颈锥切后HPV持续感染的相关影响因素。
1.2 宫颈LEEP术或CKC
具体术式选择标准为:采用随机分组对患者进行LEEP手术或者CKC,但对于特殊病例如CIN III或者HSIL;鳞柱交界区界限不清;病变超出阴道镜检查范围;宫颈管搔刮术为CIN II+等患者进行CKC锥切;CIN II级患者统一以P16染色进行分流,P16阴性者处理意见同CIN I,而阳性则按照CIN III级治疗方案[2]。
1.2.1 LEEP 术前嘱患者取膀胱截石位,常规消毒铺巾,麻醉满意后,术者常规消毒手臂,穿衣戴手套准备手术,用阴道窥器充分暴露宫颈;用无菌生理盐水或苯扎溴铵棉球轻轻拭去宫颈表面分泌物,使其宫颈表面无粘液,便于进一步观察及染色。再行醋酸白试验和碘染试验确定病变范围。根据宫颈大小,选用合适标准的电刀,在距碘不着色范围外3~5 mm处进行环形切除,切除宽度一般在病灶外5 mm,深度根据病灶范围而定,通常为15~25 mm,病变局限于宫颈表面者行宽而浅的锥切,累及颈管者行狭而深的锥切。切除组织送病理检测,由我院病理科医生检测诊断。
1.2.2 CKC 准备经过同LEEP,用allis钳夹宫颈3,6,9,12点位置,抓持相邻两把Allis钳,自病灶外侧0.5 cm处按30~50°角向内侧做锥形切除,一般手术范围较LEEP大,深度可达2~3 cm。对怀疑微小浸润癌、原位癌,要求切除宽度>2.5 cm,深度要求>3 cm时的首选方案。
1.3 纳入标准和排除标准
纳入标准:1)临床资料齐全,完成24个月随访,完成术前,以及术后3、6、9、12及24个月时HPV病毒载量(HC2-HPV法)监测者;2)对本研究知情且签署知情同意书者;3)首次接受治疗者;4)性生活史超过1年者;5)病理诊断为HSIL(CINⅡ~Ⅲ)且切缘组织为阴性的患者。排除标准:1)一般资料不齐全,未能完成相关检查者;2)妊娠期及哺乳期妇女;3)妇科良性肿瘤且切除子宫者;4)宫颈浸润癌患者;5)宫颈锥切术后切缘阳性的患者
1.4 统计学方法

2 结 果
2.1 高级别宫颈鳞状上皮内病变患者术后HPV持续感染的单因素分析
在术后278例患者随访过程中,术后3个月HPV持续感染患者152例(54.68%),术后6个月HPV持续感染患者127例(45.68%),术后12个月HPV持续感染患者69例(24.82%),术后24个月HPV持续感染患者67例(24.10%),24个月内所有患者TCT结果均为正常。单因素分析结果显示不同年龄,分娩次数的患者宫颈锥切术后HPV持续感染情况无显著差异(P>0.1), 术前不同病理分级,术前病变累及象限,高危型HPV病毒载量,不同亚型HPV病毒感染以及不同手术方式的患者宫颈锥切术后HPV持续感染情况存在显著差异(P<0.1)。具体结果见表1。
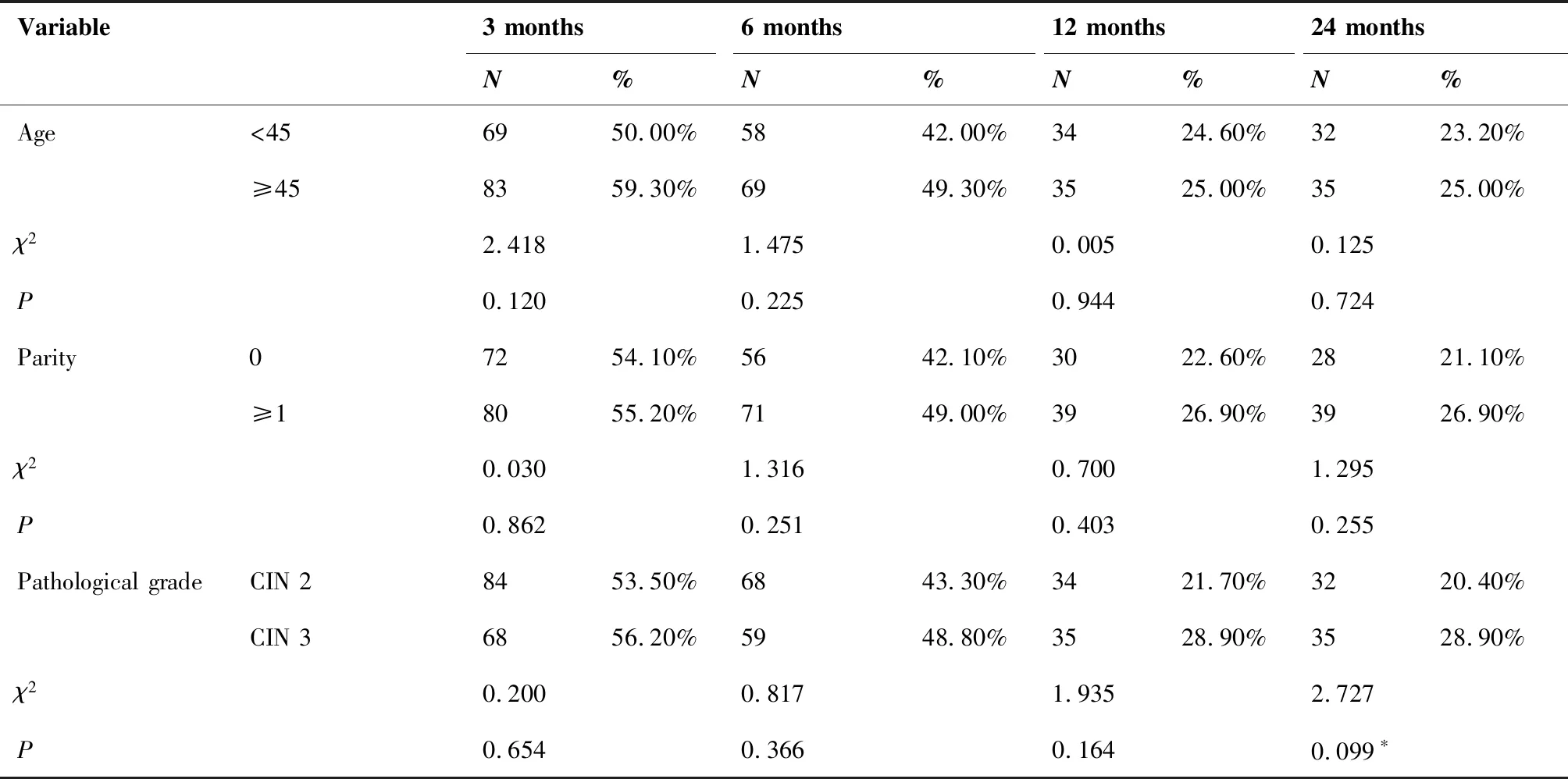
表1 术后HPV持续感染患者的单因素分析
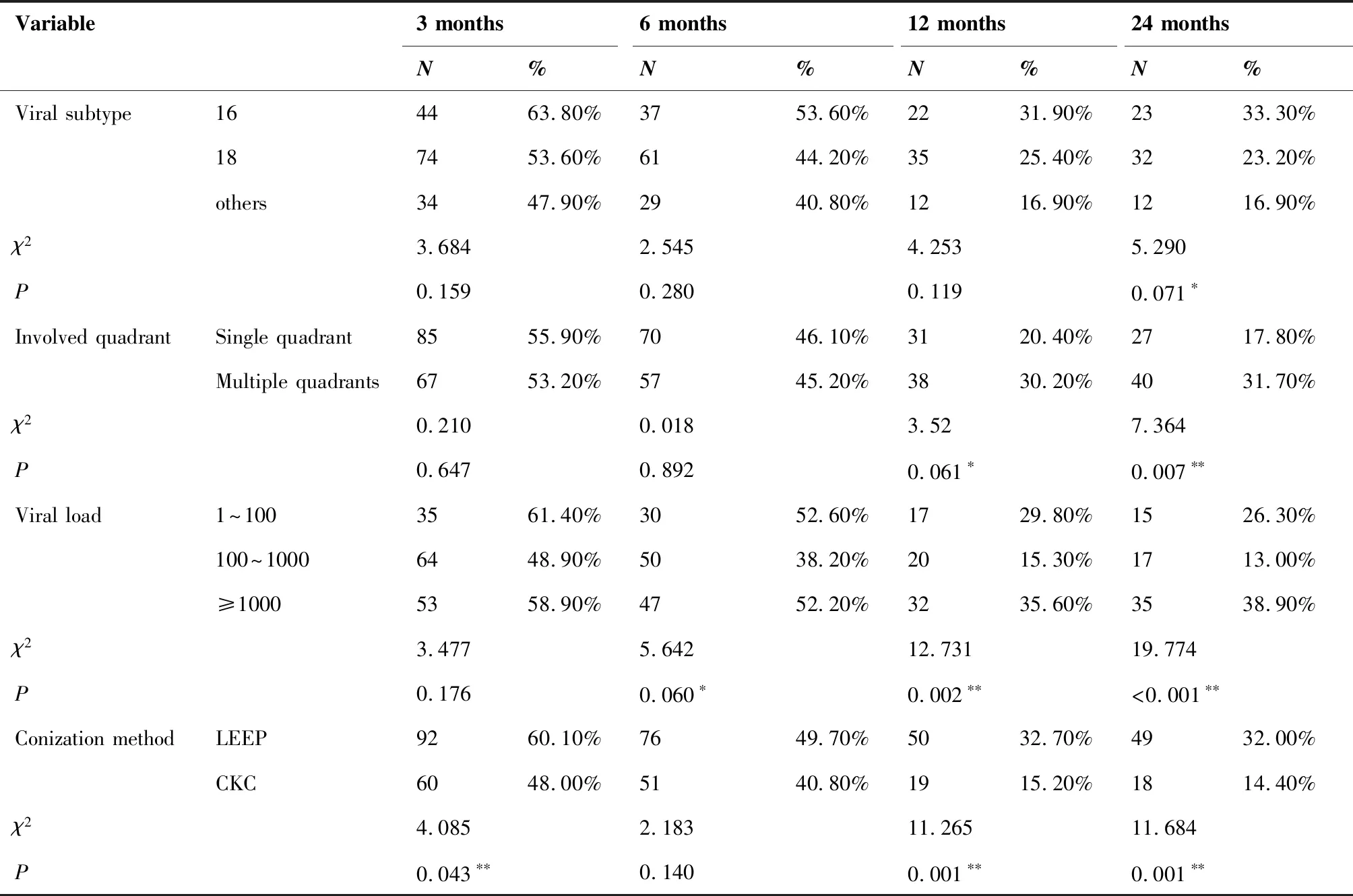
(Table 1 continues on next page)
2.2 高级别宫颈鳞状上皮内病变患者术后HPV持续感染及清除情况的多因素非条件Logistic回归分析
以HSIL患者术后HPV持续感染为因变量,病理分级、累及象限、病毒载量、病毒亚型以及手术方式为自变量,进行多因素非条件Logistic 逐步回归分析(引入水准为0.05,排除水准为0.10),结果显示,病毒载量(OR=1.532,P=0.045)和累及象限数(OR=1.992,P=0.021)和锥切方式(OR=0.400,P=0.004)为HSIL患者术后HPV持续感染的影响因素(表2)。

表2 患者宫颈锥切术后24个月HPV持续感染的多因素非条件Logistic回归分析
3 讨 论
HSIL患者锥切术后高危型HPV的转阴时间以及影响转阴的相关因素仍缺乏定论,有研究显示[8]高危型HPV可以通过隐匿感染的形式重新侵入残端上皮,造成术后HPV的持续感染。本研究中HSIL患者术后24个月持续感染率为24.10%(67/278),对于术后高危型HPV消退较慢或持续感染的患者,需要警惕发生持续感染、病变复发及阴道病变的可能。因此,寻找和发现HSIL患者术后HPV持续感染的影响因素并进行干预就显得十分重要,可以有效地为患者制定规范的随访策略,从而最大限度地防止术后病变复发和进展。
本研究发现HSIL患者病毒载量与术后HPV持续感染相关,病毒载量1 000 copies/mL以上的患者术后24个月高危型HPV持续感染率显著高于其他患者(P<0.001)。Logistic回归分析中显示病毒载量越高术后HPV持续感染风险明显增加(OR=1.532,P=0.045)。对于病毒载量,目前学术界观点不一,有学者[9]认为HPV病毒载量与宫颈癌及宫颈癌前病变呈正相关,病毒载量越高,高危型HPV整合到宿主细胞的机会越多,患者宫颈病变越严重,高危型HPV载量与子宫颈病变的程度之间明显相关,这也提示高危型HPV载量是一个有效的分流标志物[10];也有文献报道[11]高危型HPV病毒载量与宫颈病变程度无显著关联,宫颈病变程度越重,肿瘤细胞增殖、凋亡、坏死速度增加导致HPV的丢失增加。有研究[12]认为高危人乳头瘤病毒载量≥1000 copies/mL较载量<100 copies/mL的复发风险更大。因此,对于HSIL患者来说,术前高病毒载量术后高危型HPV持续感染风险增大,术后更加应密切随访,谨防病变复发。
此外,本研究发现术前病变累及象限数与术后HPV的持续感染显著相关,logistic回归分析显示多象限累及的患者术后HPV感染的阳性率明显高于单象限累及的患者(OR=1.992,P=0.021)。有研究[13]显示宫颈CIN2和CIN3的病变更常发生于宫颈较后的第2、3象限以及12点方向,CIN2病变在4点和7点方向发生率更高,但有关病变的定位机制目前还尚无定论[14]。我们推测当出现病变多象限累及时,由于性交时宫颈多个病变部位的机械性损伤、阴道前后穹隆血流减少以及液体淤积较单象限病变更严重、解剖隐窝的鳞状上皮脱落导致HPV的清除率降低。另有文献报道[15]多种亚型HPV感染时更易累及多象限病变,且HPV18、45感染与宫颈癌前病变有关但前期病变不易在阴道镜下发现,手术过程中无法完全切除感染部位使术后更易发生持续性感染,因此我们建议在做阴道镜时行多点活检避免遗漏。
宫颈锥切作为治疗CIN的标准术式,具有独特的临床应用价值。然而关于宫颈锥切方式的选择,一直颇受争议[16],传统的CKC虽然能保证足够的切除范围和清晰的切缘,但感染、术中、术后出血及宫颈机能不全的发生率均较高[17]。1989年,Prendiville等提出了LEEP,此法因其简单易行、疗效满意和并发症少被临床广泛应用[18],但有学者对其切除范围提出质疑[19]。在本研究中,我们发现采用CKC的患者术后24个月HPV持续感染率显著低于采用LEEP的患者(χ2=11.684,P=0.001),并且Logistic回归分析提示采用CKC的患者术后HPV持续感染风险明显降低(OR=0.400,P=0.004)。这可能是由于CKC切除病灶更加彻底,同时切除了更多的宫颈表面黏膜及宫颈管腺体,使宫颈黏液减少,改善局部免疫防御系统,降低病毒持续感染可能;反之,LEEP术中使用的钨丝电切环经高温( 650~800℃) 绕制而成[20],这使其弯曲时韧性增加,加之电环横截面直径仅为0.1~0.3 mm,当其接触病变部位时,组织本身产生阻抗。热损伤组织粘附于电环上,使得环移动阻力逐渐增大,同时发生肉眼不易觉察的弯曲变形,使锥切标本越往后锥高越小,造成LEEP切割深度不够,从而导致LEEP锥切术后HPV持续感染率升高。
综上所述, HPV病毒载量,术前病变累及象限和锥切方式是HSIL患者宫颈锥切术后HPV持续感染的主要影响因素,术前对HSIL患者充分评估,警惕高危因素,遵循个体化原则,制定合理、规范、针对性的治疗方案对术后降低HPV持续感染和防止病变复发具有重要的临床价值和意义。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

