子宫颈胃型腺癌11例临床分析*
王登凤,张国楠,石宇,樊英,周凤智,宋水勤,余健,徐世强,刘红
610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院附属肿瘤医院 妇科肿瘤中心
子宫颈胃型腺癌(gastric-type endocervical adenocarcinoma,G-EAC),2007年由日本学者Kojima等[1]首次提出,具有类似幽门腺上皮的形态学特征,以表达胃型黏液为特点。在2014版《WHO女性生殖器官肿瘤学分类》中,G-EAC是作为子宫颈黏液腺癌的一种特殊类型,也是预后最差的一种类型,罕见,仅占子宫颈腺癌的l0%[2]。子宫颈微偏腺癌即是高分化的G-EAC[3]。与最常见的子宫颈腺癌类型——普通型子宫颈腺癌(usual-type endocervical adenocarcinomas,UEA)不同,G-EAC与高危型人乳头瘤病毒(human papillomavirus,HPV)感染无关,临床表现不特异,病灶隐匿致取材受限,加之病理的形态特征与良性病变相似,给确诊带来了极大挑战,术前诊断率低,易被漏诊、误诊,从而延误治疗,严重影响患者预后[4]。本文收集了我院近7年余收治的G-EAC患者,总结其临床病理表现、治疗与预后随访情况,以期寻找相关的临床病理特征,为提高对该病的认识与诊治水平带来帮助。
1 资料与方法
1.1 临床资料
纳入我院2013年1月1日至2021年2月10日期间收治的、并经我院或其他三级甲等医院病理确诊的G-EAC患者,收集其年龄、孕产次、身高、体重、临床表现、体征、国际妇产科联盟(Federation International of Gynecology and Obstetrics,FIGO)2018分期、辅助检查、病理检查、手术情况及放化疗情况等资料。HPV检测采用凯杰公司(QIAGEN)高危型HPV核酸检测试剂盒(杂交捕获二代法)。
1.2 预后随访
对所有患者和/或其家属进行了电话随访,随访终点为2021年2月11日。从确诊时间开始至患者死亡时或随访终点时(存活者)为总生存时间(overall survival,OS),从治疗结束时至肿瘤复发时或随访终点时(未复发者)为无进展生存时间(progression free survival,PFS)。
2 结 果
2.1 患者的临床特征
共11例G-EAC患者,中位年龄50岁(范围38~69岁),其中6例(54.55%)为绝经后女性;Ⅰ期(9.09%)1例,Ⅱ期(27.27%)3例,Ⅲ期(18.18%)2例,Ⅳ期4例(36.36%),分期不详1例;常见的临床表现依次为:盆腹腔包块6例(54.55%)、阴道流液3例(27.27%)、阴道不规则流血2例(18.18%),6例盆腹腔包块患者中,5例为盆腔囊性或囊实性包块,最大者为12 cm×16 cm×19 cm囊性包块(病例7);子宫颈外观多为光滑和/或肥大,外观明显异常者仅占18.18%,分别为结节状1例、菜花状1例;7例有治疗前的新柏氏液基细胞学检测(Thinprep cytologic test,TCT)和HPV检测结果,7例(100%)均为HPV阴性,其中6例(85.71%)TCT正常;余详见表1。
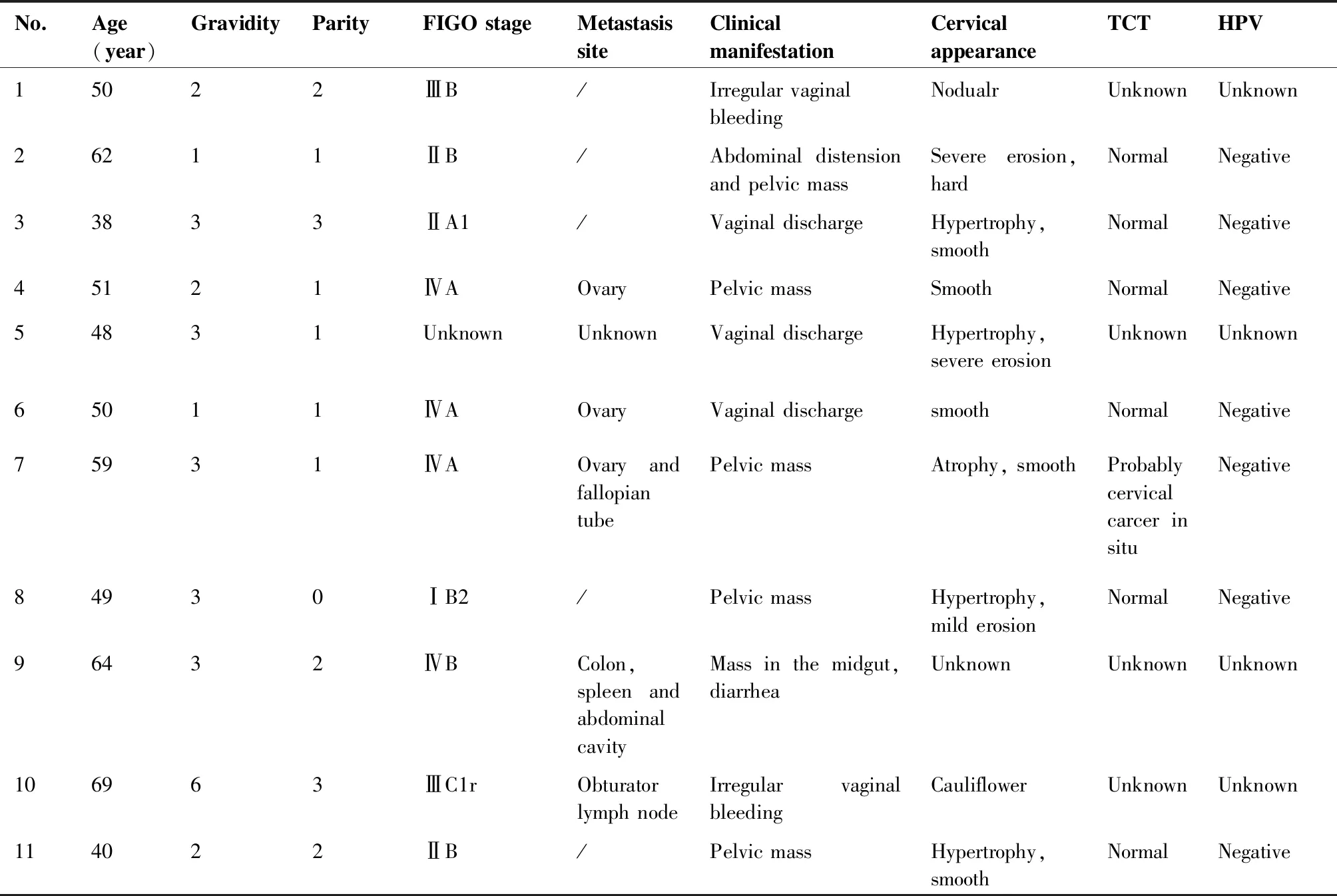
表1 11例患者的临床特征
10例患者有治疗前血清肿瘤标记物结果,阳性率从高到低依次为糖类抗原(carbohydrate antigen,CA)50、CA199、CA125和癌胚抗原(carcinoembryonic antigen,CEA),多为轻度升高,详见表2。
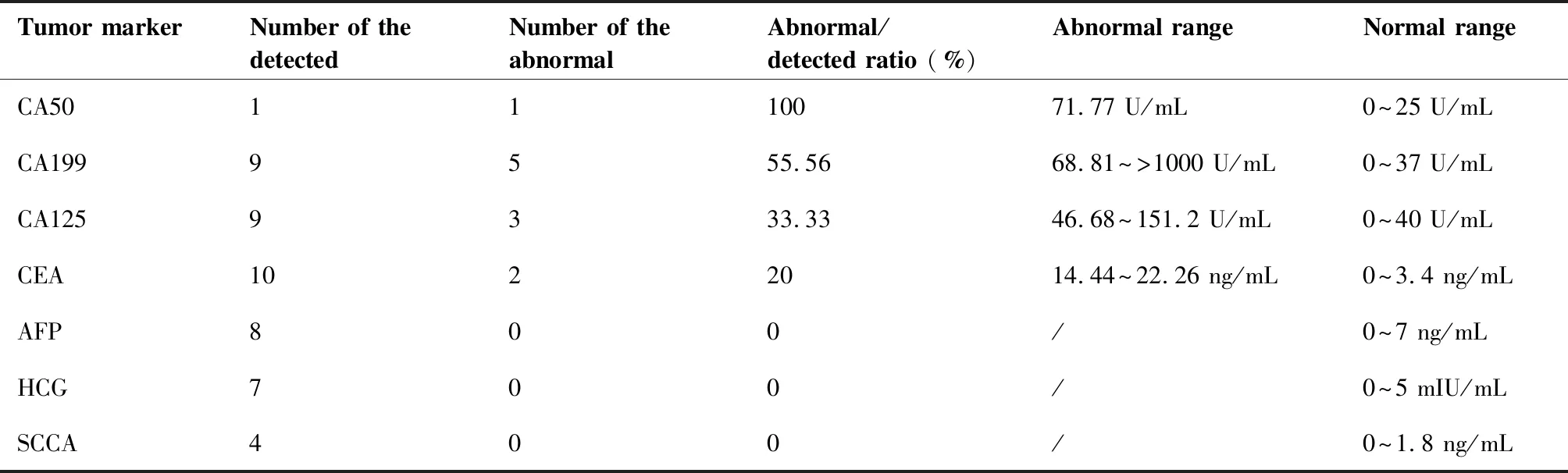
表2 患者血清肿瘤标记物情况
共5例患者行子宫颈活检,仅2例(40%)是经1次活检确诊,均为子宫颈外观明显异常者;其余3例行多次子宫颈活检均未能确诊,分别经诊断性刮宫、子宫颈锥形切除、子宫全切后确诊。在4例Ⅳ期患者中,3例(75%)有卵巢转移,另1例为结肠、脾脏、腹腔内多处转移。
2.2 患者的病理特点
病例3的术后标本大体观具有一定代表性,子宫颈外观肥大、光滑,剖视离体子宫见:子宫颈密布多囊泡状占位,直径约0.5~1.0 cm,内为黏液(似蜂窝状改变),子宫内膜光滑,肌壁未见明显异常。
8例行手术治疗者,术后病理诊断脉管癌栓(lymph-vascular space invasion,LVSI)(3/8)和神经侵犯(perineural invasion,PNI)(3/8)的阳性率均为37.50%,其中7例行全子宫切除者,57.14%(4/7)存在肿瘤局部明显浸润,肿瘤累及子宫体下段、子宫体肌壁、子宫颈管全周、深肌层浸润甚至累及子宫颈管全层至浆膜层、宫旁组织。
9例患者免疫组织化学资料完整,显示细胞角蛋白(cytokeratin,CK)7(8/8)、黏蛋白(mucins,MUC)6(6/6)、MUC5AC(2/2)、β-连环链蛋白(β-catenin)(2/2)阳性;Ki67约3%~60%(9/9);雌激素受体(estrogen receptor,ER)(5/5)、孕激素受体(progesterone receptor,PR)(5/5)、MUC-2(2/2)、特异AT序列结合蛋白2(special AT-rich sequence-binding protein 2,SATB-2)(2/2)、波形蛋白(2/2)阴性;p53突变型表达(7/9)、CEA(4/7)、CA125(2/3)多数阳性;p16(7/9)、CK20(7/8)多数阴性。6例患者尾型同源框转录因子-2(caudal-type homeobox transcription factor-2,CDX2)表达不一,可阴性或灶区阳性。
2.3 患者的治疗概况
患者的治疗以手术联合放化疗为主。病例4因子宫腺肌症、卵巢囊肿于外院行腹腔镜下全子宫+右卵巢囊肿+双输卵管切除术,当时术后病理为子宫腺肌症、右卵巢浆液-粘液囊肿、慢性子宫颈炎,术后30个月出现右侧腹壁穿刺孔处皮下包块,遂行腹壁包块切除术,术后病理确诊为G-EAC转移,后行放化疗。病例7为单孔腹腔镜下双附件及肿块切除术后确诊,二次行经腹广泛子宫+盆腔淋巴结及腹主动脉旁淋巴结+大网膜+阑尾切除术,术后放化疗。余详见表3。
2.4 患者的预后情况
11例患者中,1例为新确诊病例,目前正在治疗中,其余10例中,2例失访,8例完成随访,中位随访时间24.9个月(范围13.8~98.4个月),2例未复发,3例复发,3例死亡,详见表3。
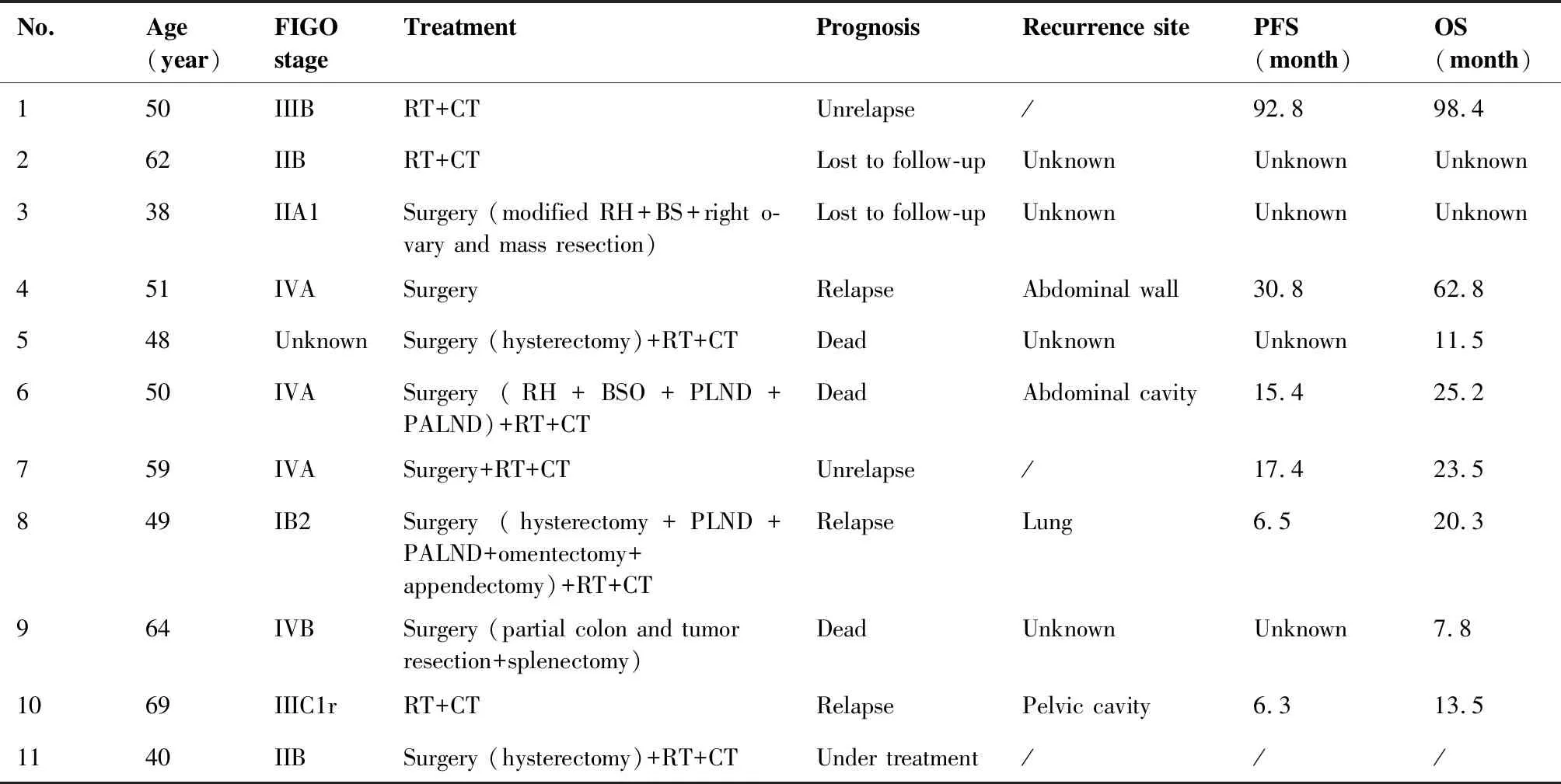
表3 患者的治疗及预后情况
3 讨 论
3.1 病因及临床表现与UEA不同,易漏诊
从肿瘤病因学角度而言,HPV感染是一个重要的预后相关因素,所以子宫颈腺癌又被分为HPV相关型和非HPV相关型。非HPV相关型包括G-EAC、子宫颈透明细胞癌、子宫颈中肾管腺癌等,其中G-EAC最常见[5]。本组病例也再次印证了这一观点,7例患者HPV均呈阴性。本组病例的发病年龄与文献报道的平均49岁(范围37~84岁)也十分吻合。此外,G-EAC常见临床症状及体征与UEA有所不同,表现呈多样性:1)常见阴道流液或白带增多,而阴道接触性出血、不规则流血则相对少见;2)子宫颈外观多呈光滑或糜烂状,子宫颈肥大,病灶多隐藏于子宫颈管,形成“桶状”子宫颈[6-9],即通常无肉眼可见的子宫颈菜花状病灶;3)常有卵巢肿瘤的症状与体征,有以下两个原因:其一,G-EAC可能出现卵巢转移;其二,存在女性生殖道同期黏液上皮化生与肿瘤(synchronous mucinous metaplasia and neoplasia of the female genital tract,SMMN-FGT),即在2个及以上女性生殖道部位同期发生多灶性胃型黏液性病变,可能是发生在子宫内膜、卵巢、输卵管的黏液化生,也可能是黏液性肿瘤[10]。因此,当发现子宫颈胃型黏液性病变时,应警惕可能在其他部位同时存在胃型黏液性病变,即SMMN-FGT的可能;反之,由于G-EAC的体征不典型,在子宫颈活检未能确诊的情况下,卵巢肿瘤就常表现为首发症状和体征。但有时鉴别SMMN-FGT与卵巢转移性病变是十分困难的[6]。胃型黏液性病变的核磁共振(magnetic resonance imaging,MRI)图像具有一定特异性[11-12]。因此,盆腔MRI可以帮助鉴别如叶状子宫颈内膜腺体增生(lobular endocervical glandular hyperplasia,LEGH)、G-EAC等胃型黏液性蛋白阳性病变(gastric-type mucin-positive lesions,GMPL)与子宫颈纳氏囊肿等胃型黏液性蛋白阴性病变(gastric-type mucin-negative lesions,GMNL)。Takatsu等[11]总结报道了关于LEGH的MRI特征:病变通常位于子宫颈较高位置,且病变中央存在一些小的囊肿或实性成分,周围被相对较大的囊肿包围,并将此特征定义为“宇宙模式”。而Ohya等[12]的研究结果也认为“宇宙模式”是GMPL的高度特异性表现,在T1WI上观察到与宫颈基质相比呈低脂信号的“宇宙模式”,则高度提示LEGH或G-EAC可能。而本组病例数较少,仅有2例患者行MRI检查,且均在外院进行,未能观察到上述特征性MRI表现。
本组病例中多数患者表现为盆腹腔包块,以盆腔囊性或囊实性包块为主,这可能与我院为肿瘤专科医院,收治的各类包块患者较多有关。本组病例中,卵巢是最常见的转移部位,患者临床表现酷似卵巢肿瘤而被误诊,且均伴有血清肿瘤标记物的轻度升高:3例有卵巢转移的ⅣA期患者中,2例CA199轻度升高、1例CA125轻度升高;1例结肠、脾脏、腹腔内多处转移的ⅣB期患者CA199和CA125有1~3倍的升高。已有文献中涉及G-EAC与肿瘤标记物的较少,Nakamura等[13]报道的13例G-EAC患者中,7例(53.8%)CA199升高、5例(38.5%)CA125升高、1例(7.7%)CEA升高;与56例非G-EAC相比,G-EAC更常见CA199升高(53.8% vs 21.4%),而本组中分别有55.56%(5/9)的患者CA199升高、33.33%(3/9)的患者CA125升高,与该研究结果相似。因此,对于G-EAC,CA199和CA125相较于其他肿瘤标记物更具特异性,且本组中3例CA125升高者,均存在盆腹腔转移,或许CA125可一定程度上提示晚期可能。因此,对于合并阴道流液或阴道不规则流血的盆腔包块患者,应警惕G-EAC的可能,结合肿瘤标记物结果,加强子宫颈细胞学的取材,行盆腔MRI了解子宫颈局部情况,必要时行分段诊刮、子宫颈深部活检、甚至子宫颈锥切,术中探查时注意有无子宫颈管增粗,检查离体标本时注意观察子宫颈及子宫颈管,如有无子宫颈蜂窝状改变的大体观等。
本组病例中,TCT阳性率仅为28.57%(2/7)(包括1例外院TCT正常、我院复查异常者)。常规的子宫颈细胞学筛查对G-EAC的检出率低,可能与以下因素有关:病灶多隐匿于子宫颈管中上段导致取材受限、细胞学改变轻微及认识不足等。单次子宫颈活检的诊断率为40%,但多次活检未能进一步提高诊断率,而联合子宫颈锥切、诊断性刮宫可提高诊断率至50%,与文献报道的多次活检及子宫颈锥切可将诊断率由单次活检的28.17%提升至50.7%有所不同[14]。因此,对于有阴道流液、不规则阴道流血等症状的子宫颈肥大或“桶状”子宫颈者,当活检结果与临床不符时,可考虑多次多点深部活检、甚至子宫颈锥切、分段诊刮,提高G-EAC的检出率,避免漏诊。
3.2 形态学联合免疫组化有助于明确诊断
Kojima等[1]提出了诊断G-EAC的3条形态学标准:丰富的黏液性胞质、透明或淡嗜酸性的胞质、清晰的胞界。但G-EAC的形态学异质性很大,这也是易漏诊或误诊的主要原因。因此,联合免疫组化等方法有助于诊断与鉴别诊断。本组病例的免疫组化表型体现了一定的特异性:1)本组中MUC6表达均呈阳性(6/6)。MUC6和HIK1083是经典的胃型黏液免疫标志物,可用于G-EAC及其谱系病变的病理诊断,是诊断G-EAC的重要依据[1,15]。两者比较而言,MUC6阳性率更高、但特异性稍低,也可见于其他部位原发的腺癌;而HIK083特异性更高,可识别胃幽门腺粘蛋白,但目前国内尚没有用于诊断的商品化HIK083抗体,只有用于研究用途的,价格较为昂贵;2)本组中p16多为阴性,少数呈灶性阳性或阳性。p16常被作为一种高危型HPV感染的重要标志,在G-EAC与UEA的鉴别诊断中具有一定意义。UEA中p16多呈弥漫强阳性表达,而G-EAC与高危型HPV感染无关,p16常呈阴性或仅局灶阳性,但也有G-EAC中p16呈弥漫强阳性的个案报道,也有学者提出p16表达未必与HPV感染相关[8,16-18]。综合本组病例特点和已有文献,G-EAC的p16多呈阴性,但也可呈局灶阳性或弥漫阳性表达;3)本组中多见p53突变型表达,与Carleton等[17]报道一致,p53也是有助于鉴别G-EAC与UEA的指标。p53与细胞生长、细胞凋亡等相关,是最常见的肿瘤相关免疫抗原之一。G-EAC中p53突变型表达,可能是肿瘤发生的主要分子机制之一,并可能与其对放疗、化疗不敏感有一定关系[19];4)本组中ER和PR均呈阴性(5/5),与文献报道一致[20],表明G-EAC的发生、发展可能与患者体内激素水平无关; 5)Ki67,即细胞核增殖抗原,是与肿瘤细胞增殖相关的关键标志物。G-EAC中Ki67较低,多在40%以下,这与其他研究[21]报道的一致,Ki67较低也容易造成G-EAC的生物学行为较为温和的错觉。综上所述,联合使用MUC6、HIK1083、p16、p53、ER、PR等免疫组化指标有助于G-EAC的诊断。
3.3 治疗方法有待探索
目前,子宫颈腺癌(包括G-EAC)的治疗与鳞状细胞癌相似,但G-EAC不适合保留生育功能。鉴于G-EAC较UEA更具侵袭性,易发生远处转移,病变多处于进展期(本组病例90%为Ⅱ~Ⅳ期),肿瘤深肌层浸润、LVSI、PNI、卵巢转移等较常见,化疗耐药更常见,预后差[6,9,22-24]。因此,G-EAC的治疗存在一定争议。我们认为,应该在规范化的基础上,根据具体情况实施个体化治疗:1)对于子宫颈早期病变患者,由于其容易发生转移和可能存在SMMN-FGT,建议除了常规的广泛性子宫切除术+盆腔与腹主动脉旁淋巴结切除术,可同时切除双附件、大网膜±阑尾,类似于分期手术,术后辅助放化疗[4];2)当患者以卵巢肿瘤为指征行手术治疗而意外发现G-EAC时,虽子宫颈局部为早期病变,但应警惕卵巢转移的可能,对于卵巢有转移者,手术应类似于肿瘤细胞减灭术,有利于缓解症状和术后实施放化疗。但从本组病例治疗上的多样化可以看出,因术前确诊困难,严重影响了患者治疗方案的制定和实施。因例数较少,未能做相关性分析,但总体来看,手术范围足够且无肿瘤残留、辅以术后放化疗者预后较好,而复发或死亡病例多存在手术不全、肿瘤残留、宫旁受侵、术后未放化疗等情况。目前,有研究[25]结果显示,人类表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)扩增在G-EAC中较其他子宫颈腺癌更为常见,且HER-2扩增更常见于分期较晚和有卵巢转移者。这表明G-EAC患者可能可以从曲妥珠单抗等抗HER-2单克隆抗体靶向治疗中获益,这可能是G-EAC的潜在治疗靶点之一。或许未来从靶向治疗方向着手,探索更多针对分子病理特征的靶向治疗方法,甚至双靶、多靶疗法,可能有望改善G-EAC的预后。
HPV相关型子宫颈癌的发病率势必会因一级预防(HPV疫苗)与二级预防(筛查)的普及而大幅下降,随之G-EAC为代表的非HPV相关型子宫颈癌的比例会逐渐升高。但G-EAC的症状与体征不特异,部分患者可酷似卵巢肿瘤的临床表现,缺乏敏感且特异的肿瘤标记物,MRI可具有一定特征性,但总体来说,术前诊断较困难,且预后差,需引起妇科医生、妇科肿瘤医生和病理医生的重视,提高对该病的认识与警惕性,充分的术前评估和术中探查,以及术后病理辅以相应免疫标记,可减少漏诊和误诊,对于患者的治疗和预后至关重要。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

