侵入后失活疟原虫的免疫保护性初探①
彭佳聪,官宏莉,李媛媛,蒋莉萍,彭小红
(桂林医学院基础医学院人体寄生虫学教研室,广西 桂林 541199)
疟疾是世界上严重危害公共卫生的三大传染病之一,主要通过感染疟原虫的雌性按蚊叮咬而传播。据WHO估计,2019年全球共有2.29亿人感染疟疾,导致约40.9万人死亡,其中2/3为撒哈拉以南非洲地区5岁以下儿童[1]。近年来,尽管疟疾防控已取得巨大进展,但疟疾患病及死亡人数仍居高不下,其原因主要是杀虫剂及抗疟药物耐药性的扩散[2-3]。因此,新型抗疟药物和疟疾疫苗的研制变得尤为迫切。
过去70多年来,全球在疟疾疫苗研制方面进行了艰苦的努力,但尚未开发出一种安全、有效的疟疾疫苗[4]。由于疟原虫抗原具有高度多态性,以疟原虫表面优势抗原为基础的亚单位疫苗产生的免疫保护性受限[5-6],使得近年来疟疾疫苗的研发焦点逐渐转移至全虫疫苗。实验证实,疟原虫红内期全虫减毒疫苗对疟原虫再感染具有免疫保护作用,但其免疫过程中可能因减毒不完全而导致接种者出现疟原虫感染[7-8]。因此,全虫灭活疫苗或许能成为红内期疟疾疫苗研制的突破点。本研究在疟原虫感染康复期小鼠红细胞内发现类似Howell-Jolly小体的单点状深紫染颗粒,采用约氏疟原虫感染小鼠模型,制备及富集该颗粒,并以此为抗原免疫小鼠,检测其接种安全性和免疫保护性,为其作为疟原虫红内期全虫灭活疫苗的研究奠定基础。
1 材料与方法
1.1 材料
健康清洁级雌性BALB/c小鼠40只,6~8周龄,购自湖南斯莱克景达实验动物有限公司;健康普通级雌性昆明株小鼠40只,6~8周龄,购自桂林医学院实验动物中心;约氏疟原虫(Plasmodium yoelii,P.yoelii)BY265株,为本室长期保存虫株;甲醇购自西陇科学股份有限公司;姬姆萨染液购自珠海贝索生物技术有限公司;磷酸氯喹(chloroquine phosphate,CQ)购自上海阿拉丁生化科技股份有限公司;生理盐水购自广西裕源药业有限公司;磷酸盐缓冲溶液(phosphate buffer solution,PBS,0.1 mol/L,pH 7.5)购自美国Sigma公司。
1.2 方法
1.2.1 小鼠接种感染 取昆明株小鼠,按常规方法经腹腔接种P.yoeliiBY265株感染的红细胞(infected red blood cells,iRBCs),接种后第3天尾静脉取血,薄血膜涂片,甲醇固定后姬姆萨染色,光镜下观察小鼠疟原虫感染情况,计数红细胞的疟原虫感染率,即原虫血症百分比。
1.2.2 抗原获取 采取以下3种方法制备类似Howell-Jolly小体颗粒抗原,每组5只昆明株小鼠。①CQ-ITV法(基于磷酸氯喹的感染后控制疫苗):按照参考文献[9]构建CQ-ITV免疫小鼠模型。末次免疫后第30天,计数P.yoelii感染小鼠的原虫血症所占百分比,根据计数结果,用生理盐水将P.yoelii感染小鼠的全血稀释至103iRBCs/100μl,尾静脉注射100μl攻击小鼠;攻击后第2天起,每日查血,计数小鼠原虫血症及类似Howell-Jolly小体颗粒所占的比例。②高剂量接种法:计数P.yoelii感染小鼠的原虫血症所占百分比,用生理盐水将P.yoelii感染小鼠的全血稀释至108iRBCs/100μl,小鼠尾静脉注射接种100μl;3 h后,腹腔注射100μl PBS稀释的CQ(0.8 mg/100μl),此后每日同一时间注射CQ,并查血计数小鼠原虫血症及类似Howell-Jolly小体颗粒所占的比例。③感染后CQ治疗法:小鼠腹腔注射100μl P.yoelii感染小鼠的全血,接种后第3天起,每日查血观察小鼠原虫血症。待原虫血症约15%时,腹腔注射100μl PBS稀释的CQ(0.8 mg/100μl)进行治疗,此后每日同一时间注射CQ,并查血计数小鼠原虫血症及类似Howell-Jolly小体颗粒所占的比例。
选择完全无疟原虫感染且含类似Howell-Jolly小体颗粒最多的时间点取小鼠全血,4℃,离心15 min,去除血浆,留取红细胞,PBS洗涤3次,5 min/次,加入与血浆等量PBS重悬,获得类似Howell-Jolly小体颗粒抗原。
1.2.3 接种安全性及保护性检测 计数以上类似Howell-Jolly小体颗粒抗原含量,用生理盐水将抗原稀释至103个/100μl及105个/100μl,分别尾静脉注射进行免疫接种两组BALB/c小鼠(5只/组,100μl/只),共免疫3次,每次间隔14 d。末次免疫后第30天,计数小鼠的原虫血症(P.yoelii感染的红细胞)所占百分比;用生理盐水将P.yoelii感染小鼠的全血稀释至103iRBCs/100μl,尾静脉注射100μl攻击小鼠,同时另取3只空白(未经免疫接种)BALB/c小鼠,同样方法进行攻击作对照,攻击后第3天起,每日查血检查小鼠疟原虫感染情况。
1.2.4 冻存后抗原的接种安全性及免疫保护性检测将1.2.2获得的抗原于-20℃冻存30 d。免疫前37℃水浴锅中迅速解冻,计数抗原含量,用生理盐水将抗原稀释至105个/100μl,尾静脉注射100μl稀释抗原对昆明株小鼠进行免疫接种(5只/组,100μl/只),共免疫3次,每次间隔14 d,另取3只空白小鼠同样方法注射100μl PBS作对照。末次免疫后第30天,用1.2.1制备的103iRBCs/100μl攻击小鼠,攻击后第2天起,每日查血检查小鼠疟原虫感染情况,检测冻存后抗原免疫保护性。
1.3 统计学分析
采用GraphPad Prism 8软件完成实验数据的统计学分析与作图,以P<0.05为差异有统计学意义。
2 结果
2.1 类似Howell-Jolly小体的单点状深紫染颗粒
小鼠疟原虫感染康复期,部分红细胞内出现类似Howell-Jolly小体的特殊单点状深紫染颗粒,其形态不同于红内期疟原虫,但这些红细胞的基本形态与正常红细胞无异,将该颗粒命名为侵入后失活疟原虫(invaded and inactivatedPlasmodium,IIP)。详见图1。
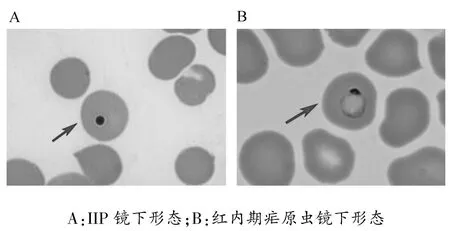
图1 IIP及红内期疟原虫光镜下形态(100×)
2.2 IIP的获取情况
采用CQ-ITV法、高剂量接种法及感染后CQ治疗法均成功获取IIP,其中CQ-ITV法最早可于接种后第59天出现IIP,高剂量接种法最早可于接种后第3天出现IIP,但小鼠外周血仅见IIP的时间差异较大,从7 d至18 d不等;感染后CQ治疗法最早可于接种后第12天出现IIP,第14天开始,外周血仅见IIP。
2.3 IIP接种的安全性
103个IIP/100μl的低剂量组,小鼠免疫全程均未出现疟原虫感染,而105个IIP/100μl的高剂量组,小鼠首次免疫后第3至8天相继出现感染。原虫血症峰值仅7%。
2.4 IIP免疫的原虫血症峰值
实验组与对照组小鼠均于攻击后第3天出现原虫血症,随着时间的增加,全部小鼠出现疟原虫感染,原虫血症也逐渐上升,两组小鼠原虫血症对比差异无统计学意义(P>0.05)。但是,未免疫组原虫血症于攻击后第12至15天达到峰值,随后逐步下降,而免疫组原虫血症在第8至22天维持在较低水平,于第23天起迅速下降。此外,免疫组原虫血症峰值(43.8%)明显低于未免疫组(56.1%)。详见图2。
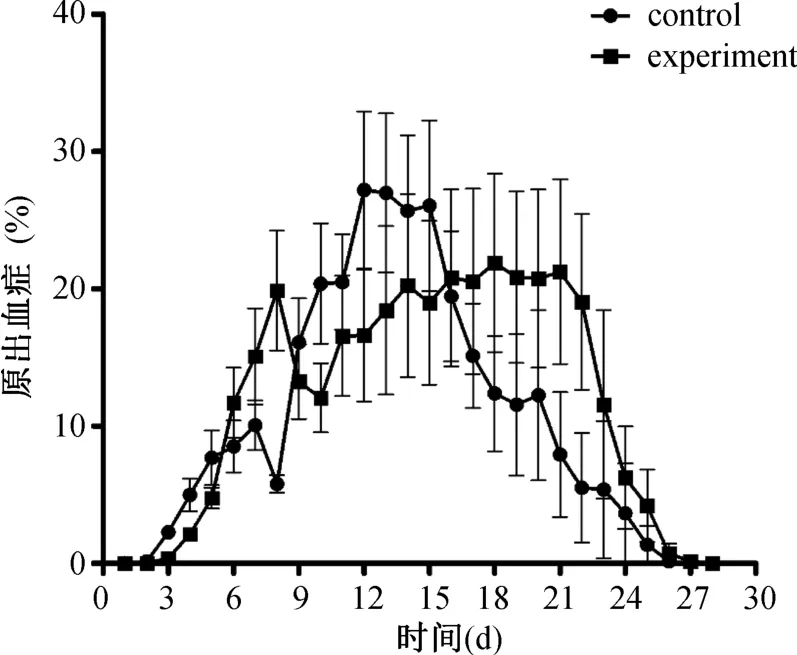
图2 IIP免疫保护性检测
2.5 IIP冻存后的安全性及免疫保护性
接种冻存后IIP小鼠3次免疫过程中均未出现疟原虫感染。免疫的实验组与对照组小鼠均于iRBCs攻击后第5天出现原虫血症,免疫的实验组原虫血症于第10天达到峰值,随后逐渐下降,至第23天完全恢复;未免疫组原虫血症于第12天达到峰值,但小鼠分别于第8、10、16天死亡;此外,免疫组原虫血症峰值明显低于未免疫组。详见图3。
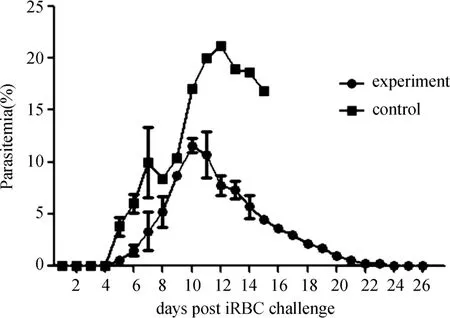
图3 IIP冻存后的免疫保护性检测
3 讨论
目前在研的疟疾全虫疫苗均为减毒疫苗,除了制备条件,安全性也是限制其应用的主要原因[10]。红外期基因减毒子孢子疫苗(genetically-attenuated parasites,GAP)的人体实验中,第一批接种恶性疟原虫p52-/p36-GAP的6名志愿者之一出现了疟原虫感染[11]。感染后控制疫苗(infection and treatment vaccine,ITV)免疫过程中低剂量的药物治疗也可能导致受试者出现疟原虫感染,提高药物浓度可降低感染风险,但高浓度药物可能会引起不良反应,残留药物也可能导致不良反应发生[12]。
本研究建立约氏疟原虫感染小鼠模型,在小鼠感染疟原虫康复期的部分红细胞内发现了单点状深紫染颗粒(图1)。起初以为该颗粒是Howell-Jolly小体,它是位于成熟红细胞或晚幼红细胞胞质中的紫红色圆形颗粒,多见于溶血性贫血。然而,在CQ-ITV免疫过程中也发现了该物质,此时小鼠处于正常生理状态,并无贫血及红细胞增生症状。CQ主要作用于疟原虫红内期裂殖体,对早期滋养体作用并不明显[13]。因此,上述特殊颗粒不是CQ直接对疟原虫杀伤形成的,而可能为侵入红细胞过程中被免疫系统杀伤失活的疟原虫。
通过比较CQ-ITV法、高剂量接种法以及感染后CQ治疗法3种制备方法发现,CQ-ITV法因其3次免疫逐步加强了对再感染的保护效果,攻击后一般不会出现疟原虫感染,但此法耗时较长,从接种到获取IIP至少需要59 d。而CQ治疗法小鼠状态稳定,且仅需约14 d即可获得IIP,因此后续实验均采用此法制备。低剂量IIP(103个IIP/100μl)接种小鼠过程中均未出现疟原虫感染,而高剂量IIP(105个IIP/100μl)首次接种即出现感染,但是小鼠原虫血症峰值仅为7%,说明IIP的制备仍有待改进。本研究所采取的IIP富集方式可能存在血涂片未见iRBCs,但体内仍有少量感染疟原虫未被发现的情况。
最后,在小鼠末次免疫后第30天给予免疫组与未免疫组小鼠103iRBCs/100μl攻击发现,两组小鼠均于攻击后第3天出现原虫血症,虽然其原虫血症对比差异无统计学意义(P>0.05),但免疫组原虫血症峰值明显低于未免疫组,说明IIP具有一定的免疫保护性,可能因免疫能力不够导致其未出现完全免疫保护作用。此外,-20℃下,IIP冻存30 d后稀释至105个IIP/100μl后免疫小鼠过程中均未出现疟原虫感染,攻击后原虫血症水平明显低于未免疫组,说明冻存后IIP具备100%的接种安全性,提示高免疫剂量可产生更好的免疫保护作用。
本研究未取得理想效果,还有很多问题有待深入探讨。首先,康复期红细胞内单点状深紫染颗粒是否为侵入后失活疟原虫值得进一步确定,后续可采用质谱分析,明确该颗粒的成分。其次,如果确定了该颗粒为疟原虫成分,其疟原虫相关抗原是否可表达于侵入红细胞表面。如果明确了上述两个问题,可采用流式细胞术分选方式获取高纯度IIP,以确保免疫过程的安全性,同时通过提高免疫剂量验证其保护性。
总之,本研究发现了疟原虫感染康复期宿主红细胞内的特殊颗粒物质,通过制备并富集证实了该颗粒具有一定的免疫保护性。提示IIP可能是潜在的疟疾红内期灭活全虫疫苗,这也为新型有效疟疾疫苗的设计提供了新的思路。

