分次灌胶制备二维凝胶电泳大胶①
徐胡斌,朱 茵,刘安敏,赵起超,2,谢 恬,2,陈功星,2③
(1.杭州师范大学医学部,浙江 杭州 311121;2.浙产中药材资源开发与应用浙江省工程实验室,浙江 杭州 311121)
蛋白质组学是分子生物学的重要内容,二维凝胶电泳(2-DE)技术在蛋白质组学研究中得到了广泛的应用,它能够根据蛋白质的等电点和分子量,将蛋白质混合物中的不同蛋白分子分开,形成各自单独的蛋白质分子点,从而能够对蛋白质表达模式进行大规模分析,解读他们在不同生物下的变化,二维凝胶电泳是分离蛋白的一种强大工具,常应用于蛋白质组学研究。尽管过去了几十年,出现了更复杂和高性能的质谱分析方法,但只有结合二维凝胶电泳才使得它在蛋白研究领域发挥更大作用[1]。最近出现的热细胞转移技术(cellular thermal shift assay,CETSA)与2-DE结合成为新的技术手段,用于药物蛋白靶标分析,在大肠癌细胞中找到了药物的靶标分子丙酮酸激酶M2型(PKM2),为新药开发提供新方法[2]。二维凝胶电泳技术在等电聚焦后的第二维凝胶电泳常在大胶中进行,但目前大胶制备时容易漏胶,导致制胶困难或胶板质量不高,影响实验结果[3-4]。但目前大胶制备时容易漏胶,笔者在实验过程中摸索出一种简便的分次灌胶制胶法,有良好的制胶质量。
1 材料与方法
1.1 材料
人肺腺癌细胞株A549为本实验室保存。细胞培养试剂RPMI1640、小牛血清购于杭州曜晖生物科技有限公司;制胶大玻璃板(25.5 cm×21 cm)、制胶立架、IPG干胶条(pH 3~10)及其相应试剂、聚焦仪、电泳仪、扫描仪均为美国GE(Ettan IPGphor 3)产品;蛋白Marker、SDS-PAGE凝胶制备试剂盒,购于上海碧云天生物有限公司;考马斯亮蓝染色液及其脱色液为实验室自配。
1.2 方法
1.2.1 细胞培养及样本制备 A549细胞培养于含10%小牛血清的RPMI1640(含青霉素100 U/ml、链霉素100μg/ml)细胞培养液中,置于37℃、饱和湿度和5%CO2孵育箱中培养;消化收集对数期生长细胞,参照美国GE(Ettan IPGphor3)使用说明,5×106个细胞混悬于10μl PBS中,然后,加入50μl细胞裂解液[9 M尿素、4%chaps、2%IPG缓冲液、40 mM的Tris-base(pH 8.8)、40 mM的DTT],冰浴,每隔2 min振荡30 s,共10 min,然后,4℃、离心45 min,取上清20℃保存备用。
1.2.2 聚丙烯酰胺大胶制板 在250 ml广口瓶中配制57 ml浓度为10%分离胶混合液,安置好长、短玻璃板,其两边上、中、下重叠部位分别用3个宽50 mm的长尾办公夹夹住,置于制胶立架上。单次与分次灌胶各制备10块大凝胶,单次灌胶为1次性灌注胶液,分次灌胶为分3次灌注胶液,前两次各3 ml,每次灌胶凝固后,再往下继续操作,第1次灌胶后会出现少量漏出,胶凝固后,第2次灌胶,未见漏出,待凝固后,底部可能的缝隙已全部堵住,可以进行最后1次灌胶。然后加0.1%的SDS液,将胶面压平。胶凝固后,倒去上层压胶液,用吸水纸吸干,大胶板配制完成。
1.2.3 聚焦电泳及染色扫描 从-20℃冰箱取出13 cm长的IPG干胶条,室温平衡30 min,剥去保护膜,胶面朝下盖住250μl水化液(8 M尿素、2%chaps、0.5%IPG缓冲液、15 mM的DTT,新鲜配制或者-20℃冰箱保存,不可反复冻融),室温被动水化10 h。将IPG胶条胶面朝上转移到聚焦仪的聚焦盘里,两端覆盖去离子水浸湿的电极滤纸,电极安装到位,加矿物油确保胶条完全浸没。安装样品杯,加入50μl提前制备好的样品。电泳参数:250 V 20 min;4 000 V 2 h,4 000 V 2.5 h等电聚焦。取5 ml平衡液[6 M尿素、2%的SDS、0.375 M的Tris-HCl(pH 8.8)、20%甘油]置于试管中,加入二硫苏糖醇50 mg,0.25%溴酚蓝25μl,取出聚焦后的胶条浸泡,水平摇床摇15 min;然后胶条置于5 ml平衡液中,加入碘乙酰胺125 mg,0.25%溴酚蓝25μl,摇15 min。将IPG胶条用电泳缓冲液轻轻浸洗,去除缓冲液,然后放入上述制备大胶的上端,并放置蛋白Marker浸泡的滤纸条,用5%低熔点琼脂糖封闭;安装电泳装置,加好电泳缓冲液,恒定功率1 W,电泳过夜。最后取出凝胶浸泡于考马斯亮蓝染色液(50%甲醇、10%乙酸、0.05%考马斯亮蓝G250)中,摇动过夜,脱色液(甲醇 ∶双蒸水 ∶乙酸=45∶45∶10)漂洗。打开扫描仪软件LabScan,扫描凝胶并保存结果。
1.3 统计学方法
数据采用Excel表统计分析,计数资料以%表示,采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两种灌胶方法分析
分次灌胶制10块板,1次漏胶,成功率为90%;单次灌胶制10块板,8次漏胶,成功率为20%,两者差异具有统计学意义(P<0.05)。见图1。

图1 大玻璃板制备聚丙烯酰胺凝胶板
2.2 聚丙烯酰胺凝胶电泳后染色扫描
大玻璃板聚丙烯酰胺凝胶双向电泳,IGP胶条长为13 cm,pH 3~10。蓝色点为A549细胞的蛋白质分子电泳后的考马斯亮蓝染色图谱,点型规范,分布自然;酸性蛋白质分子点居多,在胶的左上方;分子量>43 KD的蛋白居多。见图2。
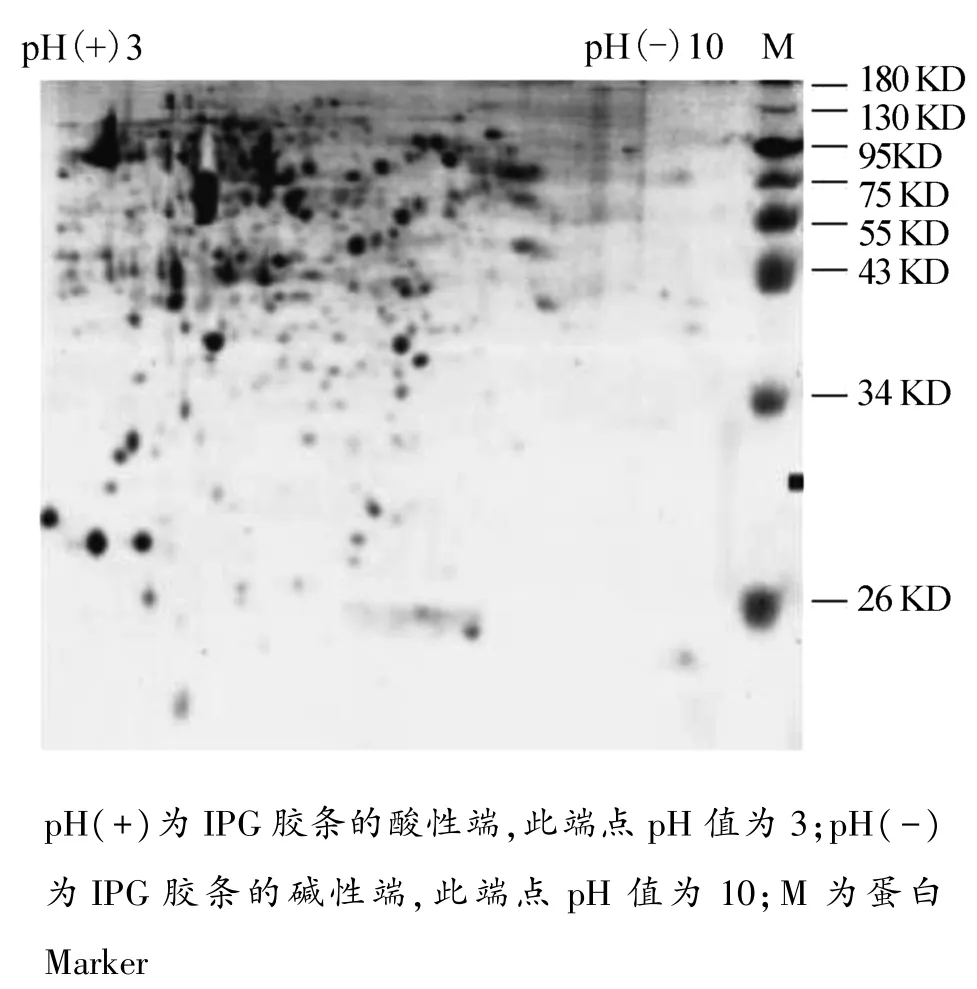
图2 双向凝胶电泳考马斯亮蓝染色图谱
3 讨论
生物分子学内容广泛,主要涉及核酸和蛋白质两大类,目前,核酸分子的研究相对较多,实际上核酸和蛋白质两大生命分子对生命的意义同样重要,蛋白质的未知领域更广阔。二维凝胶电泳技术是蛋白研究的基本技术,依据等电点和分子量两个维度对蛋白质分子进行分离,重复性良好,理论上可以分离所有的蛋白分子。二维凝胶电泳技术与质谱技术结合,在尿液中可筛查到前列腺癌的靶标蛋白[5],在大肠癌组织细胞中可检测到癌的生物标记物[6]。但由于实验过程复杂、费用昂贵、操作困难等原因,影响其应用。二维凝胶电泳在蛋白质组学分析上仍然是非常重要的技术,尤其是与新近发明的细胞热转移技术结合形成的热蛋白组技术(2DE-TPP),对于药物作用的蛋白靶点研究尤为重要[7]。此技术也将会在中药现代化工程中发挥重要作用,中草药成分复杂,不易被提取,导致许多中药主要成分确切作用的蛋白质靶分子不为人知,也因此削弱了中草药的应用价值,二维凝胶电泳技术的应用有可能在这方面有所突破。
二维凝胶电泳技术的建立和发展有数十年,有了很多改进,但聚丙烯酰胺凝胶分离系统,尤其是大胶板,需要临时配制,而本文使用的大胶板可以分析长度7、11、13、18、24 cm的IPG胶条。 虽然有专门的器具保障制胶的质量,但其一次性制备胶板数量太大,或者专门的制胶器具出现损坏不能使用的情况下,本制胶法非常合适。本研究探讨了分次灌胶制胶板的设想,原理是每次少量灌胶,让其凝固,两次后底部形成密封层,然后整个胶板灌注就不会出现漏胶现象。结果显示,分次灌胶,大胶制作成功率90%;单次灌胶,大胶制作成功率只有20%。3次灌胶制作大胶法,操作简单,配制过程中只要胶带封住底口,垂直放置即可,不需要其他特殊的设施。采用此法制备的大胶进行电泳,结果显示,蛋白点分布均匀、形态好,达到文献报道的二维凝胶电泳图形质量[8]。分次灌胶形成的密封层,化学组成与整个大胶一致,理论上不会对实验结果产生影响。由于每次灌胶后需等待凝固,因此下一次灌胶液中多加点TEMED,剂量可根据气温和预期凝固的时间确定。

