探索二甲双胍减少系统性红斑狼疮患者感染事件的作用:一项Met-Lupus研究的事后分析
耿时凯,张 乐,王慧静,吕良敬,万伟国,孙芳芳#,叶 霜#
1. 上海交通大学医学院附属仁济医院南院风湿科,上海 201112;2. 上海交通大学医学院附属仁济医院南院药剂科,上海 201112;3. 上海交通大学医学院附属仁济医院风湿科,上海200001;4.复旦大学附属华山医院风湿科,上海200041
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种复杂的、慢性炎症性的自身免疫性疾病[1-2],其远期的器官损伤和疾病活动的反复发生是当前临床治疗面临的巨大难题[3]。随着对SLE 发病机制的认识,新型生物制剂或靶向药物已逐渐投入使用[4-6],但迄今为止仍无法替代糖皮质激素的关键作用,而伴随激素使用产生的感染,目前已成为SLE患者死亡的主要原因[7-8]。
当前,通过代谢免疫思路治疗SLE 已得到国内外的广泛关注[9-13]。二甲双胍是治疗2 型糖尿病的常用药物,其通过调控代谢改善免疫状态的作用已被基础研究及临床研究所验证[11,14-15]。本研究组前期完成的临床研究[16]显示,在SLE 治疗方案的基础上加用二甲双胍能降低患者疾病的复发率,并能减少激素暴露和降低体质量指数(body mass index,BMI),改善患者代谢综合征,从而维持狼疮患者疾病的稳定。有趣的是,有研究提示二甲双胍在抗感染方面也具有一定的作用。多项研究[17-19]显示,二甲双胍对多种病原体有效,包括结核分枝杆菌、金黄色葡萄球菌、铜绿假单胞菌,以及乙型肝炎病毒等;另有研究[20-21]发现二甲双胍可以改善脓毒血症小鼠的预后。
本研究组前期开展了一项二甲双胍治疗SLE 的多中心、随机、双盲、安慰剂对照临床研究(Met-Lupus),结果显示,二甲双胍组感染率显著低于安慰剂组[22]。为了进一步探索并分析二甲双胍在SLE 中潜在的减少感染事件的作用,开展了此项事后分析。
1 对象和方法
1.1 研究对象
本研究为Met-Lupus 研究[22]的事后分析。研究对象入组标准:①年龄18~70周岁。②至少满足美国风湿病学学会(American College of Rheumatology,ACR)(1997)11 条SLE 分类标准中的4 条。③病程大于1 年,过去1 年中有明确记录的病情活动(≥1次)。④筛选阶段改良的系统性红斑狼疮雌激素安全性国家评估版-系统性红斑狼疮疾病活动指数(safety of estrogens in lupus erythematosus national assessment-systemic lupus erythematosus disease activityindex,SELENA-SLEDAI)≤6,且大不列颠群岛狼疮评估组指数(British Isles Lupus Assessment Group index,BILAG)满足A=0 或B≤1(即无疾病重度活动的系统或疾病中等活动的系统≤1 个)。⑤患者有固定的治疗方案,泼尼松剂量固定(0~20 mg/d),羟氯喹或常规免疫抑制剂至少持续使用28 d。⑥自愿加入本研究并签署知情同意书。排除标准:①糖尿病患者。②既往有肿瘤病史者。③怀孕或哺乳期妇女。
2016年5月24日至2017年12月13日,对来自上海交通大学医学院附属仁济医院南院、上海交通大学医学院附属仁济医院和复旦大学附属华山医院的180例SLE患者进行了筛查,有31 例(17.2%)不符合纳入标准,9 例(5.0%)在随机分组后未经治疗就撤回了知情同意书,最终有140例(77.8%)患者被纳入研究[22]。140例中67例受试者被随机分至二甲双胍组,平均年龄为(33.0±10.8)岁,病程为(4.6±4.1)年,其中62例(92.5%)为女性;73例受试者被分至安慰剂组,平均年龄为(33.1±12.2)岁,病程为(4.8±4.4)年,其中69例(94.5%)为女性。
1.2 研究方法
1.2.1 治疗方案 本研究为研究者发起的临床试验,受试者随访期间泼尼松、免疫抑制剂、羟氯喹及二甲双胍(或安慰剂)等药物的调整将基于研究者对患者临床表现进行判断。患者经计算机随机分组后,使用二甲双胍的受试者(二甲双胍组)及使用安慰剂的受试者(安慰剂组)入组第1周按每日500 mg的剂量分3次随餐服用,随后每周增加500 mg 的剂量,直至达到每日1 500 mg[22]。二甲双胍维持剂量方案的调整由研究者根据患者耐受性及其个人意愿制定。本研究经上海交通大学医学院附属仁济医院伦理委员会审核批准[注册号为NCT02741960,审批号为仁济伦审(2016)007k 号]。二甲双胍及安慰剂经上海食品与药品监督管理局批准。
1.2.2 随访记录 12 个月试验周期内,受试者每1~3 个月接受门诊随访1次,随访当天抽取外周静脉血,检测血常规、尿常规、肝功能、肾功能、免疫球蛋白、补体C3、补体C4、抗dsDNA 抗体,并通过就诊记录及问询病史详细记录受试者感染事件发生类型、持续时间、相关症状、治疗及转归。随访期间发生感染事件的认定基于研究者对患者局部组织、全身性炎症反应的判断(包括临床症状、实验室检查结果等)。严重感染(severe infection)定义为导致受试者住院治疗,或调整SLE治疗方案,或由研究者判断的导致受试者无法完成研究的其他情况;轻型感染(mild infection)定义为局部炎症反应,如轻微流涕、轻微干咳或经研究者在门诊治疗后痊愈者。
1.3 统计学分析
研究数据使用EpiData Manager 2.0 录入,统计软件SPSS 26.0 和Graphpad Prism 8.0 进行分析。定量资料中正态分布数据以±s 表示,组间比较使用独立样本t 检验;非正态数据以M(Q1,Q3)表示,使用Mann-Whitney U 检验。定性资料以频数和百分比表示,组间比较使用χ²检验。使用多因素Logistic 回归分析受试者感染的相关因素。使用Kaplan-Meier生存分析评估1 年随访期内受试者无感染生存情况。P<0.05认为差异具有统计学意义。
2 结果
2.1 受试者一般情况和基线期特征
Met-Lupus 研究显示二甲双胍组感染率(17 例,25.4%)显著低于安慰剂组(32 例,43.8%)[22]。为了进一步分析感染与二甲双胍暴露的关系,我们比较了1年随访期内发生感染的受试者(49例,35.0%)与未发生感染的受试者(91 例,65.0%)的基线情况,2 组受试者在性别、年龄、病程长短方面的差异均无统计学意义(均P>0.05)。实验室常规指标中,白细胞计数、中性粒细胞绝对值、淋巴细胞绝对值、血小板计数、谷丙转氨酶、血清肌酐等差异均无统计学意义(均P>0.05)。SLE 相关免疫学指标中,2 组受试者的抗dsDNA 抗体、补体C3、补体C4、免疫球蛋白(IgG、IgM、IgA)水平差异也均无统计学意义(均P>0.05)。同时,2 组SLE 受试者既往系统受累情况亦相似,主要合并狼疮性肾炎、特发性血小板减少、抗心磷脂综合征以及肺动脉高压(表1)。
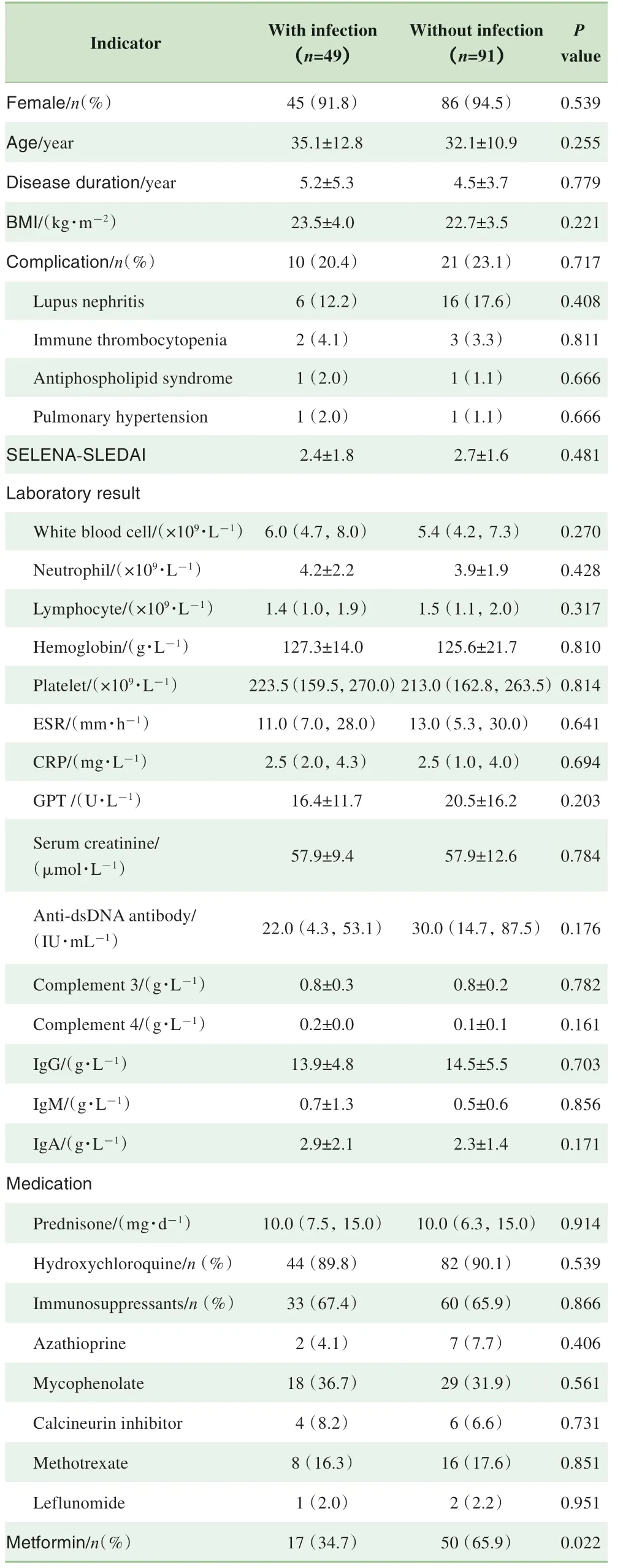
表1 发生感染与未发生感染的受试者基线期特征及治疗方案比较Tab 1 Comparison of baseline characteristics and medication between the participants with and without infection
2.2 受试者基线期治疗方案
在发生感染的受试者中,泼尼松的剂量中位数为10.0(7.5,15.0) mg/d,44例(89.8%)受试者使用羟氯喹,33例(67.4%)使用免疫抑制剂进行治疗。在未发生感染的受试者中,泼尼松的剂量中位数为10.0(6.3,15.0) mg/d,82 例(90.1%)受试者使用羟氯喹,60 例(65.9%)使用免疫抑制剂治疗。2组受试者在基线期治疗方案上的差异均无统计学意义(均P>0.05)。分析2 组受试者二甲双胍使用情况,未发生感染的受试者中二甲双胍使用率显著高于发生感染的受试者,差异有统计学意义(65.9%vs 34.7%,P=0.022,表1)。
2.3 受试者发生感染的多因素Logistic回归分析
单因素分析结果显示二甲双胍的使用可能与随访期间SLE感染发生有关。将二甲双胍使用情况及其他感染相关因素纳入多元Logistic回归模型,将是否发生感染(发生感染=1,未发生感染=0)作为因变量,将是否为女性(是=1,否=0)、是否使用羟氯喹(是=1,否=0)、是否使用二甲双胍(是=1,否=0)、年龄、泼尼松使用量以及SELENASLEDAI评分作为自变量进行分析。分析结果显示,使用二甲双胍为减少感染发生的独立保护因素(表2)。
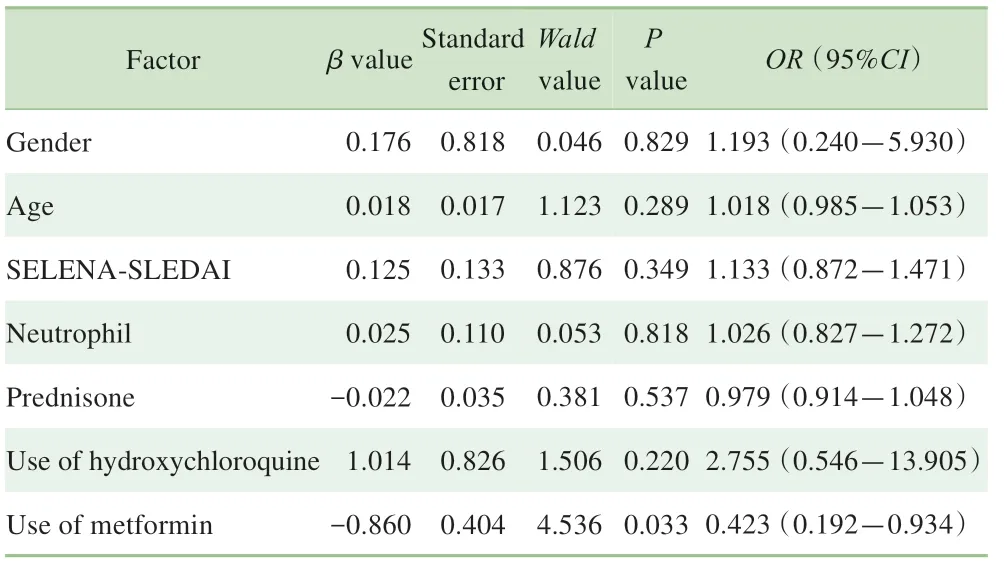
表2 受试者发生感染的多因素Logistic回归分析Tab 2 Multivariate Logistic regression analysis of the participants with infection
2.4 二甲双胍对受试者感染事件的影响
发生感染的受试者在12 个月的随访期间均只发生了1次感染。比较二甲双胍组和安慰剂组受试者的感染严重程度,差异均无统计学意义(表3)。使用二甲双胍的感染受试者中仅有1 例(5.9%)出现严重感染(急性胃肠炎,补液及使用抗生素后痊愈),而使用安慰剂的感染受试者中则有4 例(12.5%)出现严重感染(2 例肺炎、1 例肾盂肾炎、1 例急性胃肠炎),使用二甲双胍的感染受试者的严重感染发生率较低,但2 组差异无统计学意义(P=0.466)。在轻型感染方面,上呼吸道是最常见的感染部位(30 例,61.2%),主要表现为轻症的流涕、咳嗽等普通感冒症状,经研究者对症处理后患者症状均好转并消失;其次为皮肤感染(8 例,16.3%),包括甲癣4 例、带状疱疹3 例以及细菌感染1 例(表现为腿部脓疱,使用抗生素后痊愈)。
比较发生感染事件时受试者的临床情况发现,发生感染时使用二甲双胍的受试者较使用安慰剂的受试者感染持续时间更短,且差异有统计学意义(P=0.034)(表3)。同时,使用二甲双胍的受试者C 反应蛋白水平亦呈现低于安慰剂组的趋势,但差异无统计学意义(P=0.075)(表3)。而其他临床指标以及使用的治疗药物等差异均无统计学意义。

表3 发生感染时二甲双胍组和安慰剂组受试者的临床特征及SLE 治疗方案比较Tab 3 Comparison of clinical characteristics and SLE medication of participants in metformin group and placebo group during infection
生存分析结果显示,在传统SLE 治疗方案中加载二甲双胍治疗后,患者无感染生存时间显著延长(HR=0.527,95%CI=0.294~0.945,P=0.036,图1)。
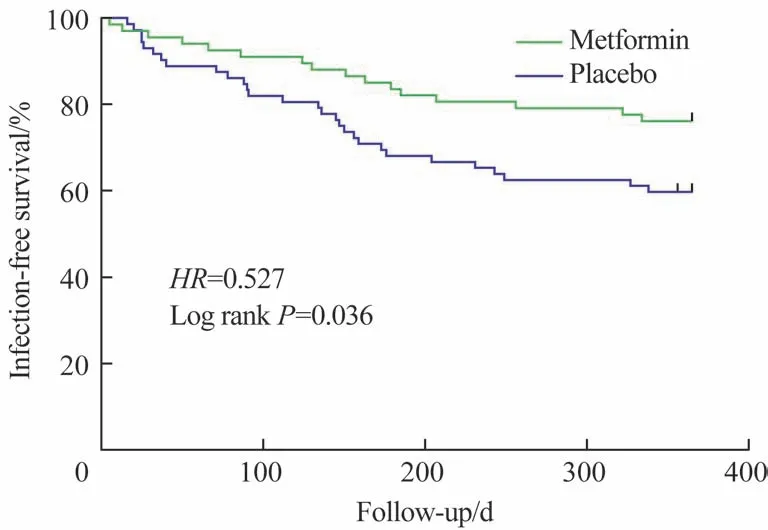
图1 二甲双胍组和安慰剂组受试者无感染生存分析比较Fig 1 Comparison of infection-free survival analysis of participants in metformin group and placebo group
3 讨论
SLE 具有复杂的发病机制,糖皮质激素[23]仍为治疗的关键药物,而激素引起的感染仍为SLE 患者最主要的死因[24],如何预防和减少感染的发生是当前临床面临的难题[25]。本研究组前期开展的概念性验证研究[16]证明了二甲双胍能降低SLE 患者疾病的复发率,同时能帮助患者减少糖皮质激素的暴露;随机对照研究[22,26]的结果显示,二甲双胍作为“Add-on”的治疗方案,具有潜在的稳定SLE 病情的作用。为了进一步探索二甲双胍能否减轻SLE 患者治疗过程中的感染风险,我们进行了此次事后分析。
本研究发现,与发生感染事件的49 例受试者相比,未发生感染事件的91例受试者有更高的二甲双胍使用率,多元回归分析结果显示使用二甲双胍的SLE 患者发生感染的风险仅是安慰剂患者的近1/2(OR=0.423)。进一步分析发现使用二甲双胍的SLE 受试者在发生感染时感染平均持续时间显著短于安慰剂组,且差异有统计学意义;而在严重感染率方面,二甲双胍组更低,但差异无统计学意义。生存分析结果提示,二甲双胍组的无感染生存时间显著延长。以上结论提示,二甲双胍对SLE 患者具有潜在的减少感染事件的作用。该结论与既往的研究相符。Singhal等[17]使用二甲双胍联用异烟肼用于结核分枝杆菌感染的小鼠,有效减少了小鼠肺部细菌的载量;Tsoyi 等[20]对败血症小鼠模型加用二甲双胍的研究显示,二甲双胍能提高小鼠存活率;Garnett等[27]对高血糖诱导的小鼠肺部金黄色葡萄球菌感染的研究提示,二甲双胍能以不依赖血糖的机制发挥抗感染的作用;多项以结核病患者为研究对象的回顾性研究[18,28]亦支持了该结论;另外,二甲双胍抗感染的作用还在乙型肝炎病毒感染、铜绿假单胞菌感染的研究[27,29-30]中得到了验证。
但二甲双胍的抗感染作用机制仍不明确。它潜在的抗感染机制可能被归因于对单磷酸腺苷依赖的蛋白激酶(adenosine 5'-monophosphate-activated protein kinase,AMPK)的活化或对线粒体呼吸链复合体Ⅰ的抑制作用[31-33],从而抑制病原菌在细胞内的生长活性[17]。由于本研究缺少机制研究方面的证据,还需要进一步的探索论证;同时,本研究纳入的SLE 受试者均为中/低活动度者,其日常糖皮质激素(泼尼松)以及免疫抑制剂使用量较低,二甲双胍对重度SLE 患者作用的评价,需要更大样本的研究来验证。
综上所述,本研究利用Met-Lupus研究的数据,进一步分析了二甲双胍在SLE 治疗中对患者感染事件的影响,提示了其潜在的减少感染事件的作用,为其未来的临床应用和研究提供了依据。
参·考·文·献
[1] Tsokos GC. Systemic lupus erythematosus[J]. N Engl J Med,2011,365(22):2110-2121.
[2] Zucchi D, Elefante E, Calabresi E, et al. One year in review 2019: systemic lupus erythematosus[J]. Clin Exp Rheumatol,2019,37(5):715-722.
[3] 刘喆,叶霜. 代谢与免疫:解析系统性红斑狼疮的新视角[J]. 中华风湿病学杂志,2016,20(8):505-507.
[4] Hahn BH. Belimumab for systemic lupus erythematosus[J]. N Engl J Med,2013,368(16):1528-1535.
[5] Lai ZW,Kelly R,Winans T,et al. Sirolimus in patients with clinically active systemic lupus erythematosus resistant to, or intolerant of, conventional medications: a single-arm, open-label, phase 1/2 trial[J]. Lancet, 2018,391(10126):1186-1196.
[6] Schneider M. Target therapy in SLE[J]. Autoimmun Rev, 2019, 18(1):21-24.
[7] Barber C, Gold WL, Fortin PR. Infections in the lupus patient: perspectives on prevention[J]. Curr Opin Rheumatol,2011,23(4):358-365.
[8] Danza A, Ruiz-Irastorza G. Infection risk in systemic lupus erythematosus patients:susceptibility factors and preventive strategies[J]. Lupus,2013,22(12):1286-1294.
[9] Morel L. Immunometabolism in systemic lupus erythematosus[J]. Nat Rev Rheumatol,2017,13(5):280-290.
[10] Sharabi A, Tsokos GC. T cell metabolism: new insights in systemic lupus erythematosus pathogenesis and therapy[J]. Nat Rev Rheumatol,2020,16(2):100-112.
[11] Teng X, Brown J, Choi SC, et al. Metabolic determinants of lupus pathogenesis[J]. Immunol Rev,2020,295(1):167-186.
[12] Teng X, Cornaby C, Li W, et al. Metabolic regulation of pathogenic autoimmunity: therapeutic targeting[J]. Curr Opin Immunol, 2019, 61:10-16.
[13] Yin Y, Choi SC, Xu Z, et al. Normalization of CD4+T cell metabolism reverses lupus[J]. Sci Transl Med,2015,7(274):274ra18.
[14] Chen FC,Kung CT,Cheng HH,et al. Metformin affects serum lactate levels in predicting mortality of patients with sepsis and bacteremia[J]. J Clin Med,2019,8(3):318.
[15] Pernicova I, Kelly S, Ajodha S, et al. Metformin to reduce metabolic complications and inflammation in patients on systemic glucocorticoid therapy: a randomised, double-blind, placebo-controlled, proof-of-concept,phase 2 trial[J]. Lancet Diabetes Endocrinol,2020,8(4):278-291.
[16] Wang H, Li T, Chen S, et al. Neutrophil extracellular trap mitochondrial DNA and its autoantibody in systemic lupus erythematosus and a proof-ofconcept trial of metformin[J]. Arthritis Rheumatol, 2015, 67(12): 3190-3200.
[17] Singhal A, Jie L, Kumar P, et al. Metformin as adjunct antituberculosis therapy[J]. Sci Transl Med,2014,6(263):263ra159.
[18] Marupuru S, Senapati P, Pathadka S, et al. Protective effect of metformin against tuberculosis infections in diabetic patients: an observational study of south Indian tertiary healthcare facility[J]. Braz J Infect Dis, 2017, 21(3):312-316.
[19] Malik F, Mehdi SF,Ali H, et al. Is metformin poised for a second career as an antimicrobial?[J]. Diabetes Metab Res Rev,2018,34(4):e2975.
[20] Tsoyi K, Jang HJ, Nizamutdinova IT, et al. Metformin inhibits HMGB1 release in LPS-treated RAW264.7 cells and increases survival rate of endotoxaemic mice[J]. Br J Pharmacol,2011,162(7):1498-1508.
[21] Kim J, Kwak HJ, Cha JY, et al. Metformin suppresses lipopolysaccharide(LPS)-induced inflammatory response in murine macrophages via activating transcription factor-3 (ATF-3) induction[J]. J Biol Chem, 2014, 289(33):23246-23255.
[22] Sun F, Wang HJ, Liu Z, et al. Safety and efficacy of metformin in systemic lupus erythematosus: a multicentre, randomised, double-blind, placebocontrolled trial[J]. Lancet Rheumatol,2020,2(4):e210-e216.
[23] Fanouriakis A,Kostopoulou M,Alunno A,et al. 2019 update of the EULAR recommendations for the management of systemic lupus erythematosus[J].Ann Rheum Dis,2019,78(6):736-745.
[24] Jorge A, McCormick N, Lu N, et al. Hydroxychloroquine and mortality among patients with systemic lupus erythematosus in the general population[J]. Arthritis Care Res(Hoboken),2020. DOI:10.1002/acr.24255.
[25] Wu W, Ma J, Zhou Y, et al. Mortality risk prediction in lupus patients complicated with invasive infection in the emergency department: LUPHAS score[J]. Ther Adv Musculoskelet Dis,2019,11:1759720X1988555.
[26] Zhang L, Geng S, Qian L, et al. Multidisciplinary care in patients with systemic lupus erythematosus: a randomized controlled trial in China[J]. Int J Clin Pharm,2019,41(5):1247-1255.
[27] Garnett JP, Baker EH, Naik S, et al. Metformin reduces airway glucose permeability and hyperglycaemia-induced Staphylococcus aureus load independently of effects on blood glucose[J]. Thorax,2013,68(9):835-845.
[28] Lin SY, Tu HP, Lu PL, et al. Metformin is associated with a lower risk of active tuberculosis in patients with type 2 diabetes[J]. Respirology, 2018(23):1063-1073.
[29] Xun YH, Zhang YJ, Pan QC, et al. Metformin inhibits hepatitis B virus protein production and replication in human hepatoma cells[J]. J Viral Hepat,2014,21(8):597-603.
[30] Patkee WR, Carr G, Baker EH, et al. Metformin prevents the effects of Pseudomonas aeruginosa on airway epithelial tight junctions and restricts hyperglycaemia-induced bacterial growth[J]. J Cell Mol Med, 2016, 20(4):758-764.
[31] Shaw RJ, Lamia KA, Vasquez D, et al. The kinase LKB1mediates glucose homeostasis in liver and therapeutic effects of metformin[J]. Science, 2005,310(5754):1642-1646.
[32] Zhang CS, Li M, Ma T, et al. Metformin activates AMPK through the lysosomal pathway[J]. Cell Metab,2016,24(4):521-522.
[33] Zhou G, Myers R, Li Y, et al. Role of AMP-activated protein kinase in mechanism of metformin action[J]. J Clin Invest,2001,108(8):1167-1174.

