以钩端螺旋体重组蛋白为包被抗原的间接ELISA 检测试剂盒的研制与性能评测
钱 杰,杨 坚,张 玥,张 蓉,张湘燕,郭晓奎,
1.上海交通大学医学院免疫学与微生物学系,上海200025;2.上海科新生物技术股份有限公司,上海201203;3.上海交通大学医学院-国家热带病研究中心全球健康学院,卫生部寄生虫病原与媒介生物学重点实验室,上海200025
钩端螺旋体病是一种由致病性钩端螺旋体(简称钩体)感染而引起的人兽共患病。该疾病在我国多省市均有流行,被列为法定报告传染病。其好发于雨季及洪涝灾害地区,啮齿类动物、犬、猪等为重要传染源[1-2],对人畜危害较大[3]。钩体病的主要临床表现为发热、寒战、黄疸、出血、肝脾肿大、肾功能衰竭等,与流行性感冒、病毒性出血热、脑膜炎、登革热、疟疾等传染性疾病及肾盂肾炎、化学中毒和食物中毒等非传染性疾病相类似。目前,实验室钩体培养法和基于活的钩体标准菌株的显微镜凝集试验(microscopic agglutination test,MAT)仍是诊断和监测钩体病的金标准[2],且国内尚无对钩体感染者进行钩体抗体检测的成品试剂盒。
钩体外膜具有抗原性,是抗体和补体的作用部位。钩体外膜蛋白(outer membrane proteins,OMPs)参与钩体与宿主黏附,在引起宿主免疫和致病过程中发挥着重要作用[4]。2003—2004 年中国问号钩体赖型赖株与巴西钩体哥本哈根型的全基因组测序完成,共报道了数百种可能与OMPs 相关的基因[5-6],该项工作为遴选钩体保守的OMPs及免疫检测靶抗原提供了可能。
本研究选择我国主要致病性钩体流行株的高度保守的OMP 重组蛋白作为包被抗原,经临床样本测试后建立敏感性与特异性较为理想的检测方法,并研制钩体特异性抗体间接酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)检测试剂盒(下文简称“试剂盒”),用于钩体病患者血清中的钩体IgG抗体的检测,从而为钩体病的诊断、监测及流行病学调查提供有利工具。
1 材料与方法
1.1 血清样本、主要仪器及试剂
本研究检测的血清样本来自本实验室血清库,包括40 例经MAT 测定的钩体病患者、50 例经MAT 测定的其他感染类疾病患者和391例健康对照者的血清样本。
Mastercycler personal PCR 仪(Eppendorf,德国),PowerPac Universal 电泳仪(Bio-Rad,美国),5800 MALDI-TOF/TOF 串联质谱仪(ABI,美国),MK3 酶标仪(Thermo,美国),Savant 冷冻干燥离心浓缩仪(Thermo,美国),SPX-808SH-Ⅱ生化培养箱(上海新苗医疗器械制造有限公司),96孔酶标板(Greiner,德国),辣根过氧化物酶标记羊抗人IgG 抗体(Sigma,美国)。其他酶联免疫反应试剂均由上海科新生物技术股份有限公司制备。
1.2 主要材料制备
1.2.1 包被抗原的制备与鉴定
根据前期研究[7],钩体OMP 重组蛋白以问号钩体黄疸出血群赖株的基因组为模板,表达载体为Pet28b,表达菌株为E. coil BL21。用1 mmol/L IPTG(异丙基硫代半乳糖苷)于22 ℃诱导表达16 h 后收集菌体,超声裂解该菌体后,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测OMP 重组蛋白的表达,并采用Ni-NTA 亲和层析法进行纯化,最终获得的OMP 重组蛋白即为包被抗原。将包被抗原送至生工生物工程(上海)股份有限公司进行基质辅助激光解析离子化串联飞行时间质谱鉴定。
1.2.2 试剂盒对照品及参考品的制备及用途
(1) 阳性对照品及阳性参考品的制备及用途 从钩体病确诊患者血清中选择经MAT 与ELISA 检测为钩体抗体强阳性的血清若干份,将其混合后制备成高效价混合阳性血清。用含1% 牛血清白蛋白的磷酸盐缓冲液(PBST)按一定比例稀释该阳性血清,得到试剂盒阳性对照品。该阳性对照品为试剂盒的组成成分,用于试剂盒的质量控制。从钩体病确诊患者的血清中选择经MAT与ELISA检测为钩体抗体阳性的血清(5份)作为试剂盒阳性参考品,为实验室内部参考品,用于试剂盒稳定性评估中的真阳性率(即阳性参考品在当次检测中被判断为阳性的例数与阳性参考品总例数的比值)的评估。
(2) 阴性对照品及阴性参考品的制备及用途 从健康对照者血清中选择经MAT 和ELISA 检测为钩体抗体阴性的血清,用PBST 按1∶100 对阴性血清进行稀释即为试剂盒阴性对照品。该阴性对照品为试剂盒的组成成分,用于试剂盒的质量控制。从健康对照者血清中选择经MAT 和ELISA 检测为钩体抗体阴性的血清(5 份)作为试剂盒阴性参考品,为实验室内部参考品,用于试剂盒稳定性评估中的真阴性率(即阴性参考品在当次检测中被判断为阴性的例数与阴性参考品总例数的比值)的评估。
(3) 弱阳性对照品(临界参考品)及灵敏度参考品 的 制 备 及 用 途 用PBST 按1∶6 000、1∶6 100、1∶6 200、……、1∶8 900、1∶9 000 的比例将高效价混合阳性血清进行梯度稀释,与391 例健康对照者血清行ELISA 同批检测。将检测获得的健康对照者血清的D(450 nm/630 nm)的平均值加上3倍标准差记为临界值(99% CI),确定检测值与该临界值相当的高效价混合阳性血清的稀释比例,而后将高效价混合阳性血清按此比例进行稀释,制备得到弱阳性对照品(即临界参考品)。该弱阳性对照品为试剂盒的组成成分,其检测D(450 nm/630 nm)相当于在血清样本中钩体抗体浓度为25 RU/mL(RU 为relative unit,即相对单位)。将弱阳性对照品在每次实验中测得的D(450 nm/630 nm)作为定性检测的临界值,以判断待检血清中的抗体浓度。用PBST对弱阳性对照品进行5倍稀释得到灵敏度参考品,该参考品为实验室内部参考品,用于对试剂盒的检测限进行评估。
(4) 精密度参考品的制备及用途 从钩体病确诊患者血清中选择强阳性、弱阳性血清各1份,分别作为强阳性、弱阳性精密度参考品。该参考品为实验室内部参考品,用于对试剂盒的精密度评估。
1.3 包被抗原的抗原性检测
将包被抗原用0.05 mol/L、pH 9.6 的碳酸盐缓冲液分别稀释成1、2、5、10 μg/mL包被酶标板,用阳性参考品(包括强阳性、弱阳性)和阴性参考品对包被抗原酶标板进行检测。
1.4 试剂盒检测体系的建立
试剂盒的主要工艺包括酶标板的包被、封闭、干燥等,反应体系包括包被抗原浓度和二抗最佳比例、样本稀释比例、二抗孵育时间、显色时间、反应温度等,试剂配方包括样本缓冲液、二抗稀释液、显色底物液、终止液等。通过对该试剂盒的检测体系进行摸索、优化及验证,最终选择出试剂盒的最佳制备工艺及反应条件。
1.5 试剂盒的性能指标评估
1.5.1 分析性能评估 主要性能指标包括:精密度、敏感性和特异性。精密度包括批内精密度、批间精密度。敏感性和特异性包括分析敏感性和分析特异性、临床样本检测敏感性和临床样本检测特异性。具体检测步骤如下。
(1) 精密度检测 选择强阳性、弱阳性精密度参考品进行精密度检测。①批内精密度:在同一批试剂盒的同一次检测中重复测定上述精密度参考品各10 次,分别计算测定结果的均值(x)及标准差(s);通过均值/标准差计算批内变异系数(coefficient of variance,CV),以评估该试剂盒的批内精密度(批内重复性),CV<15%即为批内精密度良好。②批间精密度:分别在3批试剂盒中重复测定上述精密度参考品各10 次,计算测定结果的均值(x)及标准差(s);通过均值/标准差计算批间CV,以评估该试剂盒的批间精密度(批间重复性),CV<20%即为批间精密度良好。
(2) 敏感性和特异性检测 采用试剂盒对40 份钩体病患者血清、50 份其他感染类疾病患者血清和50 份健康对照者血清进行检测,并与MAT 检测的结果进行比对,分析试剂盒的检测敏感性和特异性。公式如下:
临床样本检测敏感性=(钩体病患者样本中检测为阳性的样本数/钩体病患者的样本总数)×100%;
临床样本检测特异性=(其他感染类疾病患者和健康对照者中检测为阴性的样本数/其他感染类疾病患者和健康对照者的样本总数)×100%;
分析敏感性=(钩体病患者样本中由MAT 与试剂盒共同检测为阳性的样本数/MAT 检测为阳性的样本数)×100%;
分析特异性=(其他感染类疾病患者和健康对照者中由MAT 与试剂盒共同检测为阴性的样本数/MAT 检测为阴性的样本数)×100%。
符合率=(共同检测为阳性的样本数+共同检测为阴性的样本数/总样本数)×100%。
1.5.2 稳定性评估 评估试剂盒在实际储存条件下(2~8 ℃)和加速条件下[(37±1)℃]的稳定性(热稳定性),主要评估的技术指标包括阴性、弱阳性、阳性对照品D(450 nm/630 nm),阴性、阳性参考品的真阴性率和真阳性率,灵敏度参考品D(450 nm/630 nm)及试剂盒的批内精密度。试剂盒需同时满足以下4项即被认定是稳定的:①阳性对照品D 值/阴性对照品D 值≥4.0,弱阳性对照品D 值/阴性对照品D 值≥2.0。②阳性参考品的真阳性率和阴性参考品的真阴性率均达到100%。③灵敏度参考品D值≥0.100。④试剂盒批内CV<15%。
对3批试剂盒行实际储存条件下的稳定性评估,即每批试剂盒在2~8 ℃条件下分别存放0、6、9、12、14、18个月后对上述各项技术指标进行检测。其中,批内CV的测定方法为:选择3份精密度参考品(即强阳性、阳性和弱阳性各1 份)作为测定样本,用每1 批试剂盒对该3 份精密度参考品分别重复测定10 次。计算测定结果D(450 nm/630 nm)的均值及标准差,求出CV。
对其中1批试剂盒进行加速条件下的稳定性评估,即ELISA 试剂盒有效期(即稳定性)的最低要求为2~8 ℃下稳定12 个月。将试剂盒置于(37±1)℃条件下,设定在加速6 d 后对上述各项技术指标进行测试,合格后继续加速测试。比较分析加速实验前(37 ℃)及加速6、7、8 d 后试剂盒的上述各项技术指标,具体方法同试剂盒在实际储存条件下的稳定性评估。
同时,对3批试剂盒开封后的稳定性进行研究,即于2~8 ℃条件下开封后6 个月,对其各项技术指标进行分析,方法同试剂盒在实际储存条件下的稳定性评估。
2 结果
2.1 包被抗原的鉴定
经SDS-PAGE 检测,包被抗原相对分子质量为31 000,符合预期。包被抗原经质谱鉴定显示其为一种OMP(图1);将质谱分析得到的氨基酸序列和NCBI 数据库中的蛋白序列进行比对,结果显示测得的氨基酸序列同目的蛋白序列一致,符合率为100%。

图1 包被抗原的串联质谱图Fig 1 Tandem mass spectrum of coated antigen
2.2 临界值的确定与临界参考品的制备
对391例健康对照者的血清检测结果进行统计分析,结果(图2)显示,检测D(450 nm/630 nm)平均值为0.121、标准差为0.040 3。经计算其临界值为0.241 9,与稀释比例为1∶8 100的高效价混合阳性血清的检测值相当。因此,将高效价混合阳性血清按此比例稀释,即得到临界参考品。
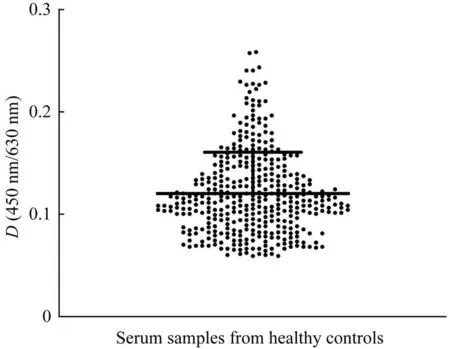
图2 ELISA检测391例健康对照者血清的D(450 nm/630 nm)分布Fig 2 Distribution of D(450 nm/630 nm)detected with 391 healthy serum controls by ELISA
2.3 包被抗原的抗原性检测分析
将纯化后的重组OMP 作为包被抗原,阳性参考品和阴性参考品的检测结果为弱阳性参考品检测D(450 nm/630 nm) 值大于0.3、强阳性参考品检测D (450 nm/630 nm) 值大于1.0、阴性参考品检测D (450 nm/630 nm)值小于0.2,表明该蛋白作为包被抗原具有较强的抗原性(灵敏度)和较低的阴性参考品检测值(特异性),且从4 种包被浓度的检测结果来看1 μg/mL 的包被浓度已可明显区分阳性参考品(包括强阳性、弱阳性)和阴性参考品(表1)。
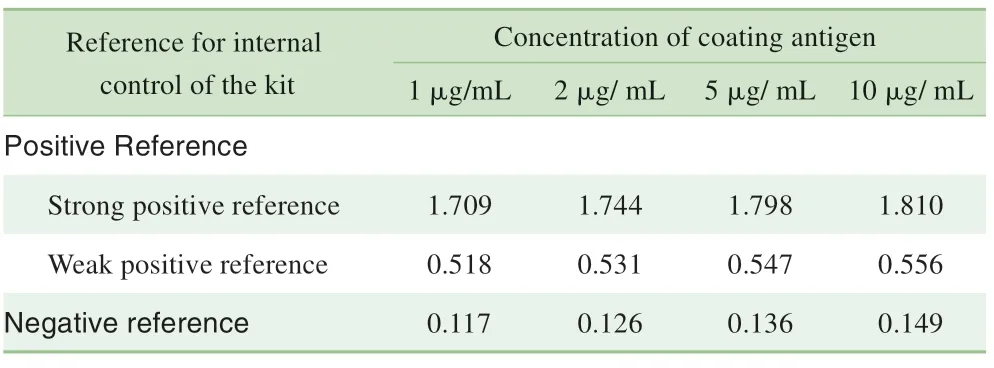
表1 包被抗原的抗原性检测Tab 1 Detection of antigenicity of the coating antigen
2.4 试剂盒检测体系的建立
本研究经过摸索、验证及优化,检测体系建立如下:以0.05 mol/L、pH 9.6 的碳酸盐缓冲液作为包被缓冲液,稀释包被抗原为2µg/mL,并于2~8 ℃包被酶标板18 h 以上。用PBST 作为封闭液,于37 ℃下封闭2 h。用含1%牛血清白蛋白、0.05%吐温-20 的磷酸盐缓冲液将待检血清按1∶101 稀释后加入酶标板中(100 μL/孔),37 ℃下温育30 min,洗板3 遍后拍干;加100 µL 二抗,37 ℃下温育30 min,洗板4 遍后拍干;加100µL 底物和50µL 显色剂,37 ℃下温育30 min,加50 µL 终止液。而后,分别于450 nm和630 nm波长下读取D值。
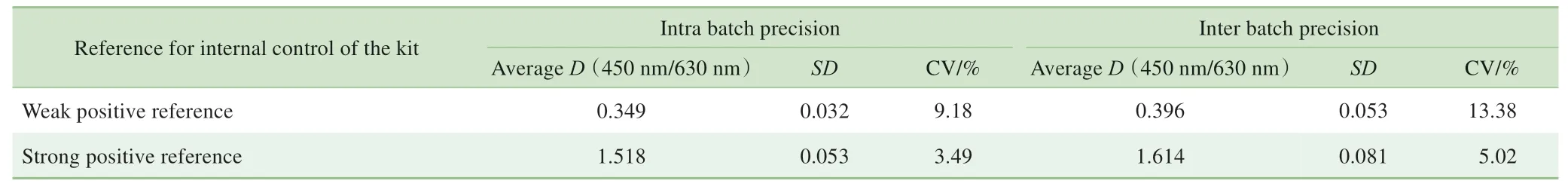
表2 试剂盒的批内精密度及批间精密度检测结果Tab 2 Results of intra and inter batch precision test of the kit
2.5 试剂盒的批内精密度和批间精密度的检测分析
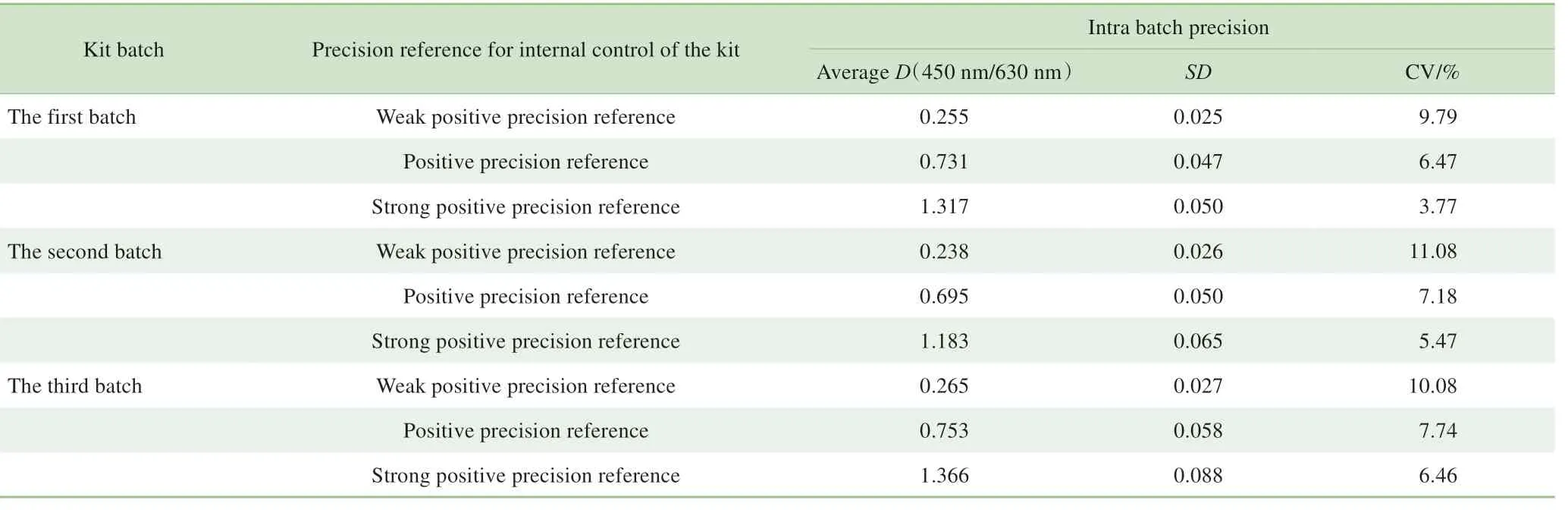
采用精密度参考品对试剂盒进行精密度分析,结果(表2)显示,精密度参考品的批内CV均小于15%,即试剂盒的批内精密度较好;精密度参考品的批间CV 均小于20%,即试剂盒的批间精密度亦较好。
2.6 试剂盒的敏感性和特异性的检测分析
采用试剂盒对40 份钩体病患者血清、50 份其他感染类疾病患者血清、50 份健康对照者血清进行检测,并于MAT 检测的结果进行比对。结果显示,试剂盒的临床样本检测敏感性为95.0%、临床样本检测特异性为95.0%;经统计分析,试剂盒的分析敏感性为91.1%、分析特异性为97.9%、符合率为95.7%。具体数据见表3、4。
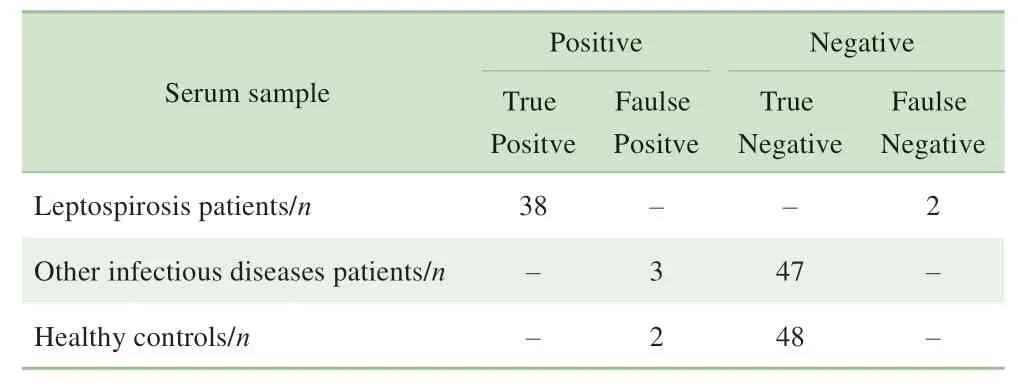
表3 试剂盒检测钩体病患者、其他感染类疾病患者及健康对照者的血清样本的结果Tab 3 Results of serum samples from patients with leptospirosis,patients with other infectious diseases and healthy controls detected by the kit
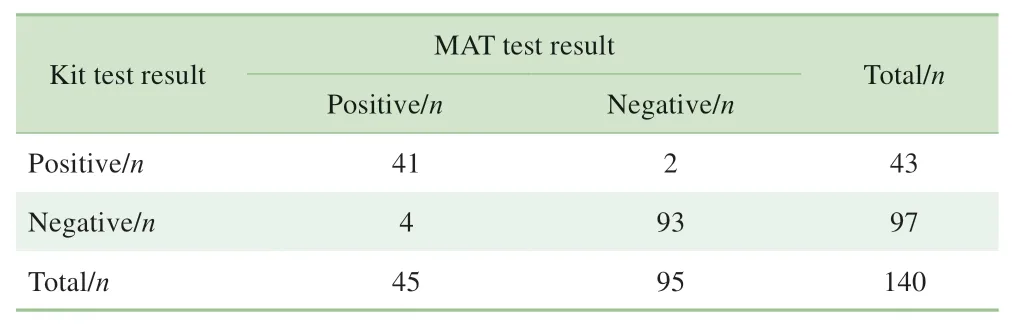
表4 试剂盒检测结果与MAT检测结果的比较(N=140)Tab 4 Comparison of kit test results and MAT test results(N=140)
2.7 实际储存条件下试剂盒的稳定性评估
基于稳定性评估中各个检测时间点的数据较多,且ELISA试剂盒有效期的一般要求为2~8 ℃下稳定12个月,因此本研究仅针对2~8 ℃条件下存放12个月后的试剂盒稳定性数据进行展示。对每批试剂盒的多个技术指标进行评估,结果显示,3批试剂盒的阴、阳性对照品D(450 nm/630 nm)(表5)、阳性参考品的真阳性率、阴性参考品的真阴性率(表6)及灵敏度参考品D(450 nm/630 nm)(分别为0.121、0.123和0.110)、批内CV(表7)均符合要求;继而表明,在上述条件下该试剂盒的稳定性良好。
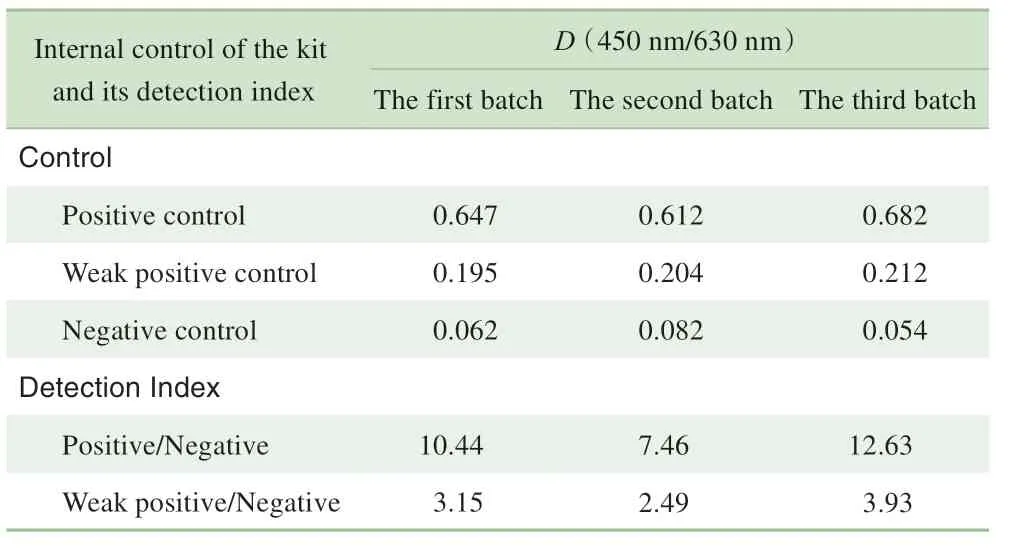
表5 2~8 ℃条件下存放12个月后3批试剂盒检测阳性、阴性对照品的结果Tab 5 Results of positive and negative internal control detected by three batches of the kit after storage for 12 months at 2-8 ℃
在2~8 ℃条件下对存放14 个月后的试剂盒稳定性进行检测,结果显示其各项技术指标仍较好(数据略);而存放18 个月后,3 批试剂盒对弱阳性精密度参考品检测的批内CV 均超过15%(分别为15.2%、18.1%和17.9%),即批内精密度不符合要求(数据略)。
2.8 加速稳定条件下试剂盒的稳定性评估
加速条件下对试剂盒的稳定性进行测评,结果(表8)显示加速6 d后试剂盒的阳性对照品D(450 nm/630 nm)/阴性对照品D(450 nm/630 nm)=10.42、弱阳性对照品D(450 nm/630 nm)/阴性对照品D(450 nm/630 nm)=3.15,阳性参考品的真阳性率和阴性参考品的真阴性率均为100%,灵敏度参考品D(450 nm/630 nm)不小于0.1,均符合试剂盒稳定性要求。
37 ℃加速6、7 d 后,采用3 份精密度参考品(强阳性、阳性和弱阳性)检测试剂盒的精密度,显示试剂盒的批内CV 均低于15%;而加速8 d 后试剂盒对弱阳性精密度参考品的批内CV为18.7%,即为不合格(表9)。
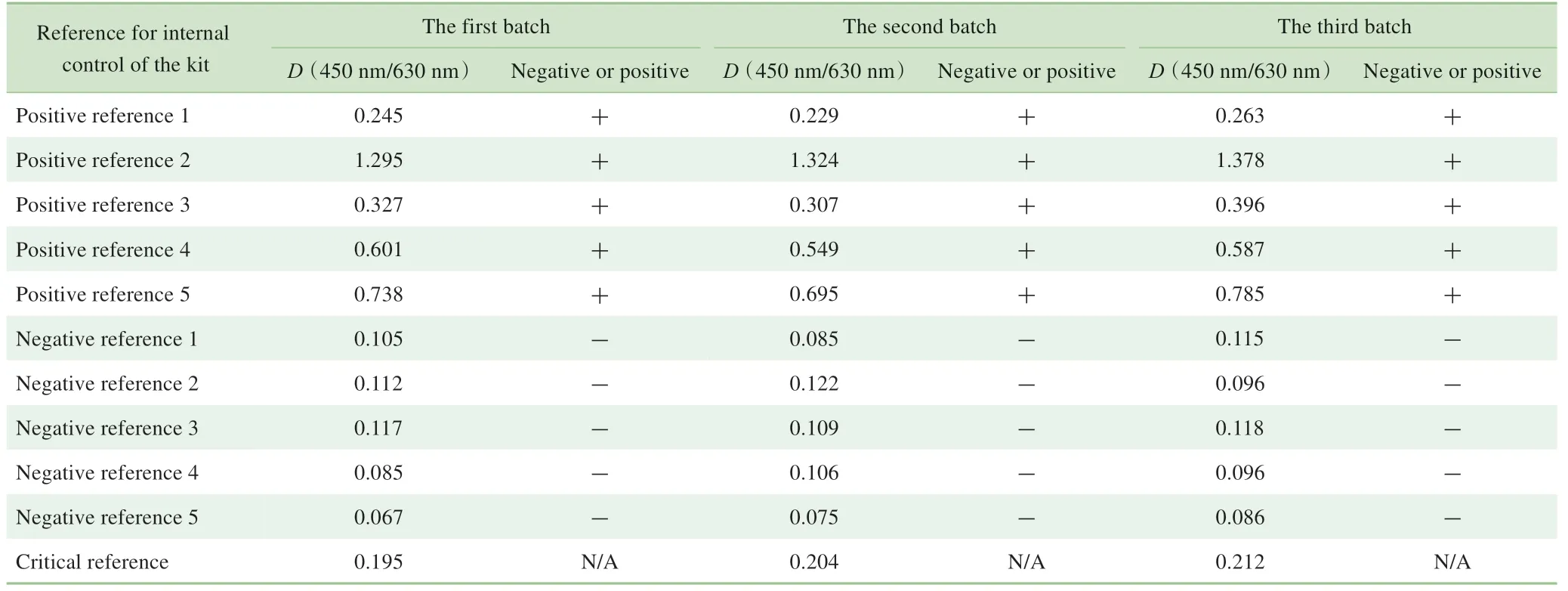
表6 2~8 ℃下存放12个月后3批试剂盒检测阴性、阳性参考品的结果及判断Tab 6 Results and evaluation of the coincidence rate of negative and positive reference for internal control detected by three batches of the kits after storage for 12 months at 2-8 ℃
Kit batch Precision reference for internal control of the kit Intra batch precision Average D(450 nm/630 nm)SD CV/%The first batch The second batch The third batch Weak positive precision reference Positive precision reference Strong positive precision reference Weak positive precision reference Positive precision reference Strong positive precision reference Weak positive precision reference Positive precision reference Strong positive precision reference 0.255 0.731 1.317 0.238 0.695 1.183 0.265 0.753 1.366 0.025 0.047 0.050 0.026 0.050 0.065 0.027 0.058 0.088 9.79 6.47 3.77 11.08 7.18 5.47 10.08 7.74 6.46

表7 2~8 ℃下存放12个月后3批试剂盒的批内精密度检测结果Tab 7 Intra batch precision results of three batches of the kits after storage for 12 months at 2-8 ℃
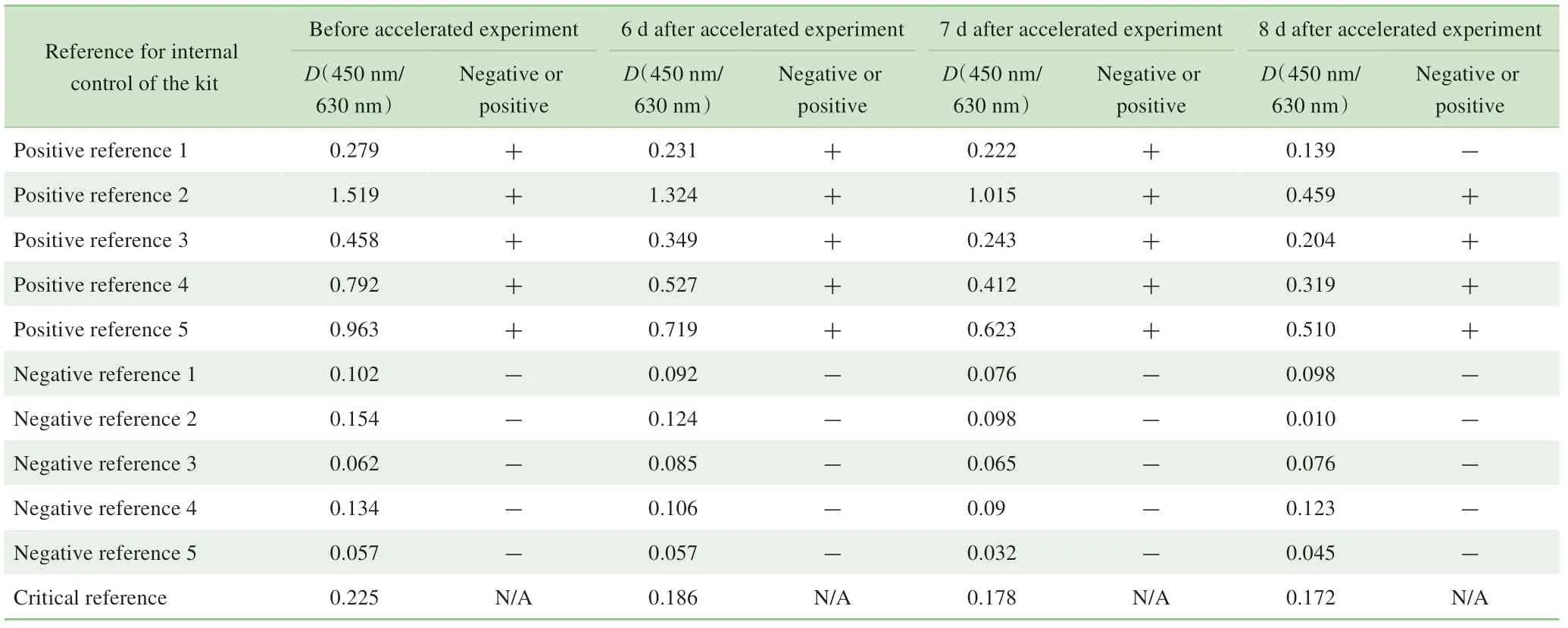
表8 加速实验前、后试剂盒检测阴性、阳性参考品的结果及判断Tab 8 Results and evaluation of negative and positive reference for internal control detected by kit before and after accelerated experiment
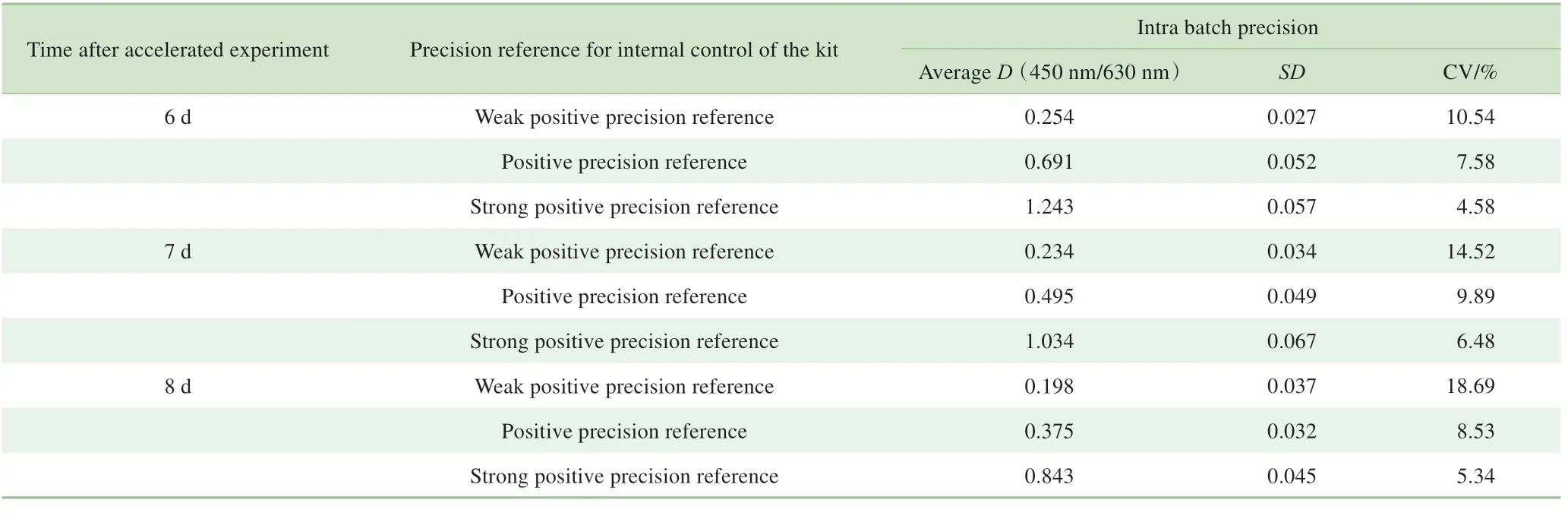
表9 加速6~8 d后试剂盒的批内精密度检测结果Tab 9 Intra batch precision results of the kit 6-8 d after accelerated experiment
2.9 试剂盒开封后的稳定性检测
将试剂盒开封后于2~8 ℃条件下存放6个月,并对其稳定性进行检测。结果显示,试剂盒的阳性对照品D(450 nm/630 nm)/阴性对照品D(450 nm/630 nm)、弱阳性对照品D(450 nm/630 nm)/阴性对照品D(450 nm/630 nm)、阳性参考品的真阳性率、阴性参考品的真阴性率、灵敏度参考品D(450 nm/630 nm)、批内精密度均符合要求合格,即在开封后6个月试剂盒依然有效。具体数据略。
3 讨论
目前,国外已有将钩体保守的OMPs用于钩体感染患者行血清抗体检测[8]、将提纯的钩体抗原用于感染犬的血清学抗体检测[9]等的相关研究,但上述研究并未在临床上广泛应用;而在国内,类似上述研究仍处于起步阶段[10-11]。研究[12-13]显示,针对血清样本中的钩体特异性核酸常采用PCR 进行检测,但该方法对仪器设备、样本预处理的要求较高,且检测时间较长。截至目前,钩体培养法和MAT仍是诊断和监测钩体病的金标准[3,14]。其中,钩体培养法需在生物安全实验室中,对钩体活菌培养2 周以上[1];MAT 则需将活的钩体标准株与感染者血清进行孵育培养,且需在暗视野显微镜下长时间观察[15]。因此,该2 种方法均无法对人群行大规模的快速筛查,亦无法对钩体病行早期诊断。
近期,本研究对国家药品监督管理局的医疗器械数据库进行检索后发现,目前国内尚无已获得医疗器械注册许可证的钩体感染诊断试剂应用于医疗机构的钩体感染检测。在国外,钩体感染商品化检测试剂盒主要有Lepto-LAT、Lepto Rapid Test、Lepto Dri Dot Test,而上述试剂盒均未在国内上市。
目前,国外实验室较常采用ELISA 对钩体患者血清的特异性抗体进行检测,但由于检测使用的钩体抗原存在地区流行差异,国外ELISA 试剂盒对我国的钩体感染检测效果并不理想。在本研究中,我们选择国内钩体流行株中高度保守的OMPs[7]的重组蛋白作为包被抗原,并采用间接ELISA 检测钩体感染者血清样本中的IgG 抗体。结果显示,我们研制的钩体特异性抗体间接ELISA检测试剂盒的物理性状、阴性符合率、阳性符合率、灵敏度、精密性、稳定性等的技术指标表现良好,符合定性检测试剂盒的技术要求;稳定性测试结果表明,3批试剂盒的稳定性均达到12 个月以上。同时,该试剂盒的检测结果准确、可靠,能够在2~3 h 内完成对上百份样本的检测,操作快速、简便,因此其可适用于国内临床检验科室、临床实验室及疾控中心等的钩体病辅助诊断、钩体病防控哨点监测及流行病学调查。
参·考·文·献
[1] 程孝连,李俊,张进,等. 钩端螺旋体病暴发疫情感染危险因素的调查分析[J]. 中国人兽共患病学报,2017,33(12):1131-1135.
[2] 周价,黄昕,何华先,等. 洪灾区钩端螺旋体宿主动物及健康人群感染情况的流行病学研究[J]. 中南大学学报(医学版),2009,34(2):99-103.
[3] 严杰,戴保民,于恩庶. 钩端螺旋体病学[M]. 3 版. 北京:人民卫生出版社,2006.
[4] Haake DA, Chao G, Zuerner RL, et al. The leptospiral major outer membrane protein LipL32 is a lipoprotein expressed during mammalian infection[J]. Infect Immun,2000,68(4):2276-2285.
[5] Ren SX,Fu G,Jiang XG,et al. Unique physiological and pathogenic features of Leptospira interrogans revealed by whole-genome sequencing[J]. Nature,2003,422(6934):888-893.
[6] Nascimento AL, Verjovski-Almeida S, Van Sluys MA, et al. Genome features of Leptospira interrogans serovar Copenhageni[J]. Braz J Med Biol Res,2004,37(4):459-477.
[7] 郭晓奎, 杨宏亮, 朱泳璋, 等. 钩端螺旋体两个疫苗候选的外膜蛋白:CN200710042222.X[P]. 2008-12-24.
[8] Yaakob Y, Rodrigues KF, Opook F, et al. Recombinant LipL32 protein developed using a synthetic gene detects Leptospira-specific antibodies in human serum samples[J]. Malays J Med Sci,2017,24(5):44-51.
[9] Sathiyamoorthy A, Selvaraju G, Palanivel KM, et al. Development of indirect enzyme-linked immunosorbent assay for diagnosis of canine leptospirosis[J]. Vet World,2017,10(5):530-535.
[10] 胡玉山,刘巧谊,肖丽红,等. 以重组融合蛋白为基础的钩端螺旋体酶联免疫吸附试验检测试剂盒的初步研制[J]. 实用预防医学, 2019, 26(7):808-811.
[11] 张湘燕,于洋,王亚琳,等. 钩端螺旋体外膜蛋白LipL45相关基因的保守性分析及在诊断中的初步应用[J]. 中华实用诊断与治疗杂志,2009,23(1):6-9.
[12] 蒋秀高,聂一新,顾莉莉,等. PCR 技术在钩端螺旋体病传染源监测中的应用[J]. 中国人兽共患病杂志,2001,17(1):108-109.
[13] 娄银莹,周梦洁,张颖欣,等. 2017—2019 北京地区犬钩端螺旋体病流行病学调查[J]. 中国人兽共患病学报,2020,36(1):56-59.
[14] 张翠彩,张汀兰,徐建民,等. 2016—2018 年江西省钩端螺旋体病鼠类动物流行病学调查与分离菌株鉴定[J]. 中国人兽共患病学报,2019,35(12):1080-1084.
[15] Niloofa R, Fernando N, de Silva NL, et al. Diagnosis of leptospirosis:comparison between microscopic agglutination test, IgM-ELISA and IgM rapid immunochromatography test[J]. PLoS One,2015,10(6):e0129236.

