胚龄对于CC级别单囊胚冻融移植周期妊娠结局的影响
赵 明,黄 亚,杜 通,林嘉盈,祁秀娟,徐 利,陆文怡,匡延平
1.上海永远幸妇科医院生殖医学中心,上海200131;2.上海交通大学医学院附属第九人民医院辅助生殖科,上海200011
随着囊胚培养技术的成熟,囊胚移植的应用愈加广泛。囊胚移植比分裂期胚胎移植的临床妊娠率更高[1],这可能是因为由于囊胚的体外培养过程,能够淘汰部分遗传物质异常的囊胚,并且内膜和胚龄更为同步[2-5]。单胚胎移植策略可有效避免多胎妊娠及其引起的妊娠期高血压、早产、不良出生结局等风险,并且研究表明单胚胎移植策略不会降低累计妊娠率[6-7]。为获得最佳的临床结局,需要选择一个具有足够发育潜能的囊胚进行移植。研究[8-10]表明,囊胚质量与妊娠结局密切相关,高质量囊胚的妊娠结局最好。
由于低质量囊胚的发育潜能不如高质量囊胚,很多生殖中心不冻存CC 级别囊胚[11]。但对于难以获得高质量囊胚的患者,移植CC 级别囊胚会增加患者的受孕机会。然而,对于移植CC 级别囊胚的临床结局情况,以及不同胚龄对于CC 级别囊胚的妊娠结局的影响等问题国内外研究资料较少,结论尚不明确。本研究旨在探讨移植CC 级别囊胚的妊娠结局情况以及不同胚龄对于CC 级别囊胚冻融移植周期妊娠结局的影响。
1 对象与方法
1.1 研究对象
本研究回顾性分析了从2017年4月—2019年12月于上海永远幸妇科医院进行单个冻融囊胚移植的565例患者资料。纳入标准:①单囊胚移植周期。②冷冻复苏移植周期。排除标准:①未经处理的输卵管积水。②先天或后天生殖道畸形。③夫妻任意一方染色体核型分析异常。若患者进行了多个移植周期,仅纳入第一个移植周期。
本中心采用Gardner 评分系统[12],从囊胚发育分期、内细胞团和滋养层细胞3个方面对囊胚质量进行评价。囊胚发育分期:1期,囊胚腔小于胚胎总体积的1/2;2期,囊胚腔大于胚胎总体积的1/2;3期,囊胚腔完全占据了胚胎的总体积;4期,囊胚腔完全充满胚胎,胚胎总体积变大,透明带变薄;5期,囊胚的一部分从透明带中逸出;6期,囊胚全部从透明带中逸出。内细胞团分级:A级,细胞数目多,排列紧密;B级,细胞数目少,排列松散;C级,细胞数目很少。滋养层细胞分级:A级,细胞较多,结构致密;B级,细胞不多,结构松散;C级,细胞稀少,结构疏松。本研究中将4~6期AA、AB、BA级别囊胚定义为高质量囊胚,4~6期BB、AC、CA级别囊胚定义为中质量囊胚,4~6期CB、BC级别囊胚定义为低质量囊胚,将4~6期CC级别囊胚定义为CC级别囊胚[8,11]。所有纳入移植周期依据囊胚质量分为:高质量囊胚组(n=189)、中质量囊胚组(n=114)、低质量囊胚组(n=140)和CC级别囊胚组(n=122)。
1.2 研究方法
1.2.1 囊胚培养 自然周期、微刺激、激动剂、拮抗剂等常规促排卵方案参照《辅助生殖促排卵药物治疗专家共识》进行[13]。高孕激素状态下促排卵方案(progestin primed ovarian stimulation,PPOS) 在我们先前发表论文[14]中有详细描述,常规方法为自患者月经第3 日起予以每日甲羟孕酮(浙江仙琚制药股份有限公司)4 mg 口服和人类绝经期促性腺激素(human menopausal gonadotropin,hMG)150~225 IU(丽珠医药集团股份有限公司)肌内注射,直至诱发排卵。取卵后4~6 h 进行体外受精(in vitro fertilization,IVF)或者卵质内单精子注射(intracytoplasmic sperm injection,ICSI)。囊胚培养采用序贯培养液,在37 °C 条件下培养。受精后第5 日(D5)观察胚胎并冷冻优质胚胎,其余胚胎则继续培养至第6日(D6)或第7日(D7)进行冷冻。
1.2.2 囊胚冷冻与复苏 采用Cryotop冷冻载杆(Kitazato Corporation,日本)进行胚胎冷冻。冷冻前利用激光对胚胎进行人工皱缩,并将胚胎放置培养液中5~15 min。随后将胚胎转入冷冻液中放置1 min,并在90 s 内转移至Cryotop 上,放入液氮中保存。复苏时,将胚胎从液氮中移出并迅速转移至37℃的解冻液1 min,然后依次将胚胎转入稀释液、初次洗涤液、二次洗涤液中分别室温放置3 min、5 min 和1 min[15]。随后将胚胎转入囊胚培养液中37 ℃培养,2 h 后移植。采用Hamilton 激光打孔仪(Hamilton,美国;型号ZILOS-tk)对胚胎进行激光打孔辅助孵化。去除透明带后,培养2~6 h后进行移植。
1.2.3 内膜准备 (1)自然周期:月经规律者,自月经周期第10~12日起阴道B超检测排卵。排卵后即开始黄体支持,排卵后第5日进行胚胎移植。
(2)微刺激周期:月经不规律及排卵障碍者,自月经第3 日起每日服用来曲唑(江苏恒瑞医药股份有限公司)2.5~5.0 mg,共计服用3~5 d;月经第10日复查B超,若主卵泡直径<14 mm,则隔日注射hMG 150 IU,直到诱发排卵。排卵后开始黄体支持,排卵后第5日进行胚胎移植。
(3)人工周期:月经不规律及内膜薄病史者,自月经第3 日起服用口服雌二醇(Abbott Healthcare Products,荷兰),当内膜厚度超过8 mm 后开始黄体支持,在黄体支持的第6日进行胚胎移植。
黄体支持为口服地屈孕酮(Abbott Healthcare Products,荷兰)、口服雌二醇地屈孕酮片(Abbott Healthcare Products,荷兰)和阴道塞入黄体酮软胶囊(法国Laboratoires,法国),黄体支持持续到妊娠后8周。
1.2.4 妊娠结局判定 生化妊娠定义为移植后14 d 血β-人绒毛膜促性腺激素(β-human chorionic gonadotropin,β-HCG)>5 IU/L。生化妊娠率=生化妊娠周期数/移植囊胚周期数×100%。临床妊娠定义为移植后35 d B超下见妊娠囊及原始心管搏动。临床妊娠率=临床妊娠周期数/移植囊胚周期数×100%。早期流产定义为妊娠12 周内自然或人工流产。早期流产率=早期流产妊娠数/临床妊娠周期数×100%。持续妊娠率的定义为妊娠20 周及以后周期数/移植囊胚周期数×100%。异位妊娠率的定义为异位妊娠数/临床妊娠周期数×100%。
1.3 统计学方法
采用R 语言(3.6.1)进行数据处理和统计分析。采用Shapiro-Wilktest 检验正态分布和Levene's test 检验方差齐性。正态分布且方差齐性资料以±s 表示,组间差异比较采用方差分析;非正态分布或方差不齐资料以M(Q1,Q3)表示,组间差异比较采用Kruskal-Wallis H 检验。定性资料以n(%)表示,组间差异比较采用χ2检验(样本量>40 且最小理论频数>5)或Fisher 精确检验(样本量≤40 或最小理论频数≤5)。采用多元回归模型校正可能的混杂因子,并计算校正比值比(adjusted odds ratio,aOR) 和95% 置 信 区 间(95% confidence interval,95%CI)。多元回归模型中“参考”是作为比较的参照,设定的aOR是1。P<0.05认为差异有统计学意义。
2 结果
2.1 不同质量胚胎移植组的比较
2.1.1 不同质量胚胎移植组患者基础情况比较 本研究共纳入565个单囊胚冻融移植周期。4组间的女方年龄、基础卵泡刺激素(follicle-stimulating hormone,FSH)水平、抗米勒管激素(anti-müllerian hormone,AMH)水平、授精方式和胚龄差异有统计学意义(P<0.05),其他基线情况差异无统计学意义(P>0.05),详见表1。
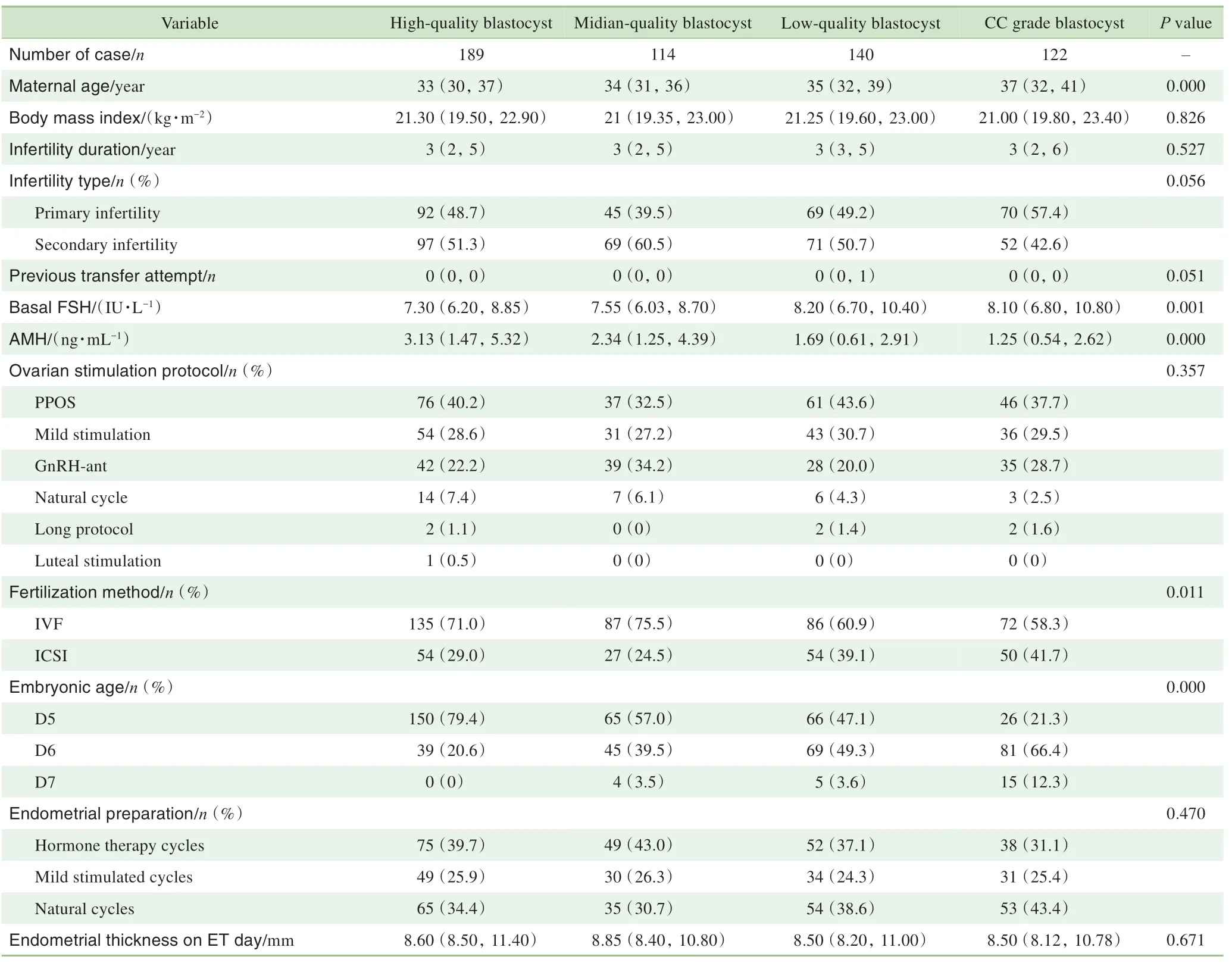
表1 不同质量胚胎移植组患者基线资料比较Tab 1 Baseline characteristics grouped by blastocyst quality
2.1.2 不同质量胚胎移植组患者临床结局比较 如表2所示,不同质量胚胎组间的生化妊娠率、临床妊娠率和活产率差异有统计学意义(均P=0.000)。高质量囊胚、临床妊娠率和活产率最高,分别达58.7%和46.2%。随胚胎质量下降,临床妊娠率和活产率随之下降。中质量囊胚的临床妊娠率和活产率分别为54.4%和43.3%,低质量囊胚的则分别为47.1%和36.2%。CC级别囊胚可获得25.4%的临床妊娠率和17.6%的活产率。4组间早期流产率和异位妊娠率差异无统计学意义(P>0.05)。不同质量囊胚子代的分娩孕周(P=0.481)和出生体质量(P=0.669)差异均无统计学意义。

表2 不同质量胚胎移植组患者妊娠结局比较Tab 2 Pregnancy outcomes grouped by blastocyst quality
多元回归分析显示(表3),胚胎质量与临床妊娠率显著相关。与高质量囊胚相比,CC 级别囊胚的临床妊娠率较低(aOR=0.81,95%CI 0.71~0.93,P=0.003)。而中低质量囊胚和高质量囊胚的临床妊娠率相似(P>0.05)。除此之外,女方年龄、基础FSH 水平、内膜准备方案和移植日内膜厚度也显著影响临床妊娠率(P<0.05)。
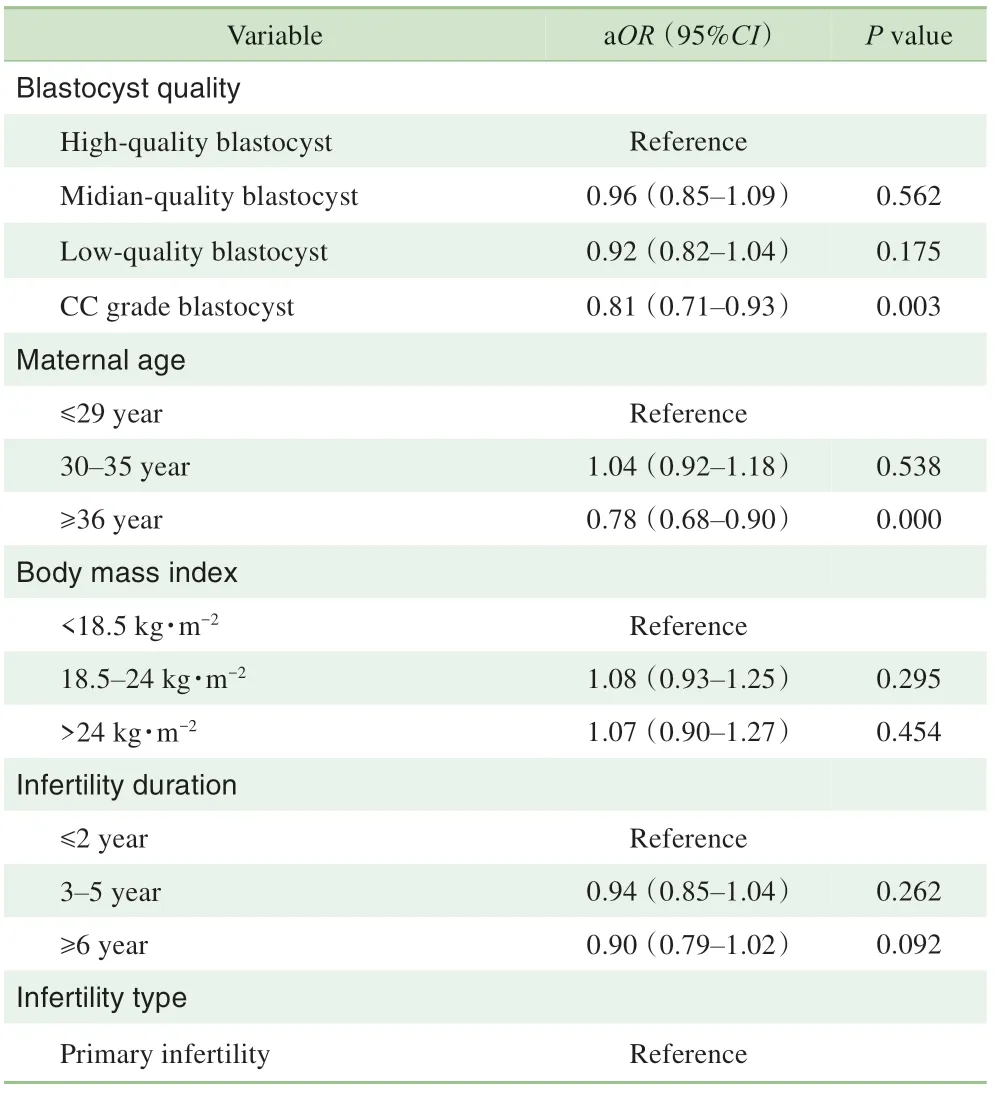
表3 临床妊娠率多元回归分析结果Tab 3 Multivariable analysis of factors associated with clinical pregnancy rate
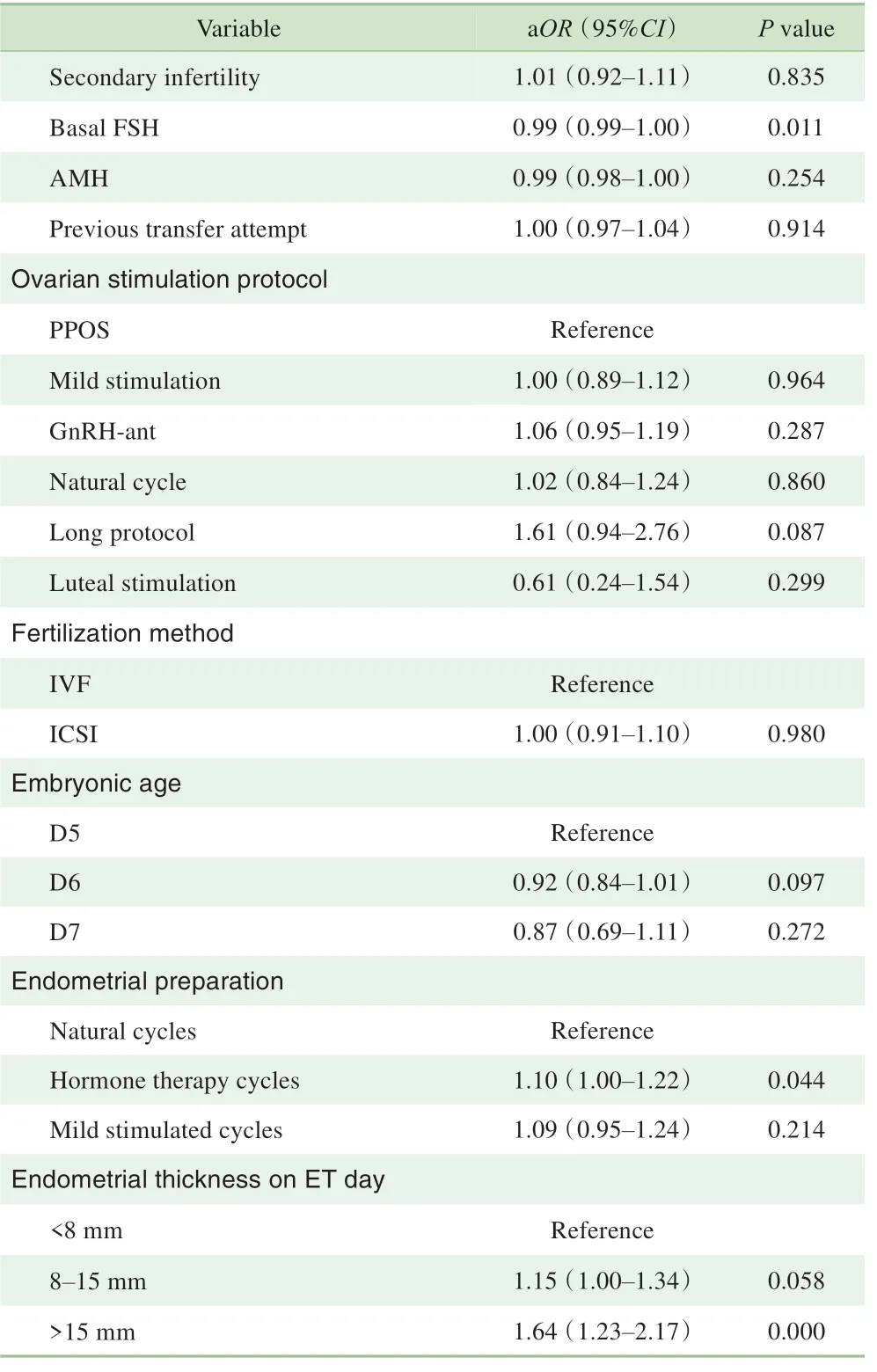
Continued Tab
2.2 不同胚龄CC级别胚胎妊娠结局比较
如表4 所示,D6 和D7 CC 级别囊胚的患者年龄显著大于D5 CC 级别囊胚的患者。D5 CC 级别囊胚生化妊娠率(46.2% vs 37.0% vs 6.7%,P=0.021)、临床妊娠率(42.3% vs 23.5% vs 6.7%,P=0.040)和活产率(31.6% vs 15.6% vs 0,P=0.133)均高于D6 和D7 的CC 级别囊胚。而早期流产率差异则无统计学意义(P=0.328)。
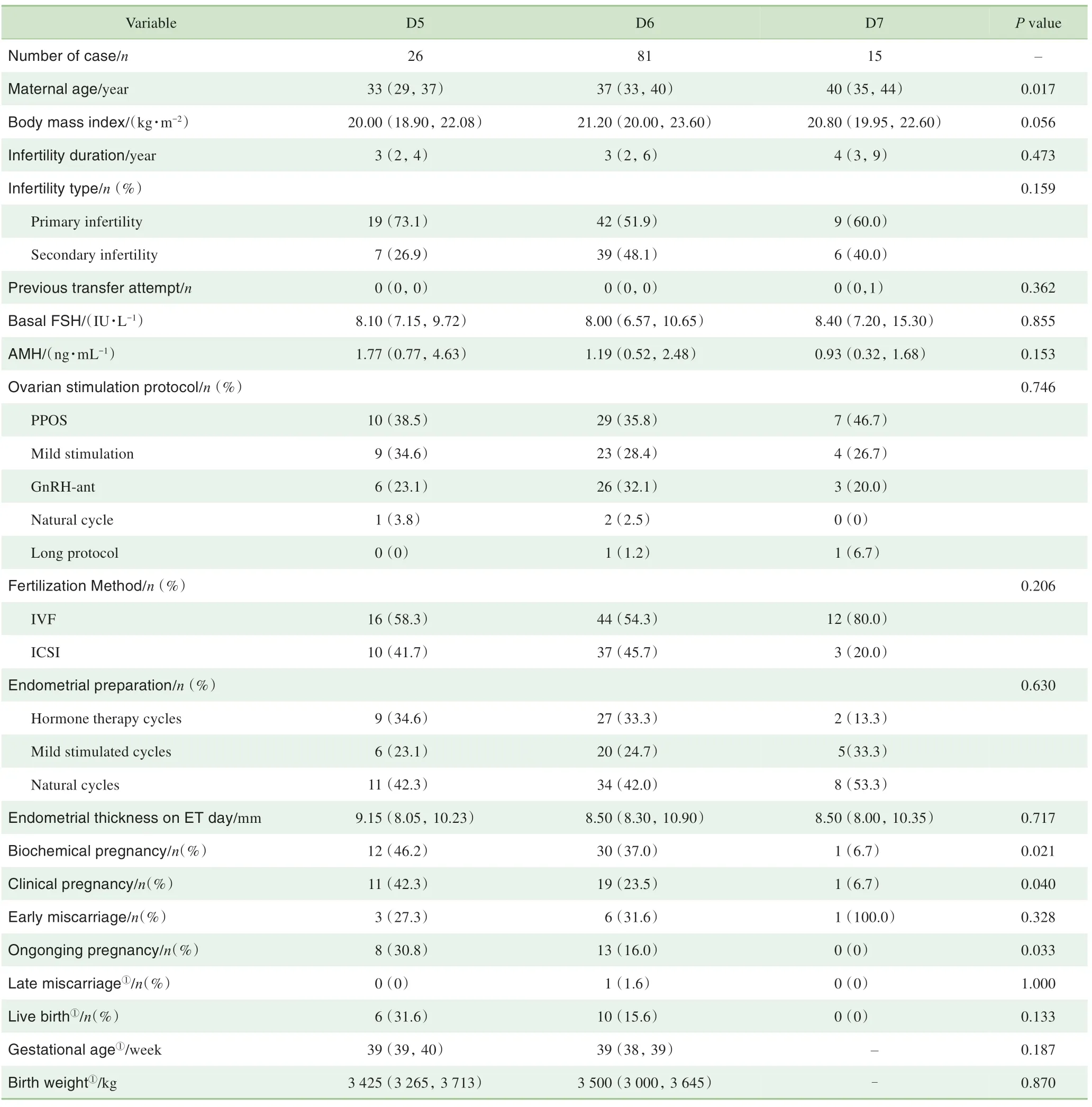
表4 不同胚龄CC级别胚胎妊娠结局比较Tab 4 Pregnancy outcomes grouped by embryonic age
如表5 所示,对CC 级别囊胚的临床妊娠率的影响因素进行多元回归分析发现,胚龄对CC 级别囊胚移植临床妊娠率有显著影响。相较于D5 的CC 级别囊胚,D7 的CC 级别囊胚的临床妊娠率更低(aOR=0.69,95%CI 0.49~0.96,P=0.032)。其他因素对CC 级别囊胚的临床妊娠率无显著影响。
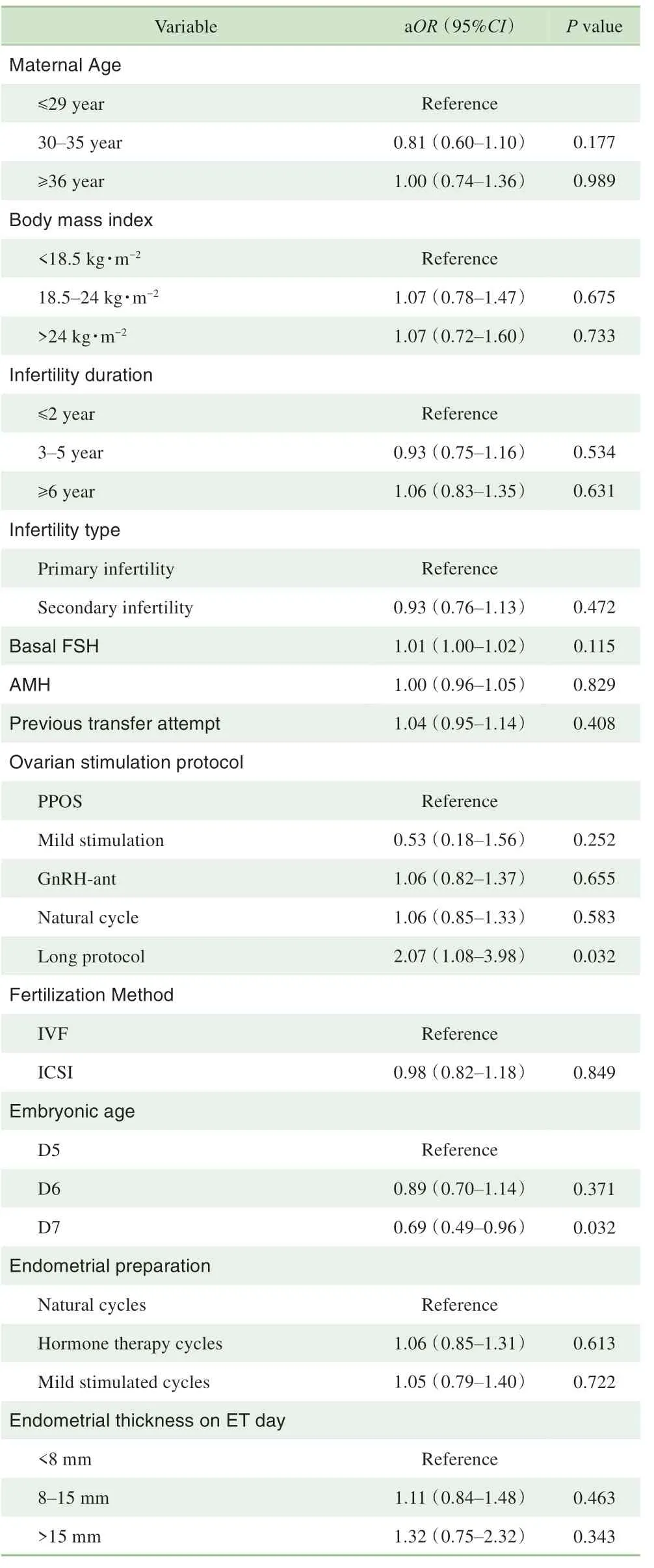
表5 CC级别囊胚临床妊娠多元回归分析结果Tab 5 Multivariable analysis of factors associated with clinical pregnancy rate for CC grade blastocysts
3 讨论
目前,涉及CC 级别囊胚妊娠结局的研究极少。van den Abbeel 等[16]的研究数据表明,内细胞团或滋养外胚层评分为C 的囊胚的活产率均较低。基于其预测模型估计3 期CC 级别囊胚的活产率可达12%,4~5 期CC 级别囊胚可达到27%。我们的研究显示,CC 级别囊胚的临床妊娠率可达到25.4%,活产率可达到17.6%。在校正了年龄等混杂因子后,虽然CC 级囊胚获得临床妊娠的可能低于高质量囊胚,但二者差距并不大(aOR=0.81,95%CI 0.71~0.93,P=0.003)。目前国内外较多的生殖中心认为CC级别囊胚发育潜能极低,不适合冻存[11]。我中心的数据显示,相较于其他级别囊胚组,CC 级别囊胚组的女方年龄和基础FSH 水平偏高、AMH 水平偏低(表1),提示该组患者整体而言卵巢储备较差。在临床实践中,高龄、卵巢储备差的患者常常经过多次取卵,仍难以获得优质胚胎。对于此类患者,建议不要轻易丢弃CC 级别囊胚,移植CC 级别的囊胚可增加患者的受孕机会。同时,我们中心的数据显示,相较于其他级别囊胚组而言,CC 级别囊胚组的早期流产率偏高,活产率偏低(表2),这一现象或与该组患者高龄、卵巢储备差有关。
目前对于胚胎发育潜能的评估主要基于胚胎形态学评分[17]。然而相同评分的囊胚却可能由发育速度不同的胚胎形成。一些研究[18-20]表明,在形态学评分相近的情况下,发育较快的囊胚相较于发育迟滞的囊胚有着更好的临床结局。Du 等[20]研究发现D7 囊胚的种植率、临床妊娠率和活产率均显著低于D5 或D6 的囊胚。其可能的原因是发育迟缓的胚胎中非整倍体率和纺锤体异常率更大,从而降低了其种植能力[21-22]。然而,关于不同胚龄对CC 级别囊胚妊娠结局的影响国内外未见报道。我们的研究发现,在冻融移植周期中,D5 CC 级别囊胚的临床妊娠率(42.3%)和活产率(31.6%)较高,具有较高的临床价值;而D6的CC级别囊胚临床妊娠率为23.5%,活产率为15.6%,虽低于D5的CC级别囊胚,但仍具有一定的移植价值;不过D7 的CC 级别囊胚的临床妊娠率仅为6.7%,远低于D5 和D6 的CC 级别囊胚,且未获得活产,临床价值很小。
我中心CC 级别囊胚妊娠率较高可能的原因如下:第一,在本研究中,一半以上的患者于促排卵周期采用了PPOS 方案。PPOS 方案由Kuang 等[14]于2015 年首次提出,其创造性地采用外源性孕激素抑制黄体生成素(luteinizing hormone,LH)峰。PPOS 方案能够获得与传统短方案一样的妊娠结局且能有效降低卵巢过度刺激的风险[13]。2017 年的一项随机临床试验[23]表明,PPOS 可以改善卵巢低储备的患者的胚胎质量。相比于采用自然周期的患者,采用PPOS 方案的患者的获卵数和有效胚胎数量更多[23]。第二,本中心实验室采用了辅助孵化技术[24]。在显微镜下人工移除透明带可减少胚胎孵出的阻力,进而提高胚胎的种植率[24]。第三,我中心采用经阴道超声引导下胚胎移植策略。因经阴道超声对于子宫的显影质量优于经腹部超声,移植医师可以更精准地选择宫腔内合适的位置进行胚胎移植。有文献[25]报道,经阴道超声引导下移植相较于腹部超声引导可显著增加胚胎种植率和临床妊娠率,并能降低异位妊娠率。
本研究主要的不足在于其回顾性研究设计,可能存在潜在的混杂因子未能校正。此外,本研究样本量较为有限,结论尚需前瞻性大样本研究进一步验证。
综上所述,本研究表明,对于难以获得优质胚胎的患者,移植CC 级别囊胚仍有临床意义。其中,D5 的CC级别囊胚具有很好的妊娠结局;D6 的CC 级别囊胚虽然妊娠率较低,但仍具有一定的移植价值;而D7 的CC 级别囊胚临床价值较小。
参·考·文·献
[1] Glujovsky D,Farquhar C,Quinteiro Retamar AM,et al. Cleavage stage versus blastocyst stage embryo transfer in assisted reproductive technology[J].Cochrane Database Syst Rev,2016(6):CD002118.
[2] Shoukir Y, Chardonnens D, Campana A, et al. The rate of development and time of transfer play different roles in influencing the viability of human blastocysts[J]. Hum Reprod,1998,13(3):676-681.
[3] Adler A,Lee HL,McCulloh DH,et al. Blastocyst culture selects for euploid embryos: comparison of blastomere and trophectoderm biopsies[J]. Reprod Biomed Online,2014,28(4):485-491.
[4] Fanchin R, Ayoubi JM, Righini C, et al. Uterine contractility decreases at the time of blastocyst transfers[J]. Hum Reprod,2001,16(6):1115-1119.
[5] Magli MC, Jones GM, Gras L, et al. Chromosome mosaicism in day 3 aneuploid embryos that develop to morphologically normal blastocysts in vitro[J]. Hum Reprod,2000,15(8):1781-1786.
[6] Mancuso AC, Boulet SL, Duran E, et al. Elective single embryo transfer in women less than age 38 years reduces multiple birth rates, but not live birth rates,in United States fertility clinics[J]. Fertil Steril,2016,106(5):1107-1114.
[7] Rodríguez Barredo DB, Tur Padro R, Mancini F, et al. Elective single embryo transfer and cumulative pregnancy rate: five-year experience in a Southern European Country[J]. Gynecol Endocrinol,2012,28(6):425-428.
[8] 夏兰,吴娴,徐慧慧,等. 胚胎质量对冻融周期中生化妊娠和胚胎早期停止发育的影响[J]. 上海交通大学学报(医学版),2017,37(3):344-347.
[9] Irani M, Reichman D, Robles A, et al. Morphologic grading of euploid blastocysts influences implantation and ongoing pregnancy rates[J]. Fertil Steril,2017,107(3):664-670.
[10] Oron G,Son WY,Buckett W,et al. The association between embryo quality and perinatal outcome of singletons born after single embryo transfers: a pilot study[J]. Hum Reprod,2014,29(7):1444-1451.
[11] 倪晓蓓,王珊珊,张宁媛,等. 单囊胚冷冻复苏周期中囊胚时期及质量与临床结局相关分析[J]. 生殖医学杂志,2016,25(10):926-931.
[12] Gardner DK, Lane M. Embryo culture systems[M]//Trounson AO, Gardner DK. Handbook of in vitro fertilization. 2nd ed. Boca Raton, FL: CRC Press,2000:205-264.
[13] 乔杰,马彩虹,刘嘉茵,等. 辅助生殖促排卵药物治疗专家共识[J]. 生殖与避孕,2015,35(4):211-223.
[14] Kuang Y, Chen Q, Fu Y, et al. Medroxyprogesterone acetate is an effective oral alternative for preventing premature luteinizing hormone surges in women undergoing controlled ovarian hyperstimulation for in vitro fertilization[J]. Fertil Steril,2015,104(1):62-70.e3.
[15] 黄亚,徐利,葛凤菊,等. 激光辅助孵化完全去除透明带对冷冻单囊胚移植结局的影响[J]. 诊断学理论与实践,2019,18(3):334-339.
[16] van den Abbeel E,Balaban B,Ziebe S,et al. Association between blastocyst morphology and outcome of single-blastocyst transfer[J]. Reprod Biomed Online,2013,27(4):353-361.
[17] 韩伟,熊顺,黄国宁. 体外受精胚胎发育潜能的形态学评估[J]. 生殖医学杂志,2012,21(2):128-132.
[18] Utsunomiya T,Ito H,Nagaki M,et al. A prospective,randomized study:day 3 versus hatching blastocyst stage[J]. Hum Reprod, 2004, 19(7): 1598-1603.
[19] Kovalevsky G, Carney SM, Morrison LS, et al. Should embryos developing to blastocysts on day 7 be cryopreserved and transferred: an analysis of pregnancy and implantation rates[J]. Fertil Steril,2013,100(4):1008-1012.
[20] Du T, Wang Y, Fan Y, et al. Fertility and neonatal outcomes of embryos achieving blastulation on day 7: are they of clinical value?[J]. Hum Reprod,2018,33(6):1038-1051.
[21] Su Y, Li JJ, Wang C, et al. Aneuploidy analysis in day 7 human blastocysts produced by in vitro fertilization[J]. Reprod Biol Endocrinol,2016,14:20.
[22] Hashimoto S,Amo, Hama S, et al. Growth retardation in human blastocysts increases the incidence of abnormal spindles and decreases implantation potential after vitrification[J]. Hum Reprod,2013,28(6):1528-1535.
[23] Chen QJ, Wang Y, Sun LH, et al. Controlled ovulation of the dominant follicle using progestin in minimal stimulation in poor responders[J].Reprod Biol Endocrinol,2017,15(1):71.
[24] Carney SK, Das S, Blake D, et al. Assisted hatching on assisted conception in vitro fertilisation (IVF) and intracytoplasmic sperm injection (ICSI)[J].Cochrane Database Syst Rev,2012,12:CD001894.
[25] 洋歌德(Jagat Prasad Deep). 经阴道与经腹部超声引导下胚胎移植对IVF临床妊娠的影响[D]. 长沙:中南大学,2012.

