围绝经期和绝经后女性睡眠质量与日常认知功能的相关性
黄文俊,蒋素素,陶敏芳
上海交通大学附属第六人民医院妇产科,上海200030
随着年龄的增长,女性睡眠障碍更为常见,并在绝经过渡期患病率增加。睡眠障碍在女性围绝经期的患病率为39%~47%,在绝经后为35%~60%[1]。围绝经期和绝经后女性睡眠障碍对其生活质量带来严重负面影响,其中一个是认知功能障碍风险可能增加。研究[2-5]报道了睡眠质量及其特定组成部分(睡眠潜伏期、睡眠效率、睡眠时间、日间功能等)与认知功能之间的关系,但研究结论尚不一致。并且,目前尚无以中国围绝经期和绝经后女性为研究对象的相关研究。因此,本研究将就诊于绝经门诊的围绝经期和绝经后女性作为研究对象,评估其睡眠质量及睡眠相关因素与日常认知功能的关系。
1 对象与方法
1.1 研究对象
选择2018 年10 月—2019 年10 月初次就诊于上海交通大学附属第六人民医院绝经门诊的281名女性患者为研究对象。根据多因素分析中要求样本例数为指标数的10~20 倍[6],本研究共包括年龄、文化程度、绝经状态、产次、睡眠质量等12 个因素,考虑15%失访率,拟纳入样本量n=20×12×(1+15%)=276 例。纳入标准:①40~65岁。②处于围绝经期(连续的月经周期长度异常持续≥7 d)、绝经早期(闭经至少12 个月,但≤5 年)或绝经晚期(闭经>5年)女性[7-8]。③未接受过绝经激素治疗。排除标准:①有肿瘤病史、未纠正的甲状腺疾病、神经源性/精神疾病和严重头部外伤。②因多囊卵巢综合征或其他原因导致的月经周期出血不规则者。③妊娠或哺乳期。④长期吸烟或饮酒。本研究已通过上海交通大学附属第六人民医院伦理委员会批准,患者均签署知情同意书。
1.2 研究方法
1.2.1 一般资料收集 采用自行设计的一般资料问卷,内容包括年龄、身高、体质量、月收入、职业状况、文化程度、绝经状态、产次、规律运动和慢性疾病史。
1.2.2 症状评估
(1)睡眠质量 采用中文版匹兹堡睡眠质量指数(Pittsburgh Sleep Quality Index,PSQI)[9]评估患者近1 个月的睡眠质量。PSQI 由18 个问题组成,评估睡眠的7 个维度,包括睡眠潜伏期、睡眠持续时间、睡眠效率、睡眠障碍、主观睡眠质量、催眠药物和日间功能障碍。每个维度得分为0~3 分,总分为0~21 分。PSQI<8 表示睡眠质量好,PSQI≥8 表示睡眠质量差,得分越高表明睡眠质量越差[10]。
(2)日常认知功能 日常认知功能量表(Everyday Cognition,ECog)是检测患者认知功能下降的知情者评估量表。本研究使用12 个项目的简短版ECog(ECog-12)[11]。ECog-12 能够很好地识别痴呆人群与正常人群[受试者操作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)=0.95,置信区间(confidence interval,CI)=0.94~0.97][11],并有希望将正常年长者从认知受损者[轻度认知损害(mild cognitive impairment,MCI)或痴呆]中识别出来。对于每一项,知情者都将患者当前的日常功能水平与他(或她)10 年前的相比。ECog-12 将患者认知功能改变程度分为4 个等级:1=比10 年前的状况好,或跟10 年前差不多;2=好像差一点,或者偶尔差一点;3=肯定差一点;4=差多了或明显减退。此外,还保留了“不知道,无法判断或者患者从不做该事情”选项。ECog-12 得分为1~4分,通过将所有完成项目的得分相加,然后除以完成的项目数计算得到,得分越高表明患者日常认知功能下降越严重。
1.2.3 资料收集与症状评估方法 经研究者统一培训的医护人员通过与患者面对面交谈方式进行一般资料问卷和PSQI 量表调查,并与患者知情人沟通进行ECog-12 的调查,确保问卷填写完整。研究实际调查281名女性患者及其知情人,回收有效问卷281份,有效回收率100%。
1.2.4 统计学分析 使用SPSS 22.0 软件进行数据分析。采用Q-Q 图检验定量资料是否符合正态分布。正态分布的定量资料以±s 表示,非正态分布的定量资料以M(Q1,Q3)表示。定性资料以n(%)表示。定量资料组间比较,采用Mann-Whitney U (两个独立样本) 或Kruskal-Wallis H(多个独立样本)检验。相关性分析使用Spearman 等级相关。采用多元线性逐步回归法分析日常认知功能的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 日常认知功能在不同社会人口学特征及睡眠质量患者中的差异
281 名研究对象平均年龄为(51.12±5.15)岁,其中45~55 岁年龄段占70.5%。Ecog-12 得分为1.42 (1.17,1.67)分。PSQI 得分为6.0(3.0,10.0)分,40.9%的妇女睡眠质量差(PSQI≥8)。研究结果(表1)显示,日常认知功能在社会人口学特征变量中差异无统计学意义。相比睡眠质量好的妇女,睡眠质量差的妇女ECog 得分更高,差异具有统计学意义(P<0.05)。
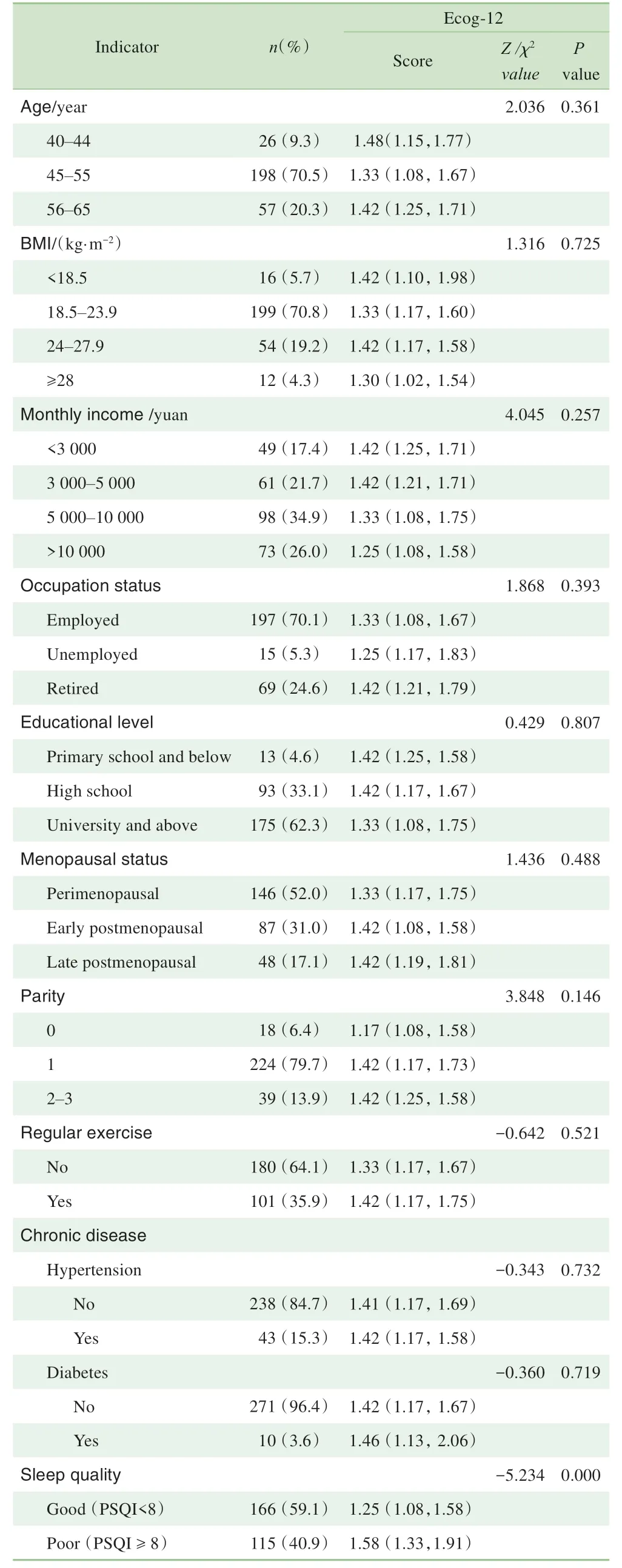
表1 日常认知功能在不同社会人口学特征及睡眠质量患者中的差异(n=281)Tab 1 Differences of daily cognitive function among patients with different socio-demographic characteristics and sleep quality(n=281)
2.2 睡眠质量与日常认知功能的相关性
Spearman 等级相关分析(表2)显示,PSQI 的各维度得分和总分均与Ecog-12得分呈正相关(P<0.001)。
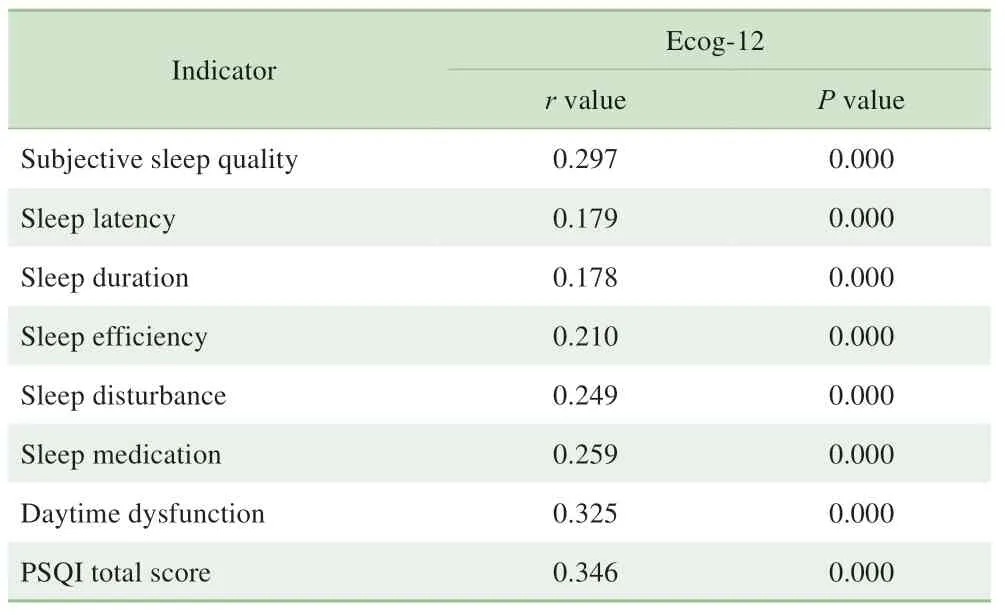
表2 PSQI与Ecog-12的相关性(n=281)Tab 2 Correlation between PSQI and Ecog-12 score(n=281)
2.3 日常认知功能影响因素的多元线性回归分析
以PSQI的7个维度得分和总分为自变量,以Ecog-12得分为因变量,调整社会人口统计学特征后进行多元线性回归分析显示,催眠药物和日间功能障碍是日常认知功能的独立影响因素,整体上对日常认知功能变异的解释率为12.6%(表3)。
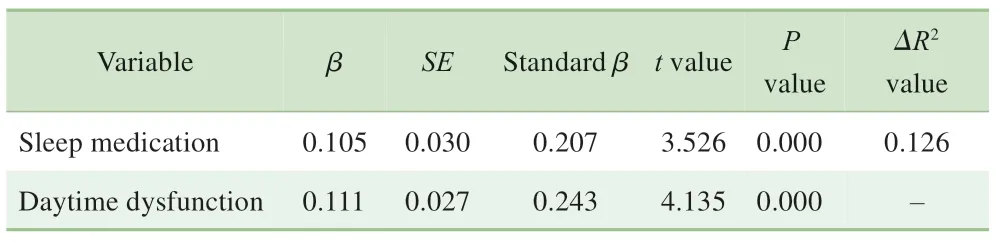
表3 日常认知功能影响因素的多元线性回归分析Tab 3 Multiple linear regression analysis of the influencing factors of everyday cognition
3 讨论
本研究通过横断面调查,评估基于绝经门诊的围绝经期和绝经后女性睡眠质量与认知功能之间的关系。研究结果显示,睡眠障碍(PSQI≥8)的患病率为40.9%,与之前的研究[12-13]相一致;并且单因素分析和Spearman相关分析均提示,围绝经期和绝经后期女性睡眠障碍影响着她们的认知功能。然而,睡眠障碍与认知功能的研究[14-15]结论不一,可能由研究对象的年龄、认知任务的负荷和睡眠测量方法等不同造成的。一项研究[3]探讨主观的夜间睡眠质量和白天嗜睡与认知障碍的关系,夜间睡眠质量和白天嗜睡情况分别采用PSQI 和Epworth 嗜睡量表(Epworth Sleepiness Scale,ESS)测量。该研究发现,白天嗜睡与成年人的认知障碍相关,而夜间睡眠质量则与老年人的认知障碍相关。Byun等[3]提出,年龄可能在心力衰竭患者的睡眠与认知中起重要作用。英国一项研究[14]表明,在未经调整的模型中,频发失眠症状与认知障碍相关;然而,在对人口统计学资料、临床资料和睡眠相关的变量进行调整后,失眠症状对认知的作用发生逆转,经常有失眠症状的患者比没有失眠症状的认知表现更好。因此,研究者提出,与睡眠不足有关的特征因素可能有助于补偿和(或)促进认知表现。例如,认知、情绪和神经生理水平的觉醒过度是失眠的特征[16],并被认为其支持在认知负荷较低的相对简短任务上的认知表现[17]。有研究[18]观察到,与睡眠良好、年龄匹配的健康对照组相比,失眠患者对基本警戒任务(vigilance tasks)的反应时间更快。觉醒过度反过来又被认为妨碍在更具认知挑战性的任务上的表现[19-20]。因此,在不同研究中采用认知测试的认知负荷不同也可能是造成结果有差异的原因之一。还有研究[21]发现,活动记录仪测量而不是自我报告的睡眠质量与认知下降有横断面和纵向关系。可能是客观的测量手段更具有足够的敏感性和(或)复杂性来揭露睡眠障碍相关的损害[22]。本研究使用的PSQI 评估的是患者的主观睡眠质量。因此,无法确定研究对象是否受到由睡眠问题引起的认知功能上的损害。
催眠药物常用于辅助失眠患者改善睡眠质量。本研究发现催眠药物与日常认知功能存在相关性,相比没有使用催眠药物的患者,频繁使用催眠药物的患者日常认知功能表现更差,与先前的研究[4,14]一致。也有一些研究[23-24]显示,使用催眠药物与认知功能障碍无关。关于催眠药物使用时间与认知功能的研究也有不同的结果。一些研究[25-27]指出,催眠药物(苯二氮、曲唑酮、唑吡坦)对认知功能的不良反应是暂时的,不会持续很长时间。然而,Takada等[28]对加拿大、美国和日本的数据源(不良事件数据库、索赔数据库)进行了分析,发现这3个国家的数据都支持长效型苯二氮类药物和长期使用苯二氮类药物与痴呆症的风险增加密切相关。目前尚不清楚为何使用催眠药物会增加认知功能下降或痴呆的风险,但存在一些可能的解释。从短期到长期记忆,苯二氮可能会减慢大脑关键区域的活动[29]。佐匹克隆(zopiclone)、艾司佐匹克隆(eszopiclone)、扎莱普隆(zaleplon)和唑吡坦(zolpidem)等非苯二氮类镇静催眠药英文名称中均有字母“z”,通常被称为z药物。虽然“z”药物在分子上与苯二氮类不同,但它们作用于同一个大脑通路,并引起类似的问题[30]。部分抗抑郁药也有催眠的作用,可能会干扰去甲肾上腺素和血清素(大脑中的2个化学信使)的作用,从而导致记忆力减退[31]。
本研究表明,睡眠障碍导致的日间功能障碍与日常认知功能相关,与之前的研究[5,32]结果一致。有中等水平的研究证据[33]表明,日间功能障碍使得认知功能障碍的风险增加16%。Yu 等[34]对年龄≥60 岁老年人的横断面研究,旨在评估MCI 组(n=48)和人口统计学体征相匹配的认知功能正常的对照组(n=48)之间自我报告的睡眠质量的差异。该研究显示,MCI 组的日间认知功能明显较差(P=0.004),但在控制抑郁和焦虑水平后,2 组的日间功能障碍差异不再具有统计学意义;作者推测除了睡眠和认知功能下降以外,抑郁和焦虑也可能是导致日间功能障碍的原因。一项对2 238 名认知功能正常和655 名MCI 的≥60 岁的韩国老年人的前瞻性研究[35]显示,在调整年龄、性别、受教育程度、载脂蛋白E 基因、抑郁评分、累积疾病和体育锻炼等协变量后,Logistic 回归分析表明,基线的日间功能障碍与随访4年后认知功能下降无相关性。虽然上述2个研究与本研究均用PSQI评估睡眠,但研究类型、样本人群、认知功能评估、纳入研究的协变量的差异可能导致研究结果不一致,也阻碍了各研究之间的直接比较。日间功能障碍对认知功能影响的作用机制尚不清楚。白天嗜睡是日间功能障碍表现之一,多个研究[36-37]证明其与较差的认知功能有关。白天嗜睡可能是痴呆和认知功能下降的前哨[38]。疲劳是日间功能障碍的另一个表现。疲劳往往伴随着不适、休息的欲望和动机的减弱。疲劳可表现为认知功能的潜在损害,且已被证明涉及与认知任务表现相关的更复杂的神经机制[39]。这些日间功能障碍的具体表现与认知功能下降密切相关,间接支持日间功能障碍对认知功能产生不利影响。
综上,本研究使用PSQI 评估了研究对象是否使用催眠药物及使用频率,没有对催眠药物进行分类和记录持续使用时间,未来研究应进一步探讨不同类型催眠药物以及持续使用时间对日常认知功能的影响。本研究表明,使用催眠药物和日间功能障碍的围绝经期和绝经后女性日常认知功能下降的风险增加,提示临床医师对有睡眠障碍的围绝经期及绝经后患者寻求催眠药物治疗时,应考虑催眠药物可能对认知功能带来的不利影响,或者给与其他治疗方法(如睡眠卫生教育、针对失眠的认知行为治疗等)。此外,医师应帮助患者重视睡眠问题,改善睡眠质量,保持良好的日间功能,避免或减轻睡眠问题造成的认知功能损害。
参·考·文·献
[1] Potter B, Schrager S, Dalby J, et al. Menopause[J]. Prim Care Clin Off Pract,2018,45(4):625-641.
[2] Chen JC, Espeland MA, Brunner RL, et al. Sleep duration, cognitive decline, and dementia risk in older women[J]. Alzheimers Dement, 2016,12(1):21-33.
[3] Byun E, Kim J, Riegel B. Associations of subjective sleep quality and daytime sleepiness with cognitive impairment in adults and elders with heart failure[J]. Behav Sleep Med,2017,15(4):302-317.
[4] Lee JE, Ju YJ, Chun KH, et al. The frequency of sleep medication use and the risk of subjective cognitive decline (SCD) or SCD with functional difficulties in elderly individuals without dementia[J]. J Gerontol A Biol Sci Med Sci,2020,75(9):1693-1698.
[5] Rice VJB, Schroeder PJ. Self-reported sleep, anxiety, and cognitive performance in a sample of US military active duty and veterans[J]. Mil Med,2019,184(Suppl 1):488.
[6] 陈彬. 医学多因素分析设计样本例数估算:多因素分析设计样本例数综合估算法[J]. 伤害医学(电子版),2012,1(4):49-56.
[7] Harlow SD, Gass M, Hall JE, et al. Executive summary of the stages of reproductive aging workshop +10: addressing the unfinished agenda of staging reproductive aging[J]. J Clin Endocrinol Metab, 2012, 97(4): 1159-1168.
[8] Zhou Y, Yang R, Li C, et al. Sleep disorder, an independent risk associated with arterial stiffness in menopause[J]. Sci Rep,2017,7(1):1904.
[10] Sun DM,Shao HF,Li CB,et al. Sleep disturbance and correlates in menopausal women in Shanghai[J]. J Psychosom Res,2014,76(3):237-241.
[11] Farias ST, Mungas D, Harvey DJ, et al. The measurement of everyday cognition: development and validation of a short form of the Everyday Cognition scales[J]. Alzheimers Dement,2011,7(6):593-601.
[12] Terauchi M, Obayashi S,Akiyoshi M, et al. Insomnia in Japanese peri- and postmenopausal women[J]. Climacteric,2010,13(5):479-486.
[13] Zhang JP, Wang YQ, Yan MQ, et al. Menopausal symptoms and sleep quality during menopausal transition and postmenopause[J]. Chin Med J(Engl),2016,129(7):771-777.
[14] Kyle SD,Sexton CE,Feige B,et al. Sleep and cognitive performance:crosssectional associations in the UK Biobank[J]. Sleep Med,2017,38:85-91.
[15] Ling A, Lim ML, Gwee X, et al. Insomnia and daytime neuropsychological test performance in older adults[J]. Sleep Med,2016,17:7-12.
[16] Riemann D, Spiegelhalder K, Feige B, et al. The hyperarousal model of insomnia: a review of the concept and its evidence[J]. Sleep Med Rev,2010,14(1):19-31.
[17] Horne J. Primary insomnia: a disorder of sleep, or primarily one of wakefulness?[J]. Sleep Med Rev,2010,14(1):3-7.
小虫正在看电视,见玉敏回来,说饿死我了。马上将碗筷排上桌,又拿了瓶白酒,斟了两杯。两人举杯,对饮起来。
[18] Altena E, van der Werf YD, Strijers RL, et al. Sleep loss affects vigilance:effects of chronic insomnia and sleep therapy[J]. J Sleep Res, 2008, 17(3):335-343.
[19] Cellini N, de Zambotti M, Covassin N, et al. Working memory impairment and cardiovascular hyperarousal in young primary insomniacs[J].Psychophysiology,2014,51(2):206-214.
[20] Edinger JD, Means MK, Krystal AD. Does physiological hyperarousal enhance error rates among insomnia sufferers?[J]. Sleep,2013,36(8):1179-1186.
[21] McSorley VE, Bin YS, Lauderdale DS. Associations of sleep characteristics with cognitive function and decline among older adults[J]. Am J Epidemiol,2019,188(6):1066-1075.
[22] Espie CA, Kyle SD. Towards an improved neuropsychology of poor sleep?[J]. Sleep,2008,31(5):591-592.
[23] Burke SL, Hu TY, Spadola CE, et al. Mild cognitive impairment:associations with sleep disturbance,apolipoprotein e4,and sleep medications[J]. Sleep Med,2018,52:168-176.
[24] Imfeld P, Bodmer M, Jick SS, et al. Benzodiazepine use and risk of developing Alzheimer's disease or vascular dementia: a case-control analysis[J]. Drug Saf,2015,38(10):909-919.
[25] Stewart SA. The effects of benzodiazepines on cognition[J]. J Clin Psychiatry,2005,66(Suppl 2):9-13.
[26] Curran HV, Sakulsriprong M, Lader M. Antidepressants and human memory: an investigation of four drugs with different sedative and anticholinergic profiles[J]. Psychopharmacology (Berl), 1988, 95(4):520-527.
[27] Wesensten NJ, Balkin TJ, Belenky GL. Effects of daytime administration of zolpidem versus triazolam on memory[J]. Eur J Clin Pharmacol,1995,48(2):115-122.
[28] Takada M, Fujimoto M, Hosomi K. Association between benzodiazepine use and dementia: data mining of different medical databases[J]. Int J Med Sci,2016,13(11):825-834.
[29] Marks AR. In search of memory the emergence of a new science of mind[J]. J Clin Investig,2006,116(5):1131.
[30] Brandt J, Leong C. Benzodiazepines and z-drugs: an updated review of major adverse outcomes reported on in epidemiologic research[J]. Drugs R&D,2017,17(4):493-507.
[31] Cooke JD, Cavender HM, Lima HK, et al. Antidepressants that inhibit both serotonin and norepinephrine reuptake impair long-term potentiation in hippocampus[J]. Psychopharmacology(Berl),2014,231(23):4429-4441.
[32] Henneghan AM, Carter P, Stuifbergan A, et al. Relationships between selfreported sleep quality components and cognitive functioning in breast cancer survivors up to 10 years following chemotherapy[J]. Psychooncology,2018,27(8):1937-1943.
[33] Xu W,Tan CC, Zou JJ, et al. Sleep problems and risk of all-cause cognitive decline or dementia: an updated systematic review and meta-analysis[J]. J Neurol Neurosurg Psychiatry,2020,91(3):236-244.
[34] Yu JH, Mahendran R, Rawtaer I, et al. Poor sleep quality is observed in mild cognitive impairment and is largely unrelated to depression and anxiety[J]. Aging Ment Health,2017,21(8):823-828.
[35] Suh SW, Han JW, Lee JR, et al. Sleep and cognitive decline: a prospective nondemented elderly cohort study[J]. Ann Neurol,2018,83(3):472-482.
[36] Gabelle A, Gutierrez LA, Jaussent I, et al. Excessive sleepiness and longer nighttime in bed increase the risk of cognitive decline in frail elderly subjects:the MAPT-sleep study[J]. Front Aging Neurosci,2017,9:312.
[37] Keage HA, Banks S, Yang KL, et al. What sleep characteristics predict cognitive decline in the elderly?[J]. Sleep Med,2012,13(7):886-892.
[38] Foley D, Monjan A, Masaki K, et al. Daytime sleepiness is associated with 3-year incident dementia and cognitive decline in older Japanese-American men[J]. J Am Geriatr Soc,2001,49(12):1628-1632.
[39] Ishii A, Tanaka M, Watanabe Y. Neural mechanisms of mental fatigue[J].Rev Neurosci,2014,25(4):469-479.

