泌乳素在不明原因复发性流产和正常妊娠早期中的差异性表达
陈 超,李聪聪,郭 枫,王巧红,赵爱民
上海交通大学医学院附属仁济医院妇产科,上海市妇科肿瘤重点实验室,上海200127
复发性流产(recurrent pregnancy loss,RPL)是生殖领域的重要疾病,美国生殖医学学会将其定义为2 次或2次以上妊娠失败[1]。在我国,RPL一般指与同一配偶发生连续2次或2次以上的自然流产[2]。RPL累及2%~5%的育龄期妇女,其中超过半数患者无法明确病因,被称之为不明原因的复发性流产(unexplained RPL,URPL)[1-3]。针对这些患者的治疗仍是目前临床医师的难题。胚胎着床和正常的胎盘发育是妊娠成功的关键,这一过程依赖于胚泡中滋养细胞对子宫内膜的黏附以及进一步对蜕膜的侵袭浸润[4]。越来越多的证据表明,人类子宫内膜的蜕膜化在胚胎着床和胎盘发育过程中起着重要作用[5],而蜕膜基质细胞(decidual stromal cells,DSCs)作为蜕膜的主要细胞成分之一,扮演着重要角色。DSCs 由子宫内膜基质细胞(endometrial stromal cells,ESCs)经蜕膜化转变而来,以分泌泌乳素(prolactin,PRL)为特征,是蜕膜分泌PRL的主体细胞和羊水PRL的主要来源[6-9]。目前PRL被广泛用以衡量ESCs/DSCs的蜕膜化程度[10]。既往报道[11-12]发现,在反复流产等患者中,PRL在黄体期子宫内膜的表达显著低于正常妇女。但关于妊娠早期ESCs/DSCs蜕膜化研究、PRL表达及其动态变化,以及PRL表达与URPL关联研究未见报道。为此,本研究通过观察比较URPL组和正常妊娠组早期DSCs 的PRL 表达情况,以及正常妊娠组、正常妊娠流产组和URPL组的外周血PRL水平及其动态变化情况,以明确URPL 是否存在ESCs/DSCs 蜕膜化异常,探讨URPL的发生是否与子宫内膜蜕膜化异常有关,为进一步阐明URPL的发病机制提供新思路。
1 对象与方法
1.1 研究对象及分组
本研究为病例对照研究。纳入2018年3月—2019年3月于上海交通大学医学院附属仁济医院妇产科就诊的80例URPL 患者,70 例自愿要求行人工流产的正常妊娠妇女及190例有生育要求的正常妊娠妇女。研究经上海交通大学医学院附属仁济医院伦理委员会批准,所有试验对象均签署知情同意书。
1.1.1 URPL组 选取行清宫手术的URPL患者,手术当日空腹采集外周血,收集蜕膜组织,并留取绒毛进行染色体检测。纳入标准:①经阴道超声检查明确胚胎停止发育,孕周<10 周。②月经周期规律(26~35 d)。③既往连续发生自然流产次数≥2 次。排除标准:①有明确的RPL 病因[1]。②双胎及多胎。③此次妊娠绒毛染色体异常。④合并高PRL 血症。⑤合并肝肾功能异常、凝血功能异常及免疫系统疾病。
1.1.2 正常妊娠组 选取同期就诊的正常早期妊娠妇女,采集空腹外周血测定。并随访其妊娠结局。纳入标准:①经阴道超声检查明确为宫内妊娠,发育符合孕周,孕周<10 周。②月经周期规律(26~35 d)。排除标准:①有胚胎移植失败或自然流产史。②此次妊娠发生胚胎停育或自然流产。其余同URPL组排除标准②~⑤。
1.1.3 人工流产组 选取自愿要求行人工流产术的早期妊娠妇女。手术当日空腹采集外周血,并收集蜕膜组织。纳入标准:①经阴道超声检查明确为宫内妊娠,胚胎发育正常,孕周<10 周。②月经周期规律(26~35 d)。排除标准:①有胚胎移植失败或自然流产病史。其余同URPL组排除标准②~⑤。
1.2 材料及方法
1.2.1 组织样本 所有患者采集空腹外周血,同时收集人工流产和URPL 患者的蜕膜组织保存于预冷的DMEM/F-12中,冰上运输至实验室。
1.2.2 DSCs 细胞分离与培养如图1所示,蜕膜标本清洗后,剪碎至1~2 mm2,按体积1∶5加入0.1%g/mL 胶原酶II(Sigma,美国)溶液,于37°C 水浴中轻柔晃动15 min,静置1 min,吸取上层消化液等待过滤,下层组织碎片继续加入新消化液重复消化,如此循环消化3次。获得的上层消化液依序于100 目和200 目筛网中过滤,向滤液中加0.5 mL 胎牛血清(fetal bovine serum,FBS)中止消化。300 ×g 离心10 min,弃上清液,加入红细胞裂解液,室温孵育15min,离心弃上清液,洗涤一遍后加入含10%FBS 的DMEM/F-12 重悬细胞,铺板,37°C 5% CO2条件下培养箱孵育6 h,更换新鲜培养基以去除悬浮细胞。
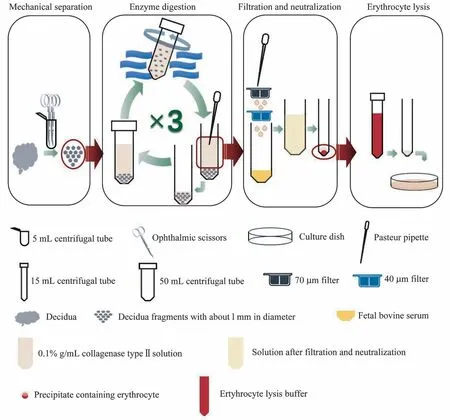
图1 原代蜕膜基质细胞的分离提取Fig 1 Isolation of primary decidual stromal cells
1.2.3 酶联免疫吸附试验 采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)方法测定外周血PRL 水平。根据ELISA 试剂盒(R&D Systems,美国)说明书要求进行,通过酶标仪检测吸光度值,并根据标准曲线计算PRL含量。
1.2.4 免疫组织化学方法 采用免疫组织化学方法(immunohistochemistry,IHC)对蜕膜进行角蛋白和波形蛋白染色以鉴定DSCs。同样采用IHC 方法检测DSCs 中PRL 的表达水平。蜕膜石蜡切片经脱蜡/水合、抗原修复和内源性过氧化物酶封闭后,用1×TBST/5%BSA 室温封闭1 h。吸去封闭液,滴加抗人角蛋白、波形蛋白或PRL一抗(Abcam,美国),4 ℃孵育过夜。滴加辣根过氧化物酶标记试剂,湿盒中室温孵育30 min。滴加过氧化物酶底物工作液,显色10 min。苏木精复染。扫描切片,Image J 软件对目标蛋白进行平均光密度(average optical density,AOD)测定和分析。
1.2.5 细胞免疫荧光 采用细胞免疫荧光(immuno fluorescence,IF)方法检测角蛋白和波形蛋白,进一步对DSCs进行鉴定。制备细胞爬片,以4%多聚甲醛室温固定15 min。滴加封闭缓冲液(1×PBS/5% BSA/0.3% Triton™X-100),室温封闭破膜60 min。吸去封闭缓冲液,加入抗人角蛋白和波形蛋白一抗,4 ℃孵育过夜。滴加荧光二抗,室温下避光孵育60 min。滴加含有染色质染料4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)的封片剂。用荧光显微镜观察拍照。
1.2.6 实时定量PCR 采用实时定量PCR(quantitative real time PCR,RT-qPCR)方法检测DSCs PRL mRNA 表达水平。按照说明书,使用MiniBEST Universal RNA Extraction Kit (Takara, 日 本) 提 取RNA, 使 用PrimeScript™RT Reagent Kit (Takara,日本)将RNA 逆转 录 合 成cDNA, 使 用PrimeScript ™RT Master Mix(Takara,日本)制备RT-qPCR 反应体系,见表1。使用QuantStudio Test Development 软件进行RT-qPCR,使用β-actin作为内参,2−ΔΔCt方法计算相对表达量。
1.2.7 蛋白质免疫印迹 试验采用蛋白质免疫印迹试验(Western bloting)方法检测DSCs 的PRL 蛋白表达水平。向培养皿中加入含有蛋白酶抑制剂(0.1 mg/mL)的细胞裂解液,冰上操作,细胞刮刀收集裂解液,冰上继续裂解30 min,13 000×g 4 ℃离心20 min,收集上清,加上样缓冲液,100 ℃煮10 min,−20 ℃冷藏待用。配制10%的SDS-PAGE胶,上样量20~30 μg,电泳。电转至PVDF膜。室温封闭1 h。加入抗PRL 一抗过夜。加入显色二抗,室温孵育60 min,扫膜,采用Image J 软件分析目标蛋白的灰度值。
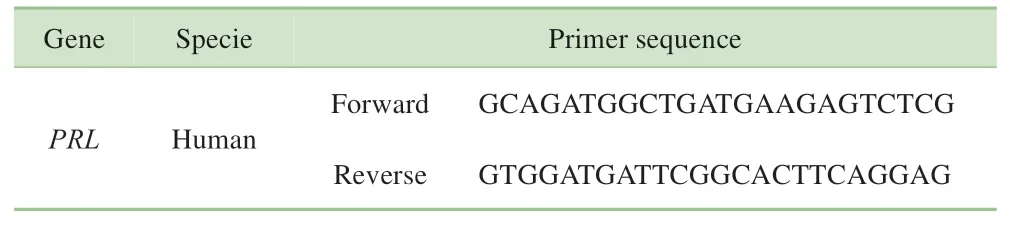
表1 RT-qPCR引物系列(5´→3´)Tab 1 Primer sequences for RT-qPCR(5´→3´)
1.2.8 统计学分析 采用SPSS 22.0统计软件进行统计学分析。定量资料以±s 表示,2 组之间比较采用独立样本t 检验,多组组间比较采用单因素方差分析(One-way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 各组一般资料
URPL 组入组80 例,其中21 例因绒毛染色体异常而排除,最终纳入59 例。人工流产组共70 例。190 例有生育要求的妊娠妇女中共计177 例完成随访(4 例失访,9 例因主观意愿终止妊娠而退出),其中157 例活产,归入正常妊娠活产组(151 例足月分娩、6 例早产),其余20 例发生胚胎停育或自然流产(6 例发生在孕5~5+6周、10 例发生在孕6~7+6周、3 例发生在孕8~9+6周、1 例发生在孕14 周),其中流产发生于孕10 周以前的19 例归入正常妊娠流产组。研究将各组按照标本采集当日的孕周分为孕5~5+6周、孕6~7+6周和孕8~9+6周3个亚组。以上各个亚组的一般情况如表2所示,同组内各亚组间的年龄差异无统计学意义,相同孕周各组间的年龄差异亦无统计学意义。
2.2 外周血PRL水平
如表3 和图2 所示,正常妊娠活产组和人工流产组妇女的外周血PRL 水平类似,都随着孕周的增加显著上升,差异有统计学意义(正常妊娠活产组:孕5~5+6周vs孕6~7+6周,P=0.002;孕6~7+6周vs 孕8~9+6周,P= 0.012。人工流产组:孕5~5+6周vs 孕6~7+6周,P = 0.015;孕6~7+6周vs 孕8~9+6周,P=0.023),且相同孕周的2 组妇女之间差异无统计学意义。而URPL 组妇女的外周血PRL 水平随着孕周增长无明显上升,差异无统计学意义;孕5~5+6周时,其与正常妊娠活产组和人工流产组相比,差异无统计学意义;孕6~7+6周和孕8~9+6周时,其显著低于相同孕周的正常妊娠活产组和人工流产组妇女,差异有统计学意义(孕6~7+6周:P= 0.018,0.024;孕8~9+6周:P=0.015,0.003)。正常妊娠流产组妇女外周血PRL水平类似于URPL妇女:不随孕周的增长而上升,差异无统计学意义;相同孕周时,两组妇女之间差异无统计意义;孕6~7+6周时,其亦显著低于相同孕周的正常妊娠活产组和人工流产组妇女,差异有统计学意义(P=0.022,P=0.041)。
表2 各组患者的一般情况比较(±s)Tab 2 Comparison of general conditions of patients in the four groups(±s)
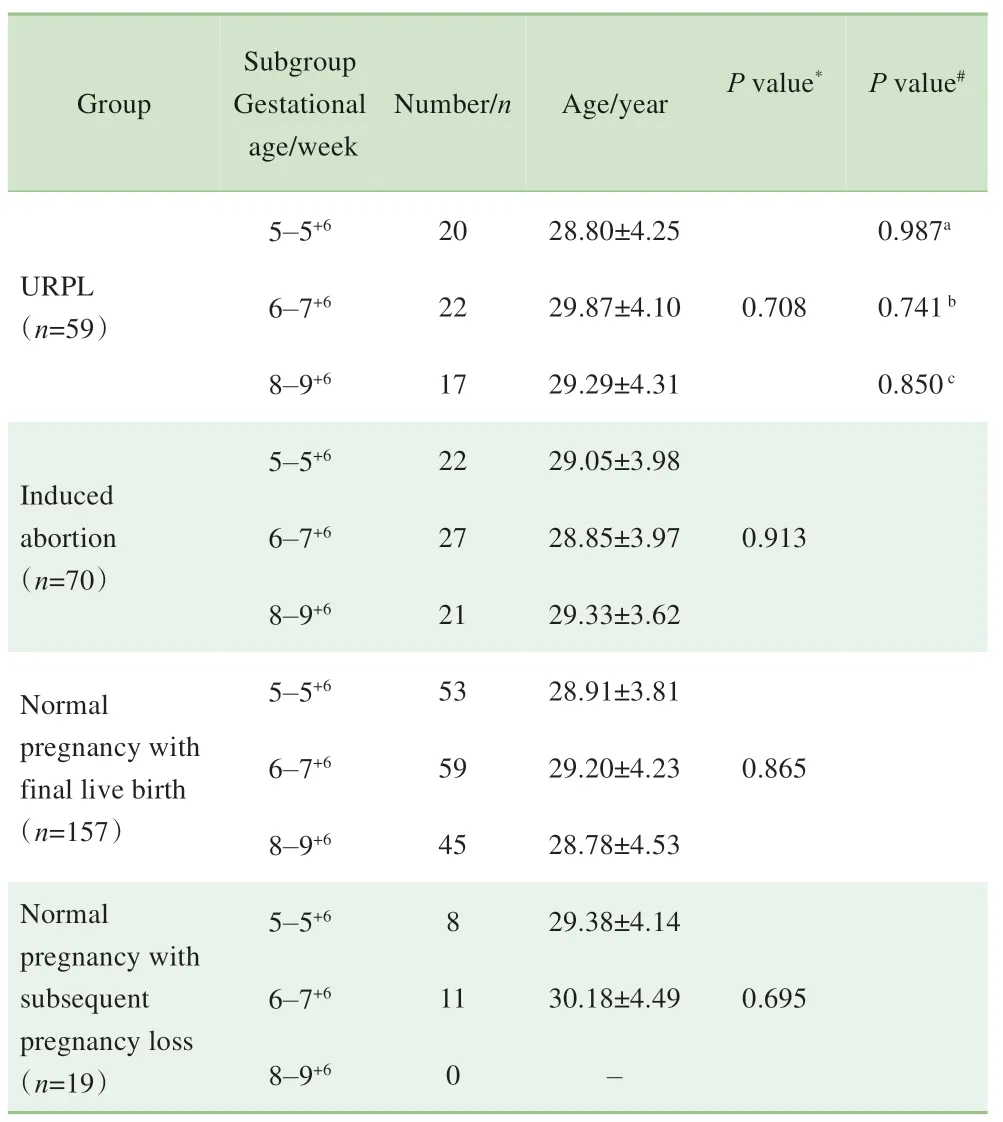
表2 各组患者的一般情况比较(±s)Tab 2 Comparison of general conditions of patients in the four groups(±s)
Note: *: Comparison of subgroups (5-5+6 week, 6-7+6 week and 8-9+6 week)in the same group by One-way ANOVA. #: Comparison of women from different groups (URPL, induced abortion, normal pregnancy with final live birth and normal pregnancy with subsequent pregnancy loss) with the same gestational week by One-way ANOVA. a: Comparison of women from different groups with the same gestation of 5-5+6 week. b:Comparison of women from different groups with the same gestation of 6 - 7+6 week.c: Comparison of women from different groups with the same gestation of 8-9+6 week.
Group Subgroup Gestational age/week Number/n Age/year P value*P value#5-5+6 URPL(n=59)6-7+6 0.708 8-9+6 0.987a 0.741b 0.850c 5-5+6 Induced abortion(n=70)6-7+6 0.913 8-9+6 Normal pregnancy with final live birth(n=157)5-5+6 6-7+6 0.865 8-9+6 Normal pregnancy with subsequent pregnancy loss(n=19)5-5+6 6-7+6 0.695 8-9+6 20 22 17 22 27 21 53 59 45 8 11 0 28.80±4.25 29.87±4.10 29.29±4.31 29.05±3.98 28.85±3.97 29.33±3.62 28.91±3.81 29.20±4.23 28.78±4.53 29.38±4.14 30.18±4.49-
2.3 蜕膜基质细胞的鉴定
角蛋白和波形蛋白被广泛用于对DSCs的鉴定。我们亦采用这2 种骨架蛋白通过IHC 和IF 方法对DSCs 进行鉴定。结果如图3所示。对于蜕膜石蜡切片进行角蛋白和波形蛋白的IHC 染色可将DSCs 与腺上皮区分开:DSCs 表达波形蛋白,不表达角蛋白;而腺上皮表达角蛋白,不表达波形蛋白。在DSCs的分离和体外培养中,对分离得到的贴壁细胞同样进行角蛋白和波形蛋白的IF 染色,发现得到的绝大多数细胞都表现为波形蛋白染色阳性,角蛋白染色阴性,证实其为DSCs。DSCs 纯度按波形蛋白+角蛋白—细胞占所有贴壁细胞的百分比计算,根据IF染色结果,DSCs纯度>95%。
表3 各组患者的外周血PRL水平(±s)Tab 3 PRL levels in peripheral blood of women in four groups(±s)
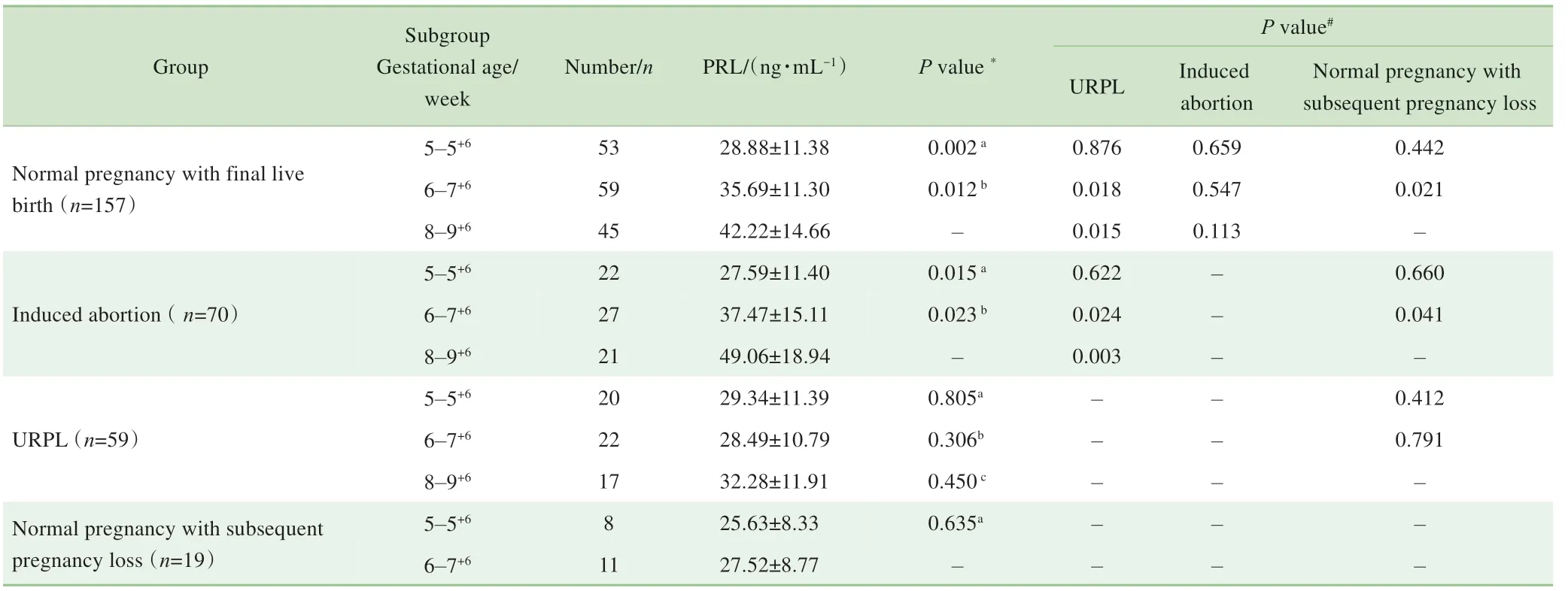
表3 各组患者的外周血PRL水平(±s)Tab 3 PRL levels in peripheral blood of women in four groups(±s)
Note: *:Comparison between subgroups in the same group by unpaired t test: a:5-5+6 week vs 6-7+6 week; b:6-7+6 week vs 8-9+6 week; c:8-9+6week vs 5-5+6 week.#:Comparison of women from different groups(normal pregnancy with final live birth,URPL,induced abortion and normal pregnancy with subsequent pregnancy loss)with the same gestational week by unpaired t test.
Group Normal pregnancy with final live birth(n=157)Induced abortion(n=70)0.876 0.018 0.015 0.622 0.024 0.003 Number/n PRL/(ng·mL−1)Subgroup Gestational age/week 5-5+6 6-7+6 8-9+6 5-5+6 6-7+6 8-9+6 5-5+6 6-7+6 8-9+6 5-5+6 6-7+6 P value#P value *URPL URPL(n=59)——-28.88±11.38 35.69±11.30 42.22±14.66 27.59±11.40 37.47±15.11 49.06±18.94 29.34±11.39 28.49±10.79 32.28±11.91 25.63±8.33 27.52±8.77 Normal pregnancy with subsequent pregnancy loss(n=19)53 59 45 22 27 21 20 22 17 8 11 0.002a 0.012b-0.015a 0.023b-0.805a 0.306b 0.450c 0.635a-Induced abortion 0.659 0.547 0.113 Normal pregnancy with subsequent pregnancy loss 0.442 0.021-0.660 0.041-0.412 0.791————---
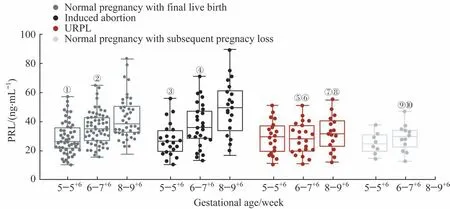
图2 正常妊娠活产组、人工流产组、URPL组和正常妊娠流产组妇女的外周血PRL水平Fig 2 PRL levels in peripheral blood of women in normal pregnancy with final live birth group,induced abortion group,URPL group and normal pregnancy with subsequent pregnancy loss group
2.4 PRL在DSCs中的表达
本研究通过qRT-PCR、WB 以及IHC 方法分别在RNA 和蛋白水平检测PRL 在DSCs 中的表达水平,结果如表4 和图4 所示:人工流产组中,DSCs 的PRL 表达在RNA 和蛋白水平上均随着孕周的增加显著上升,差异有统计学意义(孕5~5+6周vs 孕6~7+6周:qRT-PCR,P =0.020;WB,P=0.010;IHC,P=0.030。孕6~7+6周vs孕8~9+6周:qRT-PCR,P = 0.011;WB,P = 0.034;IHC,P=0.012);在URPL组中,孕6~7+6周的PRL表达与孕5~5+6周相比在RNA 水平和蛋白水平上都没有显著变化,差异无统计学意义;孕8~9+6周时,DSCs 的PRL 表达才出现显著增高,差异有统计学意义(qRT-PCR:P=0.016;WB:P=0.016;IHC:P=0.021)。URPL 妇女在孕6~7+6周及孕8~9+6周时,DSCs 的PRL 表达在mRNA 及蛋白水平上都显著低于相同孕周的人工流产妇女组,差异有统计学意义(孕6~7+6周:qRT-PCR,P = 0.012;WB,P =0.014;IHC,P = 0.028。孕8~9+6周:RT-qPCR,P =0.011;WB,P=0.030;IHC,P=0.026)。
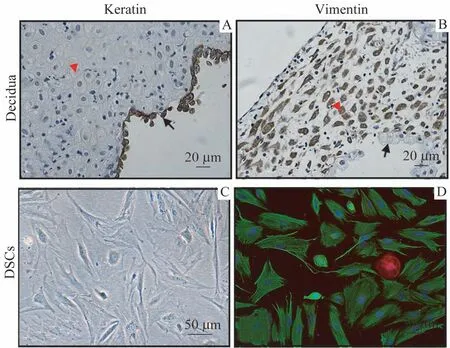
图3 蜕膜基质细胞的鉴定(IHC和IF方法)Fig 3 Identification of decidual stromal cells by immunohistochemistry and immunofluorescence
3 讨论
自然流产是妇产科常见的疾病,其中80%以上发生在妊娠早期,且大多在妊娠10 周以内[13]。Goldstein等[14]对232 名孕妇的妊娠结局进行随访,发现有13.4%的妇女发生了临床诊断明确的流产,其中的87.0%发生在妊娠10 周以前。本研究结果显示完成随访的177 例有生育要求的早孕妇女中有20 例发生流产(11.3%),其中19 例都发生在孕10 周前,仅有1 例发生在孕14 周。我们的研究结果和既往报道一致,提示妊娠10 周以前是决定妊娠结局的重要时期。这一阶段正是胎盘形成的关键时期,DSCs通过自身蜕膜化所产生的大量细胞因子[15-18]参与其中并发挥调控作用。其中,PRL 是DSCs 蜕膜化的标志性产物,已被确认羊水PRL 的主要来源就是DSCs。已有研究报道PRL 具有广泛的生理调控作用,如调节种植窗的内膜容受性,刺激滋养细胞生长和侵袭,促进血管生成,调节蜕膜NK 细胞的活性,调节羊膜中水分转运等[19-23]。对孕9~12 周的羊水和胚胎外宫腔液的一项研究发现,胚胎外宫腔液中PRL是羊水含量的近10倍[24],提示蜕膜在孕早期即有较高水平的PRL 分泌。我们既往的研究发现孕6~7 周的DSCsPRL 表达水平显著高于黄体中期的ESCs[25]。为了进一步研究早孕期DSCs 中PRL 表达及其变化趋势,以及PRL 在URPL 患者中表达是否存在异常,我们对孕5~9+6周范围内的人工流产组和UPRL 组蜕膜组织进行分析,发现正常早期妊娠中,DSCs 的PRL表达在mRNA 和蛋白水平上均随着孕周增加而显著增加;但在URPL 组,直至8~9+6周时,DSCs的PRL 表达才出现显著增加,但仍显著低于相同孕周的人工流产组。这些结果表明在正常妊娠情况下,DSCs 中的PRL 表达随着孕周的增长而不断增加,子宫内膜的蜕膜化程度亦不断进展,这有利于胚胎的植入及其生长发育。而在URPL患者中,DSCs 中的PRL 表达出现增长滞后,蜕膜化程度不足,提示PRL的表达下降和其代表的蜕膜化不足与URPL的发生可能有相关。这些研究结果为蜕膜PRL 表达对于妊娠的建立和维持的重要性提供了更多的临床证据,也为URPL的病因研究提供了新思路。

表4 人工流产组和URPL组中PRL在蜕膜基质细胞中的表达Tab 4 PRL expression of decidual stromal cells in the UPRL and induced abortion groups
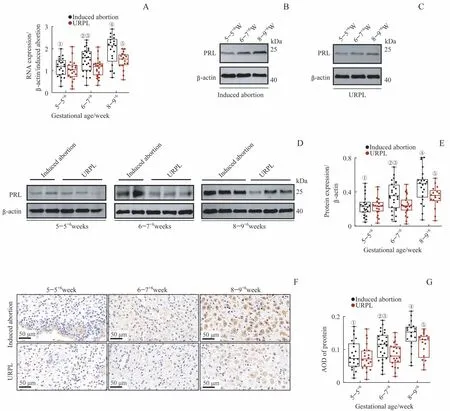
图4 人工流产组和URPL组中PRL在蜕膜基质细胞中的表达Fig.PRL expression of decidual stromal cells in UPRL and induced abortion groups
人类妊娠期间的外周血PRL 主要由垂体分泌,也可能部分来源于子宫局部DSCs 的分泌。从孕7~8 周开始,外周血PRL 水平即随着孕周增长持续上升,直至在孕36 周到达峰值,随后下降[26]。我们的研究结果提示正常妊娠外周血PRL 的显著上升始于孕6~7+6周,随着孕周增加平稳升高,而URPL 患者的外周血PRL 并不能随着孕周增长而发生显著上升。此外,对正常妊娠流产组的19 名妇女与他组妇女进行比较,发现她们的外周血PRL水平和URPL组妇女相类似,提示胚胎停育或自然流产妇女可能普遍存在外周血低水平PRL,与既往研究[27-28]结果一致。结合既往报道,我们认为孕6周以后出现的外周血PRL 水平低下或增长滞后可能预示胚胎发育不良。妊娠早期连续动态检测外周血PRL 水平对判断妊娠结局可能有一定的价值。
参·考·文·献
[1] Practice Committee of the American Society for Reproductive Medicine.Evaluation and treatment of recurrent pregnancy loss: a committee opinion[J]. Fertil Steril,2012,98(5):1103-1111.
[2] 肖世金,赵爱民. 复发性流产病因学研究进展[J]. 中国实用妇科与产科杂志,2014,30(1):41-45.
[3] Kutteh WH. Novel strategies for the management of recurrent pregnancy loss[J]. Semin Reprod Med,2015,33(3):161-168.
[4] Pijnenborg R. Trophoblast invasion and placentation in the human:morphological aspects[M]//Trophoblast Invasion and Endometrial Receptivity. Boston,MA:Springer US,1990:33-47.
[5] Sharma S, Godbole G, Modi D. Decidual control of trophoblast invasion[J]. Am J Reprod Immunol,2016,75(3):341-350.
[6] Wu WX, Brooks J, Millar MR, et al. Localization of the sites of synthesis and action of prolactin by immunocytochemistry and in situ hybridization within the human utero-placental unit[J]. J Mol Endocrinol, 1991, 7(3):241-247.
[7] McCoshen JA,Barc J. Prolactin bioactivity following decidual synthesis and transport by amniochorion[J]. Am J Obstet Gynecol,1985,153(2):217-223.
[8] Luciano AA, Varner MW. Decidual, amniotic fluid, maternal and fetal prolactin in normal and abnormal pregnancies[J]. Obstet Gynecol, 1984,63(3):384-388.
[9] Rosenberg SM,Maslar IA,Riddick DH. Decidual production of prolactin in late gestation: further evidence for a decidual source of amniotic fluid prolactin[J]. Am J Obstet Gynecol,1980,138(6):681-685.
[10] Gellersen B, Brosens JJ. Cyclic decidualization of the human endometrium in reproductive health and failure[J]. Endocr Rev,2014,35(6):851-905.
[11] Garzia E, Borgato S, Cozzi V, et al. Lack of expression of endometrial prolactin in early implantation failure: a pilot study[J]. Hum Reprod, 2004,19(8):1911-1916.
[12] Francis J, Rai R, Sebire NJ, et al. Impaired expression of endometrial differentiation markers and complement regulatory proteins in patients with recurrent pregnancy loss associated with antiphospholipid syndrome[J]. Mol Hum Reprod,2006,12(7):435-442.
[13] Hertz-Picciotto I, Samuels SJ. Incidence of early loss of pregnancy[J]. N Engl J Med,1988,319(22):1483-1484.
[14] Goldstein SR. Embryonic death in early pregnancy: a new look at the first trimester[J]. Obstet Gynecol,1994,84(2):294-297.
[15] Zhu XM, Han T, Sargent IL, et al. Conditioned medium from human decidual stromal cells has a concentration-dependent effect on trophoblast cell invasion[J]. Placenta,2009,30(1):74-78.
[16] Paiva P, Salamonsen LA, Manuelpillai U, et al. Interleukin 11 inhibits human trophoblast invasion indicating a likely role in the decidual restraint of trophoblast invasion during placentation[J]. Biol Reprod, 2009, 80(2):302-310.
[17] Jovanović M, Vićovac L. Interleukin-6 stimulates cell migration, invasion and integrin expression in HTR-8/SVneo cell line[J]. Placenta, 2009, 30(4):320-328.
[18] Prutsch N, Fock V, Haslinger P, et al. The role of interleukin-1β in human trophoblast motility[J]. Placenta,2012,33(9):696-703.
[19] Jabbour HN, Critchley HO. Potential roles of decidual prolactin in early pregnancy[J]. Reproduction,2001,121(2):197-205.
[20] Stefanoska I, Jovanović Krivokuća M,Vasilijić S, et al. Prolactin stimulates cell migration and invasion by human trophoblast in vitro[J]. Placenta,2013,34(9):775-783.
[21] Ben-Jonathan N, LaPensee CR, LaPensee EW. What can we learn from rodents about prolactin in humans?[J]. Endocr Rev,2008,29(1):1-41.
[22] Corbacho AM, Martínez De La Escalera G, Clapp C. Roles of prolactin and related members of the prolactin/growth hormone/placental lactogen family in angiogenesis[J]. J Endocrinol,2002,173(2):219-238.
[23] Tyson JE, Mowat GS, McCoshen JA. Simulation of a probable biologic action of decidual prolactin on fetal membranes[J]. Am J Obstet Gynecol,1984,148(3):296-300.
[24] Wathen NC, Campbell DJ, Patel B, et al. Dynamics of prolactin in amniotic fluid and extraembryonic coelomic fluid in early human pregnancy[J]. Early Hum Dev,1993,35(3):167-172.
[25] Chen C, Li CC, Liu WC, et al. Estrogen-induced FOS-like 1 regulates matrix metalloproteinase expression and the motility of human endometrial and decidual stromal cells[J]. J Biol Chem,2020,295(8):2248-2258.
[26] Manganiello PD, Nazian SJ, Ellegood JO, et al. Serum progesterone, 17 alpha-hydroxyprogesterone, human chorionic gonadotropin, and prolactin in early pregnancy and a case of spontaneous abortion[J]. Fertil Steril,1981,36(1):55-60.
[27] 程玲慧,曹云霞. 催乳素、孕酮、雌二醇及其受体对早期胚胎发育的影响[J]. 实用妇产科杂志,2011,27(4):307-309.
[28] 朱峻峰,周文婷,孙丹. 孕激素动态监测在孕早期胚胎发育诊断中的应用价值分析[J]. 中国妇幼保健,2018,33(10):2310-2312.

