重组角蛋白单体外源表达、纯化及鉴定
宋枭枭, 周骏驰, 徐 盼, 曹张军
东华大学东华大学化学化工与生物工程学院,上海 201620
角蛋白广泛存在于脊椎动物羽毛,鳞片,爪等部位,具有不溶于水、不易降解、含硫量高等特性[1, 2]。全球每年产生约200万吨羽毛[3],羽毛中角蛋白含量占90%[4],角蛋白相对分子量约为10 000~36 000[5,6]。角蛋白中含有大量半胱氨酸,分子内和分子间形成大量二硫键,不会被常见的蛋白水解酶降解[7]。角蛋白具有出色的生物相容性和生物降解性,在蛋白质材料方面具有广阔前景[8]。
研究发现,降解羽毛首先要破坏掉其内部的二硫键,氢键以及疏水作用,将不溶的羽毛变为可溶的角蛋白[5]。目前提取可溶性角蛋白主要通过化学还原法溶解羽毛[9],这些化学试剂会破坏角蛋白中的氨基酸组分,形成非营养性氨基酸[10]。利用微生物降解羽毛是一种高效,绿色环保的降解方法[11],但有关微生物降解羽毛角蛋白具体机理尚无定论。曹张军[12]从腐烂的鸡毛中分离出一种羽毛降解菌株,经测序鉴定命名为嗜麦芽窄食单胞菌DHHJ(S.maltophiliaDHHJ)。S.maltophiliaDHHJ是一种需氧型,氧化酶阴性,葡萄糖非发酵的革兰氏阴性杆菌(GNB),广泛存在于水、土壤、动植物体内[13, 14]。朱茜[15]使用羽毛粉M9培养基培养S.maltophiliaDHHJ,羽毛粉作为氮源,SDS-PAGE电泳检测到约为10 kDa的角蛋白单体条带。角蛋白单体是S.maltophiliaDHHJ降解羽毛过程中关键物质。
化学法溶解羽毛制备的水溶性角蛋白培养S.maltophiliaDHHJ,培养基中出现大量的絮状沉淀,对后续实验有一定的影响,且提取过程会破坏角蛋白分子中一些氨基酸,影响角蛋白的生物活性。因此,本研究通过构建角蛋白表达载体并在大肠杆菌BL21 (DE3)中诱导表达角蛋白单体,用于研究S.maltophiliaDHHJ降解角蛋白机理。
1 材料与方法
1.1 实验材料
角蛋白基因扩增引物由生工生物公司合成,S.maltophiliaDHHJ为本实验室保藏菌种,宿主菌株 BL21(DE3),质粒pET32a(+),小鼠抗6×His-tag单克隆抗体及HRP标记的山羊抗小鼠多克隆抗体购自生工生物公司,NcoⅠ和XhoⅠ购自Takara公司。
1.2 实验方法
1.2.1角蛋白基因扩增
在NCBI上查询到羽毛角蛋白基因(NM_001081702.2)[16],该基因位于鸡25号染色体上,全长297 bp,将角蛋白基因插入pET-32a(+)克隆载体,克隆位点为NcoI/XhoI。使用热激转化法将重构质粒转化到大肠杆菌BL21(DE3)中。
(1) 引物设计
使用Snap Gene设计扩增角蛋白基因片段的引物,由生工生物公司合成。上游引物NcoI-Keratin:5′ catgccatggATGTCCTGCTTCGATCTGTG 3′;下游引物Keratin-XhoI:5′ ccgctcgagTTAGCAGGGCAGACACCTCC 3′。
(2) 角蛋白基因扩增
将一定量的引物、模板、Taq酶、缓冲液、dNTP以及无菌水加至PCR管中,扩增条件如下 :1) 95℃预变性5 min,2) 95 ℃变性15 s,3) 55 ℃退火15 s,4) 72 ℃延伸15 s,30个循环,5) 72 ℃总延伸5 min,扩增反应结束后,将PCR产物进行琼脂凝胶电泳,使用生工生物公司的胶回收试剂盒回收目的片段。
1.2.2质粒构建与转化
使用NcoI,XhoI快切酶切割角蛋白基因片段与pET32a(+)质粒形成互补的黏性末端。酶切反应体系(50 μL):10×Fast Digest Buffer 5 μL;Keratin/pET32a(+)质粒 40 μL;NcoI 2.5 μL;XhoI 2.5 μL。将上述试剂依次加至离心管中,37 ℃反应3 h,酶切后的角蛋白基因片段与质粒进行琼脂糖凝胶电泳,回收酶切产物,使用T4 DNA连接试剂盒,16 ℃过夜反应,将角蛋白基因连接到pET32a(+)载体中。使用热激法将重组质粒转化至感受态BL21(DE3)。涂布至含有氨苄青霉素的LB平板,37 ℃过夜培养,挑选单菌落进行菌落PCR鉴定,同时将PCR产物送至生工生物进行测序鉴定。
1.3 重组角蛋白诱导表达
1.3.1重组角蛋白诱导表达条件优化
温度、IPTG浓度和诱导时间均会影响重组角蛋白的表达量。综合这些因素,先进行预实验探究诱导角蛋白基因表达的最适温度,最适IPTG浓度和最适诱导时间。
(1) 最适诱导温度
使用0.5 mmol/L IPTG诱导重组角蛋白表达,分别在37 ℃培养4 h,18 ℃培养17 h,取诱导后的菌液进行SDS-PAGE,判断有无包涵体生成。
(2) IPTG最佳浓度与最佳诱导时间
分别使用0.5 mmol/L、0.75 mmol/L、1 mmol/L三个浓度梯度的IPTG,18 ℃,分别培养15 h、17 h和19 h,取诱导后的菌液进行SDS-PAGE。
1.3.2重组角蛋白纯化与鉴定
(1) 使用上述实验得出的最适条件诱导重组菌株角蛋白基因表达,5 000 r/min,4 ℃离心20 min收集菌体,使用细胞破碎仪破碎菌体,12 000 r/min,4 ℃离心20 min,收集上清液,使用0.45 μm孔径的过滤器除去上清液中的不溶物。
(2) 使用Ni柱亲和层析法纯化上清液中的重组角蛋白,使用咪唑浓度为40 mmol/L的洗涤液除去杂蛋白,咪唑浓度为250 mmol/L洗脱液洗脱结合在Ni柱上的重组角蛋白。将重组角蛋白溶液装入透析袋置于50 mmol/L的Tris缓冲液(pH=7.8)中,过夜透析,除去咪唑,测定重组角蛋白浓度与产量。
(3) 重组角蛋白进行SDS-PAGE,条带转至PVDF膜上(恒流300 mA,100 min)。PVDF膜放入封闭液中封闭30 min,弃去封闭液,PBS洗膜2次。加入1∶1 000稀释的小鼠抗6×His单克隆抗体,4 ℃过夜孵育,使用TBST清洗PVDF膜3次,每次5 min,除去未结合的一抗。加入1∶2 000稀释的HRP标记的山羊抗小鼠多克隆抗体室温孵育30 min。TBST洗5次,每次5 min,洗去未结合的二抗。ECL显影法显色,凝胶成像仪记录实验结果。
1.4 重组角蛋白活性检测
1.4.1重组角蛋白M9培养基中S.maltophiliaDHHJ生长状况
取1 mL角蛋白M9培养基中过夜培养的S.maltophiliaDHHJ菌液,离心(10 000 r/min,2 min)收集菌体,PBS清洗菌体2次,加入2.5%戊二醛固定剂固定4 h; PBS清洗菌体2次,依次使用30%、50%、70%、90%、100%、100%乙醇溶液逐级脱水,每次15 min;叔丁醇置换30 min;烘干,使用无水乙醇重悬菌体,取一滴菌液滴加在铝箔上,喷金,场发射扫描电子显微镜观测。
1.4.2角蛋白酶活性测定
角蛋白酶活性测试方法参考郝亚楠[17],取4 mL重组角蛋白M9培养中的S.maltophiliaDHHJ,10 000 r/min,4 ℃离心5 min,收集上清液。称取10 mg羽毛粉作为底物,加入1 mL上清液,2 mL Tris缓冲液(50 mmol/L,pH=7.8),40 ℃水浴1 h,加入2 mL 10%三氯乙酸溶液4 ℃静置30 min终止反应,离心(10 000 r/min,4 ℃,10 min),测定上清液280 nm处的吸光度。每组做三个平行实验,水浴前加入2 mL 10%三氯乙酸溶液作空白对照组。角蛋白酶活性的定义为280 nm处的吸光值每增加0.1为1 U。
2 结果与讨论
2.1 重组菌株构建
角蛋白基因在NcoI和XhoI两种快切酶作用下形成黏性末端(图1a),pET32a(+)载体全长5 900 bp,经过NcoI和XhoI酶切后形成与角蛋白基因互补的黏性末端,T4 DNA连接试剂盒将角蛋白基因与载体连接,使用热激法将重组载体导入BL21(DE3)中得到重组菌株BL21(DE3)-pET32a(+)-Keratin(图1c)。
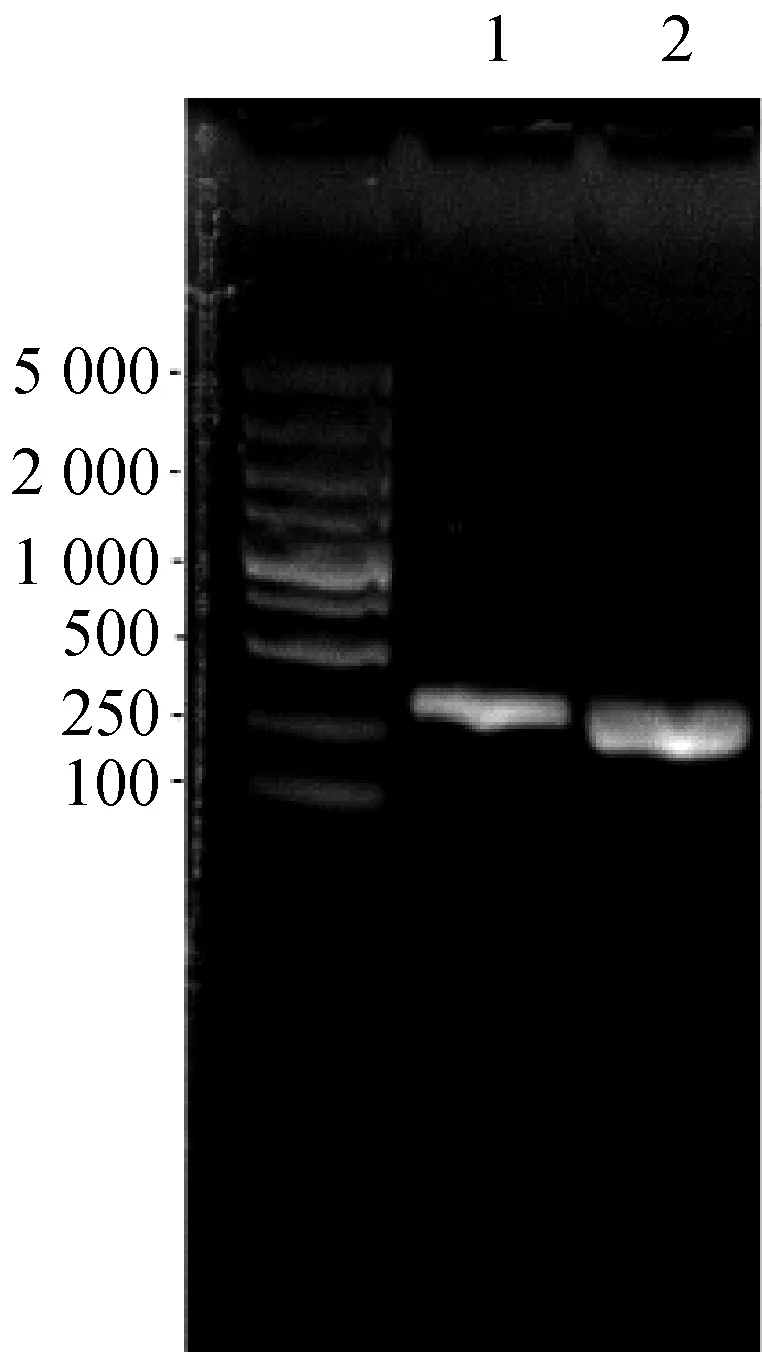
a

b

c
2.2 重组角蛋白诱导表达
图2a是18 ℃,17 h诱导角蛋白基因表达电泳图,加入IPTG后出现重组角蛋白,菌体破碎后上清液含有重组角蛋白而沉淀中没有,证明无包涵体产生,菌体表达的是可溶性重组角蛋白。图2b是37 ℃,4 h诱导角蛋白基因表达电泳图,上清液和沉淀均出现重组角蛋白,诱导过程中形成包涵体,影响重组角蛋白的产量。因此,后续实验采用低温(18 ℃)诱导角蛋白基因表达。

a
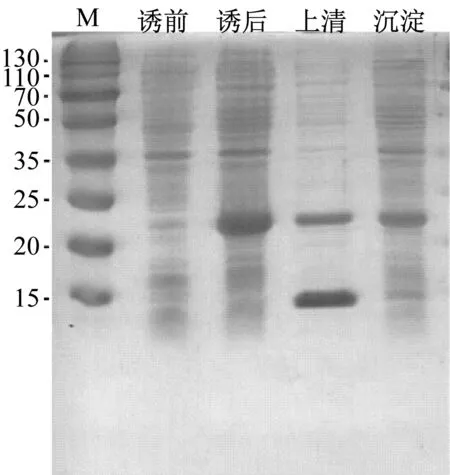
b
a: 18 ℃诱导17 h; b: 37 ℃诱导4 h
图2 重组角蛋白外源表达
图3a和b是重组角蛋白IPTG最适诱导条件电泳结果,诱导温度为18 ℃,IPTG浓度分别为0.5 mmol/L、0.75 mmol/L和1.0 mmol/L,培养时间分别为15 h、17 h和19 h。图3c是对应的重组角蛋白灰度值,结果显示IPTG浓度是0.5 mmol/L培养15 h和IPTG浓度0.75 mmol/L培养17 h,重组角蛋白表达量最高。因此后续实验采用IPTG浓度为0.5 mmol/L培养15 h诱导重组角蛋白表达。

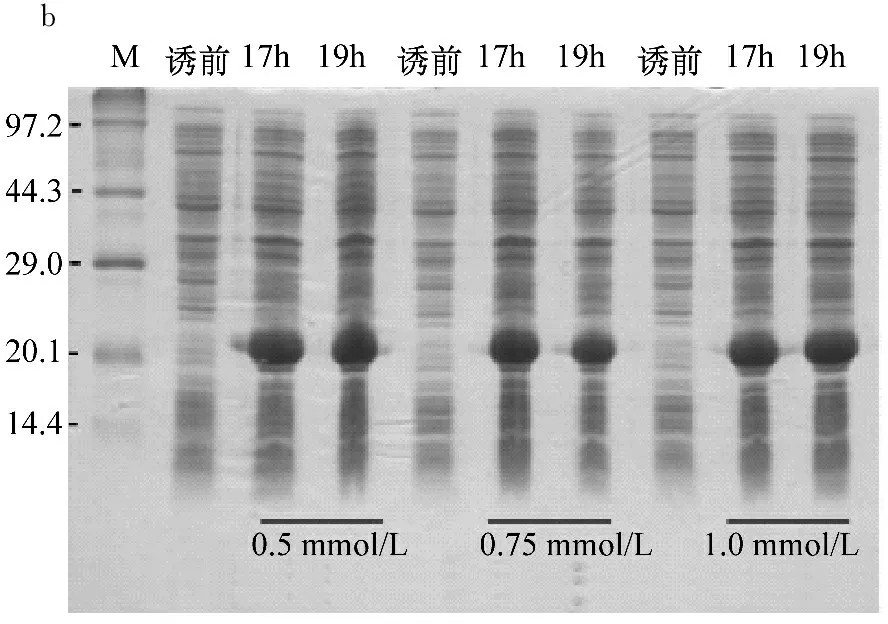
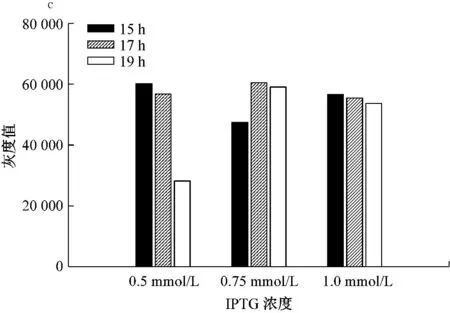
a和b为IPTG诱导浓度及诱导时间角蛋白单体产量;c为对应条带灰度值
图3 IPTG浓度与培养时间优化蛋白表达量SDS-PAGE检测
图4a中,经过Ni柱亲和层析法纯化得到重组角蛋白,蛋白条带颜色较深,无明显杂带,经测定重组角蛋白产量约为40 mg/L,浓度约为2 mg/mL。图4b中,b泳道与c泳道对应位置均出现明显的蛋白条带,证明纯化得到的蛋白就是重组角蛋白。
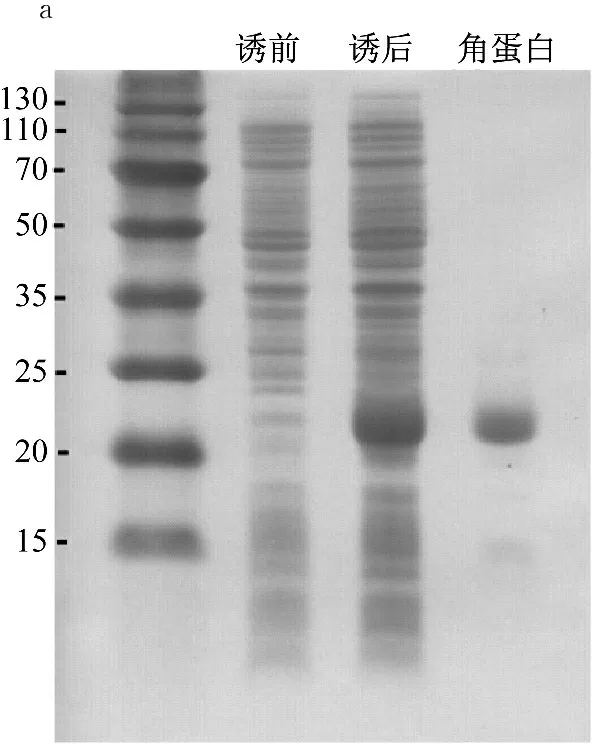
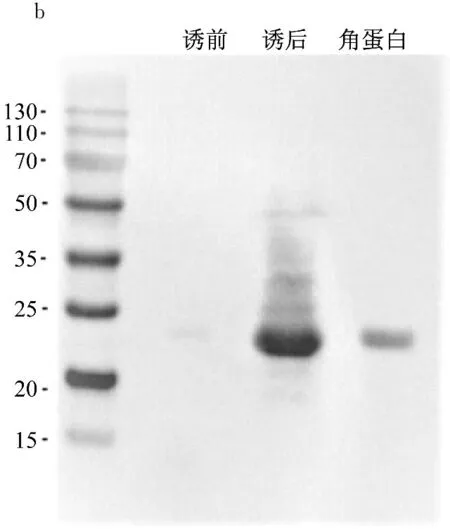
a: SDS-PAGE;b: Western Blotting
图4 重组角蛋白纯化与Western Blotting鉴定
2.3 重组角蛋白单体生物活性检测
不同来源的角蛋白M9培养基培养S.maltophiliaDHHJ 24 h后,培养液情况如图5所示。重组角蛋白培养基与牛肉膏蛋白胨培养的溶液外观相似(显现均匀浑浊),细菌能够利用重组角蛋白维持正常生理活动,试管中未出现絮状沉淀。羽毛水解角蛋白在S.maltophiliaDHHJ作用下,试管底部出现大量絮状沉淀,溶解性较差。

a: 重组角蛋白培养基;b: 羽毛水解角蛋白培养基图5 S.maltophilia DHHJ在不同培养基中生长状况
将上述培养的S.maltophiliaDHHJ细胞固定,电镜观察见图6。由图6知,试管底部絮状沉淀是S.maltophiliaDHHJ菌体与析出的角蛋白混合物,角蛋白从培养基中析出包裹在菌体表面沉淀到试管底部,对菌体生长以及生物活性造成一定影响,而重组角蛋白溶解性高于化学水解角蛋白,培养过程中不会析出,有利于菌体生长,同时也更有利于作为研究S.maltophiliaDHHJ降解角蛋白机理的底物。

a

b
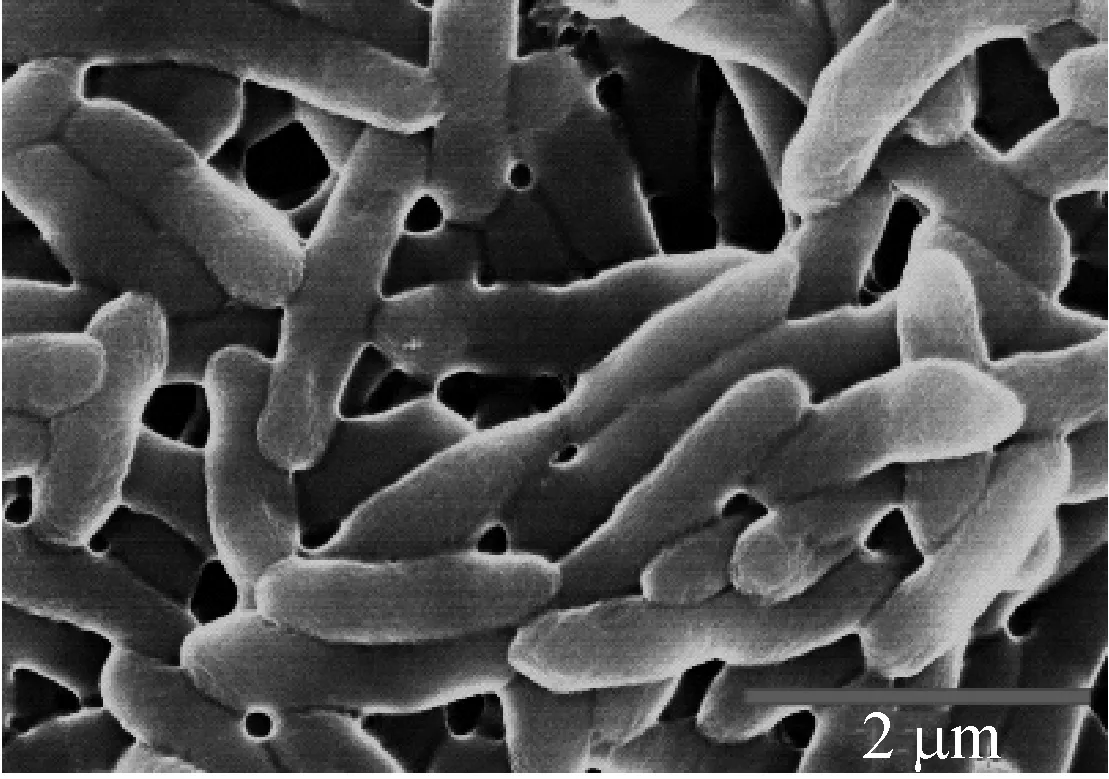
ca: 重组角蛋白培养基; b: 化学水解角蛋白培养基; c: 牛肉膏蛋白胨培养基图6 S.maltophilia DHHJ不同来源角蛋白培养基下形态观察
如图7所示,羽毛粉、化学水解角蛋白、重组角蛋白均能诱导S.maltophiliaDHHJ分泌角蛋白酶。在角蛋白等诱导物作用下,S.maltophiliaDHHJ分泌大量的角蛋白酶。三种诱导培养基中角蛋白酶活性变化趋于一致,24 h开始出现明显的角蛋白酶活性,48 h角蛋白酶活性最高,随着菌体消耗,角蛋白酶活性开始下降,但72 h时,重组角蛋白M9培养基中角蛋白酶活性明显高于其它两组,由于化学水解角蛋白在菌体的作用下会析出,而重组角蛋白则不会,培养基中重组角蛋白含量相对较高,因此,角蛋白酶活性也较高。

图7 三种诱导物诱导S.maltophilia DHHJ分泌角蛋白酶
3 结论
本文将角蛋白基因插入到pET32a(+)质粒,将重组质粒转入表达菌株BL21(DE3)。IPTG低温诱导角蛋白基因大量表达,利用Ni柱亲和层析法分离纯化得到重组角蛋白。重组角蛋白溶解性高于化学水解角蛋白,与S.maltophiliaDHHJ培养的过程中不会析出,重组角蛋白中带有His-tag与S-tag等标签,有利于重组角蛋白的纯化与鉴定。重组角蛋白具有生物活性能够被S.maltophiliaDHHJ结合并诱导菌体分泌角蛋白酶,可用于后续S.maltophiliaDHHJ降解角蛋白机制的研究。

