FBXO22 调控凋亡诱导因子的分子机制及其在肿瘤细胞凋亡中的作用
刘朦迪,潘漪莲,朱晓娜,杨 烁,杨 茜,余 韵
1. 上海交通大学医学院附属瑞金医院分子医学中心,上海200025;2. 上海交通大学医学院附属国际和平妇幼保健院生殖遗传科,上海200030;3.上海交通大学医学院附属国际和平妇幼保健院产科,上海200030
泛素化是一种由激活酶E1、结合酶E2 和连接酶E3构成的酶促级联反应,可与蛋白酶体组成泛素-蛋白酶体系统介导真核细胞内约80%的蛋白质降解或功能改变,其中连接酶E3 负责特异性识别及结合底物[1-2]。SKP1-CUL1-F-box(SCF)复合体是真核细胞中研究最多的E3连接酶,由支架蛋白CUL1、RING 型锌指蛋白、衔接蛋白S-期激酶关联蛋白1(S-phase kinase associated protein 1,SKP1)和底物招募蛋白F-box组成[3]。
F-box蛋白有2个重要的结构域,即F-box结构域和底物结合结构域;F-box蛋白可通过F-box结构域与SKP1相连,进而与CUL1、RING 等结合形成SCF 复合体。72 个F-box 家族成员根据底物结合结构域的特征被分为W、L和O 共3 个亚家族[4]。F-box 蛋白22(F-box only protein 22,FBXO22)作为O 亚家族的成员之一,其基因最早被发现是抑癌基因TP53 的靶基因[5];同时,FBXO22 可与甲基化P53、去甲基化酶4A形成三元复合体以调控细胞衰老[6]。近年来围绕FBXO22 在肿瘤中作用的研究表明:FBXO22 可通过降解类Krüppel 因子4(Krüppel-like factor 4,KLF4)促进肝癌细胞增殖[7];通过调控不同底物,促进乳腺癌的生长或抑制其转移[8-9];通过抑制基质金属蛋白酶9(matrix metalloprotein-9,MMP-9)的活性,降解转录因子BACH1(BTB and CNC homology 1),抑制肾癌细胞、肺癌细胞的转移[10-11];且本实验室前期研究发现,FBXO22 可 分 别 通 过 肝 激 酶B1 (liver kinase B1,LKB1)[12]、 抑 癌 蛋 白PTEN (phosphatase and tensin homolog deleted on chromosome ten)[13]促进肺癌细胞、结直肠癌细胞的增殖。综上所述,FBXO22能够在多种肿瘤的发生与发展中发挥促进肿瘤细胞增殖、抑制肿瘤细胞转移等作用,具有重要的临床研究意义。
凋亡诱导因子(apoptosis-inducing factor,AIF)是位于线粒体内外膜间隙的一类黄素蛋白,可在烷化剂甲基硝基亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine,MNNG)损伤、氧化应激下激活多聚ADP-核糖聚合酶PARP-1,导致多聚ADP-核糖PAR 累积,进而促进AIF从线粒体释放入核,并引起染色质凝集和DNA 大片段化,从而诱导细胞凋亡[14-18]。
目前相关研究[19-20]显示,E3 连接酶X 连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)仅能够影响AIF的活性,不能调控AIF水平。基于此,本研究通过挖掘FBXO22 的新底物,探讨其调控底物的分子作用机制,并研究该调控在结肠肿瘤细胞凋亡过程中的作用,以期为肿瘤的临床治疗提供新的潜在靶点。
1 材料与方法
1.1 细胞、主要试剂与仪器
HEK293T 细胞,肺癌细胞株A549,结肠癌细胞株SW480、SW620,结直肠癌细胞株HCT116 以及前列腺癌细胞株PC3(购自中国科学院上海细胞库),Fbxo22 野生型(Fbxo22+/+)和敲除型(Fbxo22−/−)小鼠胚胎成纤维细胞(mouse embryo fibroblasts,MEF)(由本课题组前期构建并保存)。FBXO22抗体(Proteintech Group,美国),AIF抗体(Abcam,美国),CUL1 抗体、SKP1 抗体、XIAP 抗体、β 肌动蛋白(β-actin)抗体、辣根过氧化物酶标记的鼠源或兔源免疫球蛋白抗体(CST,美国),血凝素(hemagglutinin,HA)标签抗体、偶联Flag抗体的M2亲和琼脂糖珠(Sigma-Aldrich,美国),胎牛血清(fetal bovine serum,FBS),DMEM培养基、RPMI-1640培养基(Gibco,美国),凋亡试剂盒(eBioscience,美国),Lipo2000(Invitrogen,美国),KOD DNA 聚合酶(Toyobo,日本),T4 连接酶(Promega,美国)。电泳仪、PCR 仪(Bio-Rad,美国),流式细胞仪(Becton Dickinson,美国)。
1.2 细胞培养
HEK293T细胞、A549细胞、PC3细胞和MEF细胞使用含10%FBS 的DMEM 培养基进行培养,SW480 细胞、SW620 细胞和HCT116 细胞使用含10%FBS 的RPMI-1640培养基进行培养。培养条件为37 ℃、5%CO2。
1.3 表达型质粒及短发卡RNA质粒的构建和细胞转染
表达型质粒构建:将扩增的FBXO22 全长和缺失Fbox 结构域(ΔF)的编码序列(coding sequence,CDS)分别插入PBABE-Flag 载体构建带标签的PBABE-Flag-FBXO22和PBABE-Flag-FBXO22-ΔF 表达质粒,再将其二者分别插入PLVX-ZSGreen 载体构建无标签的PLVXZSGreen-FBXO22 和PLVX-ZSGreen-FBXO22-ΔF 表 达 质粒;将扩增的AIF、CUL1 的全长CDS 序列分别插入PBABE-Flag 载体,构建带标签的PBABE-Flag-AIF 和PBABE-Flag-CUL1 表达质粒;将AIF 的全长CDS 序列插入PCDNA3.0 载体,构建PCDNA3.0-AIF 表达质粒;将扩增的ubiquitin的全长CDS序列插入PCDNA3.0-HA 载体构建PCDNA3.0-HA-ubiquitin 表达质粒。未插入CDS 的PBABE-Flag 为 空 载 体(empty vector, EV), 记 为PBABE-Flag-EV。
短发夹RNA(short hairpin RNA,shRNA)质粒构建:分别将特异靶向FBXO22 或XIAP 的shRNA 片段与线性化pSIREN Retro-Q 载体连接,构建沉默特定基因的敲除质粒(具体步骤参照T4 连接酶说明书)。特异靶向shRNA 片段的序列包括:shFBXO22#1,GTGTGGTCCTTGTCTTT GGTT;shFBXO22#2,CGCATCTTACCACATACAGTT;shFBXO22#3,CCCAAACAATGCCAAGTCCTT;shXIAP,AGATATCTGGGAGCAACTATA。同时,使用无靶向效应的序列插入到pSIREN Retro-Q载体构建阴性对照shNC。
向培养皿中接种处于对数生长期的HEK293T 细胞,待其生长融合度达50%~60%时行转染实验,具体步骤参照Lipo2000转染试剂说明书进行。
1.4 免疫沉淀联合质谱分析
分别向HEK293T 细胞转染带标签的PBABE-Flag-EV(Control组)和PBABE-Flag-FBXO22表达质粒(FBXO22组)24 h,收集HEK293T细胞并向其中加入1×RIPA细胞裂解液(含50 mmol/L Tris、150 mmol/L NaCl、1 mmol/L EDTA、1%NP40、1 mmol/L苯甲基磺酰氟、1×蛋白酶抑制剂的混合液)进行裂解,而后于4 ℃、17 000×g离心10 min去除细胞碎片,获得全细胞裂解液。将其与M2琼脂糖珠孵育行免疫沉淀(immunoprecipitation,IP)。随后,使用PBST缓冲液[含0.1%吐温的1×磷酸缓冲盐溶液(phosphate buffer saline,PBS)]洗涤M2珠3次。收集M2珠,并向其中加入1×SDS裂解液,于100 ℃下变性分离免疫沉淀复合物与M2珠。最后,将获得的免疫复合物经SDS-PAGE凝胶电泳后,使用考马斯亮蓝染液进行染色,扫描仪成像后送至质谱平台对上述2组的差异条带进行鉴定分析,寻找FBXO22的相互作用蛋白。以检测到过表达组中FBXO22自身的肽段数目,及已知的与FBXO22相互作用蛋白SKP1、CUL1和RBX1的肽段数目作为判断IP的成败标准。
1.5 变性条件下泛素化修饰实验
分 别 向HEK293T 细 胞 转 染Flag-AIF、 FBXO22、FBXO22-ΔF 以及HA-ubiquitin 表达质粒24 h 后,收取细胞沉淀。向其中加入适量1×SDS 裂解液进行细胞裂解,并于100 ℃进行蛋白变性以去除蛋白与蛋白间的非特异性结合。经17 000×g 离心10 min 去除不溶沉淀后,取上清液并向其中加入1×RIPA 细胞裂解液,以稀释至SDS 终浓度为0.1% 后与M2 珠孵育行后续IP,检测过表达FBXO22或FBXO22-ΔF对AIF泛素化水平的影响。
1.6 蛋白质印迹检测
向HEK293T 细 胞 转染FBXO22 或FBXO22-ΔF 构建FBXO22 过表达细胞株(PLVX-ZSGreen-FBXO22/ΔF 为实验组,PLVX-ZSGreen-EV 为对照组),分别向HEK293T细胞、MFE 细胞、SW620 细胞、HCT116 细胞和PC3 细胞 转 染shFBXO22#1、shFBXO22#2、shFBXO22#3 构 建FBXO22 敲 低 的 细 胞 株(shFBXO22#1、shFBXO22#2、shFBXO22#3 为实验组,shNC 为对照组),分别向A549细胞转染shFBXO22#1、shXIAP 构建FBXO22、XIAP 敲低的细胞株(shFBXO22#1、shXIAP 为实验组,shNC 为对照组)。培养并收集上述构建好的细胞,向其中加入1×SDS 裂解液进行细胞裂解,于100 ℃进行蛋白变性,经SDS-PAGE后采用湿转法将蛋白转移至硝酸纤维素膜,封闭1 h 后加入FBXO22 和AIF 抗体于4 ℃过夜。次日,经PBS 洗涤后,向其中加入相应辣根过氧化物酶标记的鼠源或兔源免疫球蛋白抗,室温孵育1 h。洗膜后进行化学发光显影,检测过表达或敲低FBXO22对AIF蛋白水平的影响。
1.7 细胞凋亡检测
向SW480 细胞分别转染shNC、shFBXO22#1 和shFBXO22#2 构建FBXO22 敲低的细胞株(shFBXO22#1、shFBXO22#2 为实验组,shNC 为对照组);分别向SW480、 SW620 细 胞 转 染PLVX-ZSGreen-FBXO22 或PLVX-ZSGreen-EV,构建FBXO22 过表达的细胞株(其中PLVX-ZSGreen-FBXO22 为实验组、PLVX-ZSGreen-EV为对照组)。将构建完成的SW480 细胞或SW620 细胞分别按照2×105个或5×105个接种于12 孔板中,培养24 h 后加入500 μmol/L MNNG 处理15 min,而后换正常的完全培养基继续培养24 h(记为MNNG 处理组);或加入1 mmol/L H2O2继续培养12 h(记为H2O2处理组);或加入PBS后同MNNG、H2O2步骤处理(记为PBS组)。待观察到处理组细胞出现明显凋亡时收集所有细胞,于2 000×g离心5 min 收集细胞沉淀,按照凋亡试剂盒说明书进行标记处理, 制备好待测样品后于0.5 h 内使用BD LSRFortessa流式细胞仪进行细胞凋亡的检测与分析。
1.8 统计学方法
采用SPSS 16.0 软件对实验数据进行统计分析。定量资料以±s 表示,组间两两比较使用Student's t 检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 FBXO22相互作用蛋白的鉴定
本研究采用IP 联合质谱分析技术寻找与FBXO22 相互作用的蛋白,结果(图1)显示免疫沉淀复合物中Flag-FBXO22 被明显富集。将Control 组和FBXO22 组进一步行质谱鉴定分析差异蛋白,结果(表1)显示过表达组中检测到的与FBXO22 相互作用的SKP1、CUL1 及RBX1 蛋白(已报道的)匹配的肽段数分别为327、76 和11个,对照组中均为0,提示IP成功;过表达组检测到的AIF的肽段数为9,对照组为0,提示FBXO22与AIF存在特异性结合。
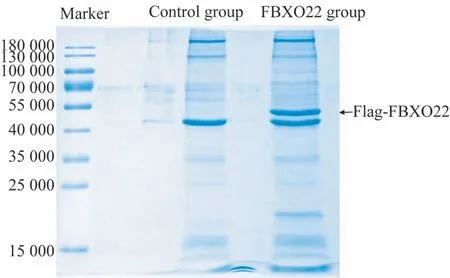
图1 SDS-PAGE及考马斯亮蓝染色检测2组免疫沉淀复合物Fig 1 Immunoprecipitation complexes of the two groups detected by SDS-PAGE and Coomassie bright blue staining
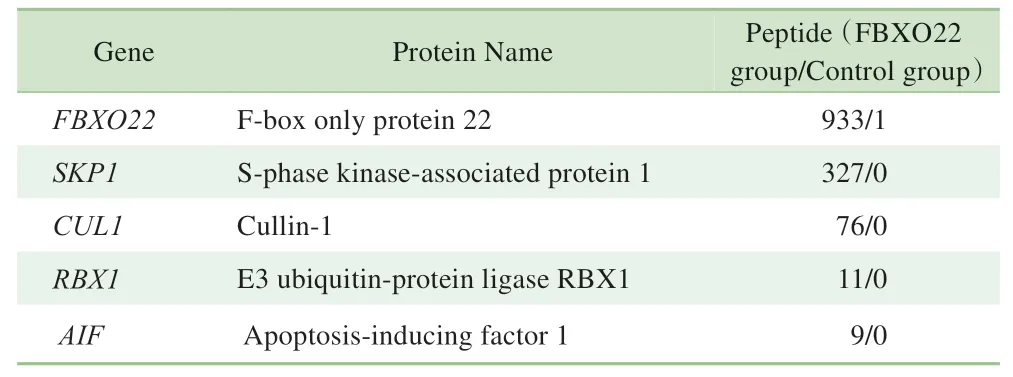
表1 质谱鉴定2组差异蛋白的肽段数Tab 1 Different protein peptide number of the two groups detected by IP/MS technology
2.2 IP 检测FBXO22 与AIF 的相互作用及其 对AIF 泛素化水平的影响
本研究向HEK293T 细胞转染相应质粒24 h 后,收集细胞沉淀进行IP,结果(图2A)显示Flag-FBXO22 与内源性AIF 存在相互作用。共表达Flag-AIF 与FBXO22/FBXO22-ΔF 的双外源IP 实验(图2B、2C)显示,Flag-AIF 与FBXO22、FBXO22-ΔF 均存在相互作用,提示AIF与FBXO22 存在相互作用且该作用不依赖FBXO22 的Fbox 结构域。随后,为验证AIF 是否通过FBXO22 与SCF复合体连接,在HEK293T 细胞中转染PBABE-Flag-CUL1/PBABE-Flag-EV、 PCDNA3.0-AIF 及 PLVXZSGreen-FBXO22进行IP,结果(图2D)显示Flag-CUL1成功沉淀SKP1、FBXO22 的同时也将AIF 沉淀下来,证明AIF通过FBXO22与SCF复合体相结合。
本研究通过变性条件泛素化IP 实验分析AIF 的泛素化水平,结果(图2E)显示过表达FBXO22 可显著增强AIF 的泛素化修饰水平,而过表达FBXO22-ΔF 对AIF 的泛素化修饰水平没有明显影响。
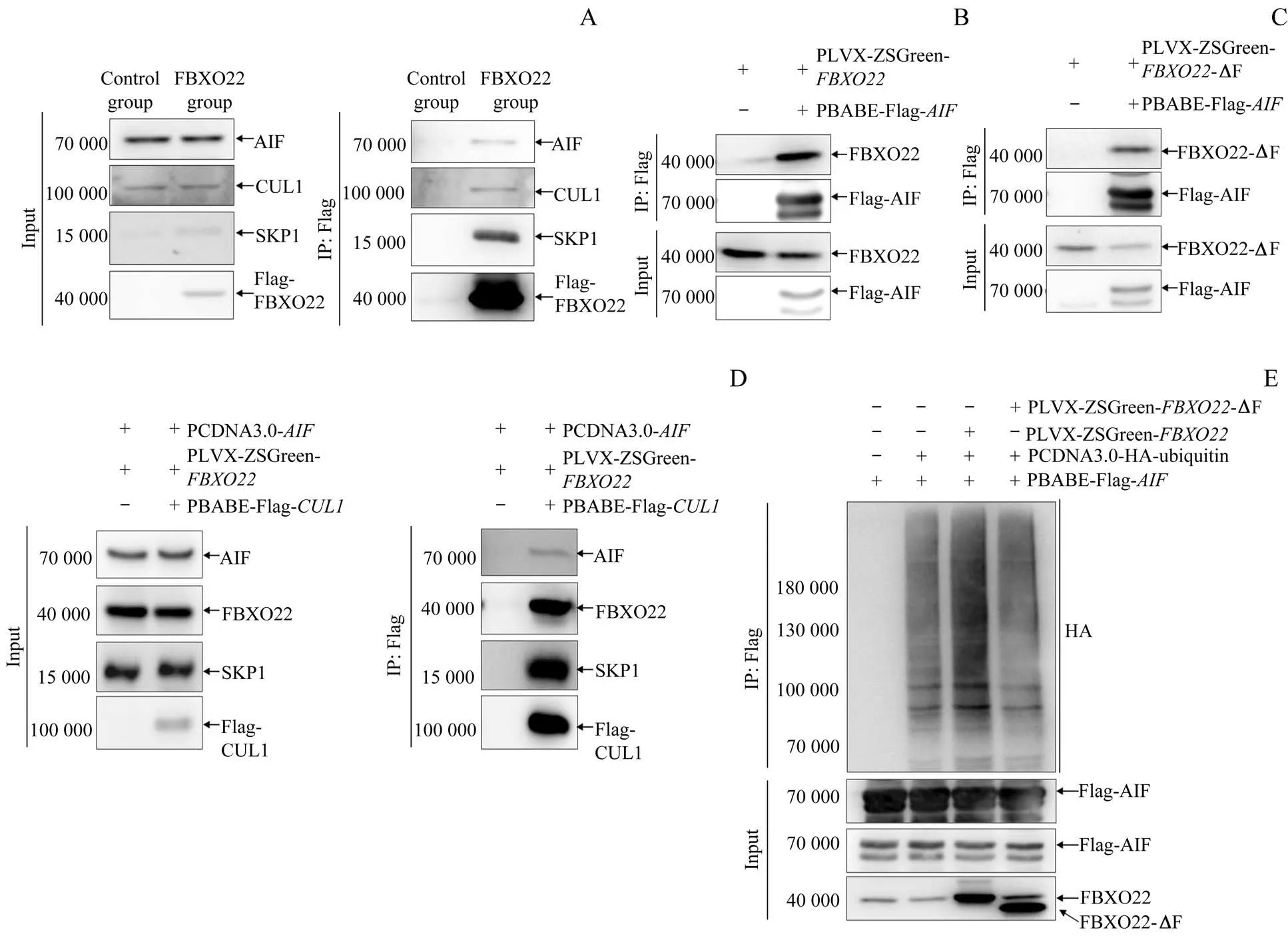
图2 IP检测FBXO22与AIF的相互作用及其对AIF泛素化水平的影响Fig 2 IP detection of the interaction between FBXO22 and AIF and its effect on the ubiquitination level of AIF
2.3 FBXO22对AIF蛋白表达水平的影响
采用蛋白质印迹(Western blotting)检测HEK293T细胞中敲低FBXO22 对AIF 蛋白水平的影响,结果(图3A)显示与shNC 组相比,shFBXO22#1、shFBXO22#2、shFBXO22#3 组的AIF 水平有明显增加。反之,本研究在HEK293T 细胞中转染过表达FBXO22 及FBXO22-ΔF 质粒,结果(图3B)显示,与PLVX-ZSGreen-EV 组相比,过表达FBXO22 可显著下调AIF 水平,而过表达FBXO22-ΔF却没有此作用。
此外,通过Western blotting 检测Fbxo22+/+和Fbxo22−/−型MEF细胞中AIF水平,结果(图3C)显示Fbxo22缺失可显著上调AIF的表达水平。通过Western blotting检测敲低FBXO22或XIAP对A549细胞中AIF水平的影响,结果(图3D)显示敲低FBXO22可显著上调AIF 水平,但敲低XIAP对AIF水平无较大影响。随后的结果(图3E~G)显示在SW620 细胞、HCT116 细胞以及PC3 细胞中敲低FBXO22 均可显著上调AIF 水平。以上结果均表明,FBXO22可负调控AIF的表达水平。

图3 Western blotting检测FBXO22对AIF水平的影响Fig 3 Effect of FBXO22 on AIF level by Western blotting
2.4 FBXO22对AIF介导的肿瘤细胞凋亡水平的影响
采用流式细胞术对经药物处理后的细胞进行分析,结果显示:①SW480 细胞(FBXO22 敲低细胞株) 经MNNG、H2O2处理后,结果显示,与shNC 组相比,shFBXO22#1 实验组和shFBXO22#2 实验组中凋亡细胞的占比均较高(图4A)。②经MNNG 诱导的SW620 细胞(FBXO22 过表达细胞株)中,PLVX-ZSGreen-FBXO22 实验组的凋亡细胞比例较PLVX-ZSGreen-EV 组有明显减少(图4B);且在经H2O2诱导的SW480 细胞(FBXO22 过表达细胞株)中,PLVX-ZSGreen-FBXO22 实验组的凋亡细胞比例较PLVX-ZSGreen-EV 组亦有明显减少(图4C)。上述结果均表明,FBXO22可抑制由AIF介导的结肠肿瘤细胞凋亡。
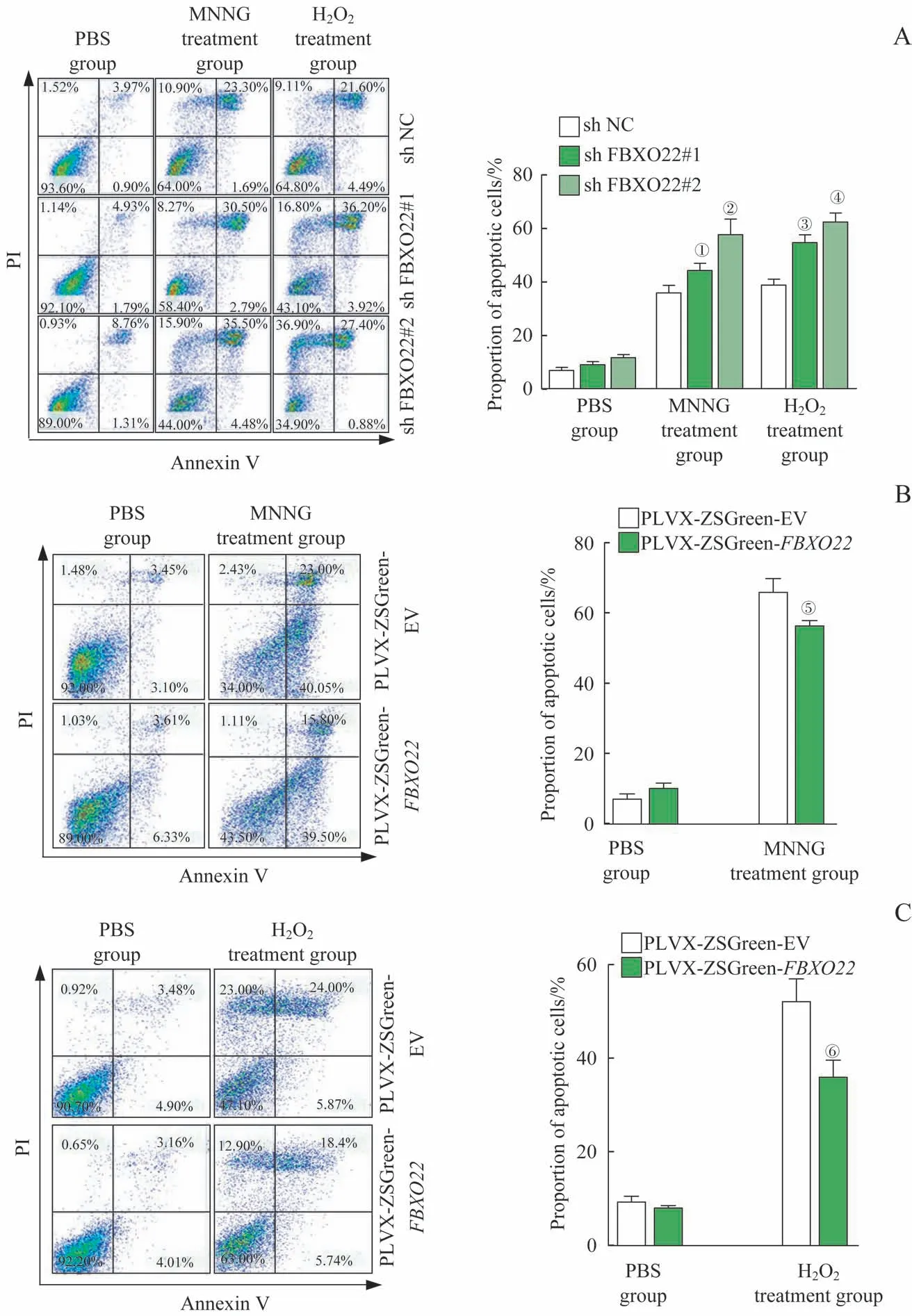
图4 FBXO22对AIF介导的肿瘤细胞凋亡的影响Fig 4 Effect of FBXO22 on cancer cell apoptosis mediated by AIF
3 讨论
本课题组前期研究发现,FBXO22 可分别通过LKB1[12]和PTEN[13]促进肺癌细胞、结直肠癌细胞的增殖;且越来越多的研究[7-11]表明FBXO22 在多种肿瘤中表现为促进肿瘤细胞生长、抑制肿瘤细胞转移的双重作用,具有重要的临床研究意义。本研究利用免疫沉淀技术挖掘FBXO22 的相互作用蛋白,经质谱鉴定显示在其相互作用表达谱中存在AIF;随后通过体外转染和免疫共沉淀实验证实,FBXO22与AIF存在相互作用。目前,关于AIF 表达调控的研究十分有限。本课题组前期研究发现,凋亡相关因子酸性亮氨酸核磷酸蛋白32B[21]和CCAAT 增强子结合蛋白[22]仅调控AIF 的转录水平。有报道显示,P53 可在不依赖DNA 损伤应激的情况下促进AIF 转录[23]。在蛋白水平上,仅发现XIAP 能泛素化AIF但不能降解AIF,即仅影响AIF的酶活性[19-20]。本研究发现FBXO22可调控AIF的泛素化水平,即敲低FBXO22可使AIF 水平上调、过表达FBXO22可使AIF水平下调;因此,FBXO22 是目前首个可以在蛋白水平上调控AIF 的E3连接酶。
AIF在烷化剂损伤、氧化应激等刺激下可引起染色体凝集和DNA 大片段化,介导细胞凋亡[17-18]。研究[14-16]显示,MNNG 是一种被公认的可通过AIF 诱发细胞凋亡的烷化剂。本研究发现,敲低FBXO22 可上调AIF 的水平,进而增加在MNNG 诱导下结肠癌细胞的凋亡比例;反之,过表达FBXO22 则可下调AIF 水平,减少在MNNG 诱导下的凋亡比例;继而提示,FBXO22 可抑制由AIF 介导的结肠癌细胞凋亡,具有促肿瘤效应,与现有报道一致。
除了能够诱导细胞凋亡外,AIF 还能与CHCHD4(coiled-coil-helix-coiled-coil-helix-domain-containing protein 4)结合共同调节线粒体的氧化呼吸链,维持其正常功能,为细胞存活提供能量保障[24-26]。另有研究[27]发现,AIF 可以维持PTEN 的脂质磷酸酶的活性,抑制蛋白激酶B 活化,进而抑制β-catenin 信号通路,阻止上皮细胞-间充质转化和远处转移。然而,FBXO22 是否能通过调控AIF的蛋白水平对AIF介导的线粒体氧化呼吸功能和癌细胞转移功能产生影响,有待进一步探讨。
参·考·文·献
[1] Nandi D, Tahiliani P, Kumar A, et al. The ubiquitin-proteasome system[J].J Biosci,2006,31(1):137-155.
[2] Tang Q, Wu P, Chen H, et al. Pleiotropic roles of the ubiquitin-proteasome system during viral propagation[J]. Life Sci,2018,207:350-354.
[3] Kitagawa K, Kitagawa M. The SCF-type E3 ubiquitin ligases as cancer targets[J]. Curr Cancer Drug Targets,2016,16(2):119-129.
[4] Jin J, Cardozo T, Lovering RC, et al. Systematic analysis and nomenclature of mammalian F-box proteins[J]. Genes Dev,2004,18(21):2573-2580.
[5] Vrba L, Junk DJ, Novak P, et al. p53 induces distinct epigenetic states at its direct target promoters[J]. BMC Genomics,2008,9:486.
[6] Johmura Y, Sun J, Kitagawa K, et al. SCF(Fbxo22) -KDM4A targets methylated p53 for degradation and regulates senescence[J]. Nat Commun,2016,7:10574.
[7] Tian X, Dai S, Sun J, et al. F-box protein FBXO22 mediates polyubiquitination and degradation of KLF4 to promote hepatocellular carcinoma progression[J]. Oncotarget,2015,6(26):22767-22775.
[8] Sun R,Xie HY,Qian JX,et al. FBXO22 possesses both protumorigenic and antimetastatic roles in breast cancer progression[J]. Cancer Res,2018,78(18):5274-5286.
[9] Bai J,Wu K,Cao M,et al. SCF FBXO22 targets HDM2 for degradation and modulates breast cancer cell invasion and metastasis[J]. Proceedings of the National Academy of Sciences,2019,116(10):201820990.
[10] Guo F, Liu J, Han X, et al. FBXO22 suppresses metastasis in human renal cell carcinoma via inhibiting MMP-9-mediated migration and invasion and VEGF-mediated angiogenesis[J]. Int J Biol Sci,2019,15(3):647-656.
[11] Lignitto L,LeBoeuf SE,Homer H,et al. Nrf2 activation promotes lung cancer metastasis by inhibiting the degradation of Bach1[J]. Cell,2019,178(2):316-329.e18.
[12] Zhu XN, He P, Zhang L, et al. FBXO22 mediates polyubiquitination and inactivation of LKB1 to promote lung cancer cell growth[J]. Cell Death Dis,2019,10(7):486.
[13] Ge MK,Zhang N,Xia L,et al. FBXO22 degrades nuclear PTEN to promote tumorigenesis[J]. Nat Commun,2020,11(1):1720.
[14] Moubarak RS,Yuste VJ,Artus C, et al. Sequential activation of poly(ADPribose) polymerase 1, calpains, and Bax is essential in apoptosis-inducing factor-mediated programmed necrosis[J]. Mol Cell Biol, 2007, 27(13):4844-4862.
[15] Yang H, Xie Y, Yang D, et al. Oxidative stress-induced apoptosis in granulosa cells involves JNK, p53 and Puma[J]. Oncotarget, 2017, 8(15):25310-25322.
[16] Jang KH, Do YJ, Son D, et al. AIF-independent parthanatos in the pathogenesis of dry age-related macular degeneration[J]. Cell Death Dis,2017,8(1):e2526.
[17] Joza N, Pospisilik JA, Hangen E, et al. AIF: not just an apoptosis-inducing factor[J]. Ann N Y Acad Sci,2009,1171:2-11.
[18] Sevrioukova IF. Apoptosis-inducing factor: structure, function, and redox regulation[J]. Antioxid Redox Signal,2011,14(12):2545-2579.
[19] Lewis EM, Wilkinson AS, Davis NY, et al. Nondegradative ubiquitination of apoptosis inducing factor (AIF) by X-linked inhibitor of apoptosis at a residue critical for AIF-mediated chromatin degradation[J]. Biochemistry,2011,50(51):11084-11096.
[20] Wilkinson JC,Wilkinson AS,Galbán S,et al. Apoptosis-inducing factor is a target for ubiquitination through interaction with XIAP[J]. Mol Cell Biol,2008,28(1):237-247.
[21] Shen SM,Yu Y,Wu YL,et al. Downregulation of ANP32B,a novel substrate of caspase-3,enhances caspase-3 activation and apoptosis induction in myeloid leukemic cells[J]. Carcinogenesis,2010,31(3):419-426.
[22] Shen SM,Yu Y, Wu ZX, et al. Apoptosis-inducing factor is a target gene of C/EBPα and participates in adipocyte differentiation[J]. FEBS Lett, 2011,585(14):2307-2312.
[23] Stambolsky P,Weisz L,Shats I,et al. Regulation of AIF expression by p53[J].Cell Death Differ,2006,13(12):2140-2149.
[24] Pospisilik JA, Knauf C, Joza N, et al. Targeted deletion of AIF decreases mitochondrial oxidative phosphorylation and protects from obesity and diabetes[J]. Cell,2007,131(3):476-491.
[25] Vahsen N, Candé C, Brière JJ, et al. AIF deficiency compromises oxidative phosphorylation[J]. EMBO J,2004,23(23):4679-4689.
[26] Hangen E, Féraud O, Lachkar S, et al. Interaction between AIF and CHCHD4 regulates respiratory chain biogenesis[J]. Mol Cell, 2015, 58(6):1001-1014.
[27] Shen SM, Guo M, Xiong Z, et al. AIF inhibits tumor metastasis by protecting PTEN from oxidation[J]. EMBO Rep,2015,16(11):1563-1580.

