超氧化物歧化酶抑制精液来源的病毒增强因子形成的研究
邱梦婕,李钊锋,黎奕斌,陈玉柳,程宏彦,刘叔文,谭穗懿
南方医科大学药学院,广州510515
人类免疫缺陷病毒(human immunodeficiency virus,HIV)是获得性免疫缺陷综合征即艾滋病的致病因子;艾滋病是全球十大致命疾病之一,目前已经造成了超过2 500 万人死亡,有超过3 000 万病毒携带者[1-2]。性传播已成为HIV 感染的主要传播方式[3],其中精液是性传播环节中的重要媒介。精液中含量较高的前列腺酸性磷酸酶(prostatic acid phosphatase,PAP)裂解所产生的多肽PAP248-286 可通过自组装形成淀粉样纤维,即精液来源的病毒增强因子(semen-derived enhancer of viral infection,SEVI),SEVI 能够极大地促进HIV 感染[4-6]。抑制PAP248-286 形成SEVI,可以有效地抑制SEVI 对HIV 病毒感染的增强作用[7-9]。因此,SEVI成为预防HIV性传播的新靶点。在我们前期筛选SEVI 小分子抑制剂的研究[8,10-12]中,意外地发现超氧化物歧化酶(superoxide dismutase,SOD)可抑制PAP248-286聚合形成SEVI且精液中天然存在SOD,因此,本研究主要围绕SOD 对PAP248-286生成的影响展开。
SOD 是带负电荷的金属蛋白酶,在人体内可以清除超氧自由基,能消除代谢过程中产生的有害物质[13-14]。SOD 在临床上有广泛的用途,能治疗因自由基损害引起的疾病[14]。SOD 在男性精液中普遍存在,但在不同疾病状态的男性精液中其活性有所不同[15-20]。本研究使用多种生物物理化学方法,从不同层面探究SOD 对前体肽PAP248-286形成SEVI的抑制作用,探讨其在精液中对人类免疫缺陷病毒1 型(HIV-1)感染的生理意义,为预防HIV的性传播提供新的研究思路。
1 材料与方法
1.1 材料
1.1.1 细胞与质粒 HEK-293T 人胚胎肾细胞、TZM-bl细胞(是一种携带有荧光素酶报告基因的传代细胞系,并且该报告基因受HIV-1 Tat 原件调控,只有在HIV-1 Tat蛋白存在下才会表达,其荧光强度与HIV 滴度成正比)于本实验室液氮中保存。感染性克隆病毒质粒SF162(通过转染能产生趋化因子受体CCR5 嗜性的HIV-1 克隆病毒)由乌尔姆大学Jan Münch教授惠赠。
1.1.2 精液的来源及处理 收集健康志愿者的精液(semen;seminal fluid,SE-F),室温放置30 min,4 ℃,10 000×g离心30 min,取上清液,加入庆大霉素(50 μg/mL)、链霉素(100 U/mL)、青霉素(100 U/mL),存于−80 ℃待用。
1.1.3 主要试剂及仪器 SOD、总SOD 活性检测试剂盒(上海碧云天),多肽PAP248-286(纯度大于95%,北京中科亚光生物),转染剂聚乙烯亚胺(polyethyleneimine,PEI,上海起福),细胞裂解液、荧光素酶检测试剂盒(美国Promega),DMEM 高糖培养基(美国Gibco),电镜碳膜铜网(上海主流贸易),3%磷钨酸(上海君瑞生物),胎牛血清(FBS,上海依科赛),硫磺素T(thioflavin T,ThT)及其他常规化学分析试剂(美国Sigma)。
Thermomixer 恒温振荡仪(德国Eppendorf),透射电子显微镜(transmission electron microscopy,TEM,日本Hitachi),圆二色谱(circular dichroism,CD)仪(日本Jasco),Genios Pro 型酶标仪、多功能检测酶标仪(美国Tecan),生物安全柜(新加坡ESCO)。
1.2 淀粉样纤维SEVI形成的检测方法
1.2.1 硫磺素T染色法 在440 μmol/L多肽PAP248-286溶液或精液中加入不同活性水平的SOD(23、46、92 U/mL),于37 ℃,200×g 的恒温振荡器中孵育,于不同时间点分别取样10 μL 加入96 孔黑板中,再加入硫磺素T 溶液190 μL/孔,立即在酶标仪中检测荧光强度(发射波长为485 nm,激发波长为440 nm)。
1.2.2 圆二色谱法 将含有不同活性水平SOD(23、46、92 U/mL)的440 μmol/L 多肽PAP248-286 溶液混匀,于37 ℃,200 ×g 的恒温振荡器中孵育,在4 h 和48 h 时取样;使用圆二色谱仪检测样品,样品按PAP248-286 浓度稀释至66 μmol/L,比色皿的光路为1 mm,扫描波长范围为190~280 nm,波长间隔1.0 nm,扫描速度24 nm/min,检测3 次后取平均值,最终图谱为样品图谱减去溶剂(PBS)的图谱。
1.2.3 TEM 观察 在440 μmol/L 多肽PAP248-286 溶 液中加入SOD(92 U/mL)混匀,于37 ℃,200×g的振荡器中孵育,在4 h和48 h分别取样;样品按PAP248-286浓度稀释至30 μmol/L,滴于铜网上,2 min 后用滤纸吸走多余的液体,然后用磷钨酸溶液(3%,pH 7.0)染色2 min并用滤纸吸走多余液体,用超纯水洗1次,待铜网自然干燥后,即可观察淀粉样纤维的形态。
1.3 病毒感染实验
1.3.1 感染性克隆病毒的制备及滴度测定 将CCR5 受体嗜性克隆病毒质粒与PEI 按1∶3 的比例(质量与体积比)混匀后转染HEK-293T 细胞,37 ℃转染8 h 后更换新鲜的DMEM 完全培养基;48 h 后,收集细胞培养液,于1 500 ×g 离心15 min,取上清液,即得到HIV-1 克隆病毒,于−80 ℃保存备用。将病毒液按不同比例稀释,分别加入TZM-bl 细胞中,48 h 后用荧光素酶检测试剂盒检测病毒滴度[10]。
1.3.2 病毒感染能力的测定 取含有不等量SOD(23、46、92 U/mL)的440 μmol/L 多肽PAP248-286 溶液,混匀,于37 ℃,200×g 的振荡器中孵育,于0、2、4、8、12、24和48 h分别取样冻存。将TZM-b1细胞接种于96孔板中(l×105/mL),37 ℃培养过夜;含有SOD 的PAP248-286 溶液样品于700×g 室温离心10 min,弃上清液,用空白培养基重悬样品,病毒(12 ng/孔,以p24抗原计算)与样品以1∶1的体积比混合均匀,室温孵育5 min,将混合液加入细胞中,感染3 h后更换新鲜DMEM 培养基;48 h后,弃上清液,PBS清洗1次,使用荧光素酶检测试剂盒检测其化学发光值,计算病毒感染增强倍数[21-22]。
1.4 SOD灭活后的作用检测
参考文献[23-24]方法,采用水浴75 ℃加热40 min灭活SOD,取等量的有活性和灭活的SOD(46 U/mL)加入440 μmol/L 多肽PAP248-286 溶液中,重复上述硫磺素T染色法、圆二色谱法、病毒感染实验。
1.5 精液中SOD活性的测定
按总SOD 活性检测试剂盒说明书操作,简述步骤如下:配制WST-8/酶工作液和反应启动工作液,依次在96 孔板中加入待测样品、SOD 检测缓冲液、WST-8/酶工作液和反应启动液,用振板器混匀,于37 ℃放置30 min后,检测溶液450 nm 处的吸光度值,按说明书计算精液中的SOD活性水平。
1.6 统计学分析
应用SPSS 22.0 统计学软件对实验数据进行分析。定量资料用±s表示,组间比较采用单因素方差分析,两两比较符合方差齐性时采用LSD 法,方差不齐时采用Dunnett T3检验法。P<0.05认为差异具有统计学意义。
2 结果
2.1 SOD对PAP248-286形成SEVI的影响
硫磺素T 染色法结果如图1A 所示:未加入SOD 的PAP248-286溶液在2 h时荧光强度已明显升高,且随时间逐渐升高,在24 h 后接近稳定,说明多肽PAP248-286 生成了淀粉样纤维,并逐渐增加。在加入不等量的SOD 体系中,SOD 呈剂量依赖性地抑制SEVI 的形成,92 U/mL SOD在48 h内几乎完全抑制SEVI的形成。
肽链的二级结构有α-螺旋、β-转角、β-折叠等特定立体结构,每种构象在圆二色谱图都有特定的吸收峰,根据吸收特征峰可判断肽链的结构。淀粉样纤维SEVI主要是β-折叠结构,在220 nm附近有负峰。圆二色谱检测结果如图1B所示:在4 h时,各PAP248-286溶液反应体系在220 nm附近均无明显负峰,表明前体肽均未产生大量β-折叠结构,即没有形成大量SEVI。在反应48 h 后,未加入SOD 的PAP248-286 溶液在220 nm 附近有明显的负峰,表明此时溶液中已形成含β-折叠结构的SEVI;而在加入了SOD 的溶液中仍未出现明显负峰,即没有形成大量的SEVI。
为了直观地观察SOD 对PAP248-286 形成SEVI 的影响,使用TEM 观察淀粉样纤维的形态。如图1C 所示,4 h 时,单纯PAP248-286 样品在TEM 下可观察到少量成熟纤维,而含有SOD 的多肽PAP248-286 溶液中未观察到明显纤维;48 h 时,单纯PAP248-286 溶液中已经形成大团的淀粉样纤维,几乎占满整个视野,而加入了SOD 的样品仍未观察到纤维。
2.2 SOD抑制精液中淀粉样纤维的形成
为了进一步探究SOD 对人体精液中PAP248-286 纤维化的影响,将健康志愿者的精液与不同活性水平的SOD混匀,振荡孵育,于2 h、8 h取样,经硫磺素T 染色后测荧光强度。如图2 所示,单纯精液振荡8 h 后其荧光值略有所增加,表明有新的淀粉样纤维生成。在加入不同活性水平SOD 的体系中,SOD 可抑制精液中淀粉样纤维的形成。
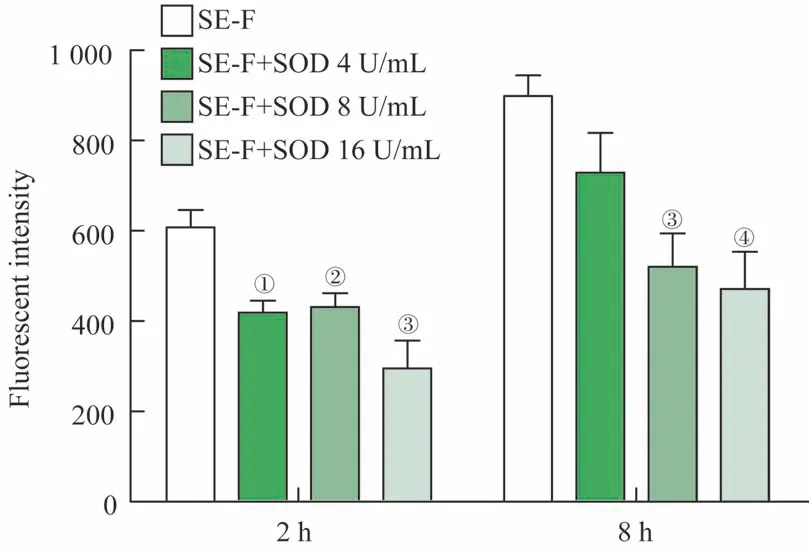
图2 SOD对精液中淀粉样纤维形成的抑制作用Fig 2 Inhibitory effect of SOD on the assembly of amyloid fibrils in SE-F
2.3 SOD对SEVI促进HIV-1感染能力作用的影响
结果如图3 所示,随着不同PAP248-286 溶液体系孵育时间的延长,病毒的感染增强倍数均逐渐增大,提示SEVI 形成的量越多,对病毒感染能力的增强作用越强;而SOD可抑制SEVI对病毒感染能力的增强作用,且SOD活性越高,抑制作用越强。
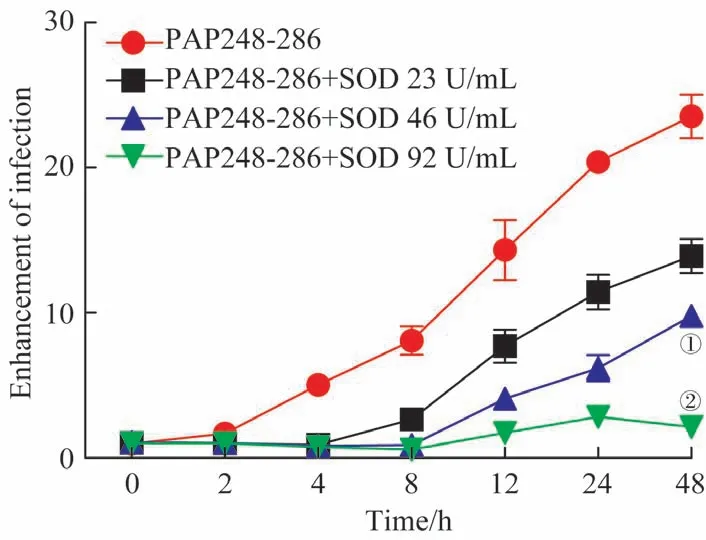
图3 SOD对SEVI促进HIV-1感染能力的抑制作用Fig 3 Inhibition of SOD on the ability of SEVI to promote HIV-1 infection
2.4 灭活的SOD对PAP248-286形成SEVI的影响
将PAP248-286 溶液分别与等量未灭活或灭活的SOD振荡孵育,硫磺素T 染色后检测结果如图4A 所示,加入灭活SOD与未加入SOD的PAP248-286溶液的荧光强度变化趋势基本一致,48 h 时荧光强度均高于加入未灭活SOD的反应体系。
在4 h和48 h分别取样,圆二色谱法检测β-折叠结构。结果(图4B)显示48 h时,未加入SOD 及加入灭活SOD的PAP248-286 溶液均在220 nm 附近出现明显的负峰,而加入未灭活SOD 的PAP248-286 溶液未出现明显的吸收峰。
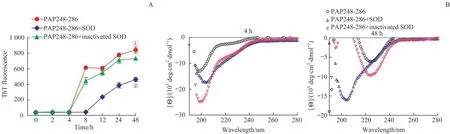
图4 灭活的SOD对淀粉样纤维SEVI形成的作用Fig 4 Effect of inactivated SOD on the assembly of SEVI amyloid fibrils
2.5 灭活的SOD对SEVI促进HIV-1感染能力作用的影响
分别检测加入等量灭活与未灭活的SOD 后,不同孵育时间点的PAP248-286 溶液对病毒感染能力的影响。结果如图5 所示,加入灭活SOD 的PAP248-286 溶液促进病毒感染的能力较加入未灭活SOD 的有所增强(P<0.05), 但 略 弱 于 未 加 入SOD 的PAP248-286 溶 液(P>0.05)。
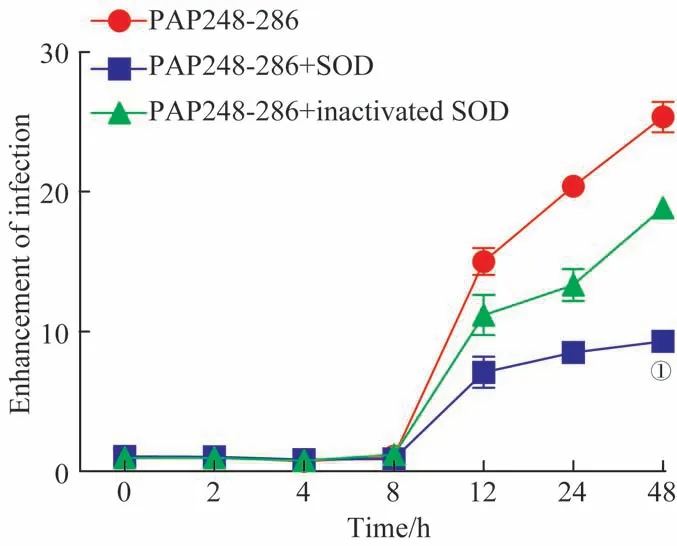
图5 灭活SOD对SEVI促进病毒感染能力的作用Fig 5 Effect of inactivated SOD on the ability of SEVI to promote HIV-1 infection
2.6 人体精液中的SOD活性
使用总SOD 活性检测试剂盒检测5 份健康志愿者精液中SOD 的活性水平,其值分别为74.87、68.69、85.46、113.29、109.53 U/mL。
3 讨论
精液中的淀粉样纤维SEVI 在HIV-1 性传播过程中可显著促进HIV-1 的感染[5],使其在近年来备受关注。本研究通过硫磺素T 荧光染色法、圆二色光谱法、TEM 观察及病毒感染增强实验均证实SOD 可抑制前体肽PAP248-286 形成淀粉样纤维SEVI,进而拮抗SEVI 对HIV-1感染能力的促进作用。SOD是人体内广泛存在的一种金属蛋白酶,酶的活性直接影响其生理功能。我们的实验结果表明,等量灭活的SOD 不能抑制PAP248-286 形成SEVI,不能有效拮抗SEVI促HIV-1 感染的能力,说明SOD 抑制SEVI形成很可能与其活性有关,但具体的内在机制有待进一步探究。
已有多项体外实验揭示了人体中天然存在一些保护因子,对HIV-1的性传播具有一定的抑制作用;例如女性阴道中的阳离子多肽(defensins)[25]、乳酸[26],女性阴道分泌液和男性精液中的外泌体[27-28]。近年来,本课题组研究了人体中潜在的通过SEVI 抑制HIV 性传播的因素。之前的研究[12]发现女性阴道中的乳酸具有抑制PAP248-286形成SEVI的作用。而本研究揭示了男性精液中天然存在的SOD 也具有抑制PAP248-286 聚合形成SEVI的作用。
根据相关文献[5]的报道,正常人体精液中PAP248-286 的浓度为35 μg/mL;而本研究使用的PAP248-286 浓度为440 μmol/L,即2 mg/mL,远高于正常人体精液中的浓度。在SOD 抑制SEVI 形成的实验中发现,SOD 活性达到46 U/mL或以上即可发挥作用;而检测的5份健康志愿者精液中SOD的活性均大于该水平。其他文献[15]结果也证实,健康男性精液中SOD 的活性约为100 U/mL。故健康人体精液中SOD 的活性可以有效抑制PAP248-286 形成SEVI。然而,据相关报道[15]称,不同疾病状态的男性的精液中SOD 活性有所不同,如抗精子抗体阳性的男性不育患者的精液中SOD 活性可降至33.54 U/mL,其抑制SEVI形成的能力可能减弱。另外,男性生殖器炎症疾病、性传播病原体共感染等均会对精液SOD 活性产生影响[29-31],提示这部分患者可能是HIV 性传播的高风险人群,对HIV阻断策略的设计及实施具有一定的指导意义。
因此,本研究的结果为预防HIV-1的性传播提供了新的思路;同时也提示SOD 可能可以与其他抗病毒药物联合使用制成多效抗微生物剂,用于抑制HIV-1的性传播。
参·考·文·献
[1] Duesberg PH. AIDS epidemiology: inconsistencies with human immunodeficiency virus and with infectious disease[J]. Proc Natl Acad Sci U S A,1991,88(4):1575-1579.
[2] Castellano LM, Shorter J. The surprising role of amyloid fibrils in HIV infection[J]. Biology(Basel),2012,1(1):58-80.
[3] Buvé A,Bishikwabo-Nsarhaza K,Mutangadura G. The spread and effect of HIV-1 infection in sub-Saharan Africa[J]. Lancet,2002,359(9322):2011-2017.
[4] Roan NR, Greene WC. A seminal finding for understanding HIV transmission[J]. Cell,2007,131(6):1044-1046.
[5] Münch J, Rücker E, Ständker L, et al. Semen-derived amyloid fibrils drastically enhance HIV infection[J]. Cell,2007,131(6):1059-1071.
[6] Roan NR,Münch J,Arhel N,et al. The cationic properties of SEVI underlie its ability to enhance human immunodeficiency virus infection[J]. J Virol,2009,83(1):73-80.
[7] Li JQ,Yang ZC,Liu H, et al. ADS-J1 disaggregates semen-derived amyloid fibrils[J]. Biochem J,2019,476(6):1021-1035.
[8] Tan SY,Li JQ,Cheng HY,et al. The anti-parasitic drug suramin potently inhibits formation of seminal amyloid fibrils and their interaction with HIV-1[J]. J Biol Chem,2019,294(37):13740-13754.
[9] Xun TR,Li WJ,Chen JQ,et al. ADS-J1 inhibits semen-derived amyloid fibril formation and blocks fibril-mediated enhancement of HIV-1 infection[J].Antimicrob Agents Chemother,2015,59(9):5123-5134.
[10] Qiu MJ,Li ZF,Chen YL,et al. Tolcapone potently inhibits seminal amyloid fibrils formation and blocks entry of Ebola pseudoviruses[J]. Front Microbiol,2020,11:504.
[11] 蓝燕, 杨梓超, 刘涵, 等. PSB0739 抑制精液来源的淀粉样纤维形成[J].南方医科大学学报,2018,38(11):1338-1343.
[12] 李锦清,宋亚丽,寻添荣,等. 乳酸抑制精液来源淀粉样纤维的形成[J].南方医科大学学报,2017,37(7):907-913.
[13] 于平. 超氧化物歧化酶研究进展[J]. 生物学通报,2006,41(1):4-6.
[14] 袁牧,王昌留,王一斐,等. 超氧化物歧化酶的研究进展[J]. 中国组织化学与细胞化学杂志,2016,25(6):550-558.
[15] Zhang HF, Zhao EY, Zhang CY, et al. The change of semen superoxide dismutase and acrosin activity in the sterility of male patients with positive antisperm antibody[J]. Cell Biochem Biophys,2015,73(2):451-453.
[16] Arisan ED, Arisan S, Kiremit MC, et al. Manganese superoxide dismutase polymorphism in chronic pelvic pain syndrome patients[J]. Prostate Cancer Prostatic Dis,2006,9(4):426-431.
[17] Eskiocak S,Gozen AS,Kilic AS,et al. Association between mental stress&some antioxidant enzymes of seminal plasma[J]. Indian J Med Res, 2005,122(6):491-496.
[18] Mostafa T, Anis TH, El-Nashar A, et al. Varicocelectomy reduces reactive oxygen species levels and increases antioxidant activity of seminal plasma from infertile men with varicocele[J]. Int J Androl,2001,24(5):261-265.
[19] Akyol O, Ozbek E, Uz E, et al. Malondialdehyde level and total superoxide dismutase activity in seminal fluid from patients with varicocele[J]. Clin Exp Med,2001,1(1):67-68.
[20] 毛静,郭润发,朱文凯,等. 男性精浆超氧化物歧化酶活性与各项精子参数间的关系[J]. 海南医学,2019,30(4):451-454.
[21] 陈金拳. SEVI 淀粉样纤维结构形成的影响因素及抑制剂的研究[D]. 广州:南方医科大学,2015.
[22] 李锦清. Suramin作为预防艾滋病多效杀微生物剂的研究[D]. 广州:南方医科大学,2017.
[23] 金生浩,吴梧桐. 肝素修饰人血超氧化物歧化酶稳定性研究[J]. 中国药科大学学报,1994,25(6):373-375.
[24] 曾仲奎,张鹏飞,鲍锦库,等. 牛血超氧化物歧化酶在变性因素影响下的酶活与构象变化[J]. 四川大学学报(自然科学版),1997,34(4):516-521.
[25] Cole AM, Cole AL. Antimicrobial polypeptides are key anti-HIV-1 effector molecules of cervicovaginal host defense[J]. Am J Reproductive Immunol,2008,59(1):27-34.
[26] Tyssen D,Wang YY,Hayward JA,et al. Anti-HIV-1 activity of lactic acid in human cervicovaginal fluid[J]. mSphere,2018,3(4):e00055-18.
[27] Madison MN, Roller RJ, Okeoma CM. Human semen contains exosomes with potent anti-HIV-1 activity[J]. Retrovirology,2014,11:102.
[28] Smith JA, Daniel R. Human vaginal fluid contains exosomes that have an inhibitory effect on an early step of the HIV-1 life cycle[J]. AIDS, 2016,30(17):2611-2616.
[29] Nada HA, El-Shabrawy MM, Ibrahim SH, et al. Measurement of serum glutathione peroxidase, catalase and superoxide dismutase concentration in patients with external anogenital warts before and after treatment with intralesional tuberculin purified protein derivative[J]. Andrologia, 2020,52(9):e13661.
[30] Quaye O, Kuleape JA, Bonney EY, et al. Imbalance of antioxidant enzymes activities and trace elements levels in Ghanaian HIV-infected patients[J].PLoS One,2019,14(7):e0220181.
[31] Strycharz-Dudziak M,Fołtyn S,Dworzański J,et al. Glutathione peroxidase(GPx) and superoxide dismutase (SOD) in oropharyngeal cancer associated with EBV and HPV coinfection[J]. Viruses,2020,12(9):E1008.

