酶消化细胞团块法对人胚胎干细胞中OCT4 与SOX2 蛋白水平的影响
孙潇智,李 爽,金 颖,廖 兵
上海交通大学基础医学院组织胚胎与遗传发育学系,上海200025
人胚胎干细胞(human embryonic stem cell,hESC)是胚胎着床前的多能细胞在体外培养中形成的多能干细胞系,其具有两大特性——无限自我更新和多能性。无限自我更新是指在体外适宜培养条件下,hESC 能够无限增殖并保持未分化状态;多能性则是指hESC 能够分化成为体内所有类型细胞的发育潜能。以上两大特性使得hESC 在药物研发与再生医学等方面具有广阔的应用前景。为了满足临床应用的要求,在体外培养中获得状态更好、更均质的hESC 就成为亟需解决的关键性问题,而对维持hESC 自我更新的分子调控网络的研究有助于该问题的解决。随着相关研究的不断深入,研究人员发现维持hESC 的自我更新不仅需要重要的细胞因子,例如碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和转化生长因子-β1(transforming growth factor-β1,TGF-β1) 等[1-4],还 需 要 维 持 细 胞 与 细 胞 外 基 质(extracellular matrix,ECM) 之间(hESC-ECM),以及细胞与细胞之间(hESC-hESC)的相互作用。传统观点认为hESC 通过整合素(integrin)黏附于ECM,不同类型的整合素能够与不同类型的ECM 组分结合[5]。而且,已有研究[6-9]表明ECM 的软硬度影响hESC 的自我更新和向不同细胞谱系的分化。但是,对于ECM 与hESC 相互作用如何调控自我更新与多能性相关信号通路和转录因子的研究还相对匮乏。
目前,已有研究[10-11]证实,八聚体结合转录因子4(octamer-binding protein 4,OCT4)和性别决定区Y 框蛋白2(sex determining region Y-box 2,SOX2)在hESC 自我更新维持与分化过程中发挥决定性作用,其蛋白水平的高低直接影响hESC 细胞的命运。有研究[12]发现,在hESC 中过表达OCT4 可上调内胚层分化的标志性基因表达,而减少OCT4的表达水平可促进中胚层和内胚层分化的标志性基因表达;另有研究[13]表明,在hESC 中降低OCT4水平可促进滋养外胚层分化的标志性基因表达。此外,升高或降低SOX2 表达水平均可诱导hESC 向滋养外胚层分化[14]。但是,hESC 与ECM 相互作用对核心转录因子OCT4 与SOX2 蛋白水平的影响还不清楚。本研究报道了破坏hESC 与ECM 相互作用对OCT4 和SOX2 蛋白质水平的负调控作用,并对相关机制进行了初步探索。
1 材料与方法
1.1 材料
1.1.1 细胞株 人囊胚内细胞团来源的人胚胎干细胞系SHhES8,由本实验室建立[15]。
1.1.2 主要试剂及仪器 DMEM 培养基、α-微管蛋白(α-tubulin) 抗体(货号T5168)、罗丹明-鬼笔环肽(rhodamine phalloidin)购自美国Sigma 公司,F12 培养基、胰蛋白酶和胶原酶Ⅳ(collagenase type Ⅳ,COL4)购自美国Gibco 公司,mTeSR1 培养基、细胞分离溶液Accutase 和分散酶Dispase 购自美国Stemcell Technologies公司,Matrigel 基质胶购自美国Corning 公司,乙二醇双(2-氨基乙醚)四乙酸(EGTA)购自上海碧云天公司,乙二胺四乙酸(EDTA)、荧光二抗(AlexaFluor-488/555/647)购自美国Thermo Fisher Scientific 公司,20S 蛋白酶体抑制剂bortezomib、Rac1 抑制剂EHT 1864 和EHop-016购自美国Selleck 公司,氯喹购自上海Topscience 公司,SOX2 抗体(货号AF2018)购自美国R&D 公司,OCT4抗体(货号sc-2079)购自美国Santa Cruz Biotechnology公司,丝切蛋白(cofilin)抗体(货号5175)、p-cofilin Ser3 抗体(货号3313)、LIM domain kinase 2(LIMK2)抗体(货号3845)、p-LIMK1 Thr508/p-LIMK2 Thr505 抗体(货号3841)、integrin-β1 抗体(货号9699)、β-肌动蛋白(β-actin)抗体(货号4967)、甘油醛-3-磷酸脱氢酶(GAPDH)抗体(货号5174)、辣根过氧化物酶(HRP)偶联二抗购自美国Cell Signaling Technology公司。
二氧化碳细胞培养箱(HERAcell 150i,美国Thermo Fisher Scientific 公司),倒置生物显微镜(ECLIPSETi-S,日本Nikon 公司),全自动化学发光图像分析系统(5200S,上海Tanon 公司),激光共聚焦显微镜(TCS SP8,德国Leica 公司),轨道阱质谱仪(LTQ Orbitrap Velos,美国Thermo Finnigan公司)。
1.2 实验方法
1.2.1 hESC 的培养及不同传代处理方式的比较 复苏SHhES8 细胞株,接种于Matrigel 包被的细胞培养皿中,加入mTeSR1 细胞培养液,置于细胞培养箱中(37 ℃,5%CO2),每日更换新鲜mTeSR1 细胞培养液。待细胞克隆长到合适大小,采用不同细胞传代方式进行处理。加入适量Dispase(1 mg/mL)或COL4(1 mg/mL)消化约8 min,使用DMEM/F12 基础培养基反复吹打细胞集落成为悬浮的细胞团块。利用Accutase(约7 min)或0.05%胰蛋白酶(约3 min) 在37 ℃分别消化hESC,使用DMEM/F12 基础培养基反复吹打细胞集落成为悬浮的单细胞。同时以机械法(用细胞刮板刮取细胞,Scrape)和未做处理的细胞(Ctrl)作为对照。离心收集细胞(100×g,5 min),加入1×蛋白上样缓冲液[protein loading buffer(PLB),含50 mmol/L Tris-Cl(pH 7.4)、2%SDS、5%β-巯基乙醇、10%甘油、0.01%溴酚蓝]裂解细胞,于100 ℃条件下热变性5 min,超声处理30 s。收集的细胞蛋白样品用于Western blotting分析OCT4和SOX2的蛋白水平。
1.2.2 细胞分组 为进一步探究hESC-ECM、hESChESC 的相互作用对细胞OCT4 和SOX2 蛋白表达的影响,将hESC 分 为COL4 组、EGTA 组、COL4+EGTA 组、Scrape 组、EDTA 组和对照组(Ctrl 组)。EGTA 是特异性钙离子螯合剂,可用于破坏hESC-hESC 的相互作用。EGTA 组细胞加入1 mmol/L EGTA(37 ℃,4 min),使用DMEM/F12 基础培养基反复吹打细胞集落成为悬浮的单细胞。COL4+EGTA 组细胞经COL4 处理(同COL4 组)后,使用1×PBS 洗涤1 次,然后加入EGTA 处理(同EGTA 组)后,吹打为悬浮的单细胞。EDTA 作为金属离子螯合剂,能够同时破坏hESC-ECM 和hESC-hESC 的相互作用,将hESC 克隆消化为单细胞。EDTA 组细胞加入1 mmol/L EDTA(37 ℃,1 min),吹打细胞集落成为悬浮的单细胞。收集细胞蛋白样品用于Western blotting分析。
1.2.3 Western blotting 分析 取适量蛋白样品进行SDSPAGE电泳,然后采用湿式电转方法将蛋白转移至硝酸纤维素膜,加入3%牛血清白蛋白封闭(室温,1 h),一抗(1∶1 000~1∶500 稀释)4 ℃下孵育过夜,1×TBS-T 洗涤3 次,加入HRP 偶联二抗,室温孵育2 h,1×TBS-T 洗涤3 次,通过电化学发光试剂(electrochemiluminescence,ECL)进行目的条带显色,使用全自动化学发光图像分析系统采集图像。利用软件Image J[16]的plot lane 和wand tool功能测量蛋白信号条带的灰度值。
1.2.4 蛋白质谱分析 收集Ctrl 组、COL4 组和COL4+EGTA 组的蛋白样品(hESC 裂解于1×PLB),交由杭州景杰生物科技有限公司进行质谱分析。简要检测步骤如下:蛋白样品经过定量、质检与淬炼等处理后,使用LTQ Orbitrap Velos 质谱仪检测磷酸化修饰蛋白与总蛋白,并用软件MaxQuant (version 1.2.2.5)进行分析定量。然后利用网络在线分析软件Metascope(http://metascape.org/)对各组间差异表达的磷酸化蛋白和总蛋白(蛋白表达差异倍数>1.2)进行功能富集分析。
1.2.5 免疫荧光染色 使用4%多聚甲醛固定细胞,1%Triton X-100透膜2 min,加入含6%驴血清的封闭液与细胞样品室温孵育1 h,按照1∶500~1∶250 比例稀释一抗,并与细胞样品4 ℃孵育过夜。1×PBS 洗涤3次,按照1∶500 比例稀释荧光二抗,将细胞样品与二抗在暗盒中室温孵育2 h,然后用荧光染料DAPI 复染来标记细胞核(室温、暗盒,孵育15 min),1×PBS 洗涤3 次,封片后,使用激光共聚焦显微镜成像系统采集图像。利用软件Image J[16]的threshold 和measurement 功能测量免疫荧光信号强度的平均灰度值。
1.3 统计学分析
使用GraphPad Prism 8.0进行统计分析。定量资料均符合正态分布和方差齐性,用±s表示,利用单因素方差分析(one-way ANOVA)进行组间比较,利用Turkey多重比较法进行两两比较。本研究的实验结果均经过3次以上独立重复实验验证。若P<0.05,则认为组间差异有统计学意义。
2 结果
2.1 不同细胞传代方法对OCT4和SOX2蛋白量的影响
在hESC传代过程中,酶消化法和机械法是比较常用的实验手段。常用的酶包括COL4、Dispase、Accutase和胰酶等,其中COL4和Dispase能破坏hESC-ECM的相互作用,但不影响hESC-hESC的相互作用,可以将hESC集落消化为细胞团块;而Accutase和胰酶能同时破坏hESC-ECM和hESChESC的相互作用,将hESC集落消化成单细胞。与未处理细胞(Ctrl)相比,使用COL4或Dispase处理导致hESC中OCT4与SOX2蛋白水平在短时间内发生显著下降,而使用Accutase或胰酶以及机械法(Scrape)均对OCT4与SOX2的蛋白水平没有显著影响(图1)。
2.2 EGTA对COL4处理引起的OCT4和SOX2蛋白水平下降的抑制作用
用COL4 或Dispase 将hESC 消化成细胞团块导致OCT4 和SOX2 蛋白水平下降,而消化成单细胞不影响其蛋白水平,提示这2 种蛋白水平下降可能与单独破坏hESC-ECM 的相互作用有关。为了验证该假设,我们采用分别破坏hESC-ECM 和hESC-hESC 细胞间相互作用的实验策略,即利用COL4 破坏hESC-ECM 相互作用[17],利用EGTA 破坏hESC-hESC 细胞间相互作用[18],研究这2 种相互作用对OCT4 与SOX2 蛋白量的影响。Western blotting 结果(图2)显示,与EDTA 组以及Scrape 组相似,EGTA 对OCT4 和SOX2 蛋白水平没有明显影响,但是EGTA 联合处理可以阻止COL4 导致的OCT4 和SOX2蛋白水平下降。
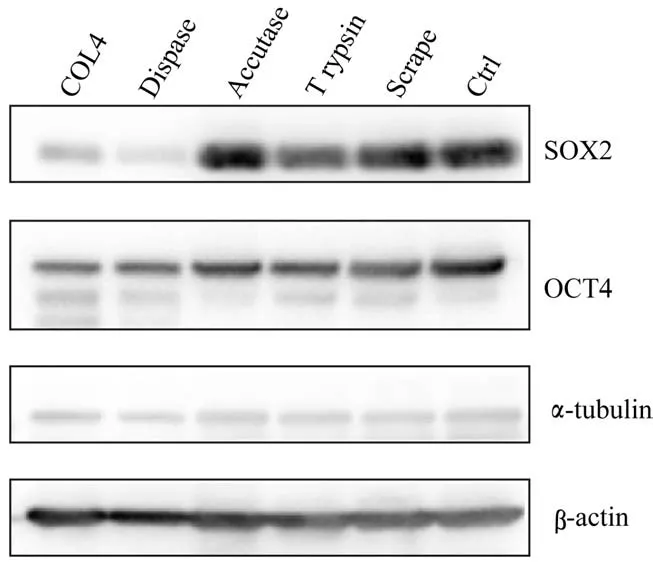
图1 Western blotting 分析不同细胞传代方法对hESC 中OCT4 和SOX2 蛋白水平的影响Fig 1 Effects of different cell passage methods on protein levels of OCT4 and SOX2 in hESCs detected by Western blotting
2.3 蛋白质谱分析筛选差异表达蛋白
由于破坏hESC-ECM的相互作用在短时间内即导致OCT4与SOX2蛋白水平的下降,推测蛋白磷酸化信号通路可能参与该过程的调控。我们采用定量蛋白质谱分析,鉴定Ctrl组、COL4组和COL4+EGTA组中差异表达的磷酸化修饰蛋白和总蛋白,并进行功能富集分析。分析结果显示,COL4组与Ctrl组的差异表达磷酸化蛋白功能注释分析富集到多个对干细胞非常重要的基础生命过程,如mRNA加工与细胞周期等,也富集到与肌动蛋白微丝(actin filament,F-actin)、微管相关的功能条目(图3A)。
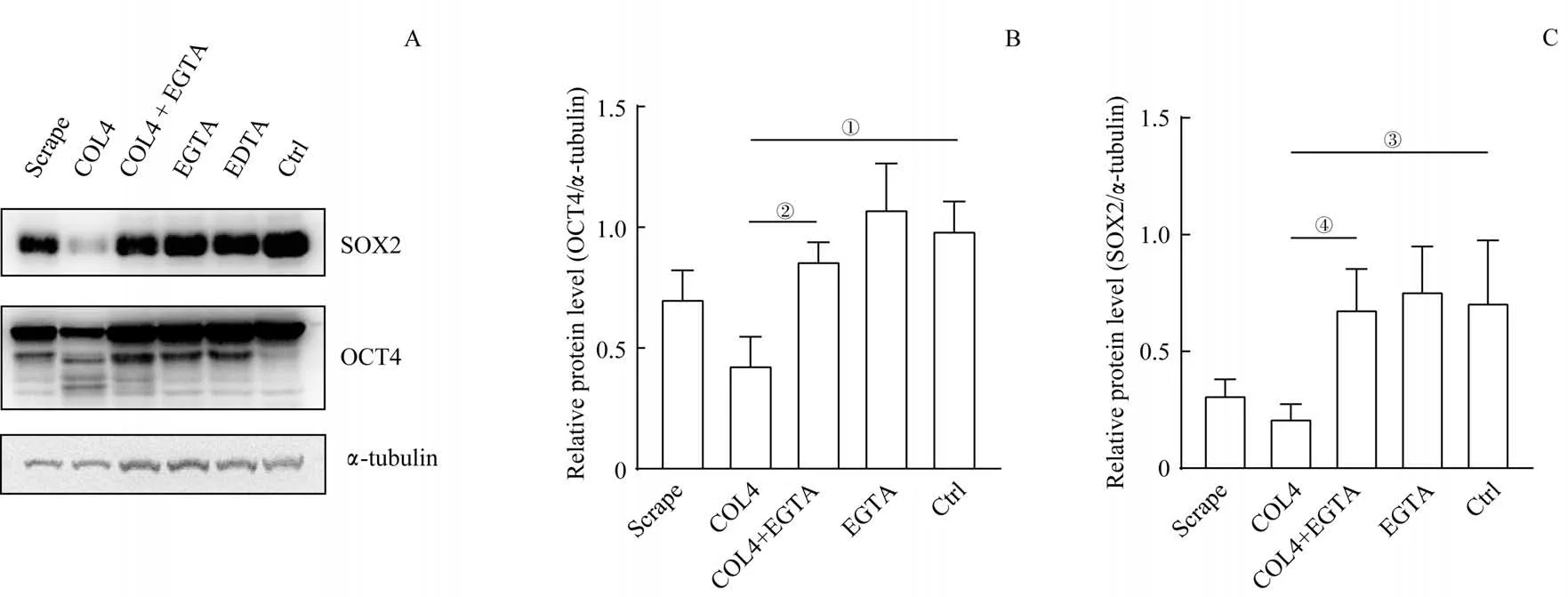
图2 同时或分别破坏hESC-ECM和hESC-hESC的相互作用对OCT4和SOX2蛋白水平的影响Fig 2 Effect of disruption of hESC-hESC and hESC-ECM interactions simultaneously or respectively on the protein levels of OCT4 and SOX2 in hESCs
在总蛋白水平,与Ctrl 组相比,COL4 组的自噬相关蛋白水平上调(图3B),COL4+EGTA 组的溶酶体相关蛋白的水平下调(图3C)。以Ctrl 组为基准,在COL4 组中表达上调的蛋白质有34 个,在COL4+EGTA 组表达下调的蛋白质有1 165 个,两者交集发现7 个共有蛋白质,其中GNAI3 (G protein subunit alpha I3) 和ATP6V0C(ATPase H+transporting V0 subunit C)均与溶酶体活性相关(图3D)。该结果提示破坏hESC-ECM 相互作用下调OCT4与SOX2蛋白水平可能有溶酶体的参与。
2.4 抑制溶酶体活性对COL4 引起的OCT4 和SOX2 蛋白水平下降的影响
为了判断破坏hESC-ECM的相互作用是否通过溶酶体下调OCT4与SOX2蛋白水平,我们使用溶酶体抑制剂氯喹(100 μmol/L)预处理2 h观察对这2个蛋白水平的影响,同时使用20S蛋白酶体抑制剂bortezomib(100 μmol/L,预处理2 h)作为对照。Western blotting结果显示,bortezomib不能阻断COL4处理引起的OCT4和SOX2蛋白水平的下降(图4A),但是氯喹有效地抑制了OCT4和SOX2的蛋白水平下调(图4B)。另外,免疫荧光染色实验也显示氯喹能够挽救COL4处理导致的SOX2蛋白水平下降(图4C)。
2.5 Rac1/cofilin/F-actin 信号通路在COL4 引起的OCT4和SOX2蛋白水平下降中的作用
蛋白质谱分析发现,COL4处理后,差异磷酸化蛋白富集到F-actin 和微管蛋白相关的功能条目,提示细胞骨架系统可能介导hESC-ECM 相互作用对OCT4 与SOX2 蛋白稳态的维持。激光共聚焦显微镜分层扫描结果(图5A)显示,罗丹明-鬼笔环肽标记的F-actin 在贴壁生长的hESC 中呈现极性分布,主要位于基底侧(basal side)和细胞-细胞连接区域(lateral side),而在细胞顶端(apical side)分布很少,提示F-actin与hESC-ECM 相互作用的相关性。作为对照,α-tubulin 在hESC 中无明显极性分布。而SOX2蛋白主要定位在细胞核中。
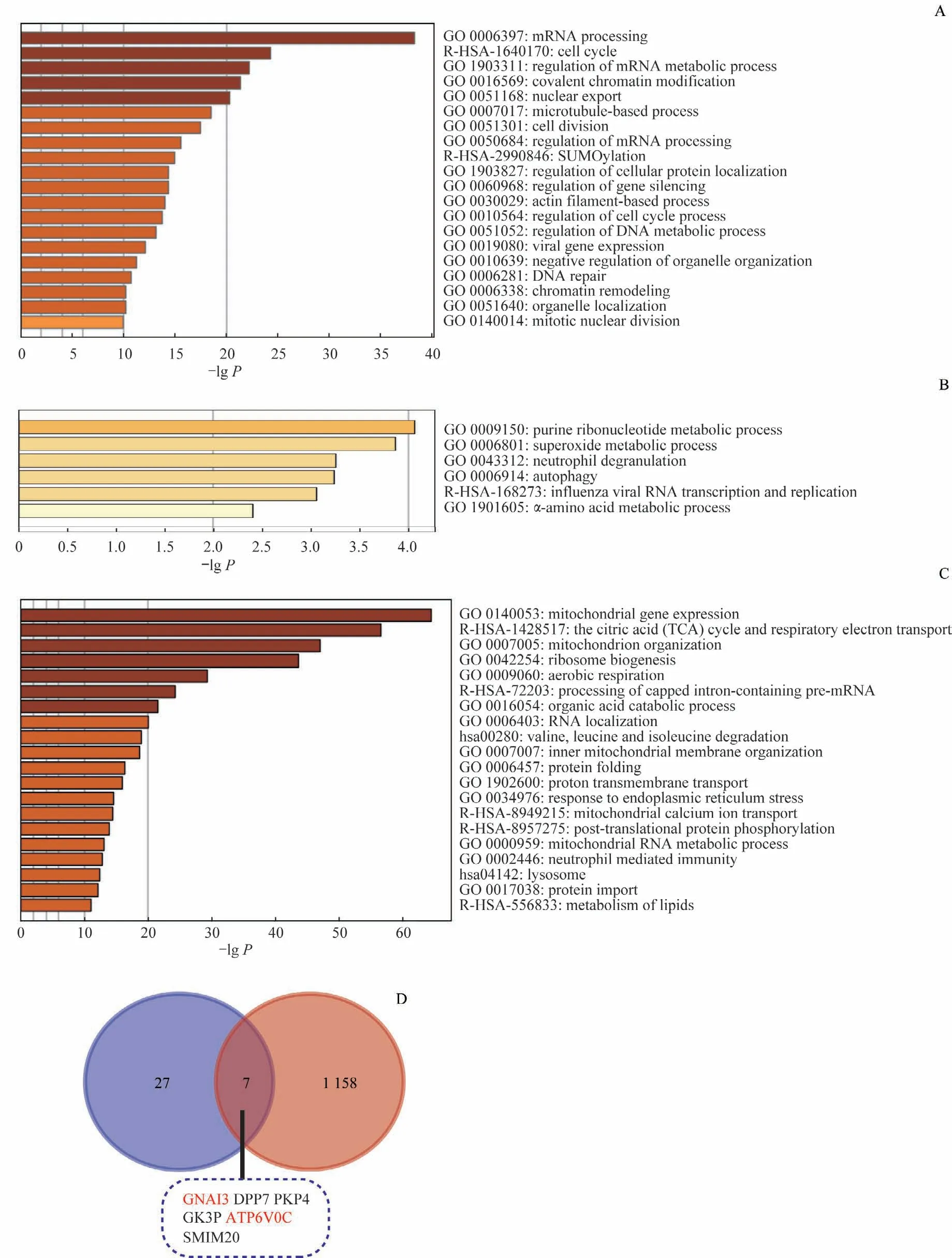
图3 蛋白质谱分析鉴定的差异表达磷酸化蛋白和总蛋白的功能富集Fig 3 Functional enrichment on differentially expressed phosphorylated proteins and total proteins identified by proteomics analysis
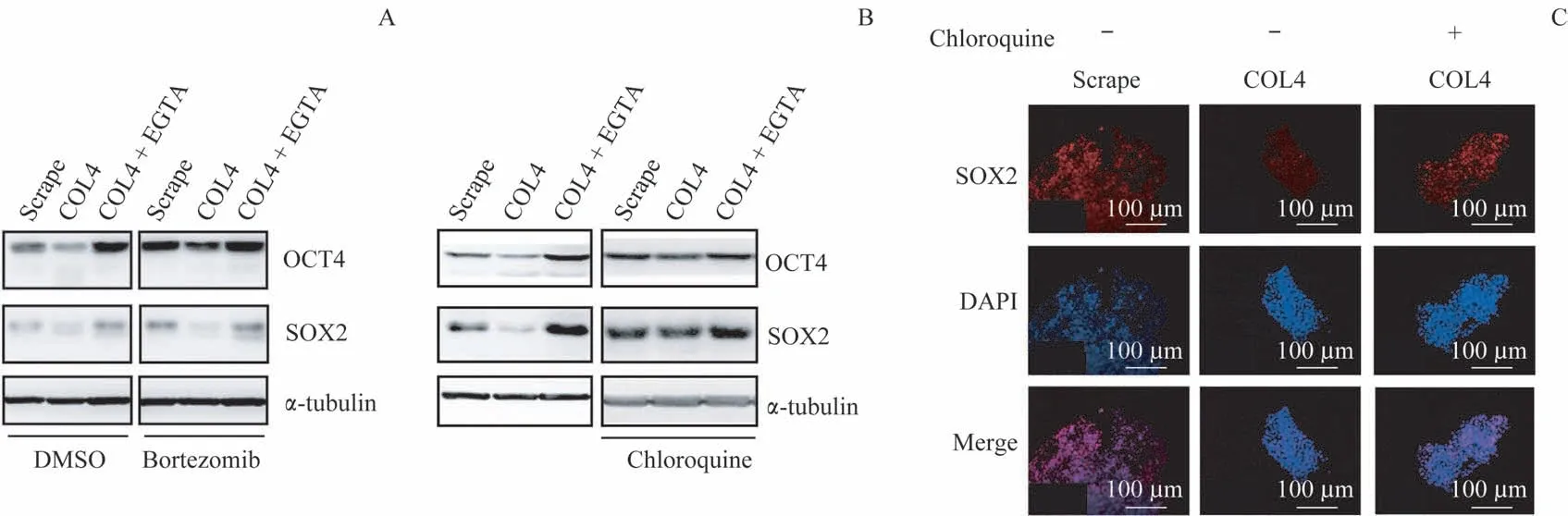
图4 氯喹对COL4引起的OCT4和SOX2蛋白水平下降的影响Fig 4 Effect of chloroquine on the decrease of OCT4 and SOX2 protein levels induced by COL4
有研究表明Rac1/cofilin信号通路可调控F-actin的形态结构[19]。因此,我们检测了该信号通路中关键因子cofilin的表达。在COL4组中,p-cofilin与cofilin蛋白水平下降显著,而integrin-β1的表达水平没有明显变化(图5B)。而且,应用Rac1小分子抑制剂EHT1864或EHop016处理hESC均可导致p-cofilin、cofilin、p-LIMK1/2、LIMK2与SOX2蛋白水平下降(图5C)。
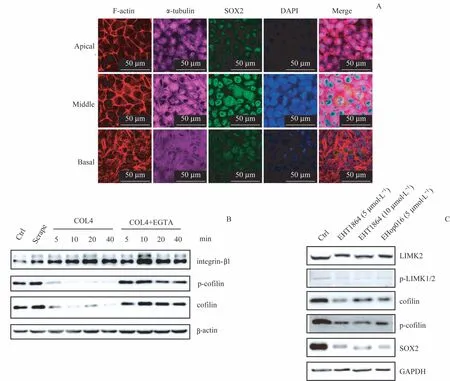
图5 Rac1/cofilin/F-actin信号通路在COL4引起的OCT4和SOX2蛋白水平下降中的作用Fig 5 Role of Rac1/cofilin/F-actin signaling pathway in the COL4-induced decrease of OCT4 and SOX2 protein levels
3 讨论
有研究报道hESC-ECM[20]和hESC-hESC[18]连接参与调控hESC 自我更新的维持,但是两者与hESC 中核心转录因子OCT4 和SOX2 的联系还未见报道。在本研究中,我们首先发现使用COL4或Dispase消化hESC集落成为细胞团块时,OCT4 与SOX2 蛋白水平迅速下降,然而使用Accutase 或胰酶消化hESC 集落成为单细胞时,不影响OCT4 与SOX2 的蛋白水平。该发现提示打断hESChESC 连接能够阻止破坏hESC-ECM 相互作用所导致的OCT4 与SOX2 蛋白水平的下降。因为EGTA 是特异的钙离子螯合剂,常被用于破坏细胞间相互作用[18],所以我们使用其破坏hESC-hESC 连接。与上述假设相一致,EGTA 能 够 阻 止COL4 消 化hESC-ECM 引 起 的OCT4 与SOX2蛋白水平的下降,但是其中的确切分子机制尚不明确。进一步研究显示,当使用COL4 消化法破坏hESCECM 相互作用时,可能有溶酶体和Rac1/cofilin/F-actin 信号通路的参与。
3.1 hESC-ECM 相互作用可能通过Rac1/cofilin/F-actin信号通路维持hESC中OCT4与SOX2的蛋白水平
通过蛋白质谱分析,我们注意到F-actin 和溶酶体可能与OCT4、SOX2 蛋白水平下降有关。而且,F-actin 在hESC 的基底侧呈极性分布,提示hESC-ECM 相互作用可能与F-actin 细胞骨架系统有联系。此外,破坏hESCECM 相互作用导致Rac1/cofilin/F-actin 信号通路中的关键因子cofilin 的蛋白水平下降,而且抑制Rac1 活性也能导致SOX2 蛋白水平显著下降,所以Rac1/cofilin/F-actin信号通路可能参与了hESC-ECM 相互作用对OCT4 和SOX2蛋白水平的正向调控。有趣的是,溶酶体抑制剂氯喹能够补救hESC-ECM 解离导致的OCT4 和SOX2 蛋白水平下降,我们猜测Rac1/cofilin/F-actin 信号通路可能通过抑制溶酶体途径提升OCT4 和SOX2 的蛋白水平。由此可见,hESC 与ECM 相互作用可在一定程度上调控核心转录因子的蛋白质稳态,该调控过程可能与Rac1/cofilin/F-actin 信号通路及溶酶体有关;但是两者在该路径中的确切作用以及具体的分子机制还需要更加深入的研究工作。
3.2 从蛋白质稳态维持角度优化hESC 酶消化细胞团块传代方法
在进行单层贴壁培养hESC 的细胞传代时,细胞团块法和单细胞法是最常用的2 种方法。与单细胞法相比较,团块法传代具有诸多优点:不破坏细胞间连接,不易引起hESC 细胞凋亡,而且细胞贴壁性更好,自发分化细胞更少等。但是,本研究发现,使用COL4 或Dispase 进行酶消化细胞团块法传代时,OCT4 与SOX2 的蛋白水平快速降低,而单细胞消化方法不影响OCT4 与SOX2 的蛋白水平。所以,细胞团块法传代具有影响OCT4 和SOX2 蛋白质稳态的缺点。我们发现EGTA 联合COL4 处理能够阻止OCT4、SOX2 以及F-actin 细胞骨架调控系统中关键蛋白cofilin 的蛋白水平下调。从维持hESC 传代过程的蛋白稳态的角度,我们的发现可能为优化hESC 酶消化细胞团块传代方法提供线索。但是,EGTA 联合COL4 处理对hESC干性维持与分化的影响还有待进一步的研究探索。
综上所述,我们的研究发现酶消化细胞团块法会干扰hESC 的蛋白稳态,特别是核心转录因子OCT4 和SOX2 蛋白水平的下降,这可能损害hESC 的自我更新能力与多能性;引起该现象的原因可能是hESC-ECM 解离导致Rac1/cofilin/F-actin 信号通路活性下降以及溶酶体活性上升。而采用COL4 联合EGTA 消化hESC 或利用溶酶体抑制剂均成功避免了团块消化法导致的OCT4 和SOX2蛋白水平下降,EGTA 的阻断作用可能不仅与其对hESChESC 的解离作用有关,可能还与其能够激活hESC 的Rac1/cofilin/F-actin 信号通路[18]有关。但是,hESC-ECM相互作用、Rac1/cofilin/F-actin 信号通路、溶酶体与OCT4、SOX2 蛋白稳态的关系还未阐明,利用针对相关节点关键基因的基因编辑和化学小分子处理方法将有助于该问题的回答。
参·考·文·献
[1] Beattie GM,Lopez AD,Bucay N,et al. Activin A maintains pluripotency of human embryonic stem cells in the absence of feeder layers[J]. Stem Cells,2005,23(4):489-495.
[2] James D, Levine AJ, Besser D, et al. TGFβ/Activin/Nodal signaling is necessary for the maintenance of pluripotency in human embryonic stem cells[J]. Development,2005,132(6):1273-1282.
[3] Vallier L, Alexander M, Pedersen RA. Activin/Nodal and FGF pathways cooperate to maintain pluripotency of human embryonic stem cells[J]. J Cell Sci,2005,118(Pt 19):4495-4509.
[4] Amit M, Shariki C, Margulets V, et al. Feeder layer- and serum-free culture of human embryonic stem cells[J]. Biol Reprod,2004,70(3):837-845.
[5] Baxter MA,Camarasa MV,Bates N,et al. Analysis of the distinct functions of growth factors and tissue culture substrates necessary for the long-term selfrenewal of human embryonic stem cell lines[J]. Stem Cell Res, 2009, 3(1):28-38.
[6] Vining KH, Mooney DJ. Mechanical forces direct stem cell behaviour in development and regeneration[J]. Nat Rev Mol Cell Biol, 2017, 18(12):728-742.
[7] Chen SS, Fitzgerald W, Zimmerberg J, et al. Cell-cell and cell-extracellular matrix interactions regulate embryonic stem cell differentiation[J]. Stem Cells,2007,25(3):553-561.
[8] Musah S, Morin SA, Wrighton PJ, et al. Glycosaminoglycan-binding hydrogels enable mechanical control of human pluripotent stem cell selfrenewal[J]. ACS Nano,2012,6(11):10168-10177.
[9] Przybyla L, Lakins JN, Weaver VM. Tissue mechanics orchestrate wntdependent human embryonic stem cell differentiation[J]. Cell Stem Cell,2016,19(4):462-475.
[10] Schöler HR, Dressler GR, Balling R, et al. Oct-4: a germline-specific transcription factor mapping to the mouse t-complex[J]. EMBO J,1990,9(7):2185-2195.
[11] Nishizawa M, Semba K, Yoshida MC, et al. Structure, expression, and chromosomal location of the human c-fgr gene[J]. Mol Cell Biol, 1986, 6(2):511-517.
[12] Rodriguez RT, Velkey JM, Lutzko C, et al. Manipulation of OCT4 levels in human embryonic stem cells results in induction of differential cell types[J].Exp Biol Med(Maywood),2007,232(10):1368-1380.
[13] Zaehres H, Lensch MW, Daheron L, et al. High-efficiency RNA interference in human embryonic stem cells[J]. Stem Cells, 2005, 23(3):299-305.
[14] Adachi K, Suemori H, Yasuda SY, et al. Role of SOX2 in maintaining pluripotency of human embryonic stem cells[J]. Genes Cells, 2010, 15(5):455-470.
[15] Zhu ZX, Li CL, Zeng YW, et al. PHB associates with the HIRA complex to control an epigenetic-metabolic circuit in human ESCs[J]. Cell Stem Cell,2017,20(2):274-289.e7.
[16] Schneider CA, Rasband WS, Eliceiri KW. NIH Image to ImageJ: 25 years of image analysis[J]. Nat Methods,2012,9(7):671-675.
[17] Bai Q, Ramirez JM, Becker F, et al. Temporal analysis of genome alterations induced by single-cell passaging in human embryonic stem cells[J]. Stem Cells Dev,2015,24(5):653-662.
[18] Ohgushi M, Matsumura M, Eiraku M, et al. Molecular pathway and cell state responsible for dissociation-induced apoptosis in human pluripotent stem cells[J]. Cell Stem Cell,2010,7(2):225-239.
[19] Rachubik P, Szrejder M, Rogacka D, et al. The TRPC6-AMPK pathway is involved in insulin-dependent cytoskeleton reorganization and glucose uptake in cultured rat podocytes[J]. Cell Physiol Biochem, 2018, 51(1):393-410.
[20] Vitillo L, Baxter M, Iskender B, et al. Integrin-associated focal adhesion kinase protects human embryonic stem cells from apoptosis, detachment,and differentiation[J]. Stem Cell Reports,2016,7(2):167-176.

