JWH133对MPP+诱导SH-SY5Y细胞铁水平和DMT1表达影响
潘东,马泽刚
(青岛大学基础医学院生理学教研室,山东 青岛 266071)
帕金森病(PD)是一种中老年人常见的、缓慢进行的神经退行性疾病。PD常见运动症状包括运动功能受损、运动缓慢、静止性震颤及平衡障碍等[1]。
PD的病理学特征是黑质(SN)多巴胺(DA)能神经元的进行性丢失和纹状体(Str)内DA的耗竭[2]。PD的发病机制与年龄老化、环境毒素、氧化应激和神经炎症等因素有关,但到目前为止PD中脑DA能神经元变性机制仍尚未明确[3]。近年来,更多的证据表明中脑DA能神经元损伤是由中脑SN铁聚积造成的[4-7]。PD病人SN铁聚积是由于铁转入蛋白二价金属离子转运蛋白1(DMT1)和铁转出蛋白(Fpn1)的表达调控失调导致的,通过免疫标记研究发现,PD 病人SN区DA 能神经元上DMT1的表达多于腹侧中脑被盖区(VTA),这也提示SN铁选择性聚积受DMT1的表达调控[8-11]。大麻素Ⅱ型受体(CB2R)是一种G蛋白耦联受体[12]。近期研究表明,CB2R在大脑的海马、VTA、SN、Str等区都有表达[13]。药理学研究表明,CB2R激活可以抑制小胶质细胞的活化并改善神经退行性疾病中的神经功能缺陷和延缓疾病的进展[14-15],CB2R现已成为 PD 等神经退行性疾病的潜在治疗靶点。内源性大麻素系统在SH-SY5Y细胞中有表达[16]。我们前期的研究显示,激活CB2R可以减轻1-甲基-4-苯基-吡啶离子(MPP+)对SH-SY5Y细胞的损伤作用。为了研究激活SH-SY5Y细胞上CB2R发挥保护作用的机制,本研究选用MPP+处理的 SH-SY5Y 细胞作为PD细胞模型,观察使用特异性CB2R 激动剂 JWH133 激活CB2R对细胞铁水平和DMT1表达的影响,以及CB2R 抑制剂AM630对 CB2R特异性激活的阻断效应,确定激活CB2R是否可以通过调控DMT1 的表达而调节细胞铁水平。
1 材料与方法
1.1 试剂及其来源
二甲基亚砜(DMSO)、MPP+、硫酸亚铁、维生素C、4-羟乙基哌嗪乙磺酸(HEPES)、钙黄绿素购自美国Sigma-Aldrich公司;DMEM高糖培养液、胎牛血清(FBS)购自以色列Biological Industries公司;青霉素/链霉素混合液(100×)购自索莱宝公司;JWH133和AM630购自美国Tocris Bioscience公司;DMT1抗体购自美国OriGene公司;β-actin抗体购自博奥森生物公司;HRP标记山羊抗兔IgG购自联科生物公司。
1.2 细胞培养及分组
在温度37 ℃、含体积分数0.05 CO2的细胞培养箱中,用含体积分数0.05的FBS和体积分数0.01青霉素/链霉素的高糖培养液培养SH-SY5Y细胞。将JWH133和AM630溶于DMSO中,制成储备溶液(1 mmol/L),加药以前用培养液稀释为工作溶液。将细胞分为对照组(A组)、MPP+组(B组)、JWH133+MPP+组(C组)和AM630+JWH133+MPP+组(D组)。对照组细胞用正常培养液培养;MPP+组细胞用含有1 mmol/L MPP+的培养液处理24 h;JWH133+MPP+组细胞用含有1 μmol/L JWH133的培养液先预处理30 min,然后再加入1 mmol/L MPP+共处理24 h;AM630+JWH133+MPP+组细胞用含有1 μmol/L JWH133和1 μmol/L AM630的培养液先预处理30 min,然后再加入1 mmol/L MPP+共处理24 h。
1.3 细胞铁水平检测
各组细胞药物处理结束后,吸净培养板中培养液,用HBS漂洗3次后每孔加入500 μL钙黄绿素,放入细胞培养箱中孵育30 min,再用HBS漂洗3次。将玻片置于含有HBS的灌流槽中,调节激光扫描共聚焦显微镜物镜找到合适的观察视野,将灌流槽中的HBS缓慢吸出,加入500 μL硫酸亚铁溶液,设置显微镜的激发光波长为488 nm,在X-Y-T模式下扫描,30 min后观察SH-SY5Y细胞钙黄绿素的荧光强度。
1.4 免疫印迹法检测DMT1蛋白的表达
各组细胞药物处理结束后,吸净培养板中的培养液,每孔加入100 μL裂解液处理30 min。吸取底部蛋白置于EP管中,在4 ℃条件下以12 000 r/min离心30 min,取上清80 μL。每组蛋白的上样量为25 μg,电泳后将蛋白转移到PVDF膜上,使用50 g/L的脱脂奶粉封闭2 h,加入相应一抗溶液后置于摇床上在4 ℃条件下孵育16 h,使用TBST漂洗4次(每次5 min),加入二抗溶液室温孵育1 h,使用TBST漂洗4次(每次5 min),用ECL显影液显影。目的蛋白的表达以DMT1与β-actin条带灰度值的比值表示,实验重复6次,取平均值。
1.5 统计学分析

2 结 果
2.1 JWH133对 MPP+诱导的SH-SY5Y细胞铁水平的影响
钙黄绿素在细胞内可以发出绿色荧光,与细胞内的铁离子结合后可导致荧光淬灭,故细胞内的铁水平可以用荧光强度表示。用1 mmol/L的硫酸亚铁溶液灌流SH-SY5Y细胞后,与对照组相比较,MPP+组细胞荧光强度明显降低,差异有显著性(F=26.620,q=10.410,P<0.05);用CB2R激动剂JWH133预处理后,JWH133+MPP+组细胞荧光淬灭程度低于MPP+组,差异有显著性(q=4.868,P<0.05);而且应用CB2R抑制剂AM630可逆转JWH133的这种作用,AM630+JWH133+MPP+组和JWH133+MPP+组荧光强度相比较差异具有统计学意义(q=5.619,P<0.05);而AM630+JWH133+MPP+组荧光强度与MPP+组相比较,差异则无统计学意义(q=0.751,P>0.05)。表明JWH133可以通过激活CB2R来抑制MPP+诱导的SH-SY5Y细胞内的铁水平升高。见表1。
2.2 JWH133对MPP+诱导的细胞DMT1蛋白表达的影响
与对照组相比,MPP+组细胞的DMT1蛋白表达量升高,差异有显著性(F=9.493,q=4.109,P<0.05);用JWH133预处理后,JWH133+MPP+组细胞DMT1蛋白表达量下降,与MPP+组相比差异具有显著性(q=4.771,P<0.05);而AM630可阻断JWH133的作用,AM630+JWH133+MPP+组细胞的DMT1蛋白表达量较JWH133+MPP+组显著升高(q=6.240,P<0.05)。见表1。
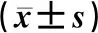
表1 各组细胞荧光强度和DMT1蛋白表达比较
3 讨 论
PD是第二常见的神经退行性疾病,随着社会老龄化的加剧,PD在中老年人群中患病率成倍增加,老年人群中65岁以上者的患病率为1%~2%,85岁以上者的患病率为3%~5%[17]。越来越多的研究表明,CB2R在PD中起着非常重要的作用。有研究在PD病人的SN区发现酪氨酸羟化酶(TH)与CB2R共表达,并且PD病人SN区CB2R的表达下降[18]。使用CB2R的选择性激动剂(HU-308)可以减少脂多糖诱导的小鼠Str和SN区DA能神经元死亡[19]。在1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)诱导损伤的模型小鼠中使用CB2R激动剂AM1241,可以减少MPTP对DA能神经元的损伤作用[20]。以上结果均证实激活CB2R对PD具有保护作用。
有研究表明,脑内铁含量与PD的进展有着密切的联系,运动障碍越严重的PD病人,其SN区的铁含量就越多[21-22]。铁元素是人体不可或缺的微量元素,中枢神经系统的多种代谢过程都需要铁参与,铁在SN区聚积可以通过催化过氧化氢(H2O2)产生羟自由基和促进α-突触核蛋白原纤维的形成导致DA能神经元的死亡[23]。大麻素可以通过激活CB2R抑制HEK293T细胞对铁的摄入[24],激活原代星形胶质细胞上的CB2R可以减少进入细胞铁的数量[25]。本研究采用激光扫描共聚焦显微镜分析技术检测SH-SY5Y细胞铁转运功能情况,结果显示,MPP+损伤可以导致细胞铁水平升高,预先使用JWH133处理细胞可使细胞铁水平明显降低,进一步使用CB2R拮抗剂AM630进行阻断验证,证实使用JWH133激活SH-SY5Y细胞的CB2R可以减少进入细胞内铁的数量,从而可能减轻铁聚积对细胞的损伤作用。
研究证实,PD病人中脑SN区DMT1表达显著升高[26],激活CB2R可以抑制MPP+诱导的原代星形胶质细胞中DMT1表达上调[25]。DMT1基因突变可以减弱MPTP和6-羟基多巴胺(6-OHDA)诱导的神经毒性作用,激活CB2R可以通过DMT1磷酸化水平的降低减少转入细胞铁的数量,并且该作用可能是通过调控cAMP-PKA信号通路来实现的[27-28]。本实验结果显示,使用JWH133预处理激活CB2R可以拮抗MPP+诱导的SH-SY5Y细胞的DMT1蛋白表达上调,使用CB2R拮抗剂AM630可以阻断JWH133的作用则更加明确激活CB2R可以调控DMT1蛋白的表达。但激活CB2R是如何调控细胞DMT1蛋白表达的机制仍不清楚,需要进一步研究。

