HDAC9基因对LPS诱导冠状动脉平滑肌细胞增殖与凋亡及炎症反应影响
刘新锋
(驻马店市中心医院心血管内一科,河南 驻马店 463000)
冠心病是由动脉粥样硬化(AS)引起的心脑血管疾病,严重影响人类的健康和生命[1]。业已证实,冠心病是一种慢性炎症性疾病[2]。有证据表明,血管平滑肌细胞(VSMCs)增殖和凋亡失衡是AS发展的关键步骤[3]。蛋白去乙酰化酶9(HDAC9)属于HDAC家族成员,HDAC9参与心血管疾病发生和发展[4-6]。而人冠状动脉平滑肌细胞(HCASMC)在外界因子刺激下增殖和凋亡能够参与AS的发病过程[7]。目前,有关HDAC9基因与HCASMC关系的研究鲜有报道。因此,本文探究HDAC9基因对脂多糖(LPS)诱导HCASMC增殖、凋亡及炎症反应的影响,以期为冠心病的治疗提供新的靶点。现将结果报告如下。
1 材料与方法
1.1 实验材料
人冠状动脉平滑肌细胞(HCASMC)购自美国Lifeline公司;DMEM高糖培养基、胎牛血清(FBS)购自赛默飞世尔科技有限公司;噻唑蓝(MTT)试剂和Lipofectamine 2000转染试剂均购自美国Invitrogen公司;二甲基亚砜购自北京索莱宝科技有限公司;LPS购自美国Sigma公司;Trizol试剂购自北京康为世纪生物科技有限公司;逆转录试剂盒和SYBR premix Ex Taq PCR Kit荧光定量PCR检测试剂盒均购自日本TaKaRa公司;HDAC9siRNA及阴性对照(siRNA Control)购自上海吉玛制药技术有限公司;肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-8(IL-8)ELISA检测试剂盒均购自南京建成生物工程研究所;Annexin V-FITC/PI凋亡检测试剂盒及Western blot检测所需试剂均购自上海碧云天生物技术研究所;HDAC9抗体、β-actin抗体及辣根过氧化酶标记的二抗均购自美国Santa Cruz公司。
1.2 实验方法
1.2.1细胞培养 HCASMC复苏后接种到含有体积分数0.10 FBS的DMEM高糖培养基的培养瓶中,将其放置于体积分数0.05 CO2、37 ℃培养箱中培养,每隔1 d更换1次新鲜培养液,待细胞贴壁生长融合度达到90%时,使用胰蛋白酶消化细胞,按照1∶3进行传代。取对数生长期的HCASMC进行后续实验。
1.2.2细胞处理和实验分组 取对数生长期的HCASMC以胰蛋白酶消化,收集细胞接种到6孔板中,待细胞单层融合时进行处理。实验分为4组:空白对照组(A组,未做处理),模型组(B组,以1 mg/L的LPS处理48 h),阴性对照组(C组,转染siRNA Control后以1 mg/L的LPS处理48 h),转染组(D组,转染HDAC9siRNA后以1 mg/L的LPS处理48 h)。每组细胞设置3个复孔。细胞转染严格按照Lipofectamine 2000转染试剂说明书进行,LPS处理HCASMC的浓度和时间参考文献方法[8-9]及预实验结果,各组细胞处理48 h后进行相应指标检测。
1.2.3实时荧光定量PCR(qPCR)检测HDAC9mRNA表达水平 采用Trizol试剂分别提取各组HCASMC中总RNA,以RNA为模板使用逆转录试剂盒合成第一链cDNA,再以cDNA为模板使用SYBR premix Ex Taq PCR Kit检测试剂盒进行qRT-PCR检测。反应体系包括:cDNA 2 μL,上下游引物各1 μL,2×SYBR 10 μL,ddH2O 6 μL,避光加样。短暂离心后放置在荧光定量PCR仪中进行反应,程序设置为:94 ℃、5 min,94 ℃、30 s,60 ℃、30 s,72 ℃、10 s,共设40个循环。以β-actin为内参照,用相对定量2-△△CT法计算HDAC9mRNA的相对表达水平。
1.2.4Western blot检测HDAC9蛋白的表达水平收集各组处理48 h后HCASMC,加入适量细胞裂解液,置冰上裂解并提取总蛋白,使用BCA蛋白浓度检测试剂盒对蛋白进行定量。取40 μg蛋白样品进行加样,行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,待电泳结束后转膜,在含50 g/L脱脂奶粉的封闭液中孵育2 h,分别加入1∶500稀释的HDAC9一抗,4 ℃过夜杂交,再加入1∶2 000稀释的二抗,室温孵育2 h,采用ECL化学发光方法显影和定影后,使用凝胶成像系统拍照,以β-actin进行标定,采用Image J软件对各条带灰度值进行分析,计算各组HCASMC中HDAC9蛋白相对表达水平。
1.2.5MTT法检测细胞活力 取对数生长期的HCASMC接种到96孔板中,按照上述1.2.2方法分组和处理,每组设置4个复孔,48 h后向各孔细胞中分别添加20 μL 的MTT溶液,37 ℃培养箱中继续培养4 h。取出96孔板,弃上清液,再向细胞中加入150 μL二甲基亚砜,放置在震荡仪上低速振荡10 min,待还原物充分溶解以后,在酶标仪上测定450 nm波长处吸光度值(A值)。
1.2.6流式细胞术检测细胞凋亡率 处理48 h后各组HCASMC加入胰蛋白酶消化,收集细胞,首先加入Annexin V-FITC重悬细胞,然后加入PI染液,轻轻混匀,室温下避光孵育10 min,随机上流式细胞仪检测细胞凋亡率。
1.2.7ELISA检测细胞上清液中炎症因子TNF-α、IL-1β和IL-8的含量 各组HCASMC处理48 h后,分别收集细胞培养上清液,参照TNF-α、IL-1β和IL-8 ELISA检测试剂盒说明书测定上清液中TNF-α、IL-1β和IL-8的含量。
1.3 统计学分析

2 结 果
2.1 LPS诱导HCASMC中HDAC9的表达
qRT-PCR和Western blot方法分别检测各组HCASMC中HDAC9的mRNA和蛋白表达结果显示,与空白对照组相比,模型组细胞中HDAC9mRNA和蛋白表达水平均明显升高(F=91.145、185.108,q=19.403、25.646,P<0.05);与模型组和阴性对照组相比,转染组细胞中HDAC9mRNA和蛋白表达水平均明显下调(q=13.393~20.714,P<0.05);而模型组和阴性对照组两组相比,细胞中HDAC9的mRNA和蛋白表达水平均无明显变化(P均>0.05)。提示LPS能够诱导HCASMC中HDAC9的表达,转染HDAC9siRNA能够成功敲低HCASMC中HDAC9的表达。见图1和表1。
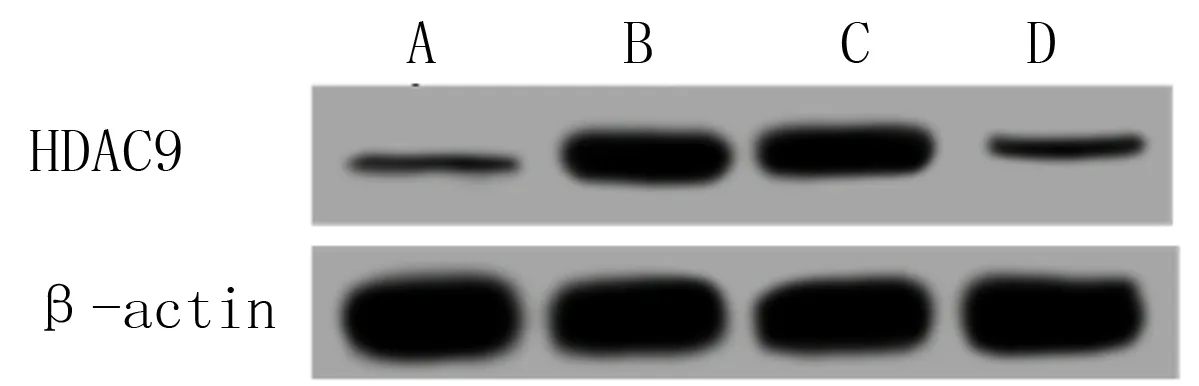
A:空白对照组,B:模型组,C:阴性对照组,D:转染组。
表1 各组HCASMC中HDAC9 mRNA和蛋白表达水平比较
2.2 敲低HDAC9表达对LPS诱导HCASMC活力的影响
MTT检测的结果表明,空白对照组、模型组、阴性对照组、转染组细胞的A值分别为0.35±0.03、0.56±0.04、0.55±0.04和0.41±0.03。与空白对照组相比,模型组HCASMC 的A值明显升高(F=77.940,q=17.819,P<0.05);与模型组和阴性对照组相比,转染组HCASMC的A值明显降低(q=12.728、11.879,P<0.05);而模型组和阴性对照组相比,HCASMC的A值无明显改变(P>0.05)。提示LPS能够提高HCASMC活力,敲低HDAC9基因表达能够抑制LPS诱导的HCASMC活力增加。
2.3 敲低HDAC9表达对LPS诱导HCASMC凋亡的影响
流式细胞术检测结果表明,空白对照组、模型组、阴性对照组、转染组HCASMC凋亡率分别为(6.64±0.74)%、(2.37±0.26)%、(2.56±0.28)%和(7.61±1.42)%。与空白对照组细胞相比较,模型组HCASMC凋亡率明显降低(F=98.321,q=15.563,P<0.05);与模型组和阴性对照组细胞相比,转染组HCASMC凋亡率明显升高(q=19.098、18.406,P<0.05);而模型组和阴性对照组相比较,HCASMC的凋亡率无显著变化(P>0.05)。提示LPS可阻碍HCASMC凋亡,而敲低HDAC9基因表达能促进LPS诱导的HCASMC凋亡。见图2。
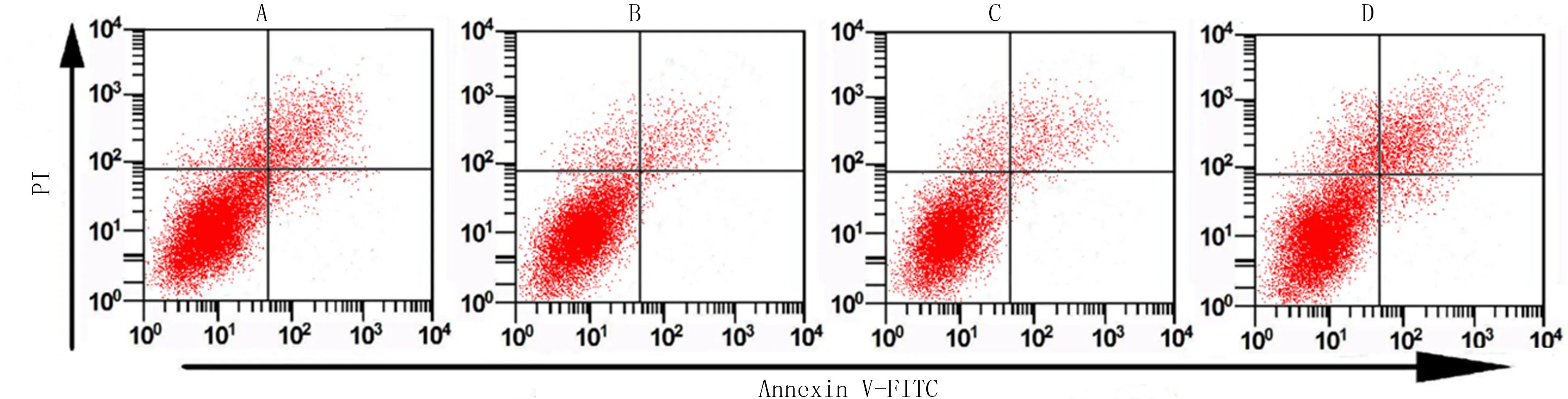
A:空白对照组,B:模型组,C:阴性对照组,D:转染组。
2.4 敲低HDAC9基因表达对LPS诱导的炎症因子分泌的影响
ELISA检测培养上清液中炎症因子TNF-α、IL-1β和IL-8的含量显示,与空白对照组相比,模型组上清液中TNF-α、IL-1β和IL-8的含量明显升高(F=91.145~325.808,q=10.813~15.180,P<0.05);与模型组和阴性对照组相比较,转染组上清液中TNF-α、IL-1β和IL-8的含量均明显降低(q=7.826~8.941,P<0.05);而模型组和阴性对照组相比,上清液中TNF-α、IL-1β和IL-8的含量无明显变化(P>0.05)。提示LPS可诱导HCASMC分泌炎症因子,而敲低HDAC9基因表达能够抑制LPS诱导的炎症因子的表达。见表2。
表2 各组细胞上清液中炎症因子TNF-α、IL-1β和IL-8含量比较
3 讨 论
冠心病是一种慢性炎症性疾病。研究表明,内皮细胞、VSMCs和炎症细胞参与冠心病的病理过程[10-15]。VSMCs的增殖失控及凋亡抑制在内膜增厚过程中起重要作用,是冠心病的重要致病机制。大量研究结果已证实,内皮细胞参与动脉粥样硬化过程[16-20]。因此,本实验选取HCASMC为载体,以探究冠心病的发病机制。近年来的研究结果已显示,体外VSMCs增殖受多种生长因子的刺激,如血管紧张素Ⅱ、氧化低密度脂蛋白(oxLDL)、脂多糖(LPS)、转化生长因子-β(TGF)-β和成纤维细胞生长因子等[21-25]。因此,本实验结合以往研究以LPS诱导HCASMC进行造模,以探究HDAC9基因对LPS诱导HCASMC增殖、凋亡和炎症反应影响。本文研究结果显示,LPS能够上调HCASMC活力,抑制HCASMC凋亡,促进炎症因子TNF-α、IL-1β和IL-8等分泌诱导炎症反应,这些结果与以往研究一致。此外,LPS能够上调HCASMC中HDAC9基因的表达。
HDAC9基因位于染色体7p21上,该基因属于HDAC家族,在心肌、骨骼肌、胎盘等组织中均有表达。靳洲等[26]报道,HDAC9通过促进AS在大动脉粥样硬化型脑梗死中发挥重要作用。成海鹏[27]的研究结果显示,沉默HDAC9基因能够促进炎症因子分泌及巨噬细胞脂质的累积。多项研究表明,HDAC9基因多态性与冠心病、AS和缺血性卒中等密切相关[28-29]。本研究通过转染特异性HDAC9siRNA敲低LPS诱导的HCASMC中HDAC9的表达,结果显示,敲低HDAC9能够部分逆转LPS诱导的HCASMC活力升高及凋亡下调。炎症反应的激活能够改变内皮细胞和VSMCs生物学行为,炎症因子可以募集更多的炎性细胞以促进AS病变的形成[30-32]。本实验结果显示,敲低HDAC9基因可抑制LPS诱导的炎症因子TNF-α、IL-1β和IL-8分泌,降低LPS诱导的炎症反应。提示HDAC9能够通过抑制炎症反应的激活抑制动脉粥样硬化性心血管疾病的发生和进展,但其具体作用机制仍需深入探究。
综上所述,敲低HDAC9基因能够抑制LPS诱导的HCASMC增殖及炎症反应,促进HCASMC凋亡。随着对HDAC9基因研究的深入,相信其可能成为动脉粥样硬化性心血管疾病治疗新的分子靶向,但HDAC9在动脉粥样硬化性心血管疾病中的作用机制目前尚不十分明确,有待进一步深入探究。此外,本实验未在动物体内进行探究尚显不足,后续实验将对此补充和验证。

