ErbB2基因沉默介导PI3K/Akt/eNOS信号通路对卵巢癌细胞生物学特性影响
石巍,王俊耐,张慧芳
(郑州大学第三附属医院妇产科,河南 郑州 450000)
卵巢癌作为一种常见女性恶性肿瘤,发病隐匿,病死率高[1]。而卵巢癌以化疗为主的治疗手段因耐药性其效果不容乐观[2]。故有必要通过对卵巢癌发病机制的探究,寻找新型的肿瘤治疗方法。ErbB2基因又称HER2,隶属于表皮生长因子受体家族[3]。ErbB2基因常高表达于肿瘤细胞中[4],而且PI3K/Akt信号转导途径活性较高[5],导致肿瘤细胞恶性程度极高,提示肿瘤病人转移率高、存活期缩短。而PI3K/Akt/eNOS信号通路是一种经典的抗细胞凋亡的信号转导途径,该通路异常已被证实在众多恶性肿瘤的发生、转移及放化疗抵抗中发挥关键作用[6-7]。PI3K抑制剂可有效抑制癌细胞增殖从而促进细胞凋亡,进而发挥肿瘤治疗作用[8]。然而,目前关于ErbB2基因是否影响卵巢癌细胞生物学特性以及其与PI3K/Akt/eNOS信号通路相关的机制的研究未见报道。因此,本研究期望通过基因沉默技术,探究ErbB2基因沉默介导PI3K/Akt/eNOS信号通路对卵巢癌细胞生物学特性的影响及可能机制,以期为卵巢癌分子靶向治疗提供潜在证据。
1 材料与方法
1.1 实验材料
人卵巢癌细胞株HO8910细胞(上海生物工程研究所提供);RPMI-1640和DMEM(Gibco公司,美国);RNA提取试剂盒(北京康润诚业生物科技有限公司);紫外线分光光度仪(上海奥析科学仪器有限公司);ABI PRISM®7300系统(ABI,USA);BCA试剂盒(上海翊圣生物科技有限公司);Wes-tern blot蛋白检测的兔多克隆一抗和山羊抗兔IgG二抗(Abcam公司,Cambridge,MA,USA);噻唑蓝(MTT)溶液(Sigma公司,USA);自动酶标读数仪(BIO-RAD公司,USA);ECL化学发光检测试剂盒(Sigma公司,USA);Annexin V-FITC/PI双标染色试剂盒(BestBio公司,上海);流式细胞仪(BD公司,USA);Matrigel基质胶(BD公司,USA);Transwell小室(康宁公司,USA)。
1.2 实验方法
1.2.1细胞培养及其分组处理 人卵巢癌细胞株HO8910细胞培养于含有体积分数0.1胎牛血清的RPMI-1640培养基中。以每孔1×105个细胞接种于6孔培养板,置于37 ℃、含体积分数0.05 CO2、饱和湿度的孵箱中培养。待细胞铺满培养板80%~90%做传代培养。弃培养液,PBS洗2次,以2.5 g/L胰蛋白酶消化,用含体积分数0.10胎牛血清的DMEM培养基重悬细胞,传代培养。
本实验siRNA序列设计参照Genbank中报道的ErbB2的mRNA全序列,并由上海生工生物工程技术服务有限公司对所有片段进行合成。选取对数生长期的HO8910细胞分为5组:空白对照组(A组:不转染任何序列)、阴性对照组(B组:转染空载体质粒)、siErbB2组(C组:转染siRNA序列)、wortmannin组(D组:转染PI3K/Akt/eNOS信号通路抑制剂wortmannin)、siErbB2+IGF-1组(E组:转染siRNA序列+PI3K/Akt/eNOS信号通路激动剂IGF-1)。
1.2.2实时定量逆转录聚合酶链反应(qRT-PCR)检测 采用RNA提取试剂盒抽提总RNA。采用紫外线分光光度法检测组织和细胞中RNA的纯度及浓度。设计ErbB2、Akt、PI3K、eNOS、Caspase-3、Bcl-2、Bax和GAPDH引物,交由TaKaRa公司合成。逆转录参照TaqMan MicroRNA Assays Reverse Transcription Primer说明书进行。取反应液进行荧光定量PCR操作。在ABI PRISM®7300系统中进行荧光定量PCR。以2-ΔCt表示实验组与对照组目的基因表达的倍比关系。其计算公式如下:ΔCt=CtmiRNA-CtU6,分别计算细胞中ErbB2、Akt、PI3K、eNOS、Caspase-3、Bax和Bcl-2的mRNA表达量。
1.2.3Western blot检测 在细胞中加入蛋白裂解液,4 ℃裂解30 min;4 ℃下12 000 r/min离心20 min。取上清液采用BCA试剂盒测定每个样品的蛋白浓度。本实验所用一抗为兔多克隆抗体ErbB2、Akt、PI3K、eNOS、Caspase-3、Bax和Bcl-2,二抗为辣根过氧化物酶标记的山羊抗兔IgG。孵育后,室温下PBS缓冲液洗涤3次,每次5 min。在暗室环境中用线片曝光,显影、定影之后观察结果。以GAPDH作内参照,以目标条带与内参照条带的灰度值之比作为蛋白质的相对表达水平。
1.2.4MTT法检测 转染24 h后,取对数生长期的细胞,调整细胞密度制备细胞悬液后,接种到96孔培养板,根据实验分组,每组各设3个复孔,置于37 ℃、体积分数0.05 CO2细胞培养箱中培养,分别于培养24、48、72、96 h时取出培养板,每孔加入5 g/L的MTT溶液20 μL继续培养4 h终止培养,弃上清液,每孔加150 μL 二甲基亚砜(DMSO),振荡15 min,使紫结晶充分溶解。采用自动酶标读数仪于570 nm波长处测定各孔吸光度(A)值。最后根据所采集值,计算HO8910细胞的生长抑制率,绘制生长曲线。
1.2.5流式细胞术检测 细胞转染48 h后,收集细胞,以2.5 g/L胰蛋白酶消化,调整细胞的密度。检测前先离心10 min,弃上清后加入预冷的体积分数0.70乙醇溶液固定细胞,4 ℃过夜。用100目的尼龙网过滤。离心弃上清,加入100 μL的RNA酶溶液。然后加入10 μL的Annexin V-FITC和5 μL 的PI轻轻混匀,避光室温反应15 min,加入300 μL结合缓冲液,用流式细胞仪以激发波长488 nm检测细胞凋亡情况。
1.2.6Transwell实验 取Transwell小室及实验所需试剂温育后,制备细胞悬液,调整细胞密度。首先于24孔板底部加入含体积分数0.10胎牛血清的培养基平衡,取配制细胞悬液加入Transwell小室,孵育过夜。培养24 h后,取出Transwell小室,吸干上室固定液,行甲紫染色。轻擦去上室内面未穿膜的细胞,光镜下计算细胞穿膜数。细胞侵袭实验用Matrigel稀释液模拟细胞外基质,观察细胞穿透向外浸润的能力。
1.3 统计学分析

2 结 果
2.1 转染后各组细胞相关信号通路因子mRNA和蛋白表达的变化
单因素方差分析显示,5组间mRAN和蛋白表达量差异具有统计学意义(F=3.58~8.69,P均<0.05)。两两比较显示,与空白对照组比较,siErbB2组和wortmannin组卵巢癌细胞中的Akt、PI3K、eNOS和Bcl-2的mRNA和蛋白表达量均显著下降(P均<0.05),Caspase-3和Bax的mRNA和蛋白表达量显著增加(P均<0.05);siErbB2组ErbB2的mRNA和蛋白表达量则显著下降(P均<0.05);与siErbB2组相比较,siErbB2+IGF-1组细胞Akt、PI3K、eNOS和Bcl-2的mRNA和蛋白表达量显著上升,Caspase-3和Bax的mRNA和蛋白表达量则显著下降(P均<0.05)。见图1。
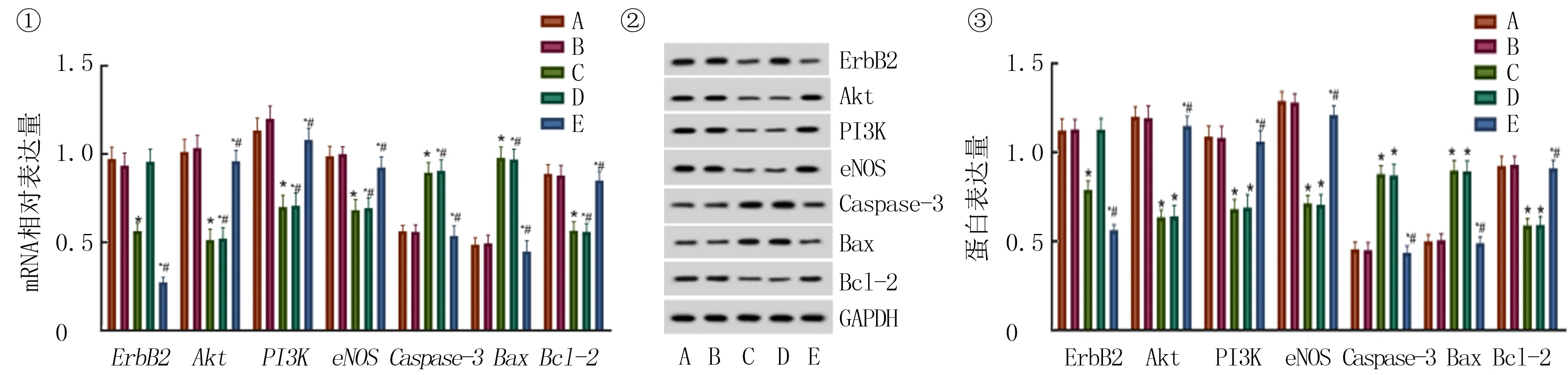
①各组细胞转染后mRNA表达的qRT-PCR检测;②、③各组细胞转染后蛋白表达的Western blot检测。A:空白对照组;B:阴性对照组;C:siErbB2组;D:wortmannin组;E:siErbB2+IGF-1组。与空白对照组相比,*P<0.05;与siErbB2组相比,#P<0.05。
2.2 转染后各组细胞的增殖变化
MTT法检测结果的单因素方差分析显示,5组间的细胞增殖差异有统计学意义(F=8.84,P<0.05)。两两比较的结果显示,与空白对照组相比较,siErbB2组和wortmannin组细胞增殖较慢(P均<0.05);与siErbB2组比较,siErbB2+IGF-1组细胞增殖增加(P<0.05)。析因设计方差分析结果显示,F组别=7.31,P=0.002;F时间=10.49,P<0.001;F组别×时间=5.78,P<0.05。见图2。
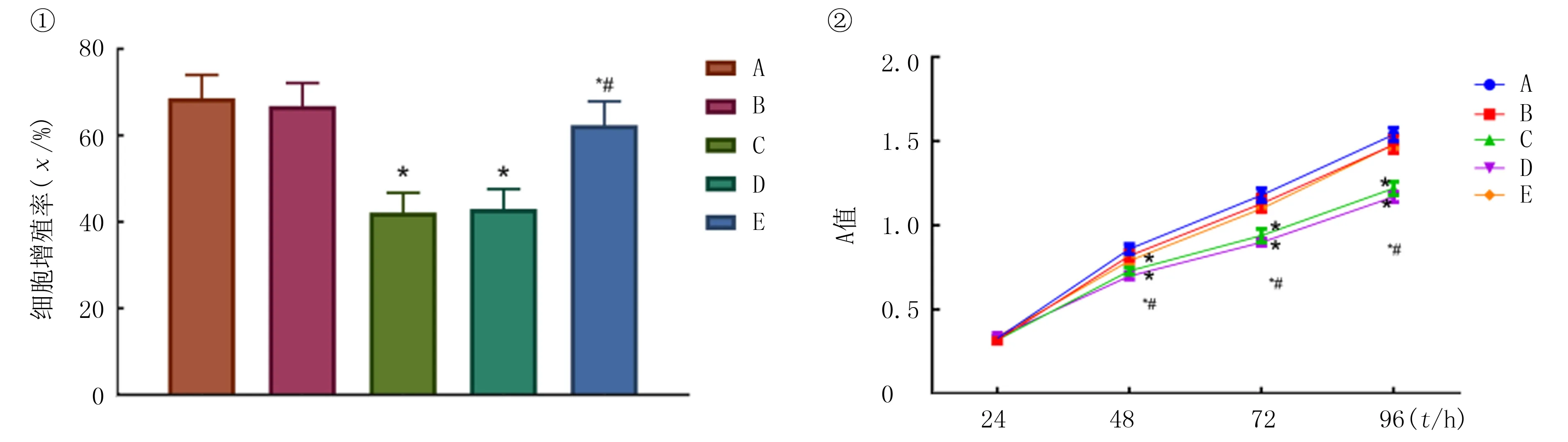
①细胞增殖率柱状图;②A值变化折线图。A:空白对照组;B:阴性对照组;C:siErbB2组;D:wortmannin组;E:siErbB2+IGF-1组。与空白对照组相比,*P<0.05;与siErbB2组相比,#P<0.05。
2.3 转染后各组细胞凋亡变化
单因素方差分析显示,5组的凋亡率差异有统计学意义(F=9.46,P<0.05)。两两比较显示,与空白对照组相比较,siErbB2组和wortmannin组细胞凋亡率均明显上升(P均<0.05);对比siErbB2组,siErbB2+IGF-1组凋亡率明显下降(P<0.05)。见图3。
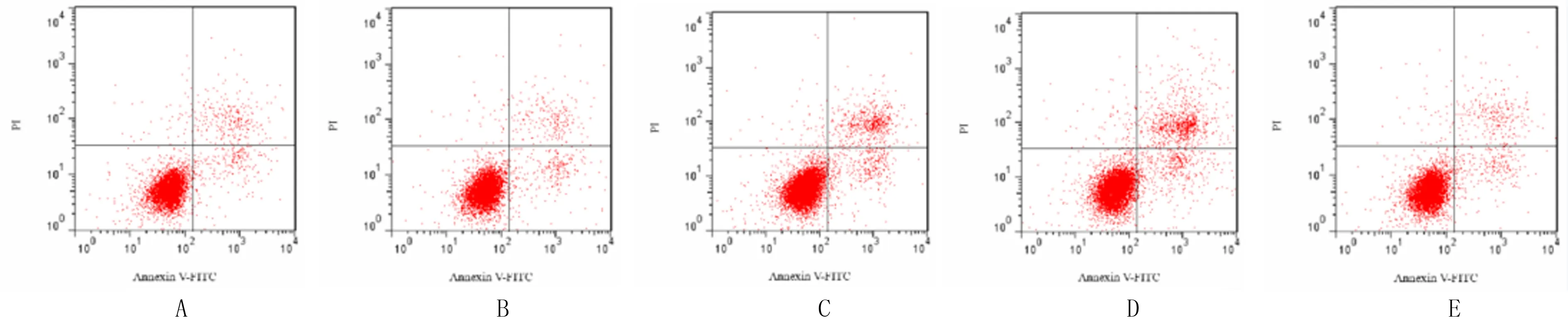
A:空白对照组;B:阴性对照组;C:siErbB2组;D:wortmannin组;E:siErbB2+IGF-1组。
2.4 转染后各组细胞迁移与侵袭的变化
转染后各组细胞的迁移结果单因素方差分析显示,5组的迁移能力差异有统计学意义(F=12.57,P<0.05)。两两比较显示,与阴性对照组相比较,siErbB2组和wortmannin组细胞迁移能力都显著减弱(P均<0.05);siErbB2+IGF-1组迁移能力明显上升(P<0.05)。转染后各组细胞的侵袭结果单因素方差分析显示,5组的侵袭能力差异有统计学意义(F=15.67,P<0.05)。两两比较显示,与空白对照组相比,siErbB2组和wortmannin组细胞侵袭能力明显降低(P均<0.05);siErbB2+IGF-1组侵袭能力明显上升(P<0.05)。见图4。
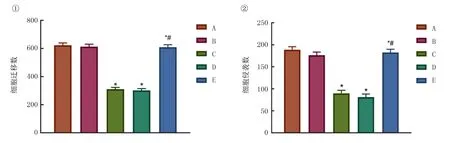
①细胞迁移检测;②细胞侵袭检测。A:空白对照组;B:阴性对照组;C:siErbB2组;D:wortmannin组;E:siErbB2+IGF-1组。与空白对照组相比,*P<0.05;与siErbB2组相比,#P<0.05。
3 讨 论
卵巢癌发病率位居女性生殖系统癌症第三,但其病死率却位居之首[9-12]。其发病隐匿,化疗等综合治疗效果不显著[13-17]。因此,提高卵巢癌早期诊断水平并探究其分子机制,对于提高卵巢癌病人生存率至关重要。而RNA干扰自其发现以来,便成为基因研究领域的热点[18-21]。基因沉默技术高效、方便,且具有极高特异性。ErbB2(HER2)基因在人类多种恶性肿瘤中呈高表达,且伴随恶性程度更高的细胞表型,诱发癌细胞增殖和转移[22-25]。既往研究者推测ErbB2在肿瘤细胞中的过度表达,与相关信号转导途径的异常相关,可诱导肿瘤微环境中良好的细胞生长环境[26]。也有学者报道,PI3K和Akt可以干扰细胞中ErbB2转录,进而影响该因子的致癌性[14]。因此,本研究作出如下假设:ErbB2基因沉默可能通过PI3K/Akt/eNOS信号通路发挥对卵巢癌细胞生物学特性的影响。
本研究采用人卵巢癌细胞系HO8910细胞,进行分组培养及转染,设置空白对照组和阴性对照组,以siErbB2组表示抑制ErbB2表达,以wortmannin组表示对PI3K/Akt/eNOS信号通路的抑制,并进一步构建siErbB2+IGF-1组验证假设推理。采用qRT-PCR和Western blot方法检测各组细胞中ErbB2、Akt、PI3K、eNOS、Caspase-3、Bax和Bcl-2的mRNA和蛋白表达水平。同时,应用MTT法、流式细胞术、Transwell侵袭实验和划痕实验检测各组细胞增殖、凋亡、迁移能力和侵袭能力的变化。本文研究结果显示,siErbB2组和siErbB2+IGF-1组ErbB2表达明显下降,而wortmannin组无明显变化,说明RNA干扰可作为研究ErbB2在卵巢癌中作用的有效工具。
为进一步了解ErbB2对卵巢癌细胞增殖、凋亡的影响及其机制。本研究后续实验应用ErbB2基因沉默技术和通路抑制剂wortmannin处理卵巢癌细胞,检测结果显示,与空白对照组和阴性对照组相比较,siErbB2组和wortmannin组卵巢癌细胞中Akt、PI3K、eNOS和Bcl-2的mRNA和蛋白表达量则显著下降,Caspase-3、Bax的mRNA和蛋白表达量显著增加;而且与siErbB2组和wortmannin组相比,siErbB2+IGF-1组Akt、PI3K、eNOS和Bcl-2的mRNA和蛋白表达量显著上升。我们推测采用wortmannin抑制剂后,PI3K/Akt/eNOS信号通路效应分子PI3K、Akt、eNOS活化状态被抑制,进而抑制肿瘤细胞生长并促进细胞凋亡、抑制肿瘤细胞的低氧耐受和肿瘤微环境中的生存能力。
本文研究结果还表明,siErbB2组、wortmannin组和siErbB2+IGF-1组细胞增殖、侵袭和迁移能力均下降,而细胞凋亡率上升。与siErbB2组和wortmannin组相比较,siErbB2+IGF-1组细胞增殖、侵袭和迁移能力均上升,而细胞凋亡率下降。以上结果从PI3K/Akt/eNOS信号通路和细胞生物学特性两个方面证实,ErbB2基因沉默或许可通过抑制PI3K/Akt/eNOS信号通路,进而抑制细胞增殖并能促进细胞凋亡。而PI3K/Akt/eNOS信号通路激活可发挥逆转作用。提示ErbB2在卵巢癌的生长转移的调控中可能发挥重要作用,且其分子机制与PI3K/Akt/eNOS信号通路密切相关。
PI3K/Akt/eNOS信号通路在细胞增殖、凋亡中的作用,既往有众多报道。例如,LI等[27]报道,FGF21抑制剂可通过eNOS/PI3K/Akt信号通路抑制人脐静脉内皮细胞的增殖和迁移;AHSAN等[28]的结果显示,磷酸肌酸可通过调节PI3K/Akt/eNOS通路保护内皮细胞免受氧化低密度脂蛋白诱导的凋亡的影响。目前针对ErbB2基因沉默通过PI3K/Akt/eNOS信号通路发挥对卵巢癌细胞生物学特性的影响的研究较少,本文借助RNA干扰技术,从基因和蛋白水平证实ErbB2基因沉默可有效影响人卵巢癌细胞株HO8910细胞增殖、凋亡等生物学行为,提示ErbB2与卵巢癌细胞的生物学行为密切相关,且其可能机制与PI3K/Akt/eNOS信号通路的抑制有关。
综上所述,本文的研究结果显示,ErbB2在卵巢癌细胞中呈高表达,RNA干扰技术可有效抑制ErbB2表达;ErbB2基因沉默可抑制PI3K/Akt/eNOS信号通路,从而抑制卵巢癌细胞增殖、促进其凋亡。而PI3K/Akt/eNOS信号通路激活可逆转ErbB2基因沉默作用,促进卵巢癌细胞增殖并抑制细胞凋亡。本研究结果为临床卵巢癌的基因治疗提供了潜在依据。值得注意的是,本研究以细胞实验探究ErbB2在卵巢癌中的作用及其与PI3K/Akt/eNOS信号通路相关的分子机制,有待进一步动物实验和临床验证。同时,抑制ErbB2在卵巢癌中的表达进而发挥抑癌作用是否受到其他信号通路的影响,均为本研究未来探讨的方向。

