不同糖代谢人群中Txnip水平及其与炎症/氧化应激的相关性研究
白桂荣,韩 晶,梁志军,谢晓敏,岳学锋
糖尿病(DM)是一组以慢性血糖升高为主要特点的内分泌代谢性疾病,严重危害人类健康和生活质量[1-2]。已有研究证实,硫氧还蛋白相互作用蛋白(Txnip)是硫氧还蛋白(Trx)的结合蛋白之一,通过与Trx的结合或与其解离来调节机体的氧化应激与炎症反应状态[3]。本研究观察了不同糖代谢人群中Txnip、炎性介质以及氧化应激指标的变化规律及其相关性,结果报告如下。
1 资料与方法
1.1 一般资料:高速低温离心机(Sanyo公司,日本);-80 ℃超低温冰箱(Thermo公司 902-ULTS,美国);全自动生化分析仪(Olympus公司BeckmanCoulter AU5400,日本); Txnip、IL-1β以及IL-18 ELISA试剂盒(上海宝曼生物科技有限公司)。
1.2 研究对象:研究对象为2016年4月-2016年12月银川市第一人民医院的健康体检者。根据《中国2型糖尿病防治指南(2013年版)》诊断标准,将研究对象分为3组:糖尿病组(DM组),FBG≥7.0 mmol/L或(和)2 h PPG≥11.1 mmol/L,27例;糖尿病前期组(PD组),6.1 mmol/L≤FBG<7.0 mmol/L或(和)7.8 mmol/L≤2 h PPG<11.1 mmol/L,30例;正常糖耐量组(NGT组)30例。排除以下人群:①既往有糖尿病或曾被诊断为糖尿病前期病史(IGT、IFG);②既往有心脑血管病、肝肾功能不全等病史;③近期有感染或其它急性疾病者。
1.3 观察指标:①年龄、性别、身高(Height)、体重(weight)、体质量指数(BMI)、收缩压(SBp)和舒张压(DBp);②FBG、HDL-C、HOMA-IR、HOMA-β等指标;③血液中Trx、Txnip以及炎性介质(IL-1β、IL-18)及氧化应激(MDA、SOD);④血液中Trx、Txnip以及炎性介质和氧化指标水平。
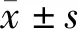
2 结果
2.1 3组一般资料比较: 3组间的性别构成比、年龄、身高、收缩压及舒张压比较差异无统计学意义(P>0.05)。DM组体重及BMI均高于NGT组(P<0.05),余2组间体重及BMI比较差异均无统计学意义(P>0.05)。
2.2 3组FBG、2 h-PBG、FINS、HOMA-IR、HOMA-β等指标比较:3组间FBG、2 h-PBG以及FINS比较,DM组>PD组>NGT组(P<0.05)。3组间HOMA-β比较,NGT组>PD组>DM组(P<0.05),见表1。
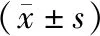
表1 3组FBG、2 h-PBG、FINS、HOMA-IR、HOMA-β的比较
2.3 3组血液中Trx、Txnip以及炎性介质和氧化指标水平比较:3组间Txnip比较,DM组>PD组>NGT组(P<0.05)。3组间Trx比较,NGT组>PD组>DM组(P<0.05)。3组间IL-1β、IL-18及MDA比较,DM组>PD组>NGT组(P<0.05)。3组间SOD比较,NGT组>PD组>DM组(P<0.05),见表2。
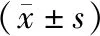
表2 3组FBG、FINS、HOMA-β、HOMA-IR、NLRP3、IL-1β、IL-18的比较
2.4 相关性分析:Txnip与IL-1β(r=0.761,P<0.05)、IL-18(r=0.796,P<0.05)、MDA(r=0.628,P<0.05)呈正相关性,与Trx(r=-0.770,P<0.05)、SOD(r=-0.661,P<0.05)呈负相关性。Trx与SOD(r=0.395,P<0.05)呈正相关性,与L-1β(r=-0.667,P<0.05)、IL-18(r=-0.715,P<0.05)、MDA(r=-0.300,P<0.05)呈负相关性。
3 讨论
慢性高血糖以及糖、脂代谢紊乱共同构成了糖尿病的主要特征。随着糖尿病逐年递增的高发病率以及疾病带来的高危害、高负担,学者们一直致力于其发病机制及治疗方法的研究[4]。
糖尿病的发病机制可能涉及基因异常、微炎症、信号通路异常等多方面因素[5]。已有研究表明,胰腺细胞具有相对较低的抗氧化酶表达水平,较易受到机体炎症损伤及氧化应激的影响,进而导致胰岛细胞功能障碍。传统上,炎症是一种保护性反应,它涉及许多复杂的机制,目的是修复组织和恢复稳态[6]。然而,慢性持续的炎症状态已被证实与糖尿病等诸多疾病相关[6]。炎症可通过多种机制激活下游信号通路,释放炎症因子,介导β细胞功能障碍和凋亡[7-8]。硫氧还蛋白系统是由Trx、NADPH、Trx还原酶三种成分组成的多功能小分子蛋白系统,具有调节细胞氧化还原状态、对抗氧化应激以及细胞凋亡等诸多作用[9]。Txnip是一种生理性的内在调节蛋白,通过与Trx结合而抑制硫氧还蛋白系统的功能,并发挥促进炎症损伤、氧化应激作用使细胞凋亡显著增加[10]。在本研究中,糖尿病患者体内Txinp含量明显高于其他2组,而Trx含量明显低于其他2组。Pearson’s线性相关分析显示Txnip与Trx呈负相关性,进一步表明Txnip在糖代谢异常早期已启动,其过度表达抑制了Trx的抗氧化作用,促进了炎症介质及氧化应激产物的产生与积聚,Txinp的表达失衡可能参与了2型糖尿病的发生发展。
正常生理条件下,机体内活性氧和活性氮可被机体抗氧化系统清除。但是,高糖、高脂毒性协同作用通过线粒体电子传递链、多远醇通路等途径导致活性氧和活性氮产生增多,超过了机体的清除能力,造成机体组织细胞蛋白质、核酸等大分子损伤,致使细胞结构和功能发生改变,并最终导致能量代谢受损、细胞信号转导和细胞周期调控紊乱、基因突变、细胞转运机制改变、生物活性降低、免疫激活和炎症[11]。IL-1β和IL-18是细胞内具有较强促炎活性的细胞因子。血浆丙二醛MDA作为氧化应激中的氧化损伤标志物,是氧自由基通过与细胞膜不饱和脂肪酸发生脂质过氧化反应所引起的产物,具有细胞毒性。MDA含量变化可方便而敏感反映机体脂质过氧化程度,并间接反映机体受自由基损伤的程度,能独立地反映2型糖尿病患者体内的氧化水平[12]。超氧化物歧化酶SOD是机体内可特异性清除超氧阴离子自由基的生物体抗氧化酶,它可对抗与阻断氧自由基对细胞造成的损害,并及时修复受损细胞。血清SOD水平可反映患者体内氧化应激水平。本研究结果表明,IL-1β、IL-18、MDA与SOD含量在不同糖耐量人群中表现出明显差异,IL-1β、IL-18、MDA在DM组中含量最高,而在NGT组中最低;SOD与此相反,在3组中NGT组最高而DM组最低。Txnip与IL-1β、IL-18、MDA呈正相关性,与Trx、SOD呈负相关性;Trx与SOD呈正相关性,与L-1β、IL-18、MDA呈负相关性。结果表明在高糖人群中存在炎症损伤及氧化应激产物增多,而清除超氧阴离子自由基的能力下降,机体中氧化和抗氧化系统失衡,并参与糖尿病的发展。
综上所述,Txnip在不同糖代谢人群中表达不同,糖尿病前期人群中即有表达增加,Txnip氧化应激与炎症损伤密切相关。但本研究样本量偏小,有一定的偏差,本研究将在后续研究中对其完善、补充。

