地西他滨逆转人乳腺癌细胞中miR-5047基因甲基化状态的研究
楚元奎,路玉祥,方丹丹,杨 丽,李 元,郭 乐,杨 华
乳腺癌是女性最常见的恶性肿瘤,研究显示,2018年全球乳腺癌的年患病人数超过208万,死亡数超过62万[1]。2019年国家癌症中心发布的最新统计数据显示,2015年我国乳腺癌的新发病例约为30.4万,位列女性恶性肿瘤的首位。寻找有效的分子诊断和治疗靶点对于提高乳腺癌的早治早诊率和乳腺癌患者的生存率具有重要意义。微小RNA(miRNAs)在乳腺癌的发生发展过程中扮演着重要的角色[2]。研究证实抑癌miRNAs的沉默与其启动子区的高甲基化状态有关[3];地西他滨(5-杂氮-2′脱氧胞苷酸,DAC)是一种去甲基化药物,可有效逆转抑癌miRNAs启动子的高甲基化状态,促进抑癌miRNAs的表达,从而抑制肿瘤细胞的生长[4-5]。本研究拟通过qRT-PCR和甲基化特异性PCR(Methylation specific PCR,MSP)检测明确乳腺癌细胞中miR-5047的表达水平及其启动子的甲基化状态,以及地西他滨处理对miR-5047启动子甲基化状态和miR-5047表达的影响。
1 资料与方法
1.1 一般资料
1.1.1 细胞株:MCF-10A、MCF-7和MDA-MB-231细胞均购自中国科学院典型培养物保藏委员会细胞库。
1.1.2 主要试剂:DMEM培养基(Gibico公司),胎牛血清(BI公司),Trizol试剂、DNA提取试剂盒(天根生化科技有限公司),EpiTect Bisulfie kit(Qiagen公司),HiScript II Q RT SuperMix for qPCR和 ChamQ SYBR qPCR Master Mix(Vazyme 公司),miR-5047启动子MSP、miR-5047和U6检测引物(上海生工生物工程有限公司),地西他滨和二甲基亚砜(DMSO,Sigma公司)
1.2 方法
1.2.1 细胞培养及药物处理: MCF-7和MDA-MB-231细胞培养于含10% 胎牛血清的DMEM培养液,MCF-10A细胞培养于人乳腺上皮细胞完全培养液(中国科学院典型培养物保藏委员会细胞库)。上述细胞均置于37 ℃、5% CO2的培养箱中培养。取处于对数生长期的MDA-MB-231细胞,以2×105个/孔的密度接种于6孔板中,培养24 h后实验组分别加入终浓度为5 μmol/L和10 μmol/L的地西他滨;继续培养48 h 后,以0.25%胰酶消化收集细胞,PBS洗涤后用于相关检测。
1.2.2 q-RT-PCR检测miR-5047的表达:Trizol法提取MCF-10A、MDA-MB-231和MCF-7以及不同浓度地西他滨处理后MDA-MB-231细胞的总RNA,以NanoDrop One超微量分光光度计(Gene公司)测定浓度。按照Vazyme公司HiScript Ⅱ Q RT SuperMix for qPCR和 ChamQ SYBR qPCR Master Mix试剂盒说明书进行反转录和PCR检测。miR-5047反转录引物5’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACCTTAC-3’;miR-5047上游检测引物5’-TTGCAGCTGCGGTTGTAA G-3’,下游检测引物5’-CAGTGCAGGGTCCGAGGTAT-3’;U6上游引物5’-CTCGCTTCGGC AGCACA-3’,下游引物5’-AACGCTTCACGAATTTGCGT-3’。使用StepOne 荧光定量PCR仪(ABI公司)进行扩增,反应体系20 μl,反应条件:95 ℃ 5 min;95 ℃ 20 s,58 ℃ 20 s,70 ℃ 20 s,40个循环。2-ΔΔCt法计算miR-5047的相对表达量,U6作为内参。
1.2.3 甲基化特异性聚合酶链式反应(MSP)检测miR-5047启动子甲基化状态: 使用UCSC网站(http://genome.ucsc.edu)提取人miR-5047上游启动子区2 000 bp的基因序列,Methprimer在线软件(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)设计甲基化和非甲基化特异性检测引物,引物由上海生工生物工程有限公司合成。甲基化上游引物:5’-GTAAGGTTTAGGTATGATAATCGGA-3’,下游引物:5’-CTACCTTTTAAAAAT TACTAACACACG-3’,扩增片段长度124 bp;非甲基化上游引物5’-AAGGTTTAGGTATGATAATTGGAG-3’,下游引物:5’-ACCTTTTAAAAATTACTAACACACAT-3’,扩增片段长度120 bp。按照试剂盒说明书提取各组细胞基因组DNA,各取1 μg进行亚硫酸盐修饰。MSP反应体系20 μl,反应条件:95 ℃ 5 min;95 ℃ 15 s,58 ℃(甲基化引物)或55 ℃(非甲基化引物)15 s,72 ℃ 15 s,35个循环;72 ℃ 10 min。取各组扩增产物6 μl进行琼脂糖凝胶电泳,凝胶成像仪(Bio-Rad公司)拍照分析。
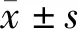
2 结果
2.1 miR-5047在正常乳腺上皮和乳腺癌细胞中的表达:以人乳腺正常上皮MCF-10A细胞作为对照,qRT-PCR检测人乳腺癌MDA-MB-231细胞和MCF-7细胞中miR-5047的表达。与MCF-10A细胞相比,MDA-MB-231和MCF-7细胞中miR-5047的表达显著下调(P<0.05),见图1(目录后)。
2.2 miR-5047启动子甲基化的分析:从UCSC网站提取人miR-5047上游启动子区2 000 bp的基因序列,Gen Script在线软件(https://www.genscript.com)分析显示在1 435~1 640区间存在一个CpG岛。使用Methprimer在线软件在该区域内设计甲基化和非甲基化检测引物,MSP检测结果显示,与MCF-10A细胞相比,MDA-MB-231和MCF-7细胞中miR-5047启动子呈高甲基化状态,见图2(目录后)。
2.3 地西他滨对MDA-MB-231细胞中miR-5047启动子甲基化水平的影响: 为明确去甲基化药物地西他滨是否能够逆转MDA-MB-231细胞中miR-5047启动子的高甲基化状态,使用5 μmol/L和10 μmol/L的地西他滨分别处理MDA-MB-231细胞,48 h 后收集细胞提取DNA,重亚硫酸盐处理后进行MSP检测。结果显示,5 μmol/L 和10 μmol/L地西他滨处理后,甲基化产物明显减少,非甲基化产物明显增多,见图3(目录后)。

2.4 地西他滨对MDA-MB-231细胞中miR-5047表达的影响:为进一步明确地西他滨是否能够通过调节miR-5047启动子区的甲基化状态从而影响miR-5047基因的表达,使用qRT-PCR法检测不同浓度地西他滨处理后MDA-MB-231细胞中miR-5047的表达。结果显示,5 μmol/L 和10 μmol/L地西他滨处理后,MDA-MB-231细胞中miR-5047的表达均显著增强,见图4(目录后)。

3 讨论
众多研究表明,miRNAs作为一类可调控促癌基因或抑癌基因表达的非编码基因参与了乳腺癌的发生发展过程。miR-193a可通过下调WT1的表达抑制乳腺癌的增殖和癌细胞转移[6]。miR-135-5p通过靶向作用于Smad3抑制TGF-β诱导的上皮间质转化和癌细胞转移[7],而miR-21则可通过直接靶向作用于LZTFL1促进乳腺癌细胞的增殖和转移[8]。miR-5047定位于人17号染色体64501214至64501313区间,研究表明miR-5047在前列腺癌[9]和宫颈癌[10]中均发挥抑癌作用,然而miR5047在乳腺癌细胞中的表达和作用目前仍不明确。课题组前期研究发现circERBB2在乳腺癌细胞中高表达,并可抑制乳腺癌细胞的增殖和迁移,生物信息学分析显示miR5047是circERBB2的一个潜在靶标miRNA,提示其在乳腺癌细胞中可能呈低表达,且发挥抑癌作用。本研究通过qRT-PCR检测发现,与正常乳腺上皮MCF-10A细胞相比,miR-5047在乳腺癌细胞MDA-MB-231细胞和MCF-7细胞中均呈低表达,初步证明miR-5047在乳腺癌中可能发挥抑癌作用。
地西他滨是一种去甲基化药物,可通过逆转抑癌基因启动子的高甲基化状态,促进其表达,进而抑制多种肿瘤细胞的生长[11-13]。尽管早期研究表明地西他滨可以诱导乳腺癌细胞视磺酸受体β2去甲基化,细胞周期捕获和生长抑制[14],然而其作用机制在很大程度上仍未阐明。近年来研究显示,地西他滨还可通过调节miRNAs启动子的甲基化水平参与肿瘤细胞的生长调控[15-16],目前在乳腺癌研究中还鲜有关于地西他滨调控miRNA甲基化水平的报道。本研究通过MSP检测发现,在乳腺癌细胞中,miR-5047启动子区的甲基化水平显著高于正常乳腺上皮MCF-10A细胞,提示其表达下调可能与其启动子区的高甲基化状态有关,课题组进而使用5 μmol/L和10 μmol/L浓度的地西他滨分别处理乳腺癌MDA-MB-231细胞,MSP和qRT-PCR检测发现,地西他滨处理后,miR-5047启动子区的甲基化水平明显降低,与此同时,miR-5047的表达则显著增强。上述结果进一步证实,miR-5047在乳腺癌细胞中的低表达与其启动子区呈高甲基化状态有关,去甲基化药物地西他滨可通过降低miR-5047基因启动子区的甲基化水平促进miR-5047的表达。以上结果为进一步研究miR-5047在乳腺癌细胞中的作用及机制提供了实验依据。

