以多柔比星为基础的化学药物治疗致心脏毒性相关危险因素研究进展
孙一琦,李新刚,沈素(首都医科大学附属北京友谊医院 药剂科,北京 100050)
多柔比星等蒽环类药物广泛用于治疗各种肿瘤,以其为核心的联合化疗方案明显延长了肿瘤患者的生存周期[1]。但蒽环类药物可导致进展性和不可逆性的心脏毒性[2],与其他化疗方案相比发生心脏毒性的风险增加了约5.43 倍[2],且低剂量蒽环类药物也可引起心脏毒性[3]。本文旨在讨论多柔比星致心脏毒性的相关危险因素的研究现状,为指导临床合理应用多柔比星提供参考。
1 蒽环类药物致心脏毒性的机制
蒽环类药物引起心脏毒性的确切机制目前尚不清楚,它可能是多因素的,基本机制可能涉及:氧自由基损伤学说[4-6]、拓扑异构酶2β的双重机制[7]和铁离子代谢紊乱学说[4]等其他间接途径。
2 文献检索
对中国知网、万方、维普、PubMed、Embase和Cochrane Library 等数据库进行全面检索,中文检索词如下:(多柔比星+阿霉素)*(心脏毒性)*(危险因素);英文检索词如下:((Doxorubicin [Title/Abstract])AND(cardiotoxicity [Title/Abstract]))AND(risk factors [Title/Abstract]), 筛选截止到2020年10月所有的相关文献(见图1),并对纳入文献的相关参考文献进行阅读。

图1 文献筛选流程Fig 1 Literature screening process
3 以多柔比星为基础的化学药物致心脏毒性的相关危险因素
蒽环类药物严重的渐进性、不可逆性的心脏毒性限制了其在临床治疗中的应用,因此,明确危险因素并针对患者进行个性化的监测和治疗尤为重要。通过阅读文献,发现危险因素主要包括以下几个方面:
3.1 蒽环类药物的累积剂量
蒽环类药物所致心脏毒性与累积剂量密切相关[1,8],是心脏毒性最显著的危险因素[6],也是独立高危因素[9]。Von Hoff 等[10]在一项回顾性分析中发现,当患者接受多柔比星400、550 和700 mg·m-2的累积剂量时,心脏毒性的发生率分别为3%、7%和18%,且存在剂量限制毒性。因此建议多柔比星的累积剂量不超过550 mg·m-2。
3.2 年龄
老年患者出现心脏毒性的风险更高[10-12]。Swain 等[12]的回顾性分析显示,多柔比星累积剂量达到400 mg·m-2时,65 岁以上患者发生充血性心力衰竭的风险是65 岁以下患者的2.25 倍。
3.3 性别
女性较男性患者更易出现心脏毒性,可能与男女体内药物分布和代谢不同有关[13]。
3.4 体质指数(BMI)
超重和肥胖的患者发生心脏毒性的危险性更高[14]。有研究表明BMI ≥24 kg·m-2的人群中,导致QTc 延长的发生率较高,为34.43%[15]。
3.5 吸烟
吸烟被认为是心脏毒性和心脏衰竭的早期标志[11]。
3.6 癌症转移
有研究显示,存在癌转移的患者发生心脏毒性的可能性是未发生癌转移患者的2.66 倍(P<0.01)[1]。
3.7 既往史和现病史
既往存在心脏危险因素的患者在使用蒽环类药物治疗时充血性心力衰竭(CHF)的发生率较高[6]。研究表明有心脏危险因素(如高血压[17]、血脂异常[14]、糖尿病[18]、冠心病[19])的患者心脏毒性的发生率要高出3 倍[16]。
3.8 其他
放射性治疗[7],联合使用其他有心脏毒性的药物[7](如曲妥珠单抗),使用抗高血压药物等都会增加患者发生心脏毒性的风险。
4 多柔比星致心脏毒性危险因素的相关临床研究结果的总结与评价
表1 列出了本文纳入的13 篇文章有关以多柔比星为基础的化疗所致心脏毒性的危险因素。表2给出了各研究中所有初始纳入预测因子,并列出了所有单因素分析后有统计学意义(P<0.05)的危险因素,表3 给出了各研究中多因素分析结果。
2020年一项在中国的研究8 个初始纳入预测因子(见表2),该研究规定出现以下任意一种情况为产生了心脏毒性:① 左室射血分数(LVEF)较基线降低至少5%至绝对值<55%,伴随CHF的症状或体征;② LVEF 降低至少10%至绝对值<55%,未伴有症状或体征;③ 有CHF 的临床证据[20]。单因素分析后有统计学意义的因素共3个,采用Logistics 回归模型进行多因素分析发现:年龄大于60 岁患者心脏毒性风险增加2.431 倍;多柔比星累积剂量≥200 mg·m-2的风险增加1.612倍;高血压患者心脏毒性风险增加1.748 倍。
2020年另一项中国研究初始纳入8 个预测因子,该研究规定患者治疗期间出现心脏毒性症状和治疗后心电图中出现QTc ≥440 ms 为产生心脏毒性。进行单因素分析后有统计学意义的共3 个,采用Logistics 回归模型进行多因素分析发现,BMI ≥24 kg·m-2的患者发生心脏毒性的风险增加0.23 倍[19]。
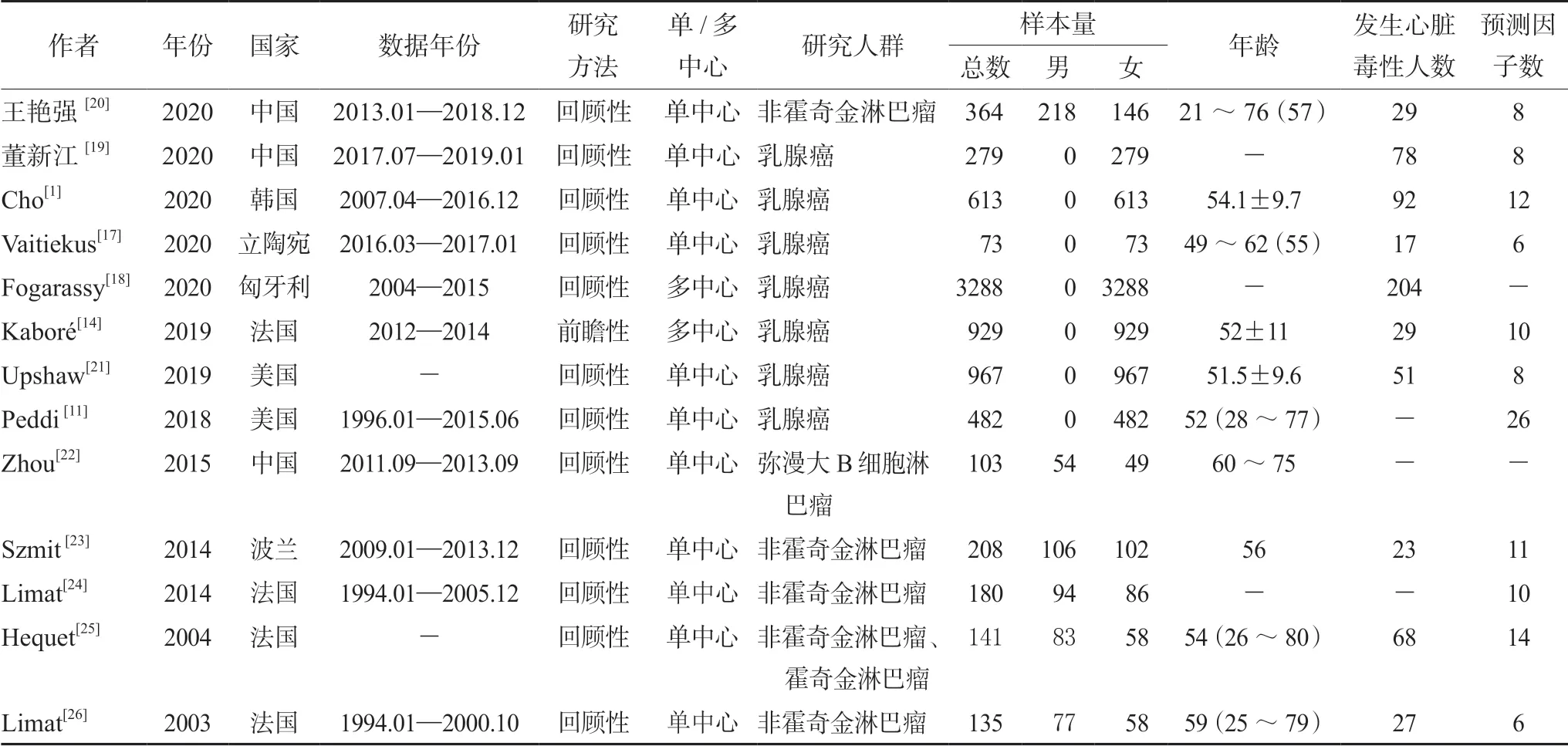
表1 多柔比星致心脏毒性相关危险因素的临床研究结果分析Tab 1 Clinical study of risk factors for doxorubicin induced cardiotoxicity
2020年一项韩国的研究初始纳入12 个预测因子,研究对心脏毒性定义为:① LVEF 比基线降低大于10%且LVEF 在心脏放射性核素扫描(MUGA)上<50%或在超声心动图上<55%;② 在MUGA 上LVEF >50%时,LVEF 较基线降低>15%;③ 在超声心动图上LVEF >55%时,LVEF 比基线降低>15%。进行单因素分析后有统计学意义的因素共2 个,采用Cox 回归模型把这2 个因素和癌转移(单因素分析P=0.11)纳入模型进行多因素分析发现,高龄、使用曲妥珠单抗、发生癌转移分别使患者发生心脏毒性的风险增加0.02、3.08 和1.66 倍[1]。
2020年立陶宛的一项研究初始纳入6 个预测因子,该研究规定患者LVEF 下降超过10%为产生了心脏毒性[17]。单因素分析后有统计学意义的因素是高血压,未进行多因素分析。同年匈牙利的研究[18]规定任何化学疗法或诊断提示心力衰竭的情况即视为产生了心脏毒性,进行单因素分析后有统计学意义的因素共7 个(见表2),也未进行多因素分析。
在法国2019年一项多中心前瞻性研究中,初始纳入11 个预测因子,研究对心脏毒性定义为:在MUGA 或超声心动上,LVEF 比基线降低>10%且LVEF <50%[14]。单因素分析后有统计学意义的因素共3 个,采用Logistics 回归模型进行多因素分析发现,使用曲妥珠单抗、BMI ≥25且<30 kg·m-2和BMI >30 kg·m-2的患者发生心脏毒性的风险分别增加11.12、1.47 和2.35 倍。
在美国2019年的研究中,初始纳入8 个预测因子,心脏毒性定义为:在MUGA 或超声心动上,左心室射血分数比基线降低大于10%且LVEF <50%,或由2 名心脏病学家和研究主席进行中央裁定,判断为临床心力衰竭(HF)事件,并要求以下症状之一:① ≥2 级呼吸困难或≥2 级水肿,LVEF 降低至正常或舒张功能障碍的下限以下;② 如果LVEF <40%,则1 级呼吸困难或水肿患者也可归为临床HF。进行单因素分析后没有统计学意义的因素[21]。研究者还将年龄、BMI、高血压、基线LVEF 直接采用Logistics 回归模型做了多因素分析发现,高BMI、高龄的患者心脏毒性风险分别增加0.06、0.04 倍。研究还用Bootstrap 法对多因素分析模型进行了内部验证,验证集的样本量为200。对模型进行性能评估,得到训练集的区分度:接收者操作特征曲线下面积(AUC)=0.701,95%置信区间(95%CI)为0.627-0.774;验证集的区分度:AUC=0.68;95%CI:0.62-0.75[21]。
另一项2018年美国的研究初始纳入26 个预测因子,心脏毒性定义为:在MUGA 或超声心动上LVEF <50%。进行单因素分析后有统计学意义的因素共8 个(见表2),未进行多因素分析[11]。
在一项2015年的中国研究中,研究者将纳入研究的103 名患者分为多柔比星治疗组(RCHOP组62 人)和脂质体多柔比星治疗组(DRCOP 组41 人)[22]。心脏毒性以超声心动观察到的LVEF下降定义:1 级为LVEF 较基线下降1%~9%;2级 为LVEF 为40% ~49%或LVEF 较基线下降10%~19%;3 级为LVEF 20%~39%或LVEF 较基线下降>20%;4 级为LVEF <20%。该研究结果表明,DRCOP 组发生3 ~4 级心脏毒性的人数显著低于RCHOP 组,(9.8%vs27.4%,P=0.029)。

表2 多柔比星致心脏毒性相关影响因素的单因素分析Tab 2 Univariate analysis of the factors affecting cardio toxicity induced by doxorubicin
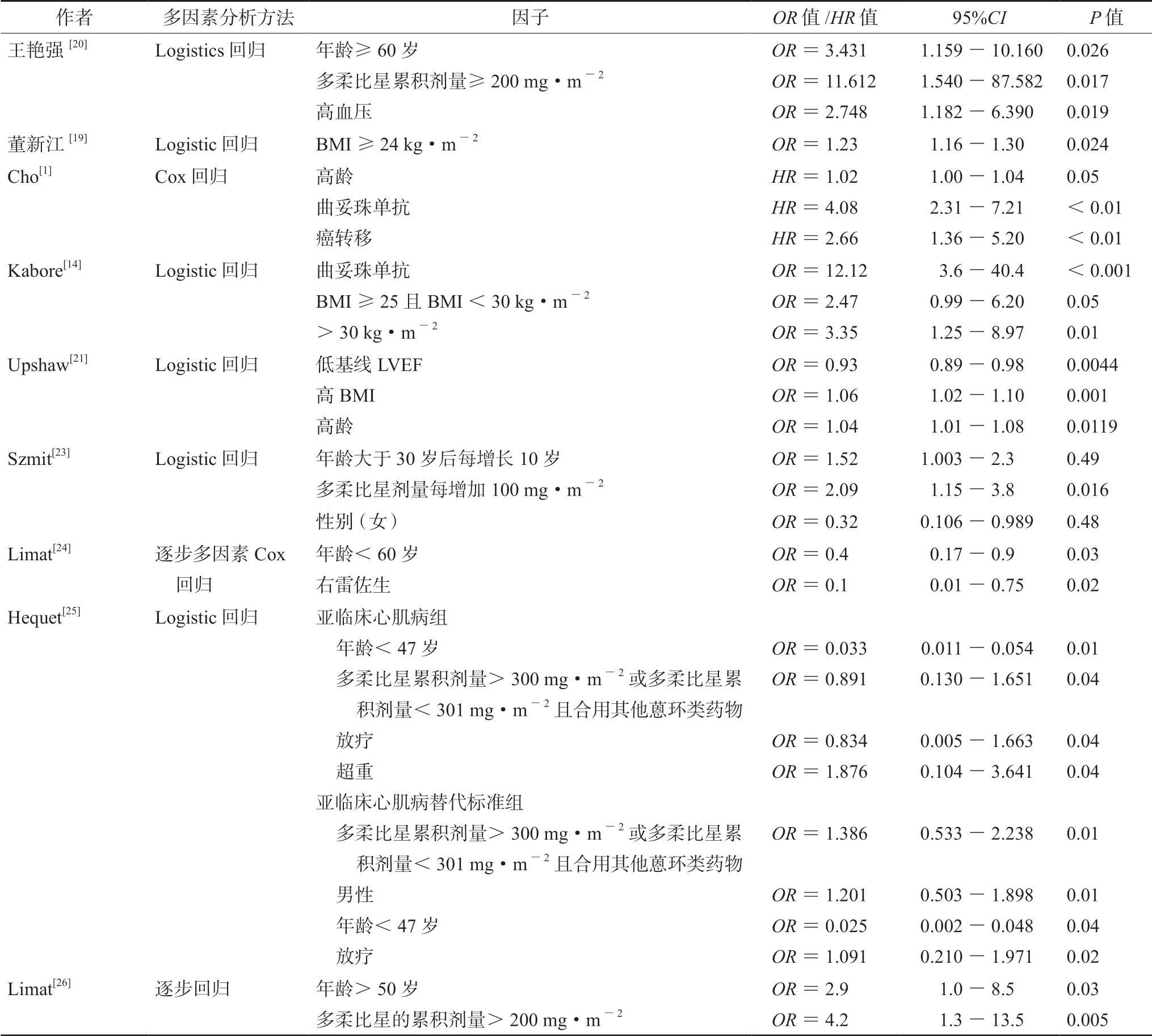
表3 多柔比星致心脏毒性影响因素的多因素分析Tab 3 Multivariate analysis of the factors affecting cardiac toxicity induced by doxorubicin
在2014年波兰的研究中,初始纳入了11 个预测因子(见表2),研究中心脏毒性定义为超声心动观察到LVEF <50%,与基线值相比至少降低10%[23]。进行单因素分析后,有统计学意义的危险因素共3 个:高血压、超重、冠心病。研究者又将初始纳入分析的11 个危险因素用Logistics回归模型进行多因素分析,发现年龄>30 岁后每增加10 岁和多柔比星累积剂量每增加100 mg·m-2,患者发生心脏毒性的风险分别增加0.52 倍和1.09 倍;而女性是发生心脏毒性的保护因素,女性患者发生心脏毒性的风险是男性的0.32 倍,与另一篇考文献[13]的结论矛盾。由于波兰的研究中只纳入非霍奇金淋巴瘤患者[23],而陈禹彤等[13]的结论是基于患各种肿瘤的患者得出,因此认为,性别因素还需进一步通过大样本量研究的亚组分析进行讨论。
2014年一项研究,初始纳入了10 个预测因子(见表2),心脏毒性事件定义为:LVEF 较基线降不少于20%且绝对值<50%;或有CHF 的临床证据[24]。单因素分析后有统计学意义的危险因素共4 个:年龄≥60 岁、性别、联用右雷佐生和利妥昔单抗,而后将这4 个因素用逐步多因素Cox 模型进行多因素分析,发现患者年龄<60岁发生心脏毒性的风险是≥60 岁的0.4 倍;用右雷佐生的患者发生心脏毒性的风险是未使用者的0.1 倍。
2004年一项研究初始纳入的预测因子有14个,定义发生心脏毒性为:左心室缩短分数(FS)减少,FS <25%,而没有CHF 临床症状;并定义替代标准是:FS <28%、射血分数降<50%、室壁运动异常中至少包括2 种[25]。以此定义,发生心脏毒性的共68 人,其中标准组39 人,替代标准组29 人。单因素分析后有统计学意义的因素有① 标准组:年龄>47 岁、性别;② 替代标准组:年龄>47 岁。研究者又将初始纳入的所有因素进行Logistics 多因素分析发现,其中年龄<47 岁是保护因素,在标准组和替代标准组中发生心脏毒性的风险分别是年龄≥47 岁患者的0.033 倍和0.025 倍。
2003年法国的一项研究,初始纳入6 个预测因子,心脏毒性定义为:LVEF 较基线下降≥15%,或基线LVEF <50%的患者治疗中又出现下降,或CHF 的临床证据。单因素分析有统计学意义的危险因素有两个,再将两个因素进行多因素分析发现,年龄>50 岁和多柔比星累积剂量>200 mg·m-2分别使心脏毒性发生风险增加1.9 倍和3.2 倍[26]。
上述研究发现的多柔比星致心脏毒性的相关危险因素不尽相同。一方面,可能是因为这些研究多为单中心的回顾性研究,导致不同研究群体间的患者异质性较大;另一方面,虽然所有研究的结局指标均为“心脏毒性”,但在不同研究中,研究人员对心脏毒性的定义却有很大差异。
5 小结
多柔比星等蒽环类药物广泛应用于治疗各种恶性肿瘤,其疗效显著但是心脏毒性等不良反应不仅限制了其给药剂量,更会威胁到肿瘤患者的生命。近年来,虽然关于多柔比星所引起心脏毒性的各种危险因素的研究已有很多,但目前国内外的临床研究仍大部分止于对各种危险因素的单因素分析和多因素分析,并没有建立起有效的心脏毒性危险因素的风险预测模型,导致对每个风险因素的认识只停留在有暴露人群和非暴露人群之间的相对效应指标的评价,而并不清楚某一患者接受蒽环类药物治疗后,心脏毒性反应的发生率。所以,现阶段的研究对医师和药师在临床实际中评估某一肿瘤患者在接受多柔比星治疗后可能产生心脏毒性的风险大小并无确切的适用性。因此,危险因素风险预测模型的建立是必要的,不仅能指导临床根据患者的危险因素进行分层,实现安全、合理用药,还能减轻患者用药后的各种不良反应并提高肿瘤患者的整体生存率,使得在临床治疗中将多柔比星发挥更大抗肿瘤效用的同时,心脏毒性事件亦能得到有效的控制。

