异鼠李素通过减轻氧化应激改善游离脂肪酸诱导肝细胞脂质沉积
周健,杜凤,康秉文,殷草草,蒋杉,石莹,王玥,周耿瑶,秦绪军*,王枫*(.空军军医大学军事预防医学系 军队健康教育与管理教研室,西安 7003;.陕西中医药大学公共卫生学院,陕西 咸阳 7046)
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是指在非过度饮酒的情况下,肝脏发生的脂质沉积现象,并排除药物、自身免疫、病毒等因素造成的肝脏疾病[1],以过量的三酰甘油(triacylglycerol,TG)在肝脏中聚积为特征[2]。NAFLD 已成为全世界人们在慢性病领域关注的焦点,我国预计在2030年成为NAFLD导致肝脏相关疾病死亡率最高的国家[3]。对于目前重症NAFLD 患者而言,除了改变不健康的生活方式之外,急需能够有效治疗NAFLD 的药物。NAFLD 发病机制复杂,致病因素众多。目前“多重打击学说”认为形成NAFLD 的因素包括肝脏TG 沉积,胰岛素抵抗(insulin resistance,IR),自噬能力减弱,炎性因子刺激以及氧化应激(oxidative stress,OS)等[4]。有研究表明,当大量活性氧(reactive oxygen species,ROS)发生OS 时,线粒体功能受到抑制,核因子相关因子2(NF-E2-related factor 2,Nrf2)与其内生的抑制剂Kelch 样ECH 相关蛋白1(Kelch-like ECHassociated protein 1,keap1)的分离可能会受到抑制,影响抗氧化基因表达,形成恶性循环,使细胞功能受损,诱发脂质沉积[5]。因此抗氧化是防治NAFLD 的重要研究内容之一。
异鼠李素(isorhamnetin,Iso)由沙棘中分离而得,是黄酮类化合物槲皮素的直接代谢产物之一[6]。沙棘具有缓解咳嗽,促进食欲的功效,被广泛用于治疗轻症的呼吸系统炎症、高原肺病、食欲不振等[7]。近几年,异鼠李素更是被证明具有保护心血管、抗炎、调节免疫、抗肿瘤、缓解肝脏纤维化等多种作用[8-11]。此外,异鼠李素抗氧化能力较强[9,12-13],能调节Nrf2 通路,从而增强血红素加氧酶1(HO-1)、谷氨酸半胱氨酸连接酶修饰亚基(GCLM)、谷氨酸半胱氨酸连接酶催化亚基(GCLC)等抗氧化基因的表达,缓解超氧化物歧化酶(SOD)过分消耗,减少ROS产生,从而缓解OS,起到抗氧化保护作用[14-15]。异鼠李素是否可以通过调节Nrf2 通路来缓解OS造成的损伤从而减轻NAFLD,尚不明确。本研究采用游离脂肪酸(FFA)构建体外脂质沉积模型,观察异鼠李素对细胞产生的ROS、抗氧化系统以及TG 沉积的变化影响,初步探讨异鼠李素抗NAFLD 的可能性及其分子机制。
1 仪器与试药
1.1 仪器
二氧化碳孵育箱(美国Thermo);紫外线超净台(江苏苏净安泰);台式离心机(陕西环宇);CKX41 倒置显微镜(日本Olympus);高速冷冻离心机5424 R(德国Eppendorf);Infinite200 PRO 全波长多功能酶标仪(德国Tecan);流式细胞仪(美国BD);Trans Blot Turbo 蛋白转印系统、蛋白电泳仪、凝胶成像系统(美国Bio-Rad)。
1.2 试药
异鼠李素(美国TargetMol,纯度≥98%,批号:T2836);胎牛血清(FBS)、DMEM 高糖培养基(美国Gibco);蛋白定量分析试剂盒(美国Thermo);青-链霉素溶液(上海源培);油红O、荧光探针(美国Sigma);过氧化氢酶(CAT)试剂盒、总SOD 试剂盒(上海 Beyotime);苏木精(珠海贝索);TG 试剂盒(日本Wako);CCK-8试剂盒(上海汉恒);浆蛋白核蛋白提取试剂盒、丙二醛(MDA)试剂盒(江苏凯基);Actin、CAT、SOD1、GPx1、GCLM 兔 抗单 克隆抗 体、SOD2 鼠抗单克隆抗体(美国Santa Cruz);Nrf2兔抗单克隆抗体(武汉 Proteintech);GCLC 兔抗单克隆抗体(南京巴傲德);HO-1 兔抗单克隆抗体(英国Abcam);ML385(美国TargetMol)。
2 方法
2.1 L-02 细胞培养与处理
人肝L-02 细胞(由中科院上海细胞库购买)接种于含10% FBS、1%青-链霉素的DMEM 高糖培养基中,在37℃、5% CO2的孵育箱中培养。取处于对数生长期细胞,均匀接种于96 孔板(用于CCK-8 实验)与6 孔板(用于蛋白水平表达等其他测定)中。油酸与棕榈酸按2∶1 的比例溶于BSA中配制成FFA[14]。将细胞分为3 组:对照(control)组,FFA 组,FFA +Iso 组。其中FFA 浓度为0.6 mmol·L-1,异鼠李素浓度为10 μmol·L-1,共处理7 d。每组设立3 个平行样。
2.2 细胞活力检测
采用CCK-8 细胞增殖试剂盒检测细胞活力。取对数生长期细胞按说明书均匀接种于96 孔板,分别给予0、5、10、20、40、80 μmol·L-1的异鼠李素培养24 h,再用10 μL CCK-8 溶液进行反应,37℃孵育2 h,在450 nm 处测定吸光度。
2.3 油红O 染色
油红O 充分溶于异丙醇中,过滤后配制5 g·L-1的储存液,与超纯水按3∶2 混合,过滤后配制成油红O 工作液。4%多聚甲醛处理细胞30 ~60 min 用于固定,60%异丙醇孵育3 min,油红O 工作液孵育5 min。苏木素孵育1 min 后进行清洗,直到呈现紫蓝色,显微镜下观察[15]。
2.4 细胞TG 检测
采用TG 试剂盒,通过GPO-DAOS 法测定细胞中TG 含量。按照试剂盒的说明进行操作:细胞用RIPA 裂解液常规裂解,4℃、14 000 g 离心20 min 后取上清液。检测液A 与B 按1∶1 混合。取2 μL 上清液加入300 μL 混合好的检测液,37 ℃孵育至少30 min,在600 nm 处测定吸光度。
2.5 细胞总ROS 检测
采用2',7'-二氯荧光黄双乙酸盐(DCFHDA)荧光探针标记,流式细胞仪检测荧光强度[16]。L-02 细胞消化重悬,加入浓度为10 μmol·L-1的DCFH-DA,37℃避光孵育30 min,孵育完成清洗3 次,重悬后用流式细胞仪FL-1通道测定平均荧光强度,激发波长为488 nm,发射波长为525 nm。
2.6 细胞MDA 含量、总SOD 活性和CAT 活性检测
在样品充分裂解后,按照说明进行操作,测定MDA、总SOD 活性及CAT 活性。MDA 荧光强度检测采用激发波长515 nm、发射波长553 nm。总SOD 活性采用450 nm 波长测定吸光度,CAT 活性采用520 nm 波长测定吸光度。
2.7 核蛋白与浆蛋白提取
采用核蛋白、浆蛋白提取试剂盒提取核蛋白及浆蛋白,在细胞中加入预冷的450 μL Buffer A与50 μL Buffer B,混匀,冰上放置30 min。4℃、3000 g 离心10 min,上清液即为胞浆蛋白。沉淀加入100 μL Buffer C,涡旋震荡15 s,冰上裂解60 min。4 ℃、14 000 g 离心30 min,上清液即为核蛋白。
2.8 Western blot
依照BCA 法,测定蛋白浓度。配制相应浓度的凝胶依次上样,恒压150 V 电泳60 min。电泳结束后,将蛋白转移至PVDF 膜上。5%脱脂奶粉室温孵育2 h。一抗在4 ℃孵育12 h,用TBST洗膜,共3次。二抗在25℃孵育2 h,TBST 洗膜,共4 次。发光液A 与发光液B 按1∶1 混匀,覆于PVDF 膜表面,并用凝胶成像进行成像。最后采用Bio-Rad Quantity One 软件对条带进行定量分析。
2.9 统计学分析
通过SPSS 22.0 统计分析软件,实验数据以±s形式表示。多组间数据采用单因素方差分析(One-way ANOVA),运用Dunnett’st检验比较实验组与对照组之间的统计学差异,以P<0.05为差异有统计学意义。
3 结果
3.1 异鼠李素对L-02 细胞活力的影响
当 浓度≤20 μmol·L-1时,异鼠 李 素对细胞活力的影响无显著区别;而当浓度≥40 μmol·L-1时,细胞活力显著降低(见图1)。因此,为了避免细胞活力受影响,选择浓度为10 μmol·L-1的异鼠李素进行干预。
3.2 异鼠李素对FFA 诱导的L-02 细胞中TG 水平的影响
与Control 组相比,经FFA 处理的细胞红色斑点大量生成,TG 水平显著提高;而经异鼠李素干预后,红色斑点显著减少,表明细胞内TG水平显著下降(见图2)。
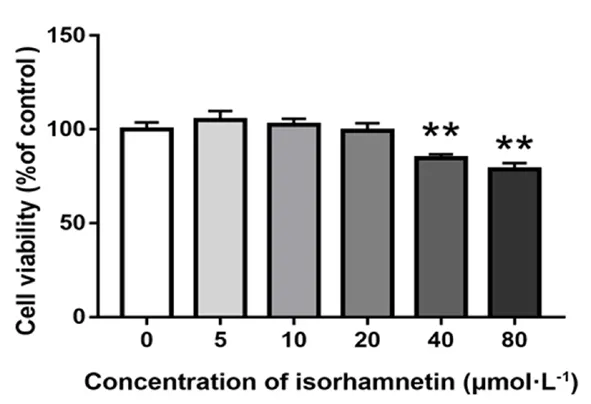
图1 不同浓度的异鼠李素处理后对L-02 细胞活力的影响(24 h)Fig 1 Effect of different concentrations of isorhamnetin on the viability of L-02 cells(24 h)

图2 异鼠李素对FFA 诱导的L-02 细胞中TG 水平的影响(7 d)Fig 2 Effect of isorhamnetin on TG level in L-02 cells induced by FFA(7 d)
3.3 异鼠李素对FFA 诱导的L-02 细胞中总ROS及MDA 水平的影响
与Control 组相比,FFA 组的总ROS 水平与MDA 水平均显著增高,表明FFA 可诱导细胞发生OS,使细胞受损;而经异鼠李素干预后,细胞总ROS 水平与MDA 水平均明显降低,表明异鼠李素可以有效缓解FFA 造成的OS 损伤(见图3)。
3.4 异鼠李素对FFA 诱导的L-02 细胞中抗氧化酶的影响
与Control 组相比,FFA 组SOD1、SOD2、GPx1的表达水平均显著下降;在异鼠李素干预后,SOD1、SOD2、GPx1 的表达水平显著提高(见图4A)。除此之外,FFA 可显著降低L-02 细胞总SOD 活性,而异鼠李素干预后总SOD 活性显著增加(见图4B)。
3.5 异鼠李素对FFA 诱导的L-02 细胞中Nrf2 蛋白及其下游蛋白水平的影响

图3 异鼠李素对FFA 诱导的L-02 细胞的总ROS 与MDA 水平的影响(7 d)Fig 3 Effect of isorhamnetin on total ROS and MDA level in L-02 cells induced by FFA(7 d)
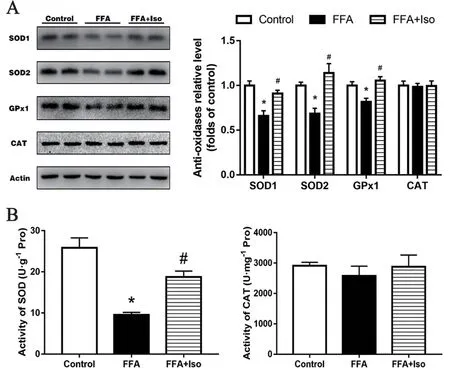
图4 异鼠李素对FFA 诱导的L-02 细胞的抗氧化酶的影响(7 d)Fig 4 Effect of isorhamnetin on anti-oxidases in L-02 cells induced by FFA(7 d)
FFA 处理后L-02 细胞胞核内的Nrf2 蛋白水平显著下降,Nrf2 下游的GCLC、GCLM 的表达水平也显著下降。与FFA 组相比,异鼠李素干预后细胞质中的Nrf2 蛋白(cyt Nrf2)水平显著下降,而细胞核中的Nrf2 蛋白(nuc Nrf2)水平则显著升高(见图5A);Nrf2 下游的蛋白表达水平也有显著提高(见图5B)。
3.6 抑制Nrf2 后异鼠李素对FFA 诱导的L-02 细胞中TG 水平的影响
与Control 组相比,FFA 组TG 水平显著升高,而异鼠李素进行干预后TG 水平有明显的下降,表明异鼠李素可以减轻FFA 诱导的脂质沉积。而在应用Nrf2 特异性抑制剂ML385(1 μmol·L-1)与异鼠李素共同处理后,细胞内TG水平明显回升,表明Nrf2 在受到抑制后,异鼠李素缓解脂质沉积的作用下降,进一步表明异鼠李素可能是通过调节Nrf2 通路缓解FFA 诱导的脂质沉积(见图6)。
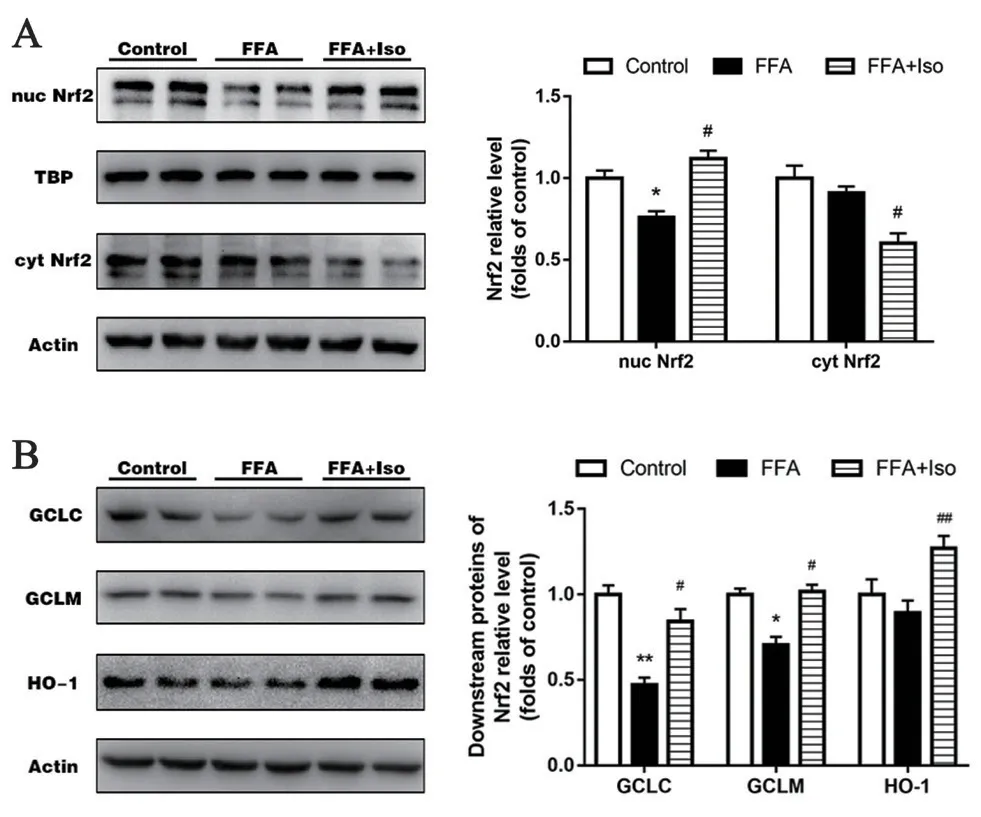
图5 异鼠李素对FFA 诱导的L-02 细胞中Nrf2 蛋白及其下游蛋白水平的影响(7 d)Fig 5 Effect of isorhamnetin on Nrf2 and its downstream proteins in L-02 cells induced by FFA(7 d)
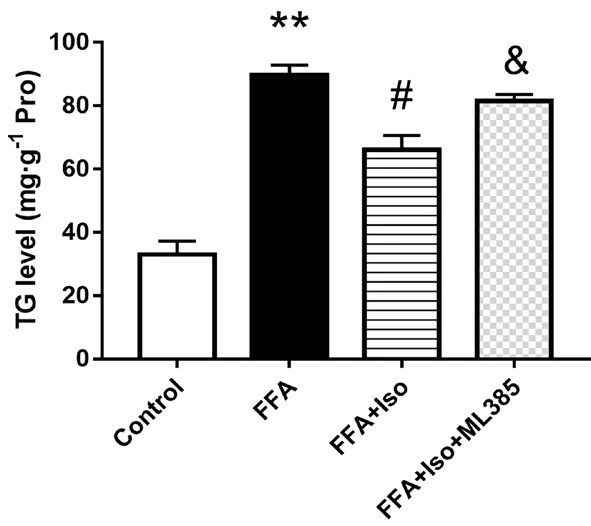
图6 抑制Nrf2 后异鼠李素对FFA 诱导的L-02 细胞中TG 水平的影响(7 d)Fig 6 Effect of isorhamnetin on the TG level in L-02 cells induced by FFA after the inhibition of Nrf2(7 d)
4 讨论
OS 是ROS 生成超过抗氧化的能力时出现的一系列应激反应,与NAFLD 的发生有着密切的联系。过量的游离脂肪酸在肝细胞线粒体内发生β氧化,造成ROS 的不断聚积,影响线粒体的活性,导致脂肪酸转化为TG 储存在肝细胞内,进一步破坏线粒体结构与功能,产生更多的ROS[17],大量TG 沉积在肝脏中最终形成NAFLD。而NAFLD 的形成也进一步使肝细胞受到脂质毒性的侵害,加重线粒体的破坏,产生更多的ROS,从而诱导IR与炎症的发生,进一步使OS 损伤加剧,形成恶性循环[18]。因此,通过减少ROS 成为预防或治疗NAFLD 的潜在有效手段[19]。
异鼠李素具有保肝的作用,可以有效缓解多种因素引起的肝细胞坏死与凋亡,这其中的机制可能与抗氧化相关[20]。在本研究中,我们发现FFA 可以诱导L-02 细胞发生脂质沉积,并且可以引起细胞发生OS 损伤,产生大量ROS,消耗多种抗氧化酶。而异鼠李素则可以有效缓解FFA诱发的脂质沉积,减少细胞中TG 的水平,并且缓解OS 损伤,减少ROS 与MDA 的水平,提高SOD1、SOD2、GPx1 的表达与活性,表明异鼠李素可能通过抗氧化来缓解脂质沉积。Nrf2 是上游重要的抗氧化转录因子,其调控机制尚不完全明确。但目前普遍的观点认为,当遇到亲电物质攻击或是发生磷酸化使其构象发生改变[21],Nrf2就会与keap1 分离进入细胞核,与一个小蛋白形成异二聚体,并识别抗氧化反应原件(antioxidant response element,ARE)序列,加强下游抗氧化蛋白表达,从而减轻ROS 带来的破坏,维持细胞的稳态[22]。此外,当keap1 发生构象的改变或是Nrf2 mRNA 水平上调,都可以促使Nrf2 通路的激活。我们进一步的研究发现,异鼠李素可以通过调控Nrf2 信号通路,促进Nrf2 进入细胞核,从而提高HO-1、GCLC、GCLM 的表达水平。这些结果表明异鼠李素可能是通过提高Nrf2 的转录活性,减轻了OS,从而缓解了FFA 诱导的脂质沉积。接下来本课题组应用Nrf2 的特异性抑制剂,发现异鼠李素缓解脂质沉积的作用减弱,细胞中TG 水平增加,这进一步表明Nrf2 通路是异鼠李素缓解脂质沉积的重要通路。Ganhold等[23]的研究证明异鼠李素可以缓解小鼠肝脏中的脂质沉积,其中的机制可能与过氧化物酶体增殖物激活受体γ(peroxisome proliferators activated receptorγ,PPARγ)通路有关。PPARγ通路与脂质合成相关,而有文献报道Nrf2 可以调控PPARγ通路,因此异鼠李素还有可能通过调控Nrf2 抑制脂肪从头合成,从而缓解脂质累积[24]。
综上所述,本研究采用NAFLD 体外细胞模型,发现异鼠李素可显著缓解FFA 引起的OS,提高细胞抗氧化的能力,降低FFA 诱导的脂质沉积,而调控Nrf2 通路是其中抗氧化的重要机制。该研究结果为进一步研究异鼠李素防治NAFLD提供了实验依据。

