程序性死亡受体1抑制剂的神经系统不良反应及药学监护
李草,赵志刚(首都医科大学附属北京天坛医院药学部,北京 100070)
免疫检查点是参与维持免疫动态平衡的分子[1],其中,关于程序性细胞死亡受体-1(programmed cell death protein 1,PD-1)和程序性死亡配体-1(programmed death ligand 1,PD-L1)的研究最深最广。临床上,针对PD-1 和PD-L1 的单克隆抗体陆续被开发,在患者中显示出良好的治疗效果[2]。免疫检查点抑制剂有一系列独特的免疫相关不良反应,表现为靶向体内正常器官或组织的炎性或自身免疫性不良事件,最常见的症状出现在皮肤、内分泌系统、胃肠道、肝脏和心脏[3]。
随着PD-1 抑制剂的逐渐应用,发生率较低的神经系统不良反应逐渐被进一步认知[4-6]。在应用此类药物时,早期识别不良反应,严重时予停药,并给予免疫抑制剂或其他相应药物处理尤为重要,在此过程中,临床药师与患者及家属的沟通、与医师护士的合作发挥着重要作用。
1 PD-1 抑制剂神经系统不良反应
近期meta 分析显示,免疫检查点抑制剂的外周神经系统1 ~5 级不良反应占比为5%,中枢神经系统3 ~5 级不良反应占比为0.46%[7]。神经系统不良反应的症状差异较大,如重症肌无力、外周神经病、非感染性脑膜炎、脑炎等(见表1)。外周神经病变一般相对较轻,中枢神经系统病变则通常较重;此外,不良反应发生时间差异较大且难以预测,疾病状况发展可能较快甚至致命。

表1 PD-1 抑制剂神经系统不良反应症状及发生率(%)Tab 1 Symptoms and prevalence of PD-1 inhibitor related neurologic adverse reactions (%)
1.1 外周神经不良反应
1.1.1 周围神经病 在一项纳入347 名患者的研究中[4],有4 人发生了不同表型的外周神经系统病变。外周神经病变常见症状包括感觉缺失或异常、反射消失、感觉性共济失调、麻木、疼痛等[8-9]。1 例黑色素瘤患者在使用10 个疗程的PD-1 抑制剂后,在胸腰段发生了4 级轴突多发性神经病,停药后使用泼尼松治疗,神经系统症状持续数周后缓解;1 例使用PD-1 抑制剂治疗黑色素瘤的患者发生严重的长度依赖性神经病变合并脱髓鞘病变,同样在停药并使用泼尼松治疗后症状缓解;另1 例使用PD-1 抑制剂治疗晚期腹膜间皮瘤的患者,在用药5 个周期后出现非对称性血管炎性周围神经病,停药后使用激素(甲强龙静脉注射后口服泼尼松)处理后症状缓解[4]。PD-1 抑制剂联合达拉菲尼(dabrafenib)的患者在治疗35 周后左侧臀部疼痛,随后发展为双腿虚弱,间歇性发烧和恶心,最终呈现特伦德伦堡步态。此患者MRI 排除脑和脊髓肿瘤转移,经高剂量泼尼松龙治疗后症状迅速改善[10]。
1.1.2 重症肌无力 使用PD-1 抑制剂可能导致重症肌无力,常见症状包括骨骼肌无力、易疲劳、眼皮下垂、视力模糊、抬头困难、严重时呼吸困难[4,8]。病例报告显示,1 例黑色素瘤患者在第3 次治疗后,迅速发生了眼球转动不灵活、呼吸困难等症状,其MRI 结果显示脑部没有肿瘤转移,其他生化学指标指示为免疫诱导性的重症肌无力。对于此例患者,仅靠高剂量糖皮质激素并不能缓解神经系统症状,进一步使用血浆置换术和溴吡斯的明处理后最终病情仍然进展[11]。
另一项大型回顾性研究表明,在9869 名使用PD-1 抑制剂的患者中,有12 名患者出现过重症肌无力(包括6 名男性和6 名女性),均发生在治疗后的早期阶段,并迅速恶化。在这12 名患者中,4 例有肌炎,3 例有心肌炎,其中1 例同时发生肌炎与心肌炎。激素疗法被用来处理神经系统并发症,预后结果显示有4 名患者缓解较差,且有2 名患者最终因为不良反应而死亡[12]。研究报道PD-1 抑制剂单药治疗或与CTLA-4(cytotoxic T-lymphocyte-associated protein 4)单抗联用的患者出现了重症肌无力的病例[13]。
1.1.3 吉兰-巴雷综合征 吉兰-巴雷综合征(Guillain-Barré syndrome,GBS)也被称为格林巴利综合征,是常见的周围神经和脊神经根的脱髓鞘病变,表现为感觉-运动障碍并伴随自主神经失调、腱反射减弱或消失,部分病例出现眼睑下垂或复视、吞咽或发声困难、呼吸困难等[5]。1 名黑色素瘤患者使用PD-1 抑制剂20 个疗程后,出现2 级脊髓神经根多发性神经元炎,表现为GBS,停药后静脉注射免疫球蛋白后缓解[4]。病例报告显示患者使用PD-1 抑制剂后,出现急性GBS 或者慢性炎症性的多发性神经根脱髓鞘病变[14]。GBS 与脱髓鞘的发病机制包括自身免疫,这表明PD-1 抑制剂的不良反应可能与调节免疫功能相关。
1.2 中枢神经系统不良反应
中枢神经系统不良反应包括自身免疫性脑炎、无菌性脑膜炎以及脊髓炎[15-16],通常较为严重,能达到3 ~5 级。单独基于临床症状,不能断定脑炎是否由免疫检查点抑制剂引起,患者可能会出现头痛、发烧、虚弱、疲劳、混乱、记忆困难、困倦、幻觉、癫痫发作以及颈部僵硬等,需深入分析以排除脑炎的其他潜在病因。因此,药师要密切关注患者情况,并与医护人员多讨论、沟通。
Williams 等[16]报道CTLA-4 单抗和PD-1 抑制剂联合治疗后,产生了2 例自身免疫性脑炎。2 例患者在PD-1 抗体注射几日内即出现自身免疫性脑炎,说明发生脑炎和使用免疫检查点抑制剂的时间间隔较短,表明两者之间有直接的关系。2 例患者在激素治疗后均有显著改善。另外,文献报道1 例黑色素瘤患者使用PD-1 单抗一年后,出现边缘性脑炎、进行性认知衰退,MRI 结果显示大脑边缘性结构改变,脑脊液检查发现白细胞计数增多以及蛋白水平升高[13]。
1.3 病理生理学机制
PD-1 抑制剂引起神经系统不良反应的病理生理学机制仍然不明,多种机制可能参与了病变过程[9]。正常情况下部分患者的自身免疫与免疫耐受相互平衡,自身免疫不会攻击机体自身,使用PD-1 抑制剂后平衡被打破,导致了临床上的自身免疫性疾病[17]。肿瘤新抗原与组织的正常抗原发生交叉反应,导致了免疫相关的不良反应[18];PD-1 抑制剂也可以直接靶向正常组织,引起抗体依赖性的毒性和补体介导的炎症。此外,机体本身存在的亚临床炎症、外界刺激、免疫检查点抑制剂的抗体暴露也是可能的机制。还有,细胞因子与PD-1 抑制剂可能诱导并放大T 细胞的炎症反应,并增加Th1/Th17 细胞的分化,促进白介素2、白介素7、白介素17、肿瘤坏死因子α的产生并减少Th2 细胞的白介素5、白介素13 的释放。
2 药学监护
由于神经系统不良事件可能会迅速发展并造成严重后果,因此药学监护至关重要[15]。临床药师需要对这些不良反应保持高度关注,笔者根据国内外指南以及临床实践,总结简单的临床处理方法,见表2[16-19]。神经系统不良反应异质性较高,发病状况可能有很大的不同,有些情况开始不明显并呈现不断变化的特点,部分严重的病变会在数天到数周内迅速进展。分级:1 级,轻度;2 级,中度;3 级,严重;4 级,危及生命;5 级,不良反应相关性死亡。分级标准为《常见不良反应评定标准(CTCAE_5.0)》。
2.1 PD-1 抑制剂神经系统不良反应评估
用药后,如果出现不良反应,首先,应精确排除肿瘤本身可能引起的神经系统症状,比如排除肿瘤压迫脊髓神经或者颅内转移灶[19];其次,详细观察出现的症状,比如晨轻暮重的乏力症状通常与神经肌肉接头相关;长度依赖性、感觉症状先于运动症状、缓慢渐进发展是外周神经病的症状;神经性肌炎症状包括四肢无力但感觉神经不受影响,累及眼部或呼吸系统,肌酸激酶升高(>1000 IU),肌电图正锐波;重症肌无力的症状通常包括视觉障碍,延髓、呼吸系统症状,单纤维肌电图震颤增加等;认知或意识状态改变多为中枢症状的脑炎,常伴发头痛、运动或感觉功能失调、失语、发热、脑脊液白细胞升高等[20]。血清学与电生理检查也很有必要,包括血细胞计数、血生化(肌酸激酶、乙酰胆碱受体、维生素B12、叶酸、铜等)、甲状腺功能、肌电图、神经传导功能、核磁共振等,能够辅助确定不良反应类型。在某些特定情况下,可以进行腰椎穿刺,白细胞计数来辅助确定症状是否为免疫介导的神经系统病变。
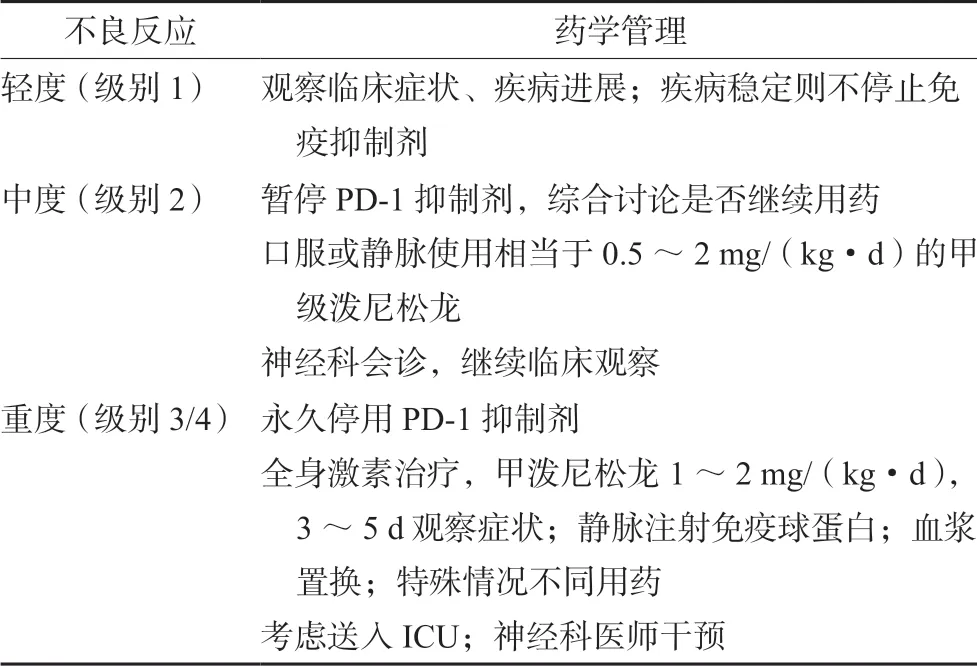
表2 PD-1 抑制剂神经系统不良反应的药学管理Tab 2 Pharmaceutical management of PD-1 inhibitor related neurologic adverse reactions
2.2 药学监护
系统性评估神经系统不良反应后,按照《常见不良反应评定标准(CTCAE_5.0)》标准,可将不良反应近似分为轻、中、重3 个级别,分别给予对应处理。在怀疑出现神经系统症状时,药师应该引起警惕。
2.2.1 PD-1 潜在神经毒性 出现PD-1 潜在神经毒性系统轻度不良反应时,可以暂时不用药物干预,需检测血常规、电解质、肝肾功能、维生素B12/叶酸、排除感染等,密切关注患者状况,如果症状进展则需使用激素治疗[19-20]。
2.2.2 PD-1 中到重度不良事件 如果怀疑有免疫相关的中到重度不良事件,应当迅速使用高剂量激素,0.5 ~2 mg·kg-1泼尼松龙(或等效药物)可能停止并逆转神经系统并发症[15]。鉴于PD-1抑制剂的半衰期长,激素必须在逐渐减量的情况下至少给予1 个月。如果发生严重的(3 级或4 级)神经毒性反应,应永久停用免疫检查点抑制剂。如果激素不足以对抗不良反应,必须考虑进一步用免疫球蛋白治疗(2 g·kg-1,连用5 d)、血浆置换术(2 周内共5 次)或免疫抑制剂英夫利昔单抗(5 mg·kg-1)[21]。怀疑中枢症状除应检查常规血生化外,还应进行MRI、腰椎穿刺等,完善NMDA 受体、CASPR2 等免疫学检测;外周不良反应鉴别则有神经电生理检测、心电监测、呼吸监测,肌酸激酶、乙酰胆碱受体、肌肉特异性激酶检测、肌肉活检等。中枢与外周症状处理方式类似,但也有所不同,比如在重症肌无力患者中,应当尽早使用溴吡斯的明(30 mg tid)或霉酚酸酯(500 mg bid)[20]。
2.2.3 不良反应的药学监护 PD-1 抑制剂神经系统症状的药物自身也可能引起不良反应。糖皮质激素是最常用的治疗PD-1 抑制剂神经系统不良反应的免疫抑制剂,长时间应用可能增加病原菌感染风险,发生糖代谢异常、类库欣综合征、骨质疏松和高凝状态等。临床药师在监护过程中,应关注这些额外的风险因素,避免迅速撤药。也有研究报道,可使用其他药物以及医疗技术治疗PD-1 抑制剂神经系统不良反应,如溴吡斯的明、人免疫球蛋白和血浆置换术等[4,11,15-16]。溴吡斯的明不良反应包括泌尿生殖系统、精神、胃肠道等;人免疫球蛋白不良反应涉及心悸、一过性头痛等。这些药物应用于患者时,应注意甄别。
2.3 停药管理
免疫相关不良事件的频率和严重程度可能是剂量依赖性的,并且可以预测免疫检查点抑制剂使用后的疗效[21-22]。然而,不良反应的发展常常会导致免疫检查点抑制剂治疗中断。值得一提的是,部分因为神经系统不良反应中断了治疗的患者,仍然对放疗敏感。目前,在使用免疫检查点抑制剂时,只有有限的数据可用于预测哪些患者可能发生严重不良事件[14]。
2.4 患者教育
PD-1 抑制剂为新一代抗肿瘤药物,在使用前应与患者充分沟通。应告知以下内容:① 药物名称、治疗时间周期、剂量、频次[23]。② 说明不良反应的类别、症状、发生和持续时间、是否能恢复,使其对发生程度和应对措施有充分认知。③ 出现神经症状时患者的自我管理:家属和照护者的陪护;不良反应的自我监测;出现症状后及时与药师、医护人员沟通。这些症状包括输液相关的过敏反应如头晕、心悸、呼吸困难等;消化道如腹泻、腹痛、血便、黏液便、黑便等;肺部如咳嗽、咳血、呼吸困难、胸痛等;肾脏如尿液颜色、尿量改变、血尿、腰痛、下肢水肿等;肝脏如巩膜和皮肤黄疸、白便或黏土色便;甲状腺如畏冷畏热、体质量异常增减等;皮肤如瘙痒、皮疹、水泡等;以及前文所述的中枢、外周神经系统症状。④ 患者对新药的期望值较高,应与患者、家属沟通此类药物在相应疾病中的临床治愈率;晚期肿瘤患者也存在恐惧、绝望等负面情绪,临床药师应充分与患者和家属沟通,解决出现的问题,提升人文关怀。
3 讨论
尽管临床益处明显,但免疫检查点抑制剂伴随着免疫相关独特的不良反应。随着这些药物获批适应证的增加,越来越多的患者使用此类药物,不良反应也增多。肿瘤患者在接受PD-1 抑制剂治疗时,有发生神经系统并发症的风险。应注意药物不良反应和疾病本身进展以及其他潜在原因的排除和鉴别。
临床药师进行药学监护实践中,管理患者不良反应包括以下流程:
① 熟悉神经系统不良反应:主要包括免疫介导性多发性神经病、GBS、重症肌无力、可逆性脑病综合征、无菌性脑膜炎、肠神经病变、横贯性脊髓炎以及免疫性脑炎等。
② 确定特殊人群:患者基本情况、免疫疾病史、肿瘤特征、感染状态、是否高龄等。
③ 掌握处理方法:主要有口服或者全身皮质类固醇激素、免疫球蛋白、英夫利昔单抗、溴吡斯的明疗法,以及血浆置换术等。
④ 跟踪随访:神经系统不良反应种类较多,出现的时间各异,应结合患者状态以及实验室和影像学检查,密切与患者沟通,综合判断出现的不良反应,与其他药物联合治疗可能出现的不良反应进行区别。
临床药师必须在整个药学监护的过程中保持警惕,甚至在治疗完成后一段时间内也不能掉以轻心,每3 个月进行一次综合评估。

