circ_0003159 对胃癌细胞增殖、侵袭和迁移能力的影响及机制研究
邰小华 冯联忠 章波 张斌忠 李斌 王胤达
近年来,circRNAs 被广泛报道其作为促癌基因或抑癌基因,与多种恶性肿瘤的发生、发展进程密切相关[1],例如circ_OSBPL10[2]、circ_006100[3]和circ_SERPINE2[4]可促进胃癌细胞增殖、侵袭和迁移。Tian 等[5]研究发现,circ_0003159 在胃癌组织中低表达,且低表达circ_0003159 与胃癌转移和肿瘤大小呈正相关。此外,circRNA-miRNA-mRNA 调控网络参与调控多种恶性肿瘤细胞的恶性生物学行为[6]。starBase 数据库显示,miR-32-5p 作为促癌基因以及circ_0003159 的潜在靶基因之一,在多种恶性肿瘤组织中高表达[7-8]。同时,第10 号染色体缺失的磷酸酶及张力蛋白同源基因(phosphate and tension homology deleted on chromsome ten,PTEN)作为miR-32-5p 的潜在靶基因之一,过表达PTEN 可显著抑制肿瘤细胞的生物学行为[9]。然而,目前circ_0003159/miR-32-5p/PTEN 分子轴调控胃癌细胞增殖、侵袭和迁移的作用机制尚未见报道。因此,本研究拟探讨circ_0003159 对胃癌细胞增殖、侵袭和迁移的影响以及其潜在作用机制,以期为胃癌早期诊断和临床治疗提供潜在的生物分子靶点。
1 材料和方法
1.1 材料 选取2015 年6 月至2018 年12 月嘉兴市第二医院肿瘤外科经手术切除的30 例患者的胃癌组织和配对的癌旁组织(距离肿瘤≥5 cm)。纳入标准:(1)经X 线钡餐、腹部超声、螺旋CT 与正电子发射成像、肿瘤标志物以及病理学检查确诊为胃癌;(2)术前未经放疗、化疗以及免疫治疗;(3)患者没有其他的重大疾病。手术前均告知患者并签署知情同意书,本研究经本院医学伦理委员会批准。
1.2 细胞和主要试剂 人胃癌细胞系(BGC823、AGS、MKN45)以及人胃黏膜上皮细胞GES-1 均购自中国科学院上海细胞库;细胞培养基DMEM(500 ml,批号:11965-092)、胰蛋白酶(500 ml,批号:25200072)和FBS(500 ml,批号:10100)均购自美国Gibco 公司;青霉素和链霉素均购自上海碧云天生物技术有限公司(100 ml,批 号:C0222);Trizol 试 剂 购 自 美 国Invitrogen 公 司(200 ml,批号:15596018);circ_0003159 模拟物(pcDNA3.1-circ_0003159)、空载体阴性对照物(pcDNA3.1-NC)、miR-32-5p 模拟物(miR-32-5p mimic)及空载体对照物(mimic-NC)均购自上海吉玛制药技术有限公司;LipofectamineTM3000 购自北京BioTeKe 公司(批号:BP2041);逆转录试剂盒购自江苏凯基生物技术有限公司(批号:KGA1311);CCK-8 试剂盒购自日本Dojindo公司(批号:CK04);Transwell 小室(批号:3422)和Matrigel(批号:354234)均购自美国康宁公司;兔抗人PTEN(批号:9188)、β-actin 单克隆抗体(批号:4970)和辣根过氧化物酶(HRP)山羊抗鼠IgG(批号:7077)均购自美国Cell signaling Technology 公司;BCA 蛋白定量试剂盒购自美国Thermo 公司(1 000 ml,批号:23229);双荧光素酶报告基因试剂盒购自美国Promega 公司(批号:LF103)。
1.3 细胞培养、转染和分组 采用含有10%FBS 和双抗(100 U/ml 青霉素和100 μg/ml 链霉素)的DMEM 培养人胃癌细胞系和人胃黏膜上皮细胞,置于37 ℃、5%CO2的培养箱中培养。待BGC823 细胞生长密度达到80%时,采用胰酶消化细胞,并将收集到的细胞于2×105个/孔的浓度接种到6 孔板中,同时将BGC823 细胞分为以下组别:circ_0003159 超表达组(转染pcDNA3.1-circ_0003159)、阴性对照组(转染pcDNA3.1-NC)、过表达miR-32-5p 组(转染miR-32-5p mimic)及对照组(转染mimic-NC)。转染时严格参照LipofectamineTM 3000试剂说明书进行操作,并将上述载体转染于细胞中,并继续培养6 h 后,更换正常培养基DMEM 继续培养48 h后用于后续实验。
1.4 circ_0003159、PTEN 和miR-32-5p 的相对表达水平检测 采用qRT-PCR 法。收集人胃癌组织、癌旁组织、生长对数期胃癌细胞BGC823、AGS、MKN45 以及正常胃黏膜上皮细胞GES-1,采用TRIzol 提取组织和细胞中总RNA,并采用NanoDrop 检测RNA 的浓度。随后,采用一步法逆转录试剂盒将RNA 反转录为cDNA,严格按照qPCR 试剂盒说明书检测circ_0003159 和miR-32-5p 的mRNA 表达水平,以U6 作为miR-32-5p 的内参,以及GAPDH 作为circ_0003159 和PTEN 的内参。circ_0003159 上游引物为5'-ACTGGGAATGGAGGAAGA-3',下游引物为5'-TGAGAAAGGATTGAGGGAAAAG - 3' ;GAPDH 上 游 引 物 为5' - AAGCCACCC-CACTTCTCTCTAA-3',下游为5'-AATGCTATCACCTCCCCTGTGT -3';PTEN 上 游 引 物 为 5' -ACCAGTGGCACTGTTGTTTCAC-3',下游引物为5'-TTCCTCTGGTCCTGGTATGAAG-3';miR-32-5p 上 游 引 物 为5'-CGGTATTGCACATTACTAAGTTGCA-3',下游引物为5'-CTCGCTTCGGCAGCACA-3';U6 上游引物为5'-CTCGCTTCGGCAGCACA-3',下游引物为5'-AACGCTTCACGAATTTGCGT-3'。
1.5 细胞增殖能力检测 采用CCK-8 法。将转染后的circ_0003159 超表达组和阴性对照组中BGC823 细胞消化制成单细胞悬液,以2×104个/孔的浓度接种于96孔板中,并在没孔中加入100 μl DMEM 培养基,每组设置6 个复孔。置于37 ℃、5%CO2的培养箱中培养0、24、48和72 h 后,向每孔中加入10 μl CCK-8 溶液(0.5 mg/ml)后继续于培养箱中孵育4 h 后,采用酶标仪检测450 nm处的每孔光密度(OD450)值,并计算平均值。
1.6 细胞侵袭和迁移能力检测 采用Transwell 小室试验。将转染后的circ_0003159 超表达组和阴性对照组中BGC823 细胞以1×105个/孔的浓度接种于Transwell 小室上室,下室加入500 μl DMEM 培养基后常规培养24 h。培养激素后采用1%结晶紫染色20 min,并于光学显微镜下随机选择5 个视野计算侵袭和迁移细胞数,并计算平均值。对于侵袭实验,Transwell 小室上室需采用Matrigel 胶包被,其他实验与迁移实验步骤一致。
1.7 双荧光素酶报告基因检测 收集对数期生长期的过表达miR-32-5p 组和对照组中BGC823 细胞,以1×106个/ml 的浓度接种于12 孔板中,待细胞汇合度达到70%时,采用LipofectamineTM3000 转染试剂,将miR-32-5p mimic 转染至过表达miR-32-5p 组,将mimic-NC转染至对照组,另外将pGL3 空白质粒、circ_0003159 3'-UTR 突变型(MUT)质粒或PTEN 3'-UTR MUT 质粒、circ_0003159 3'-UTR 野生型(WT)质粒或PTEN 3'-UTR WT 型质粒共转染至两组细胞,常规培养36 h。加入细胞裂解液裂解细胞,并于4 ℃、12 000 r/min 离心10 min,取上清液进行荧光素酶活力值检测。
1.8 PTEN 蛋白相对表达水平检测 采用Western blot法。采用RAPI 裂解液提取过表达miR-32-5p 组和对照组BGC823 细胞中的总蛋白。随后,根据BCA 试剂盒说明书检测提取到的蛋白质浓度。然后,进行10% SDSPAGE 分离蛋白、电转膜法将目的条带转移至PVDF 膜上、以5%脱脂奶粉室温封闭1 h。其次,分别加入兔抗人PTEN(1∶1 000)和β-actin 单克隆抗体(1∶1 000),4 ℃孵育过夜。之后,加入HRP 标记的山羊抗鼠IgG(1∶2 000)室温孵育2 h。最后,进行ECL 染色,凝胶成像仪采集图像;通过Image J 分析灰度值。
1.9 统计学处理 采用SPSS 22.0 统计软件,并采用GraphPad Prism 8 对实验数据进行绘图。计量资料以表示,两组间比较采用两独立样本t 检验,多组间比较采用单因素方差分析,两两比较采用SNK-q 检验。P<0.05 差异有统计学意义。
2 结果
2.1 人胃癌组织及其癌旁组织中circ_0003159、PTEN和miR-32-5p 相对表达水平比较 胃癌组织中circ_0003159 和PTEN 的相对表达水平均明显低于癌旁组织(均P<0.05),但胃癌组织中miR-32-5p 的相对表达水平明显高于癌旁组织(P<0.05),见表1。

表1 circ_0003159、PTEN 和miR-32-5p 在胃癌组织及其癌旁组织中相对表达水平比较
2.2 4 种细胞中circ_0003159 相对表达水平比较 胃癌细胞系BGC823、AGS、MKN45 中circ_0003159 的相对表达水平均明显低于正常胃黏膜上皮细胞GES-1(均P<0.05),且BGC823 细胞中circ_0003159 的相对表达水平最低,见表2。

表2 4 种细胞系中circ_0003159 相对表达水平比较
2.3 两组转染细胞增殖能力比较 相比于阴性对照组,circ_0003159 超表达组在48、72 h 时OD450 均明显下调,差异均有统计学意义(均P<0.05),见表3。
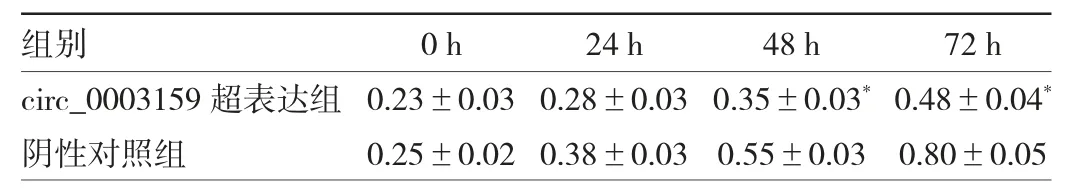
表3 两组转染细胞增殖能力比较
2.4 两组转染细胞侵袭和迁移能力比较 与阴性对照组比较,circ_0003159 超表达组中细胞侵袭数和迁移数均明显减少,差异均有统计学意义(均P<0.05)。见表4。

表4 两组转染细胞的侵袭和迁移能力比较(个)
2.5 circ_0003159 和miR-32-5p 靶基因预测及验证 预测结果可知miR-32-5p 为circ_0003159 潜在的靶基因,PTEN 是miR-32-5p 潜在的靶基因,见图1。荧光素酶报告基因实验结果显示,与对照组比较,过表达miR-32-5p 组中circ_0003159-MUT 和PTEN-MUT 相对活力值比较差异均无统计学意义(均P >0.05),而circ_0003159-WT 和PTEN-WT 相对活力值均明显下调,差异均有统计学意义(均P<0.05),见表5。

图1 靶基因预测结果(a:miR-32-5p 与circ_0003159;b:miR-32-5p 与PTEN;PTEN 为磷酸酶及张力蛋白同源基因)
2.6 两组转染细胞中PTEN 蛋白相对表达水平比较与对照组相比,过表达miR-32-5p 组中PTEN 蛋白相对表达水平明显下降(P<0.05),见表6、图2。
3 讨论
近年来,非编码RNA(circRNA、lncRNA 和miRNA)被广泛报道可作为包括胃癌在内的多种恶性肿瘤发生、发展的分子标志物[10],例如circ_0000467[11]、circ_0000592[12]和circ_0000190[13]可作为胃癌早期诊断的生物标志物。同时,多种circRNAs 通过调控癌细胞增殖、侵袭和迁移,从而介导肿瘤的发展进程[14]。例如,Liu等[15]研究表明,circ_0009910 在胃癌组织中高表达,且高水平的circ_0009910 与较差的生存期呈正相关;过表达circ_101882 可显著促进胃癌细胞侵袭、迁移和上皮间质转化[16];过表达circ_104916 可抑制胃癌BGC823 和MGC803 细胞增殖和转移[17];本研究亦发现,circ_0003159在胃癌组织和细胞系中低表达,过表达circ_0003159 可显著抑制胃癌BGC823 细胞增殖、侵袭和迁移能力。
circRNA 通过靶向结合下游miRNA 并介导mRNA参与调控肿瘤细胞增殖、侵袭和迁移。Wang 等[18]研究发现,circ_EIF4G3 可通过靶向下调miR-335 促进胃癌细胞增殖、侵袭和迁移。Li 等[19]研究证实,circ_0056618 可通过下调miR-206 的表达,进而抑制胃癌增殖和转移。Sun 等[20]研究表明,circ_SFMBT2 可通过靶向下调miR-182-5p 对CREB1 表达的抑制作用,进而促进胃癌细胞增殖。胃癌组织和细胞中低表达的circ_0027599 和PHDLA1 竞争性结合miR-101 促进胃癌细胞增殖和转移[21]。本研究结果表明,circ_0003159 通过靶向下调miR-32-5p 对PTEN 表达的抑制作用,可抑制BGC823细胞增殖、侵袭和迁移能力。此外,miR-32-5p 被报道在多种恶性肿瘤中其作为促癌基因,通过敲降miR-32-5p可显著抑制肿瘤细胞增殖、侵袭、迁移和诱导细胞凋亡[9,22]。Yan 等[23]研究发现,过表达miR-32-5p 可促进胃癌细胞增殖、侵袭和迁移能力。本研究发现,miR-32-5p在胃癌组织中高表达。

表5 两组细胞荧光素酶相对活力值比较

表6 两组细胞PTEN 蛋白相对表达水平比较
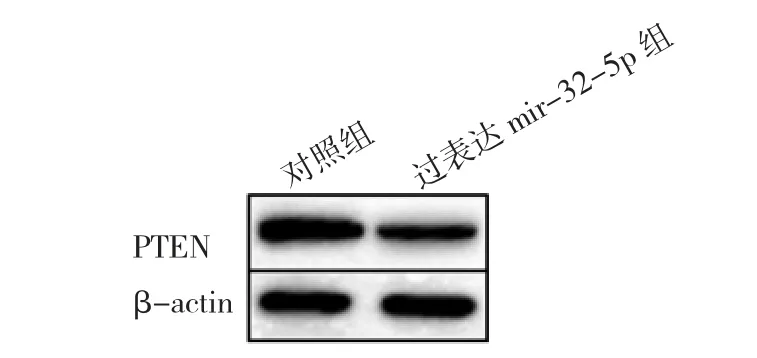
图2 2 组细胞PTEN 蛋白表达的电泳图(PTEN 为磷酸酶及张力蛋白同源基因)
大量研究证实,PTEN 作为抑癌基因在多种肿瘤组织和癌细胞系中低表达[24-25]。过表达PTEN 可抑制肿瘤细胞增殖、侵袭和迁移以及诱导细胞凋亡,从而介导肿瘤的发展进程[26]。此外,也有研究证实,PTEN 可通过阻断PI3K/Akt 通路抑制恶性肿瘤细胞生物学行为[27],例如Liu 等[28]研究表明,PTEN 通过阻断PI3K/Akt 通路抑制乳腺癌细胞侵袭和迁移能力。Gao 等[9]研究证实,miR-32-5p 通过靶向PTEN 促进胰腺癌细胞增殖、侵袭和迁移能力。同时本研究亦证实PTEN 可作为miR-32-5p的靶基因。
综上所述,本研究证实circ_0003159 在胃癌组织和细胞中低表达,过表达circ_0003159 可显著抑制胃癌细胞增殖、侵袭和迁移能力。同时,circ_0003159 可通过靶向下调miR-32-5p 对PTEN 的表达。希望通过本研究可以为临床上治疗胃癌提供潜在的分子标志物及实验依据。

