人参皂甙Rg3对人喉鳞癌细胞中SIX1和TGF-β诱导上皮-间质转化的作用研究
张继华,张皓蕾,刘玲玲,王 燕,王 来
(河北医科大学第一医院,河北 石家庄 050031)
人参皂甙Rg3是一种新近研究发现的抗肿瘤中药单体,其有抑制肿瘤细胞增殖、分裂、局部浸润及远处转移等作用[1],但其具体作用机制尚不明确。在恶性肿瘤局部浸润和远处转移过程中,上皮-间质转化起着重要作用,上皮-间质转化过程是由多个信号传导途径触发和调控的,这些信号途径能够对细胞外的刺激产生应答而被激活,其中TGF-β途径被认为是最重要的途径之一[2-3]。以往研究表明,SIX1同TGF-β相互作用能促进多种恶性肿瘤细胞淋巴结的转移[4],但具体作用机制以及对恶性肿瘤细胞上皮-间质转化的影响尚不明确,三者在人喉鳞癌中的相互作用仍少见报道。本研究通过培养原代人喉鳞癌细胞,观察了人参皂甙Rg3在抑制人喉鳞状细胞癌上皮-间质转化中的作用,并以SIX1、TGF-β为切入点,探讨其具体的作用机制,为人喉鳞状细胞癌的临床治疗提供理论参考。
1 实验材料与方法
1.1实验细胞 取术中留存的人喉鳞状细胞癌组织,河北医科大学第一医院耳鼻咽喉实验室自行原代细胞培养。
1.2药物 Rg3(20R,标准品,中国药品生物制品检定所,样品批号:110804-200301,样品纯度98%),使用前应用二甲基亚砜(DMSO)助溶,抽虑方法除菌后-20 ℃冰箱保存。顺铂(注射用,冻干型,齐鲁制药有限公司出品,产品批号:04090251),试验前用0.9%氯化钠注射液配成相应浓度,-20 ℃冰箱保存。
1.3试剂 SIX1免疫组化用多克隆抗体,武汉博士德公司,工作浓度为1∶75。TGF-β免疫组化用多克隆抗体,武汉博士德公司,工作浓度均为1∶55。E-cadherin免疫组化用多克隆抗体,北京奥维亚生物技术有限公司,工作浓度为1∶50。免疫组化用SP染色试剂盒、DAB显色用试剂,北京中杉金桥公司。转染用SIX1和TGF-β试剂盒,美国Invitrogen公司。
1.4主要仪器 GeneAmp PCR system9600仪(美国Perkin Elmer公司),二氧化碳MCO175型培养箱(日本三洋公司),洁净工作台JJT-2型(北京半导体设备厂),倒置相差显微镜CX-PC-2型(日本OLYMPUS公司),GDS-8000凝胶成像分析系统(美国UVP)。
1.5实验方法
1.5.1原代人喉鳞癌细胞培养 手术留取人喉鳞癌组织,置4 ℃的0.9%氯化钠注射液中无菌保存,留取的组织块尽快转移至实验室超净台,进行如下处理并原代细胞培养:修剪留取新鲜、正常肿瘤组织,庆大霉素杀菌处理15 min,0.9%氯化钠注射液冲洗2次,将组织块剪碎(初步使组织块分离成单细胞),庆大霉素液冲洗2次,0.9%氯化钠注射液冲洗2次,加入I型胶原酶消化1 h,每间隔10 min进行1次吹打混合,促进喉癌组织块分解成单个肿瘤细胞。消化结束后,0.9%氯化钠注射液冲洗细胞混合液2次,加入细胞培养液,内含20%胎牛血清,将细胞悬浊液接种于6孔灭菌细胞培养板,上述接种的细胞转移至培养箱,常规培养48 h。取出培养板,培养孔内加入消化用胰蛋白酶,利用杂质细胞(成纤维细胞为主)与喉鳞癌肿瘤细胞对胰蛋白酶消化作用不同而出现不同细胞脱离培养板底壁时间差异,去除杂质细胞。反复进行上述纯化,直至得到纯化的肿瘤细胞。待其稳定传代后,对培养细胞进行鉴定(2名副高以上职称病理科医生共同鉴定)并确认为鳞癌细胞后,扩增细胞,进行试验。
1.5.2试验细胞分组 原代人喉鳞癌细胞分为对照组、顺铂组、Rg3组。顺铂组人喉鳞癌细胞内加入顺铂,使其终浓度为3 μg/mL;Rg3组人喉鳞癌细胞内加入Rg3,使其终浓度为300 μg/mL(参考文献[5],顺铂3 μg/mL与Rg3 300 μg/mL对人喉鳞癌细胞的抑制率无差异)。处理后继续培养细胞24 h,收集、处理、备用。
1.5.3SIX1、TGF-β及E-cadherin蛋白表达免疫组织化学法检测 消化原代人喉鳞癌细胞,用细胞培养液配制细胞悬液,使其浓度为1×105个/mL, 取24孔细胞培养板,板内置已灭菌玻璃片,每组设6孔,向孔内的灭菌玻璃片上接种肿瘤细胞,每孔接种上述细胞悬液1滴。培养板转移入细胞培养箱,常规培养4 h,倒置显微镜下观察细胞生长情况,待玻璃片上细胞达80%以上已经贴壁,向培养板每孔内加约1 mL DMEM培养液。培养箱中培养48 h,培养板内肿瘤细胞已达80%~90%%汇合,取出培养板,PBS溶液冲洗1次,甲醛溶液固定10 min,PBS溶液冲洗2次,每次5 min。留取玻璃片上爬片细胞,参照免疫组化试剂盒说明,进行爬片细胞免疫荧光染色,盖玻片封存,镜检。 结果判断采用半定量双评分法,倒置荧光显微镜高倍镜视野下根据阳性细胞所占比例以及细胞绿色荧光强度进行综合判定。表达强度评分标准:未见荧光或者仅见极弱荧光, 记0分;荧光微弱但明显可见,记1 分;荧光可见且光色明亮,记2分;荧光可见且光色闪亮, 记3分。高倍镜下视野内阳性细胞比例:阳性细胞比例<25%,记0分;阳性细胞比例25%~50%,记1分;阳性细胞比例51%~75%,记2分;阳性细胞比例>75%,记3分。两种方法所得评分和0~1分为目的蛋白阴性(-),2 分为目的蛋白弱阳性(+),3~4分为目的蛋白阳性(),5~6分为目的蛋白强阳性()。
1.5.4SIX1、TGF-β和E-cadherin蛋白表达Western blot检测 参照试剂盒说明书,提取样本蛋白,制备Western blot检测样品,检测各组样品蛋白浓度,常规上样,配制选用12%分离胶以及4%浓缩胶,每组样品上样量65 μg,同时设置Marker预染蛋白,100 V电泳约1 h 25 min,转膜30 V,0.9 mA过夜。洗膜,定影后进行图像分析。
1.5.5SIX1、TGF-β及E-cadherin mRNA表达RT-PCR检测 Trizol法提取样本肿瘤细胞总的RNA,检测各组样本细胞浓度,确定样本细胞RNA完整,cDNA反转录合成,取转录产物2 μL进行PCR反应。GAPDH:上游5’-GAC AGT CAG CCG CAT CTTCT-3’,下游5’-TTA AAA GC AGC CCT GGT GAC-3’;SIX1:上游5’-CCACTAGAAGAGGAATT-3’,下游5’-CACGCCGGAGCCAAACT-3’,产物大小254 bp,退火温度56.3 ℃;TGF-β:上游5’-CTGTAATTCTGCTGTAATA-3’,下游5’-GGCTTAGTATTCTGGGAAA-3’,产物大小287 bp,退火温度54.2 ℃;E-cadherin:上游5’-AGGCCAAGCAGCAGTACATT-3’,下游5’-ATTCACATCCAGCACATCCA-3’,产物大小为288 bp,退火温度为56.6 ℃。反应条件:94 ℃变性1 min,57 ℃复性1 min,75 ℃延伸1 min,共设计32个循环,最后设计75 ℃延伸10 min。以GAPDH的荧光表达量作为检测基因表达参照量。
2 结 果
2.13组人喉鳞癌细胞中SIX1、TGF-β及E-cadherin蛋白表达免疫组化染色表现 对照组SIX1、TGF-β蛋白强阳性表达,E-cadherin蛋白弱阳性表达;顺铂组SIX1和E-cadherin蛋白阳性表达,TGF-β蛋白强阳性表达; Rg3组SIX1蛋白弱阳性表达,E-cadherin和TGF-β蛋白强阳性表达。见图1。
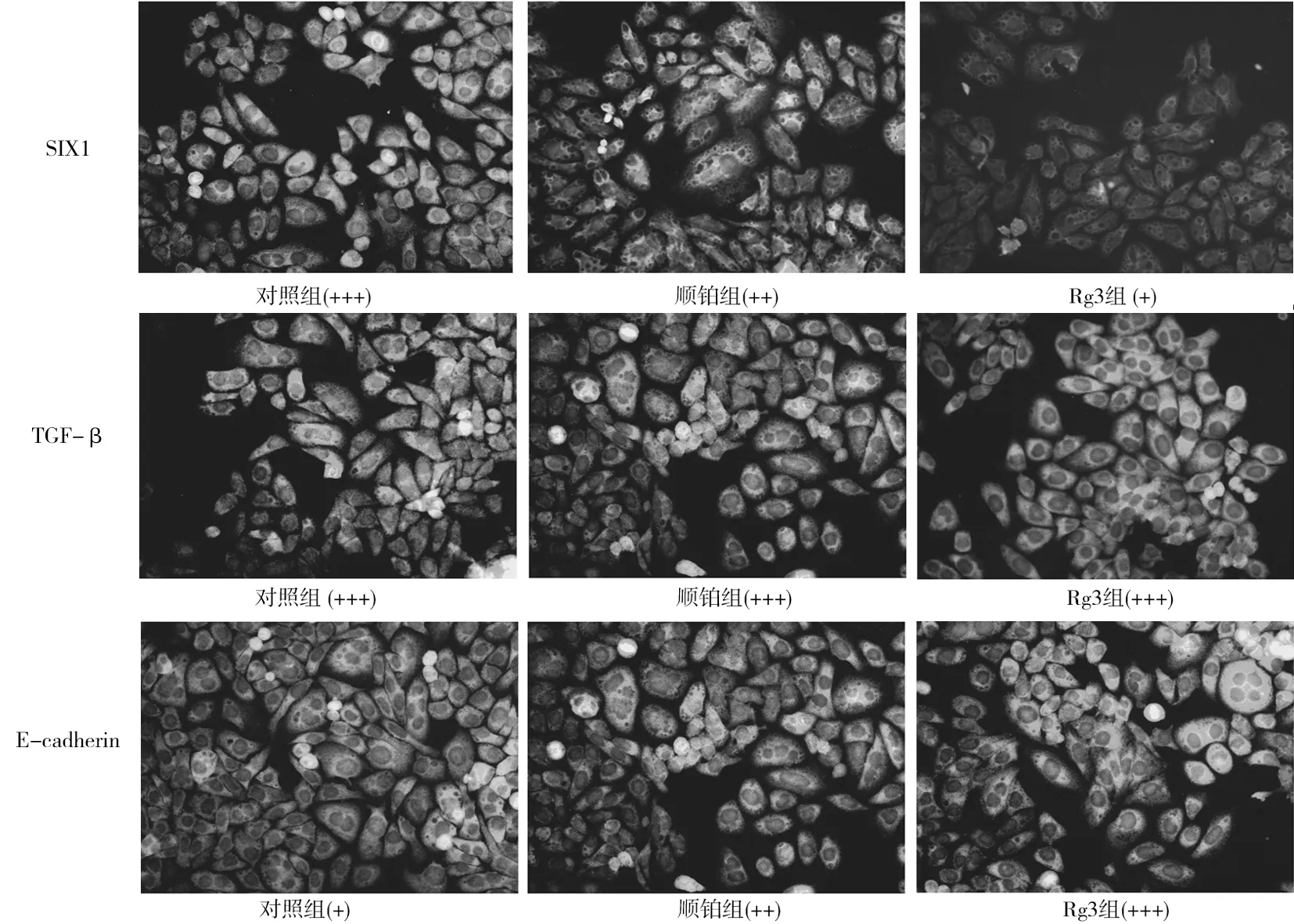
图1 3组人喉鳞癌细胞中SIX1、TGF-β及E-cadherin蛋白表达免疫组化染色表现(×200)
2.23组人喉鳞癌细胞中SIX1、TGF-β及E-cadherin蛋白表达水平 顺铂组及Rg3组SIX1蛋白表达水平均明显低于对照组(P均<0.05),且Rg3组明显低于顺铂组(P<0.05);顺铂组及Rg3组E-cadherin蛋白表达水平均明显高于对照组(P均<0.05),且Rg3组明显高于顺铂组(P<0.05); 3组间TGF-β蛋白表达水平比较差异均无统计学意义(P均>0.05)。见表1。
表1 各组人喉鳞癌细胞中SIX1、TGF-β及E-cadherin蛋白表达水平比较
2.33组人喉鳞癌细胞中SIX1、TGF-β及E-cadherin mRNA表达情况 顺铂组及Rg3组SIX1 mRNA表达水平均明显低于对照组(P均<0.05),且Rg3组明显低于顺铂组(P<0.05);顺铂组及Rg3组 E-cadherin mRNA表达水平均明显高于对照组(P均<0.05),且Rg3组明显高于顺铂组(P<0.05); 3组间TGF-β mRNA表达水平比较差异均无统计学意义(P均>0.05)。见表2及图2。
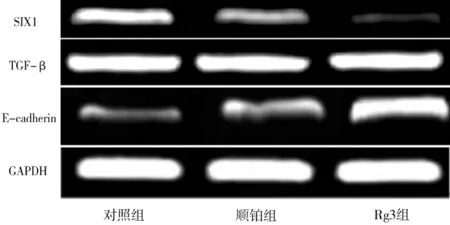
图2 3组人喉鳞癌细胞中SIX1、TGF-β及E-cadherin mRNA表达情况
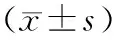
表2 各组人喉鳞癌细胞中SIX1、TGF-β及E-cadherin mRNA表达水平比较
3 讨 论
上皮-间质转化是指肿瘤上皮细胞在一定的环境及相应转化因子等共同因素的相互影响下逐步转变成间质细胞的现象,是恶性肿瘤细胞生长、转变的过程之一,同恶性肿瘤细胞的局部浸润及远处淋巴结转移紧密相关。上皮-间质转化的过程主要表现为原肿瘤上皮细胞极性逐渐消失,上皮细胞与其周围其他细胞的接触相应减少,细胞间的连接包括黏附连接及紧密连接减少,使得细胞脱离的机会增加,易于发生局部浸润及发生远处迁移,上皮-间质转化的发生会出现原有上皮细胞表型的转变,其上皮表型如E- eadherin、角蛋白丝等消失,间质表型、纤维连接蛋白、N-钙黏素等逐渐形成。其中代表细胞间黏附力的E-cadherin表达下降是上皮-间质转化的主要表现,也被视为上皮-间质转化的标志[6]。相关实验研究表明,上皮-间质转化可诱导多种恶性肿瘤细胞如卵巢癌、肝癌、结肠癌及恶性黑色素瘤等局部浸润和淋巴转移[7-10]。因此,上皮-间质转化被认为是多种恶性肿瘤转移潜能的标志。
上皮-间质转化的过程是由多个信号传导通路触发和调控的,TGF-β能够通过MAPK通路、SMAD通路及Wnt通路等途径对肿瘤的浸润及转移进行调节,在多种肿瘤组织如肺癌、乳腺癌、大肠癌等中均存在TGF-β的高表达,其表达强度与肿瘤的病理分化、淋巴转移及预后密切相关[11-12]。TGF-β能够被细胞中的多种活性因子激活,并与这些因子共同作用,激活及影响细胞内多种传导通路,但肿瘤细胞中转录因子的高表达能否增强TGF-β途径在诱导人喉鳞癌上皮-间质转化过程中的作用尚不清楚。
SIX1是一种成熟相关的细胞因子,在发育成熟的细胞内很少表达,但其在多种恶性肿瘤如卵巢癌、乳腺癌、肝细胞癌等组织中呈现出高表达,能够影响Cyclin A1、Cyclin D1及Ezrin 等多种下游编码基因的表达,与肿瘤的预后密切相关[13-15]。最近研究证明,SIX1 能够与TGF-β共同作用,并通过SMAD2/3途径调节血管内皮生长因子(VEGF)等多种基因的表达,进而发挥其促进肿瘤细胞淋巴结转移的功能。基于以上研究结果,本研究探讨了SIX1与TGF-β是否在人喉鳞癌细胞上皮-间质转化的过程中起着促进作用。
本实验结果显示,顺铂组及Rg3组人喉鳞癌细胞中SIX1蛋白及其mRNA表达较对照组明显下调,E-cadherin蛋白及其mRNA表达较对照组明显上调,TGF-β蛋白及其mRNA表达无明显变化,说明顺铂及Rg3能够通过抑制人喉鳞癌细胞中SIX1的表达,进一步抑制喉鳞癌细胞的上皮-间质转化。Sun等[16]的研究结果显示,TGF-β能够通过SMAD2/3途径促进卵巢癌细胞上皮-间质转化,而此过程是SIX1依赖性的,SIX1表达降低能够抑制TGF-β促卵巢癌上皮-间质转化的发生,SIX1蛋白的表达同E-cadherin表达呈负相关。本研究结果与之相似,推测TGF-β能够通过SMAD2/3途径促进喉鳞癌细胞上皮-间质转化发生,这一过程亦是SIX1依赖性的。本研究还发现,Rg3组人喉鳞癌细胞中SIX1蛋白及其mRNA表达水平明显低于顺铂组, E-cadherin蛋白及其mRNA表达水平明显高于顺铂组,提示Rg3抑制人喉鳞细胞上皮-间质转化的作用强于顺铂,其原因可能同Rg3有更强的抑制喉鳞癌细胞内SIX1表达作用有关。
综上所述,人参皂甙Rg3能够通过下调SIX1表达起到抑制人喉鳞癌细胞上皮-间质转化的作用,且作用强于顺铂,其可以作为抑制喉癌淋巴转移的一个新型用药,但Rg3抑制肿瘤细胞内SIX1表达及SIX1、TGF-β与E-cadherin之间的具体作用机制尚待进一步研究。
利益冲突:所有作者均声明不存在利益冲突。

