紫草素通过调控Hippo-YAP信号通路对咪喹莫特诱导银屑病小鼠保护作用的研究
张 凡,王星星,朱新景,景慧玲,王绾江
(1. 陕西中医药大学,陕西 咸阳 712000;2. 陕西省西安市中医医院,陕西 西安 710016)
银屑病是一种常见的易于反复发作的慢性炎症性皮肤病,病程长,可累及皮肤、毛发、指趾甲等部位,临床表现多种多样,主要表现为瘙痒、鳞屑和红斑,可并发自身免疫病、代谢综合征、心血管疾病、肿瘤及心理、精神类疾病[1]。银屑病的治疗尚未有明确的特效药,主要是使用免疫抑制剂、皮质类激素和维A酸类等,但是不能长期使用,且治疗效果因人而异。中医认为银屑病是由于素体血中蕴热,复感风热毒邪,或恣食腥发动风之物,或情志内伤,五志化火,两阳相合,内不能疏泄,燔灼血液,充斥肌肤,“血分有热”是银屑病的主要发病原因,清热凉血法是治疗银屑病的主要方法。紫草首载于《神农百草经》,具有清热解毒、凉血止血、透疹发斑作用[2],是治疗银屑病的常用药物之一,既可单味药使用,又可与其他药物配伍使用,既能内治又可外用,临床疗效肯定。紫草素是紫草的主要有效成分,现代药理研究认为紫草素具有抗炎、抗肿瘤、抗过敏的作用[3-5],但其治疗银屑病的作用机制尚不明确。本研究主要探讨紫草素通过调节皮肤基底的RAS含量干预Hippo-YAP 信号通路达到抗银屑病的作用。
1 实验材料与方法
1.1实验动物 25只SPF级BALB/C雄性小鼠,6~8周龄,体质量18~22 g,由三峡大学提供,动物许可证号:SYXK(鄂)2017-0012。小鼠饲养于SPF级动物实验中心,室温 22 ℃,整个实验期间允许动物自由采食、饮水,定期更换垫料,并给予12 h光照/12 h 黑暗循环。
1.2试剂与仪器 紫草素(Sigma,货号:S7576); 5%咪喹莫特乳膏(四川明欣药业有限责任公司,国药准字H20030128);凡士林(上海泽叶生物科技有限公司);IL-17、IL-22、TNF-αELISA试剂盒(伊莱瑞特);苏木素(Sigma,货号:H9627);伊红Y(水溶性)(国药集团,货号:71014544); Trizol(Ambion);HiScript Reverse Transcriptase (RNase H)(VAZYME);5×HiScript Buffer(VAZYME); Ribonuclease Inhibitor(TransGen);dNTP(TIANGEN);50×ROX Reference Dye 2(VAZYME);SYBR Green Master Mix(VAZYME);Taq Plus DNA Polymerase(TIANGEN);DL2000 DNA Marker(TIANGEN);Random Primer(N6)(TAKARA)。病理切片机,切片刀,组织摊烤片机,显微镜,离心机,电热恒温培养箱,FlexStation 3多功能酶标仪,电热恒温鼓风干燥箱,实时荧光定量PCR仪,荧光定量PCR管,PCR仪,紫外分析仪。
1.3分组、造模及干预 取BALB/C雄性小鼠25只,随机分为正常组、模型组、紫草素高浓度组、紫草素中浓度组、紫草素低浓度组,每组5只。小鼠戊巴比妥(80 mg/kg)腹腔注射麻醉,背部剃毛面积约3 cm×5 cm。正常组:每日定时在小鼠裸露处皮肤均匀涂抹纯凡士林,1次/d,连续7 d;模型组:外涂5%咪喹莫特乳膏,1次/d,42 mg/次,连续7 d;紫草素高浓度组:外涂5%咪喹莫特乳膏,1次/d,42 mg/次,同时给予80 mg/(kg·d)紫草素混悬液灌胃,连续7 d;紫草素中浓度组:外涂5%咪喹莫特乳膏,1次/d,42 mg/次,同时给予40 mg/(kg·d)紫草素混悬液灌胃,连续7 d;紫草素低浓度组:外涂5%咪喹莫特乳膏,1次/d,42 mg/次,同时给予20 mg/(kg·d)紫草素混悬液灌胃,连续7 d。
1.4观察指标与方法
1.4.1体征观察 用数码相机记录每组小鼠的皮损变化,采用PASI评分标准对各组小鼠相应红斑、鳞屑及浸润程度进行评分(0分=无,1分=轻度,2分=中度,3分=重度,4分=极重度),最后将三者积分相加得到总积分,并依据银屑病皮损面积和疾病严重程度指数(PASI)评分,将各组小鼠积分取平均值后 绘制皮损积分趋势线,观察各组小鼠皮损的变化情况。
1.4.2组织病理学观察 各组小鼠干预结束后处死,取背部裸露皮肤,在生物组织脱水机中将皮损组织经乙醇脱水、透明剂透明和浸蜡,接着使浸透蜡的组织块包裹在石蜡块中,切片(厚度约4 μm)、烤片、脱蜡、Mayer氏苏木素染液染色和水溶性伊红染液染色,风干后中性树胶封片,显微镜下观察。
1.4.3皮损组织中IL-17、IL-22、TNF-α表达水平检测 取正常组、模型组、紫草素高浓度组小鼠皮损组织,用预冷的PBS冲洗,去除残留血液,称重后将组织剪碎。将剪碎的组织与PBS按1∶9的比例混合,加入玻璃匀浆器中,于冰上充分研磨。最后将匀浆液于5 000 r/min离心5~10 min,取上清液,按照TNF-α、IL-17、IL-22的ELISA试剂盒说明操作检测。
1.4.4皮损组织中RASSF1A、CXCL1、CXCL2、S100A7、YAP、TAZ mRNA表达水平检测 取-80 ℃冰箱中保存的新鲜冰冻正常组、模型组、紫草素高浓度组小鼠皮损组织,使用 Trizol法提取总RNA。根据吸光光度值按下列公式计算样品RNA的浓度:总RNA浓度(μg/μL)=OD 260×40×10-3。使用逆转录试剂盒生成cDNA后,稀释5倍在检测系统上进行逆转录定量聚合酶链反应(RT-qPCR),数据以2-△△Ct进行分析。基因特异性引物序列:RASSF1A上游5’-CCAGCAAGAAACCACCTTCC-3’,下游5’-CCGTTCAGTTCGCTCAAAGA-3’;CXCL1上游5’-CACCTCAAGAACATCCAGAGC-3’,下游5’-CTTGGGGACACCTTTTAGCA-3’;CXCL2上游5’-AGTGAACTGCGCTGTCAATG-3’,下游5’-CAGGGTCAAGGCAAACTTTTT-3’;S100A7上游5’-ACACTGCTTCCATCACTATGC-3’,下游5’- TTTTGTCAGCTGCCCGGAA-3’;YAP上游5’-ACCCTCGTTTTGCCATGAAC-3’,下游5’-TTCAACCGCAGTCTCTCCTT-3’;TAZ上游5’-CTGCGCTTCAAATGGGTAGGA-3’,下游5’-CAAAGCGGGGGAAGTAGGG-3’;GAPDH上游5’-ATGGGTGTGAACCACGAGA-3’,下游5’-CAGGGATGATGTTCTGGGCA-3’。
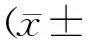
2 结 果
2.1各组小鼠皮损及PASI评分比较 模型组小鼠造模第2天开始背部剃毛皮肤出现红斑、鳞屑和厚度增加,之后持续进展;紫草素各组小鼠造模第2天开始背部剃毛皮肤出现发红,附有鳞屑及肥厚的现象,但是与模型组相比程度明显减轻,且紫草素浓度越高,皮损越轻。PASI评分显示,模型组和紫草素各组均明显高于正常组(P均<0.05),紫草素高、中、低浓度组均明显低于模型组(P均<0.05),紫草素高浓度组明显低于中、低浓度组(P均<0.05)。见图1及图2。
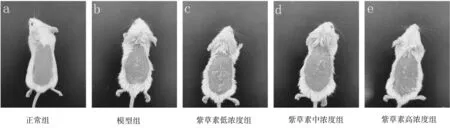
图1 各组小鼠实验第7天皮损表现
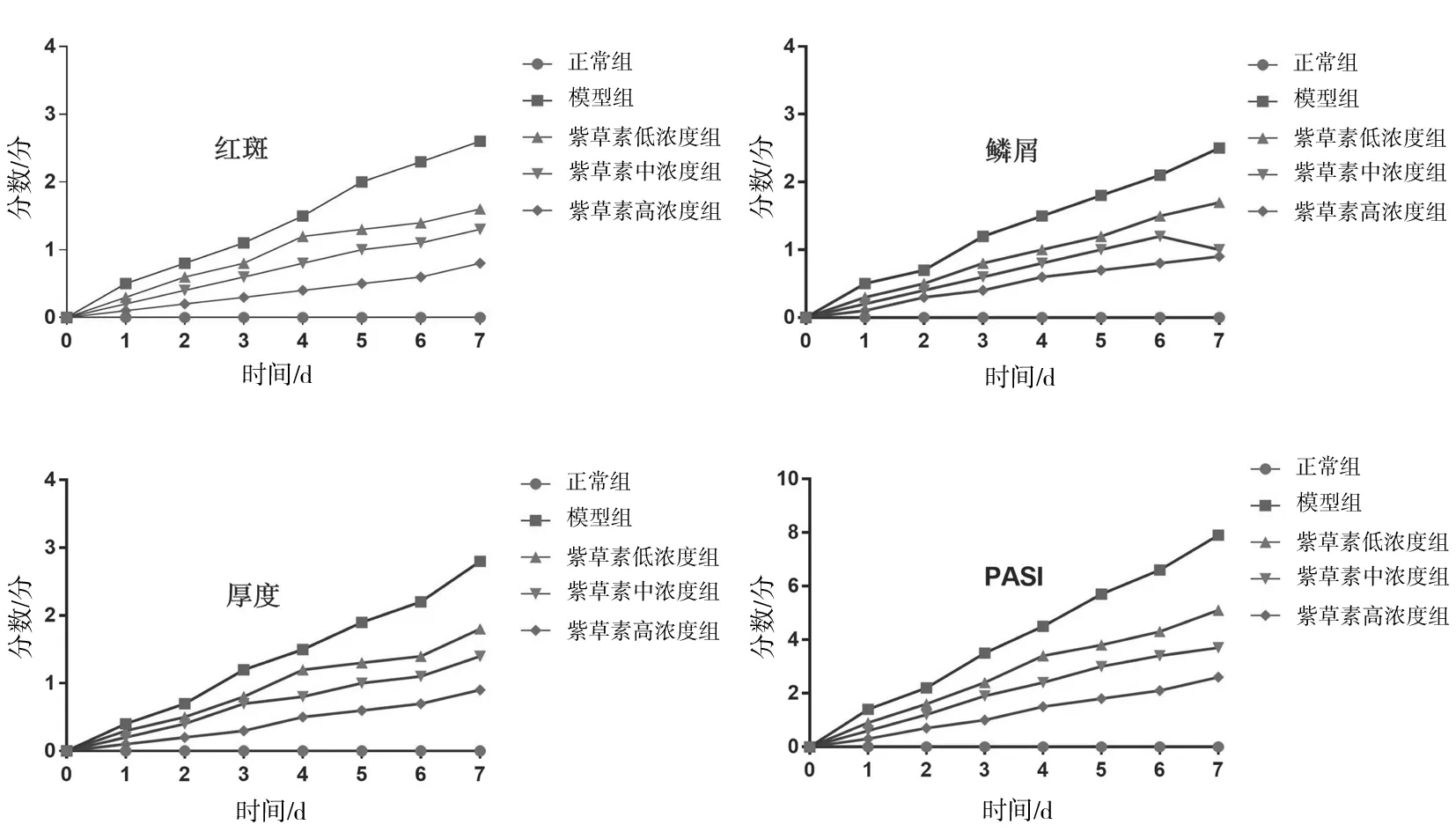
图2 各组小鼠不同时间皮肤病变红斑评分、鳞屑评分、厚度评分及总评分
2.2各组小鼠皮肤组织病理学表现 HE染色结果显示,正常组小鼠皮肤组织基底层为单层柱状细胞;模型组小鼠皮损表皮向下延伸,角化不全,颗粒层减少或消失,棘层增厚,炎性浸润;紫草素各组小鼠皮损表皮厚度减少,棘皮病减轻和轻微炎性细胞浸润,且皮损减轻程度与紫草素浓度成正向相关。见图3。
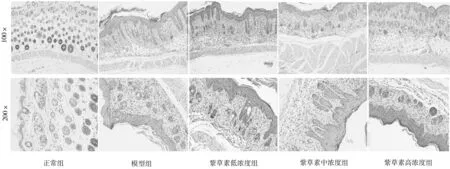
图3 各组小鼠皮肤组织病理学HE染色表现
2.3各组小鼠皮损组织中IL-17、IL-22、TNF-α表达水平比较 模型组、紫草素高浓度组小鼠皮损组织中IL-17、IL-22、TNF-α表达水平均明显高于正常组(P均<0.05),紫草素高浓度组小鼠皮损组织中IL-17、IL-22、TNF-α表达水平均明显低于模型组(P均<0.05)。见图4。
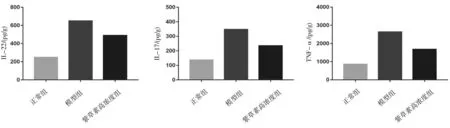
图4 各组小鼠皮损组织中IL-17、IL-22、TNF-α水平
2.4各组小鼠皮损组织中RASSF1A、CXCL1、CX-CL2、S100A7、YAP、TAZ mRNA表达水平比较 紫草素组小鼠皮损组织中RASSF1A mRNA表达水平明显低于正常组(P<0.05),CXCL1、CXCL2、S100A7、YAP、TAZ mRNA表达水平均明显高于正常组(P均<0.05);紫草素对银屑病小鼠模型皮损组织中趋化因子和转录因子有明显干预作用。见图5。
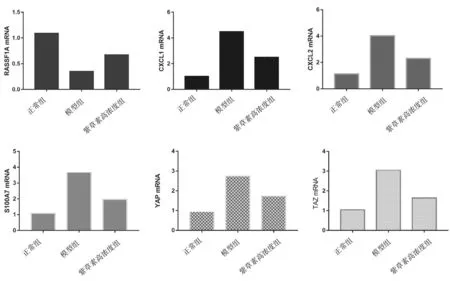
图5 各组小鼠皮损组织中RASSF1A、CXCL1、CXCL2、S100A7、YAP、TAZ mRNA表达水平
3 讨 论
银屑病是一种免疫介导的炎症性皮肤病,发病机制尚不清楚,主要是免疫细胞活化产生大量的趋化因子和炎症细胞因子,介导嗜中性粒细胞的募集,形成Munro微脓肿[6]。银屑病皮肤炎症的发生,是由于活化的RAS基因在皮肤基底上的过表达引起的[7-8],RAS在基底角质形成细胞(KC)中的过表达导致银屑病皮肤发炎、棘皮增厚、角化过度,表皮内中性粒细胞和T细胞包括IL-17、IFN-γ、CD8+T
细胞浸润[8-10]。过表达RAS的KC可能通过释放与CD8+T细胞上 特异性表达的CXCR6相互作用的CXCL16介导CD8+T细胞进入人类皮肤[11],优先在CD8+T细胞上表达,产生IFN-γ和IL-17,有利于中性粒细胞募集和Munro微脓肿形成[11-12],增强KC活化和增殖[13],促进中性粒细胞吸引CXCL1和S100家族成员(S100A7,S100A8和S100A9)的KC产生[13-14],并有助于CD4+T细胞活化,有利于CD4+T细胞渗入皮肤[8-9],产生IL-17、IL-22、TNF-α、IL-23[1,9,14]。IL-17参与免疫反应,可促进血管生成,加速表皮增殖,促进中性粒细胞浸润与活化。IL-22可促角质形成细胞生成,诱导细胞免疫紊乱,加重银屑病。TNF-α主要由单核巨噬细胞产生,是一种促炎症性细胞因子,可诱导趋化因子和黏附因子,活化中性粒细胞与血管内皮细胞而引起机体强烈的炎症反应,在诱发银屑病的炎症增生过程及维持银屑病炎性浸润中起重要作用[15]。
Hippo-YAP途径是一个由一系列蛋白激酶和转录因子组成的激酶级联反应,是血管内皮生长因子(VEGF)诱导的血管生成的关键介质[16]。Hippo-YAP/TAZ的失调,影响T细胞的增殖分化,导致自身免疫和/或炎症性疾病[17]。成年基底表皮细胞核中YAP的过度表达可导致皮肤增厚[18],而YAP和TAZ缺失导致伤口愈合能力减弱[6]。RASSF1A为RAS的效应蛋白,其可与YAP结合。银屑病细胞与鳞状细胞癌(Cscc)细胞极为相似,YAP可能通过激活与Cscc细胞相关的AREG/RAS/AKT/ERK轴[19],调节银屑病角质形成细胞的细胞增殖、细胞周期和凋亡。
既往研究证实,紫草素可通过JAK/STAT3途径的激活诱导CEBP-δ蛋白表达下调,抑制角质形成细胞的增殖[20];可通过抑制AKT/mTOR途径来有效促进iTreg细胞的分化减缓炎症的发展[21];还可抑制血管增生,通过阻滞JAK2/STAT3途径抑制IL-17诱导的VEGF表达[22]。本实验结果显示,紫草素能够改善咪喹莫特诱导的银屑病皮损,减少皮损厚度、红斑及鳞屑;且紫草素干预后,小鼠皮损组织中IL-17、IL-22、TNF-α水平和CXCL2、S100A7、YAP、TAZ mRNA表达水平均明显降低,RASSF1A、 CXCL1 mRNA表达水平均明显升高。说明紫草素有抗炎作用,可通过调节Hippo-YAP信号通路中的趋化因子及转录因子干预银屑病的进展。
本实验结果显示,紫草素通过增加皮肤基底RASSF1A mRNA的含量,降低Hippo-YAP信号通路上游转录因子YAP、TAZ的含量,致下游趋化因子和炎症因子CXCL1、CXCL2、S100A7、IL-17、IL-22、TNF-α降低达到抗银屑病的作用,改善IMQ诱导的银屑病皮损病理表现,减少皮损厚度、红斑及鳞屑。
利益冲突:所有作者均声明不存在利益冲突。

